止颤汤对帕金森病异动症大鼠DARPP-32磷酸化表达的影响
2018-03-14,
,
帕金森病(Parkinson’s disease,PD)是目前中老年的一种多发病,已成为继阿尔海默茨病之后影响老年人心身健康的第二大神经退行性功能障碍疾病[1]。目前PD的治疗仍以左旋多巴为主的替代治疗。但长期使用左旋多巴,会出现一些严重的并发症,其中最为突出的是异动症(LID),异动症是一种舞蹈样、手足徐动样或简单重复的不自主动作,很多中晚期病人因此致残[2]。
PD运动并发症是临床上的工作难点,目前未有临床上广泛推广的治疗药物及技术,主要以减量外源性多巴胺摄入为主,但这样可能加重PD 症状。故中医药治疗异动症是一个很好的切入点。止颤汤治疗异动症有很好的疗效,但其作用机制尚不明确。目前研究发现,纹状体黑质投射神经元内纹状体环磷酸腺苷(cAMP)依赖性蛋白激酶(PKA)通路和其下游信号转导蛋白多巴胺和环磷腺苷调节的磷酸化蛋白-32(DARPP-32)的蛋白Thr34位点磷酸化表达改变可能参与了异动症的发病[3-4]。故本课题拟采用中药止颤汤治疗异动症大鼠,观察大鼠异常不自主行为及纹状体DARPP-32(Thr34)磷酸化表达的影响,旨在探讨其治疗LID的作用机制。
1 材料与方法
1.1 实验动物 成年雄性SD大鼠50只,体质量180 g~220 g,经反复行为检测确认无旋转行为。
1.2 药物配制 止颤汤为上海市中医医院名老中医李如奎教授经验方,中剂量药物:黄芪15 g,丹参9 g,钩藤18 g,知母12 g,白芍12 g,制大黄15 g,升麻9 g组成,水煎浓缩至每毫升含生药1.28 g。大、小剂量药物分别为在中剂量基础上增减20%,储存于冰箱备用。
1.3 方法
1.3.1 LID大鼠模型制备 利用6-羟基多巴胺(6-OHDA)制备PD模型大鼠[5],2周后进行行为学观察:按0.5 mg/kg腹腔注射阿扑吗啡,记录1 h内大鼠旋转总圈数,大于100圈即为PD模型制作成功。同时随机选取6只大鼠用生理盐水代替6-OHDA 注射作为正常组(假手术组)。将左旋多巴和苄丝肼溶于含0.2% 维生素C的消毒生理盐水中,使左旋多巴终浓度为10 mg/mL,苄丝肼为2.5 mg/mL。3周后对造模成功的PD大鼠腹腔注射左旋多巴甲酯(50 mg/kg)/苄丝肼(12.5 mg/kg)4周,每日两次(09:00与17:00),制备LID大鼠模型[6]。随机将LID模型分为:模型组、西药组、中药小剂量组、中药中剂量组、中药大剂量组,每组6只。模型组大鼠给予腹腔注射含0.2% 维生素C的消毒生理盐水,持续29 d;西药组为腹腔注射左旋多巴甲酯/苄丝肼,每日两次(09:00与17:00),持续29 d;中药小剂量组、中药中剂量组、中药大剂量组在给予左旋多巴甲酯/苄丝肼的基础上分别加用止颤汤灌胃,1次/日,持续29 d,每次灌胃量为9 mL/kg。于治疗第8天、第15天、第22天、第29天上午用药后进行大鼠异常不自主运动(AIM)评分。
1.4 测试指标
1.4.1 AIM评分测定 各组大鼠于治疗期间每周进行1次AIM评分[7],每次评定结果由经用药后每间隔30 min的AIM总分组成,每次连续评定4组数据(持续120 min),共有5组数据,5组数据之和为该次评定结果。将AIM分为4个部分(前肢、口面部、轴性及运动)进行评定,每部分又根据其有或无及严重程度划分为5个等级(0分~4分):0分,无;1分,偶尔出现,出现时间少于观察期的一半;2分,经常出现,出现时间大于观察期的一半;3分,整个观察期内持续存在,但触觉刺激可使之停止;4分,整个观察期内持续存在,刺激不能使之停止。理论上1只大鼠1次用药后最大评分为64分。
1.4.2 免疫印迹检测 样本变性后加入1倍体积的2×SDS上样缓冲液,沸水浴5 min,置冰上,检测蛋白表达,以目的条带与β-actin比值表示各组蛋白表达水平。结束注射后3 h,快速分离双侧纹状体,每10 mg组织加入100 μL蛋白裂解液RIPA和1 μL蛋白酶抑制剂PMSF,超声裂解,提取总蛋白。测定蛋白浓度后于-80 ℃保存。上样前煮沸3 min,取20 μg样本经10%SDS一聚丙烯酰胺凝胶电泳后,电转移至二氟化树(PVDF)膜,用5% BSA溶液室温孵育,TBST洗脱;加入一抗溶液,4 ℃孵育过夜;TBST冲洗,加HRP标记的二抗以结合一抗及HRP标记的抗生物素抗体,37 ℃孵育1 h;TBST冲洗,将膜置于反应液中室温孵育5 min。去除过量的溶液,将膜夹在两塑料薄膜之间,以X光胶片曝光。Western blot图像采用ImageJ图像分析软件计算各样本目的与β-actin比值表示各组蛋白表达水平。
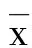
2 结 果
2.1 各组大鼠AIM评分比较 干预后第8天、第15天、第22天各组大鼠AIM 评分差异无统计学意义(P>0.05),第29天,中药小剂量组AIM 评分与西药组比较差异无统计学意义(P>0.05),中药大剂量组、中药中剂量组AIM 评分较小剂量组明显降低(P<0.01),中剂量组AIM 评分与大剂量组比较差异无统计学意义(P>0.05)。详见表1。
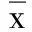

2.2 免疫印迹 模型组大鼠磷酸化DARPP-32(THr34)的灰度值为(2.69±0.22)×106,较正常组灰度值(1.04±0.15)× 106增高,差异有统计学意义(P<0.01);西药组磷酸化DARPP-32(THr34)灰度值为(2.67±0.24)×106,与模型组比较,差异无统计学意义(P>0.05)。中药大、中、小剂量组大鼠纹状体磷酸化DARPP-32(THr34)灰度值分别为(1.40±0.09)×106、1.69±0.09)×106、(2.25±0.12)×106,与西药组比较差异均有统计学意义(P<0.05)。中药中剂量组磷酸化DARPP-32(THr34)的灰度值与中药大剂量组比较差异无统计学意义,而中药中剂量组、中药大剂量组磷酸化DARPP-32(THr34)的灰度值较中药小剂量组降低(P<0.05)。详见图1。
3 讨 论
帕金森病的患病率随年龄增长而逐渐增高,其病理改变主要出现在黑质纹状体系统,为黑质多巴胺神经元变性引起的黑质纹状体系统多巴胺递质含量显著减少[8]。而左旋多巴作为多巴胺的前体,通过代谢成为多巴胺进行补充来减轻帕金森病的症状,因此迄今为止,左旋多巴一直是PD的基础药物,也是判断治疗PD疗效的“金标准”。但随着左旋多巴的长期使用,50%~80%的PD病人逐渐出现疗效减退及运动并发症等不良反应,其中最为突出的运动并发症是异动症[9],很多中晚期病人因此致残,不仅影响左旋多巴的临床价值,而且严重影响病人的生活质量。
异动症的发病机制是由于疾病的进展,黑质多巴胺能神经元进行性丢失,导致多巴胺能神经元突起减少,多巴胺能神经元释放、存储多巴胺的调节能力下降,对外源性左旋多巴药物的缓冲能力降低。服用半衰期较短的外源性左旋多巴药物,更易造成对纹状体棘状神经元上多巴胺受体形成异常的波动性刺激,使本已失衡的多巴胺能环路更加异常,从而引起直接和间接纹状体输出通路的失衡,这可能是异动症产生的主要病理机制[10-11]。近年研究表明LID的发生与表达D1受体的直接通路及其下游cAMP依赖性蛋白激酶(PKA)等信号传导通路的激活关系密切[12-13]。DARPP-32是直接通路上信号传导的重要物质,大量集中于纹状体区,直接参与并调控直接通路的活化程度[14-15]。众多实验也表明,LID大鼠纹状体内DARPP-32的Thr-34位点的磷酸化水平增高,可能造成了直接通路过度活化,引起直接、间接通路的平衡失调及清除异常运动信息的功能被破坏,最终导致LID 的发生[16]。
而随着PD发病率的增加,中医药治疗PD日益受到重视。根据临床表现和体征,PD属于中医“颤证”范畴[17]。《素问·至真要大论篇》曰:“诸风掉眩,皆属于肝”。《素问·五常政大论》“其病摇动”“掉眩巅疾”,这些论述均说明“掉”表现为摇动之象。此类疾病属风象,与肝有关。明代医家孙一奎在《赤水玄珠》中指出:“此病壮年鲜有,中年以后乃有之,老年尤多,夫年老阴血不足,少水不能制肾火,极为难治”。其病机通常认为是本虚标实。本虚是指肝肾精血不足与气血亏虚,标实常指痰热夹风阳为患。其病位在脑,与肝、脾、肾三脏有关。盖肝为风木之脏,以血为体,以气为用,肝血不足则筋失柔润。肾主骨生髓,肾精不足,髓海不充;肾阴亏虚,水不涵木,虚风内动,四肢震颤,经谓风淫末疾也。气血两虚,筋脉失于濡养,为之振摇;且滋水涵木,濡血柔肝,佐金制木,培土养肝,皆有赖于益气养血,滋其化源。止颤汤即以此立意,并结合现代研究,注重清热泻火,升清降浊。本课题选用的中药止颤汤剂,是我科上海市名老中医李如奎教授结合多年治疗PD的经验,经过探索筛选研制所得,在我科近几十年的临床上运用于帕金森病及异动症病人颇有疗效[18],并在李如奎教授的指导下,科内已有国家及地方各级课题和多篇论文[19]提示止颤汤对于帕金森病大鼠模型有治疗作用,并成功制作PD大鼠模型及LID大鼠模型,该研究将止颤汤应用于LID大鼠,旨在进一步探索该药的作用机制。
本实验结果显示,在早期止颤汤对于LID大鼠的AIM评分效果不明显,在中后期,中药小剂量组同样效果不明显,而中药中、大剂量组可减轻LID大鼠AIM评分,总的来说,止颤汤可以缓解LID大鼠不自主运动行为。
对纹状体磷酸化DARPP-32(THr-34)表达的研究表明,LID大鼠DARPP-32(THr34)磷酸化的程度较正常组明显升高,西药组DARPP-32(THr34)磷酸化与模型组比较,差异无统计学意义。而中药组治疗后降低了THr-34磷酸化的表达,其中中药中、大剂量作用明显,起到改善LID的目的,从而表明,LID时DARPP-32(THr34)表达增加,且它的变化水平与LID发展趋势相关。DARPP-32的Thr34位点磷酸化后成为蛋白磷酸酶1(PP-1)的高效抑制剂,后者可以调控神经元许多磷酸蛋白的磷酸化状态,从而激活直接通路,引发LID。而中药的治疗可改善磷酸化DARPP-32(THr34)的表达,抑制PKA通路的过度活化,缓解LID的进一步加重。
综上所述,PD病人经长期反复左旋多巴治疗波动性刺激多巴胺D1受体,从而选择性异常活化直接通路,使基底节环路失衡进而引起LID的形成,其中DARPP-32(THr34)水平的变化是直接通路过度活化的关键因素。因此通过调控DARPP-32的磷酸化状态或拮抗直接通路活性,逆转通路活动失衡有可能阻抑LID的发生。
[1] Parkinson J.An essay on the shaking palsy.1817(Reproduced)[J].J Neuropsychiatry Clin Neurosci,2002,14(2):223-236.
[2] Olanow CW.Obeso JA.Preventing levodopa-induced dyskines-ias[J].Ann Neurol,2000,47(4):167-178.
[3] 梁直厚,管强,曹学兵,等.异动症大鼠直接通路中DARPP-32蛋白变化的机制[J].中国康复医学杂志,2006,21(11):963-966.
[4] 牛轶碹,曹学兵,魏桂荣,等.DARPP-32磷酸化状态与左旋多巴诱发异动症形成间关系的研究[J].脑与神经疾病杂志,2008,16(1):1-4.
[5] 陈生弟,陈先文.帕金森病动物模型的研制[J].中国神经免疫学和神经病学杂志,2003,10(1):28-32.
[6] 孙慧勤,陈先文,李芳,等.左旋多巴诱发异动症大鼠模型的制作及其行为学研究[J].安徽医科大学学报,2009,44(3):355-358.
[7] Lee CS,Cenei MA,Schulzer M,et al.Embryonic ventral meseneephalie grafts improve levodopa-induced dyskinesia in a rat model of Parkinsan’s disease[J].Brain,2000,123(7):1365-1379.
[8] Lee AC,Harris JP,Calvert JE.Impairment of mental rotation in Parkinson disease[J].Neuropsychologia,1998,36:109-114.
[9] Amick MM,Schendan HE,Ganis G,et al.Frontostriatal circuits are necessary for visuomotor transformation:mental rotation in Parkinson’s disease[J].Neuropsychologia,2006,44:339-349.
[10] Thanvi BR,Lo TC.Long term motor complications of levodopa:clinical features, mechanisms,and management strategies[J].Postgrad Med J, 2004,80:452-458.
[11] 巴茂文,刘振国.左旋多巴诱发异动症的病理生理机制研究进展[J].中华神经科杂志,2005,38(6):403-404.
[12] Aubert I,Guigoni C,Hakansson K,et al.Increased D1 dopa-mine receptor signaling in levodopa-induced dyskinesia[J].Ann Neurol,2005,57:17-26.
[13] Santini E,Valjent E,Usiello A,et al.Critical involvement of cAMP/DARPP 32 and extracellular signal-regulated protein kinase signaling in L-dopa-induced dyskinesia[J].Neurobiol Dis,2007,27:6995-7005.
[14] 浦政,陆丽霞,刘振国,等.脑深部电刺激对异动症大鼠纹状体DARPP-32及其磷酸化蛋白表达的影响[J].上海交通大学学报(医学版),2009,29(7):817-820.
[15] 梁直厚,管强,曹学兵,等.异动症大鼠直接通路中DARPP-32蛋白变化的机制[J].中国康复医学杂志,2006,21(11):963-966.
[16] 陈志斌,管强,曹学兵,等.异动症大鼠模型基底节DARPP-32蛋白磷酸化状态的变化[J].中国现代医学杂志,2007,17(5):536-539.
[17] 陈湘君,蔡淦.中医内科学[M].上海:上海科学技术出版社,2001:1-5.
[18] 刘毅,王慧新,李如奎.止颤汤治疗帕金森病的临床疗效观察[J].中西医结合心脑血管病杂志,2007,5(11):1064-1065.
[19] 李文涛,汪洋,施慧芬,等.止颤汤对神经干细胞向多巴胺能神经元诱导分化作用的研究[J].世界科学技术-中医药现代化,2009,11(3):371-374.
