水产品中丁香酚残留的人体健康风险分析
2018-03-10方晓磊柯常亮古小莉李刘冬
方晓磊,柯常亮,刘 奇,李 乐,古小莉,李刘冬
( 1.中国水产科学研究院 南海水产研究所,农业部水产品加工重点实验室,农业部水产品贮藏保鲜质量安全风险评估实验室,广东 广州 510300; 2.浙江海洋大学,浙江 舟山 316021;3.中国水产科学研究院,北京 100141 )
一直以来,中国居民偏爱食用鲜活水产品。由于气候和养殖条件限制,中国水产品养殖生产存在区域差异[1]。为满足市场需求,鲜活水产品的长途运输状况十分普遍。然而,鲜活水产品在收贮运环节因受应激胁迫、水质恶化和受伤感染等因素的影响导致活鱼免疫力、存活率和产品价值降低,不仅给水产品质量安全带来风险,还制约了水产业的发展[2-4]。目前,美国、日本等国家都有合法的食用鱼麻醉剂用于鲜活水产品捕捞、分级、转移和运输等渔业活动,以降低活鱼收贮运过程的死亡率和损伤率[5-9]。我国截至目前依然没有合法登记使用的鱼用麻醉剂用于收贮运过程鲜活水产品的保活、保值。
丁香酚对鲜活水产品具有良好的麻醉效果,可以有效降低活鱼的氨氮排放、代谢速率、游动行为和应激效应,提高存活率和运输密度[10-13]。因此,少数从业人员为提高活鱼存活率,减少经济损失,在鲜活水产品收贮运环节使用丁香酚作为鱼用麻醉剂。2012年“麻醉鱼”见诸报端后,丁香酚作为鱼用麻醉剂的安全性骤然引起了社会的广泛关注。为评估水产品中丁香酚残留对人体的健康风险,笔者综述了丁香酚的毒理和残留消除方面的研究成果,结合水产品中丁香酚残留监测的数据,评估了食用鱼中丁香酚麻醉剂的安全性,为水产品收贮运环节丁香酚的监管提供科学依据和参考。
1 丁香酚简介
丁香酚源自植物丁香(Syzygiumaromaticum),是其植物精油的主要成分,含量为72.3%~97.7%[14]。丁香酚作为药品和医疗器械在中国可以合法使用,起杀菌消毒和麻醉镇痛作用[15-18]。作为食品添加剂,丁香酚主要用于增强食品的风味。丁香酚在中国、美国和欧盟等国家和地区作为香料和食品风味剂可以合法使用,且没有制定最大残留或使用限量[19-21]。
1972年日本学者遠藤俊夫研究发现,丁香酚含量为10%药物制剂FA100对几种淡水鱼类有很好的麻醉效果[22],开启了丁香酚作为鱼用麻醉剂的先河。研究表明,丁香酚对海、淡水鱼类、虾类和贝类等不同水产品均有良好的麻醉效果,且麻醉诱导时间和净化复苏时间均较为短暂,适合各类渔业活动对活鱼进行处理[23-28]。由于价格低廉,麻醉效果好,丁香酚已经成为鲜活水产品收贮运环节应用最为广泛的鱼用麻醉剂之一。
2 丁香酚的毒理学数据
2.1 急性毒性及不良效应
急性毒性研究显示,丁香酚经口半致死剂量对大鼠为2680 mg/kg和1930 mg/kg,小鼠为3000 mg/kg,几内亚猪为2130 mg/kg[29]。依据世界卫生组织对农药毒性划分的标准,丁香酚属于低毒害物质[30]。经口剂量1400~4000 mg/kg,给药34 d,大鼠肝脏质量有稍许增加并变黄,前胃部出现增生和过度角化,并伴随病灶性溃疡[29]。
2.2 致敏性
根据小鼠局部淋巴结试验,丁香酚诱导刺激效应含量值为13%,根据世界卫生组织对化合物的致敏效力划分,丁香酚致敏效力为3级,属弱致敏物[31]。
2.3 致癌性
美国国家毒理学计划研究显示,以丁香酚含量为0、0.6%、1.25%的饲料饲喂雌性F344/N大鼠、雄性F344/N大鼠103周,没有证据显示丁香酚对大鼠致癌;以同样方式饲喂小鼠,雌性B6C3F1小鼠体内肝癌细胞和腺瘤均有显著增加,雄性B6C3F1小鼠仅在低剂量组中发现癌细胞和腺瘤的发生率增高[32]。经皮和腹腔注射两种给药方式的试验结果也无法表明丁香酚对试验动物致癌。因此,丁香酚对试验动物致癌的证据不足。由于无法确证丁香酚对试验动物是否致癌,加之流行病学数据缺乏,世界癌症研究机构将丁香酚归类为可疑致癌物[29]。
2.4 致突变
丁香酚对大肠杆菌(Escherichiacoli)WP2 uvrA,鼠伤寒沙门氏菌(Salmonellatyphimurium)株TA1530、TA1535、TA1537、TA1538、TA98、TA100均无致突变作用。外源性代谢系统缺失的条件下,丁香酚可诱发中国仓鼠(Cricetulusgriseus)卵巢细胞染色体的畸变。当外源性代谢系统存在时,多氯联苯诱导后中国仓鼠的卵巢细胞在丁香酚的诱导下也会产生染色体畸变[32]。无论外源性代谢系统的是否缺失,姐妹染色单体互换的发生率都稍许增加[32]。
大鼠肝脏上皮细胞中丁香酚可以代谢产生2′,3′-环氧丁香酚和2′3′-二羟基-2′3′-二氢戊烯两种产物。此外,在大鼠的尿液中也分离出了(3′-甲氧基-4′-羟基苯基)-1-丙酮和3-吡咯烷基-1-(3′-甲氧基-4′-羟基苯基)-1-丙酮两种丁香酚代谢产物[29]。在外源性代谢系统缺失的条件下,2′,3′-环氧丁香酚对鼠伤寒沙门氏菌TA 1535 和 TA 100两种菌株产生突变诱导效应,但是对TA1537、TA 1538和T A98 3种菌株无论代谢系统是否缺失都没有突变诱导效应[29]。存在于尿液中的两种代谢物对鼠伤寒沙门氏菌均无致突变效应,即便使用丁香酚剂量为200 mg/kg 对雄性C3H/HeJ小鼠进行宿主间介试验时也没有产生突变诱导作用[29]。因此,丁香酚的小鼠代谢物2′,3′-环氧丁香酚对细菌产生突变诱导效应,存在潜在危害。
3 水产品中丁香酚残留消除特征
Guénette等[33]将虹鳟(Oncorhynchusmykiss)[体质量(63.7±14.4) g,体长(18.7±1.7) cm]置于丁香酚质量浓度为75 mg/L水中药浴15 min,于48 h内不同时间间隔采集血液样品,研究虹鳟中丁香酚药代动力学特征。结果显示,虹鳟血液中丁香酚残留峰值为10.53 μg/mL,药物半衰期为12.14 h,药时曲线下面积AUC0-t和AUC0-∞值分别为16.55 μg·h/mL和17.04 μg·h/mL,表明丁香酚在鱼体中的吸收和消除都很好,血液中丁香酚半衰期较长可能是重复给药药物累积所致。同为虹鳟,Meinertz等[34]将平均体质量385 g的虹鳟置于5~100 mg/L的丁香酚溶液中药浴4~1440 min,发现10 mg/L药浴60 min时虹鳟鱼肉丁香酚残留量最高(44.5 mg/kg),鱼肉中丁香酚消除半衰期仅19.97 min。表明丁香酚在虹鳟鱼肉中消除速率远高于其在血液中的消除速率,这可能与鱼的个体有关系,前者试验用虹鳟质量仅为后者的1/6。
Kildea等[35]模拟新南威尔士渔民的作业方式用丁香油快速麻醉商品规格(457±116) g的银鲈(Bidyanusbidyanus)。结果显示,初次暴露后净化48 h鱼肉中丁香酚的残留量低于检测限。二次给药净化1周后,银鲈肌肉组织中丁香酚残留0.32 mg/kg。单次给药时高剂量组(50 mg/L)在温度较高的条件下,银鲈肌肉中丁香酚的残留量更高,而低剂量组(15 mg/L)肌肉中丁香酚的残留量几乎不受温度影响,无论高剂量组还是低剂量组中肌肉中丁香酚的残留量在48 h后低于检测水平。
Li等[36]用10 mg/L的丁香酚溶液药浴草鱼(Ctenopharyngodonidella)2 h,肌肉中丁香酚药峰质量浓度1.93 mg/kg,清水净化96 h后肌肉中没有丁香酚残留。
Meinertz等[34]用14C标记的丁香酚研究其在消除过程鱼肉中标记代谢物。研究显示,虹鳟经10 mg/L14C标记的丁香酚药浴 60 min,鱼肉中14C标记的丁香酚含量在初始时(0 min)占98.6%,240 min后降至85.7%。
活鱼鱼肉中丁香酚残留消除率快,且鱼肉中残留的主要成分依然为丁香酚。重复给药影响活鱼对丁香酚残留消除能力。活鱼对初次吸收的丁香酚消除能力强,鱼肉中丁香酚的残留消除快,但同时也削弱了鱼体对丁香酚残留消除能力,所以二次给药后鱼肉中丁香酚残留消除时间长。
4 水产品中丁香酚残留健康风险评估
2015年在国家水产品质量安全风险评估项目的资助下,项目组对水产品运输环节丁香酚残留进展开了风险监测。在广东、上海、福建、浙江、北京和辽宁等6个省市的运鱼车及市场暂养池中共计采集了537份活鱼样品,应用气相色谱串联质谱法分析测定了鱼肉中丁香酚的残留量[37]。结果显示,57份活鱼样品中检出丁香酚残留(0.003~36.1 mg/kg),检出率10.6%。
中国居民营养与慢性病状况报告显示,2012年中国居民鱼虾类的日摄入量为23.7 g/d[36]。按照下式计算中国居民通过食用鱼肉对丁香酚膳食暴露量。
式中,EDI为日摄入量估计值( mg/kg);C为鱼体中丁香酚残留量,为增大安全边际效应本公式取监测样品中丁香酚的最大残留量36.1 mg/kg计算;E为日暴露量(g/d);m为体质量(kg)。
不同年龄段人群丁香酚日摄入量估算值见图1。由图1可知,儿童膳食消费风险高于成人,女性的风险略高于男性。虽然如此,所有人群的日摄入量均远低于联合国粮农组织和世界卫生组织食品添加剂联合专家委员会推荐的丁香酚每日允许摄入量2.5 mg/kg·bw[39]。
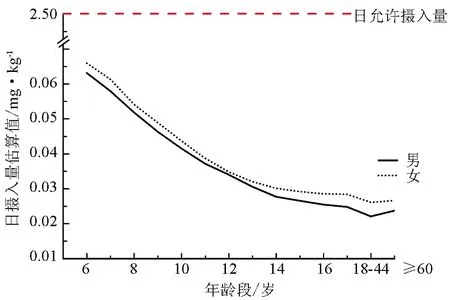
图1 不同年龄段人群丁香酚日摄入量估算值
若以丁香酚残留量为36.1 mg/kg估算,不同年龄段的人群膳食消费水产品使丁香酚的人体暴露量超过联合国粮农组织和世界卫生组织食品添加剂联合专家委员会推荐的每日允许摄入量,儿童日消费水产品须超过1.1 kg,成人大于3.97 kg。中国居民膳食指南(2016)中特定人群膳食指南推荐儿童(3~5岁)、成年女性、成年男性、乳母和孕妇水产品消费量分别为20、50、75、85 g/d和100 g/d,老人(65岁以上)为30~100 g/d[40]。由此可见,估算值远高于正常的膳食推荐值,普通人日常难以达到如此高的膳食消费量。
因此,根据现有数据水产品中丁香酚残留对人体的健康风险较低。
5 结论与展望
现阶段,不同国家针对食用鱼中使用丁香酚的管控措施也不同,主要有3种:(1)以美国和加拿大为代表的北美地区不允许使用[5,41]。美国国家毒理计划研究显示,丁香酚的同系物甲基丁香酚对大鼠致癌,异丁香酚致癌性尚未明确[5]。因担心丁香油(酚)产品含有甲基丁香酚或异丁香酚成分,美国食品药品监督管理局兽药中心没有批准丁香酚作为渔用麻醉剂[5]。目前,三卡因甲磺酸盐是美国唯一批准使用的渔用麻醉剂,用于活鱼的运输与处理,虽然安全性高,但休药期过长(21 d),实用性差[42]。因此,丁香酚是否可以作为零休药期的渔用麻醉剂和镇静剂在美国水产养殖业和渔业应用还存在争议[43]。(2)允许使用,同时制定有残留限量和休药期。日本虽然允许使用丁香酚作为水产麻醉剂,但制定了最大残留限量(0.05 mg/kg),规定鱼类和甲壳类产品使用丁香酚后需分别休药7 d和10 d后方可食用[44-45]。(3)丁香酚作为合法鱼用麻醉剂且无残留限量和休药期。新西兰食品安全局认为丁香酚在鱼体中消除速率快,远低于其在其他食品中的残留量,而且鱼体中丁香酚类残留没有急性和慢性膳食风险,故撤销水产品中丁香酚的残留限量,且无需休药期[7,46]。
目前,鲜活水产品运输容量、鱼体“品相”和产品存活率已成为制约中国鲜活水产品流通和水产行业发展的技术瓶颈,严重影响待售水产品的经济价值和水产品流通的运营成本,抑制供给,无法满足广大消费者的需要。因此,亟需一种低毒、高效的渔用麻醉剂来解决当前中国鲜活水产品运输的困境。水产品中丁香酚残留消除快、对人体健康风险低,可以作为候选渔用麻醉剂。在未来,建议深入研究丁香酚在不同种类水产品中的药代动力学特征及其标志代谢物,开展市售水产品中丁香酚残留风险监测,评估其作为渔用麻醉剂的安全性。
[1] Cao S P. National aquaculture sector overview: China.National aquaculture sector overview fact sheets.Rome: Food and Agriculture Organization, 2005 [EB/OL]. [2016-10-15].http://www.fao.org/fishery/countrysector/naso_china/en.
[2] Coyle S D, Durborow R M, Tidwell J H. Anesthetics in Aquaculture[R]. Texas: Southern Regional Aquaculture Center,2004.
[3] 段亚飞, 董宏标, 王芸,等. 干露胁迫对日本囊对虾抗氧化酶活性的影响[J]. 南方水产科学, 2015, 11(4):102-108.
[4] 付腾, 宋沙沙, 马红玲,等. 硝态氮对凡纳滨对虾血清免疫相关酶活性的影响[J]. 南方水产科学, 2016, 12(2):44-50.
[5] Melton S. Concerns related to the use of clove oil as an anaesthetics for fish. FDA Guidance for industry No. 150.maryland: center for veterinary medicine, food and drug administration, USA, 2007 [EB/OL]. [2016-10-15]. http://101.110.118.68/www.fda.gov/downloads/AnimalV.../ucm052520.pdf.
[6] Australian Government Federal Register of Legislation. Australia new zealand food standards code: standard 1.4.2 maximum residue limits (Australia Only). federal register of legislative instruments F2013C00763[EB/OL]. [2016-10-15].https://www.legislation.gov.au/Details/F2016C00122.
[7] Goodhew H J. New Zealand (Maximum residue limits of agricultural compounds) food standards [S]. Wellington:Ministry for Primary Industries, 2015.
[8] 日本农林水产省.水产用医药品的使用第28报[R].2016[EB/OL]. [2016-10-15].http://www.maff.go.jp/j/syouan/suisan/suisan_yobo/pdf/28_suiyaku.pdf.
[9] European Medicines Agency. European public MRL assessment report (EPMAR):Isoeugenol (fin fish)[R].Commission Regulation (EU) No 363/2011,O.J. L 100, of 14.04.2011. 2011[EB/OL]. [2016-10-15].http://www.ema.europa.eu/docs/en_GB/document_library/Maximum_Residue_Limits_-_Report/2011/05/WC500106362.pdf.
[10] 庄平, 徐滨, 章龙珍,等. MS-222和丁香酚对中华鲟幼鱼耗氧率与排氨率的影响[J]. 中国水产科学, 2009, 16(4):612-618.
[11] Cupp A R, Hartleb C F, Fredricks K T, et al. Effectiveness of eugenol sedation to reduce the metabolic rates of cool and warm water fish at high loading densities[J]. Aquaculture Research, 2016, 47(1):234-242.
[12] Forgan L G, Forster M E. Oxygen consumption, ventilation frequency and cytochrome c oxidase activity in blue cod (Paraperciscolias) exposed to hydrogen sulphide or isoeugenol[J]. Comparative Biochemistry and Physiology C—Toxicology & Pharmacology, 2010,151(1):57-65.
[13] Sutili F J, Kreutz L C, Noro M, et al. The use of eugenol againstAeromonashydrophilaand its effect on hematological and immunological parameters in silver catfish (Rhamdiaquelen)[J]. Veterinary Immunology & Immunopathology, 2014, 157(3/4):142-148.
[14] European Food Safety Authority. Conclusion on pesticide peer review:conclusion on the peer review of the pesticide risk assessment of the active substance eugenol[J]. EFSA Journal, 2012,10(11):9-14.
[15] 杨素芳, 闫小风, 薛华,等. 4种中药单体对牙根尖周炎中常见厌氧菌的抑菌效果评价[J]. 山西医药杂志, 2014(10):1108-1110.
[16] 向强, 郑敏. 氧化锌丁香酚水门汀治疗干槽症[J]. 检验医学与临床, 2015(14):2136-2137.
[17] 申崇光, 陈妍, 田嘉松. 丁香酚对牙龈炎、牙菌斑的减缓作用[J]. 口腔护理用品工业, 2011(4):6-7.
[18] 俞懿强,邹德荣. 丁香酚的药理作用及在口腔医学应用的研究进展[J]. 临床口腔医学杂志,2009, 25(3):187-189.
[19] 国家卫生和计划生育委员会. GB 2760—2014食品安全标准食品添加剂使用标准[B].北京:中国标准出版社,2014.
[20] The Flavor and Extract Manufacturers association of the united states. FEMA flavor ingredient library[EB/OL]. [2016-10-25].http://www.femaflavor.org/flavor/search?text=eugenol.
[21] European Food Safety Authority. Database of flavouring substances - European Commission [EB/OL]. [2016-04-25].http://www.efsa.europa.eu/en/topics/topic/flavourings.
[22] Endo T,Ogishima K, Tanaka H, et al. Studies on the anesthetic effect of eugenol in some fresh water fishes [J]. Nippon Suisan Gakkaishi, 1972, 38(7):761-787.
[23] Hekimoglu, M A, Ergun M. Evaluation of clove oil as anaesthetic agent in fresh water angelfish,Pterophyllumscalare[J]. Pakistan Journal of Zoology, 2012, 44(5):1297-1300.
[24] Cooke S J,Suski C D, Ostrand K G, et al. Behavioral and physiological assessment of low concentrations of clove oil anaesthetic for handling and transporting largemouth bass (Micropterussalmoides).[J]. Aquaculture, 2004, 239(1/4):509-529.
[25] Akbari S,Khoshnod M J, Rajaian H, et al. The use of eugenol as an anesthetic in transportation of with Indian shrimp (Fenneropenaeusindicus) post larvae [J]. Turkish Journal of Fisheries & Aquatic Sciences, 2010, 10(3):423-429.
[26] Huntsberger C. Use of Injectable eugenol for euthanasia and anesthesia of American lobsters (Homarusamericanus) and similar species [D]. Carlton:Roger Williams University, 2012.
[27] Manush S, Asimkumar P. Anesthetic effect of eugenol and menthol on handling stress inMacrobrachiumrosenbergii[J]. Aquaculture, 2009, 298(1/2):162-167.
[28] Suquet M, Kermoysan G D, Araya R G, et al. Anesthesia in Pacific oyster,Crassostreagigas[J]. Aquatic Living Resources, 2009, 22(1):29-34.
[29] International Agency for Research on Cancer (IARC). IARC monographs on the evaluation of carcinogenic risks to humans volume 36: allyl compounds, aldehydes, epoxides and peroxides [EB/OL]. [2016-10-25].http://monographs.iarc.fr/ENG/Monographs/vol1-42/mono36.pdf.
[30] World Health Organization.The WHO recommended classification of pesticides by hazard and guidelines to classification[R]. Geneva: World Health Organization Press, 2009.
[31] World Health Organization. Harmonization project document No. 5: skin sensitization in chemical risk assessment [R]. Geneva: World Health Organization Press, 2008.
[32] National Institutes of Health. National toxicology program technical report series no.223 carcinogenesis studies of eugenol in F344/N rats and B6C3F1 mice (feeding studies) [R]. North Carolina: U.S. Department of Health and Human Services, 1983.
[33] Guénette S A, Uhland F C, Hélie P, et al. Pharmacokinetics of eugenol in rainbow trout (Oncorhynchusmykiss)[J]. Aquaculture, 2007, 266(1/4):262-265.
[34] Meinertz J R, Schreier T M, Porcher S T, et al. Depletion of eugenol residues from the skin-on fillet tissue of rainbow trout exposed to 14 C-labeled eugenol [J]. Aquaculture, 2014,430(1):74-78.
[35] Kildea M A, Allan G L, Kearney R E. Accumulation and clearance of the anaesthetics clove oil and AQUI-STMfrom the edible tissue of silver perch (Bidyanusbidyanus)[J]. Aquaculture, 2004, 232(1/4):265-277.
[36] Li J, Zhang J, Liu Y. Optimization of solid-phase-extraction cleanup and validation of quantitative determination of eugenol in fish samples by gas chromatography-tandem mass spectrometry [J]. Analytical and Bioanalytical Chemistry, 2015, 407(21):6563-6568.
[37] Ke C, Liu Q, Li L, et al. Simultaneous determination of eugenol, isoeugenol and methyleugenol in fish fillet using gas chromatography coupled to tandem mass spectrometry [J]. Journal of Chromatography B Analytical Technologies in the Biomedical & Life Sciences, 2016(1031):189-194.
[38] 国家卫生和计划生育委员会疾病预防控制局. 中国居民营养与慢性病状况报告[M]. 北京:人民卫生出版社, 2015.
[39] Joint FAO / WHO Expert Committee on Food Additives. WHO technical report series 934: evaluation of certain food additives, page 49-54[R]. Geneva: World Health Organization, 2006.
[40] 中国营养学会. 中国居民膳食指南2016[M].北京:人民卫生出版社,2016.
[41] Canadian Food Inspection Agency. Animal health care products and production aids [EB/OL]. [2017-05-04].http://www.inspection.gc.ca/food/organic-products/standards/animal-health/eng/1327935670685/
1327935800942?chap=0.
[42] Food and Drug Administration. ANADA 200-226 Tricaine-S - original approval [EB/OL]. [2017-05-04].https://www.fda.gov/AnimalVeterinary/Products/ApprovedAnimalDrugProducts/FOIADrugSummaries/ucm132992.htm.
[43] Rosalie R S. Zero withdrawal anesthetic for all finfish and shellfish [J].Fisheries, 2006, 31(3):122-126.
[44] The Japan Food Chemical Research Foundation. Revision of MRLs of agricultural chemicals, feed additives and veterinary drugs in foods.Maximum residue Limits (MRLs) list of agricultural chemicals in foods: eugenol [EB/OL]. [2016-10-27].http://www.m5.ws001.squarestart.ne.jp/foundation/agrdtl.php?a_inq=12900.
[45] 日本农林水产省动物医药品监察所. FA100使用注意事项[EB/OL]. [2016-10-27].http://www.nval.go.jp/asp/asp_dbDR_idx.asp.
[46] New Zealand Food Safety Authority. Proposed amendment to the New zealand (Maximum residue limits of agricultural compounds) food standards 2005: proposal to exempt eugenol and its isomers [R]. Wellington:Ministry for Primary Industries, 2005.
