白细胞介素-34对类风湿关节炎成纤维样滑膜细胞CCL28表达的影响①
2018-03-07欧阳寻丽孙晓彤
欧阳寻丽 李 寒 孙晓彤 张 彦 李 霞 魏 晶
(大连医科大学,大连 116044)
RA是一种病因不明,以滑膜增生和关节软骨破坏为特征的自身免疫病,其病因和发病机制尚不明确。其主要病理表现为滑膜衬里层成纤维细胞增生,导致滑膜衬里层增厚,继而向血管翳转化,最终引起软骨和骨的侵蚀破坏。FLS在RA中异常活化[1],活化的FLS可分泌多种细胞因子、趋化因子和基质降解酶等活性介质,介导炎症反应,引起骨和软骨组织的破坏[2]。IL-34是近年新发现的一种细胞因子,具有增强单核细胞活力、调节髓样细胞生长分化、加速破骨细胞形成等生物学功能[3,4]。有研究表明转化生长因子和骨形成蛋白2可抑制RA FLS IL-34的表达[5]。我们及其他研究者发现RA患者血清IL-34水平升高,且与疾病病情活动有关[6-8],但IL-34对RA FLS的作用尚不清楚。CCL28是近年新发现的一种CC类趋化因子[9],在炎症、肿瘤免疫中起重要作用,但关于CCL28参与自身免疫病的相关报道甚少,尤其在RA FLS中的作用机制尚无报道。本实验通过研究IL-34对RA FLS CCL28表达的影响,初步探讨其在RA发病中的作用。
1 材料与方法
1.1实验材料
1.1.1研究对象 关节滑膜组织取自大连医科大学第二附属医院关节外科行关节置换术的RA患者,本研究得到大连医科大学第二附属医院伦理委员会支持(批准文号:2015-02),所有患者均签署知情同意书,且均符合1987年ACR修订的RA分类标准[10],并排除其他风湿性疾病,其中男性2例,女性4例。
1.1.2主要试剂 DMEM培养基、青-链霉素、胰酶购买于美国Hyclone公司,胎牛血清购自美国Gibco公司,IL-34及受体拮抗剂购于R&D公司,c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)抑制剂(SP600125)、p38 MAPK抑制剂(SB203580)、NF-κB抑制剂(IKK-16)、细胞外调节蛋白激酶 (Extracellular regulated protein kinases,Erk)抑制剂(FR180204)均为美国Selleck公司产品,RNAiso plus、反转录试剂盒购于宝生物公司,ELISA试剂盒购于南京森贝伽生物科技公司,酶标分析仪为BioTek ELX-800,购于美国宝特公司。
1.2实验方法
1.2.1RA患者FLS分离、培养与鉴定 无菌条件下获取手术中RA患者的滑膜,浸泡于预冷DMEM培养基中,无菌磷酸盐缓冲液洗涤,去除残留脂肪和结缔组织,将滑膜剪成1 mm3小块,加入胶原酶Ⅰ(2.5 mg/ml),37℃消化2 h,200目钢网过滤,1 000 r/min离心5 min后用无血清的DMEM培养基洗涤,加入含10%胎牛血清、1%青-链霉素(P/S)的高糖DMEM培养基中培养。选取第 4 代进行表型鉴定(CD14-、CD68-、Vimentin+>95%),确认后第3~5代细胞用于实验。
1.2.2IL-34刺激FLS 将6株FLS分别接种于6孔板中,调整细胞密度约为2×104个/ml。细胞分为三组:刺激组、受体拮抗剂组和信号通路抑制剂组。刺激组:每孔加入IL-34(100 ng/ml) 刺激细胞0、6、24、48、72 h,刺激6 h的细胞提取RNA,收集0、24、48、72 h上清用于ELISA检测;受体拮抗剂组:每孔先加入集落刺激因子1受体(Colony stimulating factor 1 recepter,CSF-1R)抗体(100 ng/ml),37℃,5%CO2孵箱孵育1 h后,再加入IL-34(100 ng/ml)刺激48 h;信号通路抑制剂组:每孔分别加入IKK-16、SP600125、SB203580、FR180204各10 μmol/L,37℃,5%CO2孵箱孵育1 h后加入IL-34(100 ng/ml)刺激细胞48 h。收集各组细胞培养上清用于ELISA检测。
1.2.3RNA抽提和反转录 将上述方法培养的FLS按1×105个/ml传入6孔板中,按试剂盒说明书常规操作提取总RNA并反转录合成cDNA,以cDNA为模板进行PCR扩增,引物序列见表1,退火温度为58℃。所得产物用Syber GreenⅠ预染的2%琼脂糖凝胶进行电泳,结果于紫外灯下观察。
1.2.4ELISA方法检测上清CCL28水平 采用ELISA双抗体夹心法检测细胞培养上清中CCL28水平,具体操作按说明书进行。试剂盒灵敏度为 2 ng/L。

2 结果
2.1IL-34促进RA患者FLS CCL28的表达 采用RT-PCR法检测IL-34刺激FLS 6 h后CCL28 mRNA的表达。结果显示,与未刺激组相比,IL-34刺激的RA FLS其CCL28 mRNA的表达明显升高(图1A);ELISA检测IL-34刺激RA FLS 0、24、48、72 h后上清CCL28水平,结果显示,与未刺激组相比,在不同时间点IL-34刺激的FLS分泌CCL28均增加且呈时间依赖性(P<0.05,图1B)。表明IL-34可能上调RA FLS表达CCL28。
表1引物序列
Tab.1Primersequences
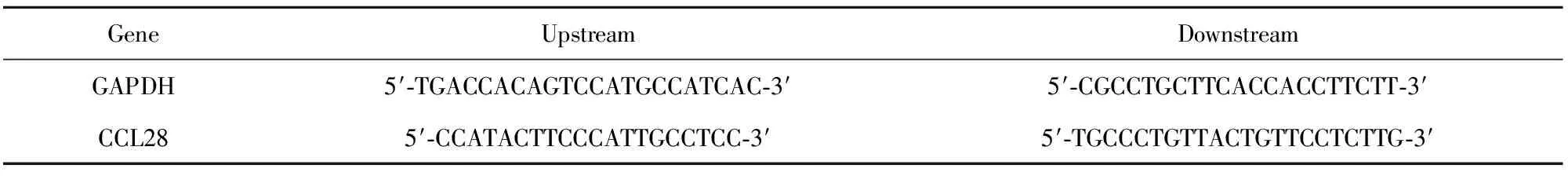
GeneUpstreamDownstreamGAPDH5′⁃TGACCACAGTCCATGCCATCAC⁃3′5′⁃CGCCTGCTTCACCACCTTCTT⁃3′CCL285′⁃CCATACTTCCCATTGCCTCC⁃3′5′⁃TGCCCTGTTACTGTTCCTCTTG⁃3′

图1 IL-34刺激前后RA患者FLS CCL28表达情况Fig.1 Expressions of CCL28 of FLS in RA FLS before and after IL-34 stimulationNote: *.P<0.05,compared with the control.
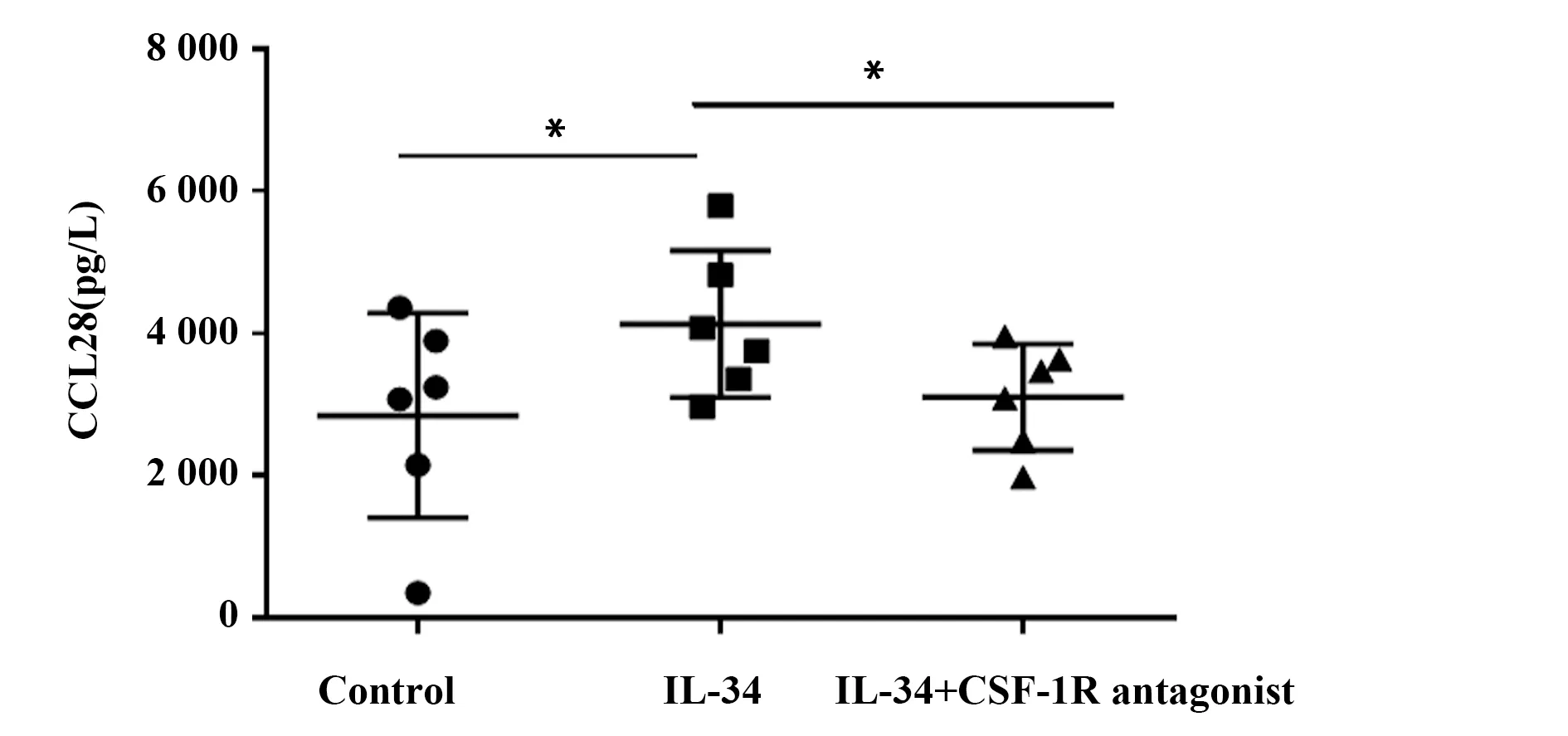
图2 加入CSF-1R抗体前后RA FLS分泌CCL28水平的变化Fig.2 Comparison of CCL28 levels in RA FLS with or without CSF-1R antagonist treatmentNote: *.P<0.05,compared with the control.
2.2IL-34通过与IL-34受体结合促进FLS表达CCL28 多个研究发现RA FLS表面高表达IL-34受体,为验证IL-34是否通过与其受体结合介导CCL28的表达,本实验在IL-34刺激的RA FLS培养体系中入CSF-1R抗体后再培养48 h后用ELISA测定细胞培养上清CCL28水平。结果显示,与未加入拮抗剂组相比,加入拮抗剂后IL-34刺激的RA FLS CCL28水平明显降低(P<0.05,图2)。提示IL-34可能通过RA FLS表面的CSF-1R结合而发挥作用。
2.3IL-34激活p38 MAPK和NF-κB信号通路促进RA FLS 分泌CCL28 在RA FLS中先加IKK-16、SP600125、SB203580、FR180204孵育1 h后,再加IL-34刺激48 h,利用ELISA检测上清中CCL28水平。结果显示,与未加入信号抑制剂组相比,加入SB203580和IKK-16后RA FLS分泌CCL28水平明显下降(P<0.05),而加入SP600125、FR180204后CCL28水平没有明显变化(P>0.05,图3)。说明IL-34可能通过激活p38 MAPK和NF-κB通路促进RA FLS分泌CCL28。

图3 信号通路抑制剂作用前后IL-34刺激RA FLS分泌CCL28水平的变化Fig.3 Levels of CCL28 of FLS in RA FLS before or after adding signaling pathway inhibitorsNote: *.P<0.05,compared with the control.
3 讨论
RA是一种常见的自身免疫病,渐进性关节软骨及骨质破坏伴累及正常关节为该病的主要致残原因。有研究表明FLS是RA损伤的主要细胞[1],活化的FLS可使滑膜组织中大量炎性细胞(T淋巴细胞、B淋巴细胞、巨噬细胞等)浸润由循环穿过血管内皮外渗至炎症关节,此过程趋化因子发挥重要作用[2]。CCL28也称黏膜相关上皮趋化因子,广泛表达于黏膜组织的上皮细胞,唾液腺、乳腺、结肠和直肠表达较丰富。CC类趋化因子受体10(CC motif chemokine receptor 10,CCR10)和CCR3是CCL28的两个受体[11],其与受体结合后可参与黏膜反应、炎症反应、肿瘤免疫调节等。有研究者发现原发干燥综合征(primary Sjögren′s syndrome,pSS)的患者唾液中CCL28明显降低[12],特应性皮炎、银屑病、大疱性类天疱疮的患者血清中CCL28明显升高[13],提示其可能参与了自身免疫病的发病过程。也有研究表明CCL28和CCL10在RA患者滑膜组织的髓系细胞和内皮细胞均有表达,其可与内皮细胞上的CCR10结合激活Erk信号通路促进血管翳形成,加重RA患者病情[14]。
IL-34是由241个氨基酸组成的二聚体蛋白,在心、肝、脑、脾等多种组织中均可表达,尤其在脾脏中呈高表达[3],能诱导人全血中IL-6、IL-8、干扰素诱导蛋白10、单核细胞趋化蛋白1产生[15],也能促进人外周血单核细胞的生存以及骨髓培养中巨噬细胞集落形成单位的形成[3]。近来大量的研究已经证实IL-34与多种自身免疫性疾病以及炎症性疾病密切相关,如RA、溃疡性结肠炎、pSS、冠状动脉炎等,尤其在类风湿关节炎中研究较为深入[16-18]。我们前期的研究证实RA患者血清IL-34的表达水平明显增高[8],且在IL-34增高的患者中,IL-34升高程度与类风湿因子以及抗环状瓜氨酸抗体表达量呈正相关[7]。推测IL-34可能通过影响RA发病中的某些主要效应细胞的功能加重RA患者病情,而FLS是介导RA损伤的主要效应细胞,我们为研究IL-34对RA FLS是否有影响,因此在体外用IL-34刺激FLS,结果显示IL-34刺激后FLS CCL28的表达明显升高。表明IL-34可能通过刺激FLS分泌CCL28参与RA的病理过程。
IL-34通过与其受体结合可参与多种疾病生理和病理过程,包括细胞分化、增殖、炎症和免疫反应,RA FLS高表达CSF-1R,且CSF-1R是IL-34的受体之一[19-21]。我们的实验结果表明IL-34通过与CSF-1R结合上调RA FLS表达CCL28。既然IL-34与RA FLS表面的CSF-1R相互作用上调CCL28的表达,我们深入信号通路研究,加入JNK、p38 MAPK、NF-κB、Erk相关信号通路抑制剂后,结果显示抑制p38 MAPK和NF-κB通路后RA FLS分泌CCL28明显减少,提示IL-34刺激RA FLS分泌CCL28可能是通过激活p38 MAPK和NF-κB实现的。
综上所述,本研究表明IL-34可与CSF-1R结合通过激活p38 MAPK和NF-κB通路促进RA FLS表达CCL28从而介导RA的炎症反应,但IL-34在RA发病机制中的具体作用尚待进一步探讨。
[1] Muller-Ladner U,Ospelt C,Gay S,etal.Cells of the synovium in rheumatoid arthritis.Synovial fibroblasts [J].Arthritis Res Ther,2007,9(6):223-233.
[2] Huber LC,Distler O,Tarner I,etal.Synovial fibroblasts:key players in rheumatoid arthritis [J].Rheumatology(Oxford),2006,45(6):669-675.
[3] Lin H,Lee E,Hestir K,etal.Discovery of a cytokine and its receptor by functional screening of the extracellular proteome [J].Science,320(5877):807-811.
[4] Guilonneau C,Bézie S,Anegon I.Immunoregulatory properties of the cytokine IL-34 [J].Cell Mol Life Sci,2017,74(14):2569-2586.
[5] Chemel M,Brion R,Segaliny AI,etal.Bone morphogenetic protein 2 and transforming growth factor β1 inhibit the expression of the proinflammatory cytokine IL-34 in rheumatoid arthritis synovial fibroblasts [J].Am J Pathol,2017,187(1):156-162.
[6] Tian Y,Shen H,Xia L,etal.Elevated serum and synovial fluid levels of interleukin-34 in rheumatoid arthritis:possible association with disease progression via interleukin-17 production [J].J Interferon Cytokine Res,2013,33(7):398-401.
[7] Moon SJ,Hong YS,Ju JH,etal.Increased levels of interleukin 34 in serum and synovial fluid are associated with rheumatoid factor and anticyclic citrullinated peptide antibody titers in patients with rheumatoid arthritis [J].J Rheumatol,2013,40(11):1842-1849.
[8] Wang B,Ma ZJ,Wang MM,etal.IL-34 upregulated Th17 production through increased IL-6 expression by rheumatoid fibroblast-like synoviocytes[J].Mediators Inflamm,2017:1567120
[9] Wang W,Soto H,Oldham ER,etal.Identification of a novel chemokine (CCL28),which binds CCR10 (GPR2) [J].J Biol Chem,2000,275(29):22313-22323.
[10] Arentt FC,Edworthy SM,Bloch DA,etal.The ARA 1987 revised criteria for classification on rheumatoid arthritis [J].Arthritis Rheum,1988,31(3):315-324.
[11] Pan J,Kunkel EJ,Gosslar U,etal.A novel chemokine ligand for CCR10 and CCR3 expressed by epithelial cell sinmucosal tissues [J].J Immunol,2000,165(6):2943-2949.
[12] Hernandez-Molina G,Burkhardt AM,Lima G,etal.Absence of salivary CCL28 in primary Sjögren′s syndrome [J].Rheumatol Int,2015,35(8):1431-1434.
[13] Kagami S,Kakinuma T,Saeki H,etal.Increased serum CCL28 levels in patients with atopic dermatitis,psoriasis vulgaris and bullous pemphigoid [J].J Invest Dermatol ,2005,124(5):1088-1090.
[14] Chen Z,Kim SJ,Essani AB,etal.Characterising the expression and function of CCL28 and its corresponding receptor,CCR10,in RA pathogenesis [J].Ann Rheum Dis,2015,74(10):1898-1906.
[15] Eda H,Zhang J,Keith RH,etal.Macrophage-colony stimulating factor and interleukin-34 induce chemokines in human whole blood [J].Cytokine,2010,52(3):215-220.
[16] Chemel M,Le Goff B,Brion R,etal.Interleukin 34 expression is associated with synovitis severity in rheumatoid arthritis patients [J].Ann Rheum Dis,2012,71(1):150-154.
[17] Das LM,Katz J ,Awais D,etal.Increased levels of IL-34,a novel colony stimulating cytokine in the intestinal lesions of ulcerative colitis patients [J].Gastroenterology,2012,142(5):s872-s873.
[18] Ciccia F,Alessandro R,Rodolico V,etal.IL-34 is overexpressed in the inflamed salivary glands of patients with Sjogren′s syndrome and is associated with the local expansion of pro-inflammatory CD14brightCD16+monocytes [J].Rheumatology,2013,52 (6):1009-1017.
[19] Hume DA,Freeman TC.Transcriptomic analysis of mononuclear phagocyte differentiation and activation [J].Immunol Rev,2014,262(1):74-84.
[20] Liu H,Leo C,Chen X,etal.The mechanism of shared but distinct CSF-1R signaling by the non-homologous cytokines IL-34and CSF-1[J].Biochim Biophys Acta,2012,1824(7):938-945.
[21] Yang S,Jiang S,Wang Y,etal.Interleukin 34 upregulation contributes to the increment of microRNA 21 expression through STAT3 activation associated with disease activity in rheumatoid arthritis [J].J Rheumato,2016,43(7):1312-1319.
