NOD小鼠胰岛的分离及其在体内外的生物学特性
2018-03-06舒冠男滕夏虹许倩倩邹春林
舒冠男,滕夏虹,许倩倩,邹春林
(1. 广西医科大学转化医学中心,南宁 530021; 2. 长寿与老年相关疾病教育部重点实验室(广西医科大学),南宁 530021; 3. 广西医科大学基础医学院,南宁 530021; 4. 广西医科大学信息与管理学院,南宁 530021)
Conflict of interest statement: We declare that we have no conflict of interest statement.
1型糖尿病是一类自身免疫性疾病,胰岛β细胞由于受到自身免疫系统的攻击,导致胰岛β细胞的破坏,胰岛素的绝对缺乏,产生一系列的代谢障碍和血糖升高。目前常用的1型糖尿病动物模型是链脲佐菌素(streptozotocin, STZ)诱导的1型糖尿病啮齿类动物模型[1], 但这种模型是利用STZ对胰岛β细胞的选择性毒性杀伤作用,诱使动物产生糖尿病,这种化学诱导法虽然简单易操作,但与临床上1型糖尿病病人的发病原因并不相同。非肥胖型糖尿病小鼠(NOD)是通过选择繁殖和近亲交配从Jcl:ICR小鼠中获得的一种1型糖尿病小鼠模型,该小鼠模型通常于4~5周龄开始出现胰岛炎,进而破坏胰岛β细胞,于12~14周龄时出现明显糖尿病症状,到30周龄时雌性小鼠累计发病率可达到60%~80%,而雄性小鼠则不到20%~30%[2]。其与1型糖尿病患者一样,都是由于自身免疫系统的攻击导致胰岛细胞的损坏,最终导致代谢紊乱和血糖升高。因此,在1型糖尿病的研究中,具备较高的研究与实用价值。目前国内有关NOD小鼠胰岛分离与纯化方法的研究报导较少[3],未见有对分离的NOD小鼠胰岛生物学功能的详细研究报道。本文旨在建立一种稳定高效的NOD小鼠胰岛分离方法,并对其体内外的生物学功能进行研究。旨在为今后利用NOD小鼠进行胰岛移植实验提供有价值的实验依据。
1 材料与方法
1.1 实验材料
1.1.1 实验动物
7~8周龄雌性SPF级NOD小鼠23只, 体重18~20 g;13周龄雌性SPF级NOD小鼠30只,体重 22~25 g,均由北京华阜康生物科技股份有限公司【SCXK(京)2014-0004】,并已通过相关检疫,饲养于广西医科大学实验动物中心【SYXK桂2014-0003】,SPF级封闭环境下,温度: 22~24℃, 湿度:45%~80%, 光照:150~300 Lx, 12 h昼夜交替。动物实验方案已通过广西医科大学实验动物管理与伦理委员会审查批准(批准号:201702007)。
1.1.2 主要试剂
胶原酶(货号:C9263)、Ficoll PM 400(货号:F4375)和双硫腙 (dithizone, DTZ)(货号:D5130) 均购自Sigma公司。小鼠Insulin ELISA试剂盒(货号:10-1247-01)购自Mercodia公司。25 μL气相微量进样针购自Hamilton公司。RPMI-1640(货号:11875-093)和胎牛血清(fetal bovine serum,FBS)(货号:10099-141) 购自Thermo Fisher Scientific公司。
1.2 实验方法
1.2.1 实验分组
同基因胰岛移植胰岛供体小鼠:7~8周龄血糖正常的雌性NOD小鼠。同基因胰岛移植受体小鼠:13周龄的雌性NOD小鼠每周监测两次血糖,连续两次血糖均>16.7 mmol/L即定义为发病小鼠,30只小鼠中共有12只发病,将发病小鼠随机分为两组,每组6只,一组移植组,一组为假手术组。
1.2.2 小鼠胰岛细胞团的分离纯化
10%水合氯醛腹腔注射麻醉胰岛供体NOD小鼠,动脉夹夹闭胆总管近胆囊端。小号头皮针(0.45 mm×0.16 mm)于胆总管内插管逆行注射预冷的胶原酶2~2.5 mL。分离胰腺,转移至50 mL离心管,每只胰腺再加入2 mL胶原酶溶液,于37℃水浴锅中消化18 min。消化完毕加入预冷的RPMI 1640溶液至50 mL终止消化,手摇1 min,然后通过孔径为500 μm的不锈钢滤网过滤,离心去上清(800 r/min,2 min),并再次洗涤两次(800 r/min, 2 min)。完全去除RPMI1640液,加入4 mL 25%的Ficoll (常温),涡旋数秒,待细胞液混合均匀,转移至15 mL离心管。再依次沿离心管壁缓慢加入2 mL 23%、21.5%、11.5%的Ficoll溶液和2 mL RPMI1640溶液,常温下2 500 r /min,离心15 min,并缓慢降速。使用微量移液器小心吸取11.5%与21.5%交界层的细胞团。转移至15 mL离心管,加入8 mL RPMI1640溶液洗涤两次(800 r/min,2 min)。
1.2.3 分离胰岛的染色鉴定与纯度分析
将分离纯化后的胰岛细胞团转移至6 cm培养皿,加入3 mL RPMI 1640。均匀加入60 μg/mL的DTZ溶液3 mL,避光常温下孵育15 min。倒置显微镜下拍照观察。成桃红色的即为胰岛细胞团。Image J 统计计数阳性胰岛细胞团。
1.2.4 分离胰岛糖刺激实验
胰岛细胞团培养两天后,于倒置显微镜下,采用20 μL的移液枪小心吸取胰岛细胞团置于1.5 mL EP管中,50个胰岛/管,共3管,然后转移至24孔板中。分别按照KRBB基础液,含1.6 mmol/L 葡萄糖的KRBB低糖刺激液和含16.7 mmol/L葡萄糖的KRBB高糖刺激液的顺序依次刺激1 h、1.5 h、1.5 h。收集低糖与高糖刺激上清液。采用小鼠的insulin的ELISA试剂盒检测胰岛素的分泌量。

注:a. 新鲜分离胰岛;b. DTZ染色胰岛;c. 培养2 d后胰岛。bars=200 μm图1 分离纯化后胰岛细胞团Note. A. freshly isolated islets. b. DTZ-stained islets. c. islets after 2 days of culture. Scale bars=200 μm.Fig.1 Isolated and purified NOD mouse islets
1.2.5 分离胰岛的移植实验
科学研究是建立在诚信的基础上的。科学的目标在于求真——探究自然界运动变化的规律,所谓“真”,即与事实相符合。科学家探求真理是通过“从事实出发探究其中规律”的途径实现的,为此必须不断地通过观察实验而获得大量的、确凿的经验事实和数据,并在此基础上提出规律性的说明,否则“巧妇难为无米之炊”,探究自然规律就无从谈起。由此,所获经验事实和数据必须真实可信,不容半点虚假,否则会导致虚假、无效的结论。
在倒置显微镜下收集胰岛细胞团与1.5 mL EP管中,每组收集300胰岛团左右。收集完毕于4℃冰上保存。转运至SPF级别的动物房中进行移植操作。将细胞团于离心机中离心30 s,采用微量移液器小心吸除大部分上清。留下大概20~30 μL上清液。10%的水合氯醛腹腔注射麻醉受体小鼠, 将小鼠正面放置于手术台,并将四肢固定。取脊柱旁切口暴露左侧肾脏,并轻轻将其挤压出体外。于肾脏中部将肾被膜切开一小口,通过该切口应用玻璃剥离子将肾被膜下腔隙扩张分离至肾上极,然后通过PE50管将胰岛细胞团缓慢注入肾被膜下(假手术组仅移植注射PBS),同时在移植过程中采用生理盐水始终保持肾被膜的湿润状态,并使用玻璃剥离子将胰岛细胞团推至远离切口处,将肾重新纳入腹腔内,缝合针缝合腹膜及皮肤。将小鼠置于热源灯光下复温1 h,待小鼠呼吸平稳,神经反射恢复,方可放回鼠笼中继续饲养。在手术后的两周内,每天检测小鼠非空腹血糖和体重,两周之后每周检测两次。
1.2.6 移植后小鼠腹腔糖耐量实验
分别于移植实验前一周,移植后两周行糖耐量实验。通过腹腔注射葡萄糖溶液(葡萄糖注射量为2.0 g/kg),然后分别测定0、15、30、60、90、120 min和180 min的血糖结果。通过计算血糖曲线的曲线下面积(AUC)来判断小鼠胰岛β细胞功能和机体对血糖的调节作用。
1.2.7 肾被膜下移植物的免疫组化染色
移植侧小鼠肾组织经 4%多聚甲醛固定,石蜡包埋, 切成 5 μm 厚的切片,石蜡切片经二甲苯和乙醇脱蜡,5%正常封闭用驴血清于室温下封闭1 h, 然后加入rabbit anti-insulin antibody(1∶100,Cell Signaling Technology)4℃孵育过夜,0.01 mol/L PBS 漂洗(5 min×3次),转入Alexa Fluor 555 donkey anti-rabbit IgG (H+L)(1∶400,Thermo Fisher Scientific)室温孵育1.5 h, 0.01 mol/L PBS 漂洗(5 min×3 次),然后DAPI复染细胞核5 min,0.01 mol/L PBS 漂洗(5 min×3 次),最后用含10%甘油的PBS封片,并于Olympus BX53荧光显微镜下观察拍照。
1.3 统计学分析

2 结果
2.1 分离胰岛的鉴定与纯度
胰岛细胞团经分离纯化后,镜下可见包膜完整、大小不一的细胞团(图1 a)。平均每只小鼠可分离得到(116±12)个胰岛团,胰岛细胞团经DTZ特异性染色后,呈现鲜艳的亮红色(图1b),经Image J计数阳性细胞团,结果显示,亮红色的胰岛细胞团占细胞团总数的90%以上,表明分离纯化后的胰岛细胞团纯度>90%。且该胰岛细胞团经培养2 d以后,相较于未培养前,形态更为光滑,包膜更为完整(图1c)。
2.2 血糖正常NOD小鼠胰岛与KM小鼠胰岛糖刺激胰岛素释放水平的比较

注:NOD小鼠胰岛与KM小鼠胰岛比较,***P<0.001。图2 NOD小鼠与KM小鼠胰岛素释放量比较Note.NOD mouse islets vs.KM mouse islets,***P<0.001.Fig.2 Comparison of the insulin secretion in NOD mice and KM mice
2.3 胰岛移植对糖尿病发病NOD小鼠血糖的影响
如图3所示,假手术组小鼠在两周左右陆续死亡,且血糖一直维持在20 mmol/L以上,而相对于假手术组,胰岛移植组小鼠在移植了(300±23)个胰岛后,血糖有了明显的降低(P<0.001)。有66%的老鼠在两周以内将血糖维持在10~15 mmol/L。两周后血糖逐步上升。而有33%的小鼠在移植后50 d仍然能够将血糖控制在10 mmol/L左右。

图3 胰岛移植后血糖变化Fig.3 Blood glucose levels at different times after islet transplantation
2.4 胰岛移植对糖尿病发病NOD小鼠体重的影响
如图4所示,在移植后,我们分别检测了假手术组和胰岛移植组小鼠的体重变化,移植组在移植后半个月体重变化不明显,与术前比较体重基本在0.5 g上下浮动,而假手术组小鼠在术后第5天和第7天体重较术前有明显减轻,其下降幅度分别为(4.68±0.55) g和(2.14±0.56) g,与移植组的体重变化幅度比较,差异有显著性(P<0.001和P<0.01)。

图4 移植后体重变化量Fig.4 Changes of body weight of the mice after transplantation
2.5 移植前后糖耐量实验结果
为了评价移植胰岛在体内的生物学功能,本研究分别于移植前和移植后两周,对胰岛移植组小鼠进行腹腔糖耐量实验。结果如图5所示,胰岛移植组小鼠的糖耐量在移植后明显改善,并通过比较糖耐量曲线下面积(area under the curve, AUC),结果如图6所示,移植前AUC值为(3784.2±435) mmol/L×180 min,移植后AUC值为(2489.2±389.3) mmol/L×180 min,差异有显著性(P<0.05)。

注:a. 在残存移植胰岛细胞团(白色虚线框出)周围存在大量的淋巴细胞浸润(红色箭头所指);b. 肾被膜下可见胰岛素抗体免疫荧光染色阳性的细胞团(红色荧光),DAPI复染细胞核,bar=200 μm。图7 移植后肾被膜下移植部位的HE染色和胰岛素抗体免疫荧光染色Note. Extensive lymphocyte infiltration (red arrows) surrounding the transplanted islet (outlined by a white line)(HE staining). B. Insulin-positive cells (red fluorescence) in an subcapsularly transplanted islet. The blue fluorescence indicates cell nuclei. Immunofluorescence DAPI staining. Scale bar=200 μm.Fig.7 Histology of an islet transplanted under the renal capsule

图5 糖耐量实验结果Fig.5 Results of IPGTT in the transplant recipients
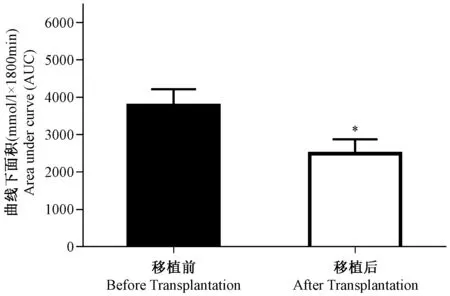
注:移植前与移植后比较,*P<0.05。图6 移植前和移植后糖耐量曲线下面积比较Note.Before vs.after transplantation,*P<0.05.Fig.6 Comparison of the areas under the curve (AUC) before and after islet transplantation
2.6 肾被膜下移植胰岛组织形态学观察
为了证实移植胰岛在受体小鼠体内的存活情况,本研究对移植侧小鼠肾脏进行HE染色和免疫荧光染色,结果显示肾被膜下可见胰岛素抗体免疫荧光染色阳性的细胞团,表明该细胞团确为移植入肾被膜下的胰岛细胞团(图7b),并且在残存移植胰岛细胞团周围存在大量的淋巴细胞浸润(图7a)。
3 讨论
1型糖尿病是一种由T淋巴细胞介导的以免疫性胰岛炎和选择性胰岛β细胞损伤为特征的自身免疫性疾病。在胰腺或胰岛移植术后,移植物胰岛内免疫细胞的积聚导致胰岛炎,是糖尿病复发的主要原因。 有研究报道1型糖尿病病人接受白细胞抗原相同的非糖尿病正常胰腺移植后,发生了针对移植物内胰岛的单核细胞浸润,胰岛结构被破坏,导致糖尿病复发[4]。提示即使同基因胰岛细胞移植同样有可能遭到1型糖尿病宿主自身免疫反应的攻击,而使移植的胰岛细胞被破坏。而NOD小鼠也是一种自身免疫性1型糖尿病小鼠模型。T细胞攻击胰岛细胞团导致胰岛素的分泌不足是其发病主要原因[5]。因此,NOD小鼠是一种研究如何保护移植胰岛免受自身免疫反应攻击的理想动物模型,而如何获得高质量的NOD小鼠胰岛以及对它们进行生物学功能进行分析是这方面研究的基础,目前有关这方面的研究报道不多。本文旨在建立一种高效稳定的NOD小鼠胰岛分离纯化方法,并对分离纯化的NOD小鼠胰岛进行生物学功能研究。
由于在血糖正常NOD小鼠的胰腺内,胰岛周围已有一定的炎性细胞浸润,因此本研究发现,在分离NOD小鼠胰岛的操作过程中,存在许多与之前其他研究报道的小鼠胰岛分离方法的不同之处:(1)消化酶浓度的的选择不同:有文献报道,小鼠胰腺多采用0.5~1 mg/L胶原酶[6-9],但本研究发现,NOD小鼠采用过高浓度的胶原酶消化,会对分离的胰岛团造成损害,破坏胰岛包膜的完整性,且会产生大量的死细胞,分泌许多粘性物质,影响胰岛团的纯化,因此在分离过程中,我们选择采用0.3 mg/mL的V型胶原酶进行灌注消化。不仅能够保持包膜的完整性,得到较高的产率,而且基本不产生粘性物质,不会影响后续的纯化移植。(2)静止消化时间上的不同:合适时间对于胰岛团的得率至关重要,但消化时间与所选择消化酶的种类和浓度密切相关,以小鼠胰岛分离中常用的collagenase P和collagenase V为例, 3 mg/mL的collagenase P消化时间一般为6~7 min,collagenase V一般为10 min[10],但在本实验中,由于降低了胶原酶的浓度,因此本研究选取了几个时间点作为比较:10、15、18 min和20 min,本研究发现10 min与15 min的细胞得率极低,18 min与20 min均能够得到纯度高,包膜完整的细胞团,因此本研究最终选择18 min作为消化时间,不仅节约了时间,而且提高了胰岛分离的产率。(3)分离纯化后NOD小鼠胰岛的体外培养:由于在胰岛分离纯化过程中,胰岛会受到许多外界压力的损伤,例如失巢凋亡[11]、缺氧和受损胰腺外分泌细胞所释放蛋白酶的损伤作用等[12-13]。 因此,通过体外培养过程,有利于所分离胰岛活性和功能的修复。此外,由于胰腺外分泌部细胞在体外悬浮培养条件下不易存活,也有利于排除胰岛分离过程中受损的胰腺外分泌细胞。本研究之所以选择葡萄糖浓度为11.1 mmol/L的RPMI 1640培养基,是由于有研究显示,当培养基的葡萄糖浓度低于11 mmol/L时,胰岛细胞内调节糖代谢的基因表达将下调,而当葡萄糖浓度高于11 mmol/L时,将导致培养胰岛细胞的损伤[14]。
在胰岛生物学功能研究方面,本研究在体外的糖刺激实验中发现,血糖正常NOD小鼠胰岛的刺激指数(SI=高糖刺激胰岛素分泌量/低糖刺激胰岛素分泌量比值)仅为1.33,远低于KM小鼠。这表明由血糖正常NOD小鼠分离的胰岛细胞团,其胰岛素分泌功能已经受损。这与NOD小鼠在4到5周出现胰岛炎的报道相一致。在NOD小鼠同基因异体的移植实验中,我们发现胰岛移植后所有NOD糖尿病小鼠的血糖水平明显降低,表明移植胰岛在受体小鼠体内能够分泌胰岛素调节宿主血糖,但移植胰岛在改善受体小鼠高血糖状态时间长短方面个体差异较大,有的受体小鼠在移植后,高血糖逆转仅能维持15 d,有的可维持50 d以上。由于是同基因小鼠间的移植,因此不存在同种异体排斥反应,出现上述移植胰岛不能在受体小鼠体内长期存活的原因,可能是已发生糖尿病的受体NOD小鼠自身免疫系统对移植胰岛的破坏所造成。本研究体内实验结果也显示,在移植后期,在残存移植胰岛的周围存在大量的淋巴细胞浸润。综上所述,本研究为今后利用NOD小鼠同基因异体胰岛移植模型,探讨1型糖尿病胰岛移植治疗中如何保护移植胰岛免受自身免疫系统攻击,提供了一定的研究基础和借鉴。
References)
[1] 金勇, 朱勇, 吴南翔. 实验性链脲佐菌素诱导的大、小鼠糖尿病动物模型研究进展 [J]. 中国比较医学杂志, 2009, 19 (3):80-82.
Jin Y, Zhu Y, Wu NX. Advances in experimental streptozotocin-induced rodent models of diabetes mellitus [J]. Chin J Comp Med, 2009, 19 (3):80-82.
[2] Anderson MS, Bluestone JA. The NOD mouse: a model of immune dysregulation [J]. Annu Rev Immunol, 2005, 23: 447-485.
[3] 蒋铁建, 苏恒, 周智广. NOD小鼠胰岛分离与纯化的方法研究 [J]. 中南大学学报 (医学版), 2002, 27(1): 85-87.
Jiang TJ, Su H, Zhou ZG. Study on isolation and purification of islets in NOD mice [J]. J Centr South Univ Med Sci, 2002, 27 (1): 85-87.
[4] Sibley RK, Sutherland DE, Goetz F, et al. Recurrent diabetes mellitus in the pancreas iso- and allograft. A light and electron microscopic and immunohistochemical analysis of four cases [J]. Lab Invest, 1985, 53(2): 132-144.
[5] Adorini L, Gregori S, Harrison LC: Understanding autoimmune diabetes: insights from mouse models [J]. Trends Mol Med, 2002, 8(1): 31-38.
[6] 李敏, 宋陆军, 高晓东, 等. 一种高效的小鼠胰岛分离纯化新技术 [J]. 中国临床医学, 2011,18(02): 145-146,149.
Li M, Song LJ, Gao XD, et al. An efficient technology for isolation and purification of mouse islets [J]. Chin J Clin Med, 2011,18 (02): 145-146,149.
[7] Shewade YM, Umrani M, Bhonde RR. Large-scale isolation of islets by tissue culture of adult mouse pancreas [J]. Transplant Proc, 1999, 31 (3): 1721-1723
[8] 刘爽, 崔士华, 孙海晨, 等. 一种改良的小鼠胰岛分离和移植模型 [J]. 首都医科大学学报, 2009, 30(2): 259-261.
Liu S, Cui SH, Sun HC, et al. An improved model for isolation and transplantation of mouse islets[J]. J Capit Med Univ, 2009, 30 (2): 259-261.
[9] Yin ZL, Zuo FN, Li H, et al. A rapid, efficient, and economic device and method for the isolation and purification of mouse islet cells [J]. PLoS One, 2017, 12(2): e0171618.
[10] Ramírez-Domínguez M (ed.), Pancreatic Islet Isolation, Advances in Experimental Medicine and Biology [M]. Switzerland: Springer International Publishing, 2016.
[11] Wang RN, Rosenberg L. Maintenance of beta-cell function and survival following islet isolation requires re-establishment of the islet-matrix relationship [J]. J Endocrinol, 1999, 163(2):181-90.
[12] Elgendy H, Okitsu T, Kimura Y, et al. Augmented damage of islets by impaired exocrine acinar cells undergoing apoptosis that is possibly converted to necrosis during isolation [J]. Islets, 2011, 3(3): 102-110.
[13] 韩小乐, 黎沙, 夏小林, 等. α-1抗胰蛋白酶减轻小鼠胰腺外分泌细胞对移植胰岛的损伤[J]. 中华器官移植杂志, 2015, 36 (2): 102-107.
Han XL, Li S, Xia XL, et al. α-1 antitrypsin reduces the damage about mouse pancreatic exocrine cells to graft islet [J]. Chin J Organ Transplant, 2015, 36 (2): 102-107.
[14] Bensellam M, Van Lommel L, Overbergh L, et al. Cluster analysis of rat pancreatic islet gene mRNA levels after culture in low-, intermediate- and high-glucose concentrations [J]. Diabetologia, 2009, 52(3): 463-476.
