Micro RNA 对间充质干细胞骨分化作用的研究进展
2018-03-05卓丽丹冯顶丽综述郭红延审校
卓丽丹,冯顶丽,芦 笛,李 红,傅 营 综述 郭红延 审校
因手术、创伤、牙周疾病导致骨缺损和骨缺失的修复问题一直备受人们关注。临床骨修复及再生传统方法主要有,自体骨移植、异体骨移植、引导组织再生和牵张成骨术。这些方法存在操作复杂、损伤大、修复时间长等局限性,近年来,骨组织工程和再生医学为骨修复或者骨再生提供了新的治疗策略。间充质干细胞(mesenchymal stem cell, MSC)是干细胞家族的重要成员,来源于发育早期的中胚层,属于多能干细胞。MSC具有成骨分化潜能,提取技术简便、来源广泛等优点,常用于工程化骨组织的构建。目前促进干细胞骨分化的方法有: 肽类、表型遗传、小分子化合物、Micro RNA和物理诱导等。越来越多的证据表明MicroRNA参与干细胞骨分化过程转录后的基因调控,本文主要以Micro RNA对MSC骨分化的研究进展进行阐述。
1 MSC发现及作用
1966年,Friedenstein等[1]首先发现骨髓中存在具有分化为成骨细胞的干细胞;至1991年Caplan[2]进一步将这类干细胞统称为“间充质干细胞”;1999年,Pittenger等[3]在science上发表,MSC具有多向分化的潜能,激起众多研究者对于MSC多向分化潜能的研究[4]。因MSC具有成骨分化潜能,来源广,易提取,目前已成为骨组织工程中理想的种子细胞[5]。
干细胞骨分化涉及多个信号通路、转录因子、化学小分子等之间的相互复杂而又稳定的作用。研究者对MSC成骨分化进行大量的研究[6],BMP、TGF、wnt/β-catenin、Notch、RUNX2、osterix、骨形成蛋白、地塞米松(dexamethasone)、β-甘油磷酸酯等对MSC骨向分化有重要的作用。近年来一些实验结果显示出Micro RNA (miRNA)在调节骨分化过程中起着关键的作用。
2 Micro RNA 的概述
miRNA是一种潜在的调节成骨分化的内源性小RNA分子,一般长度为21~25 bp,主要作用于mRNA的3’端非编码序列区,促进或者阻遏翻译作用。与骨方向分化的调控方式和通路有密切关系。单一miRNA可能作用于不同的信号传导通路或者转录因子,同时信号传导通路或者转录因子也可由不同的miRNA协调控制。因效率高,价格低,对于人体无损害,故成为目前干细胞骨分化研究热点,不同的miRNA对于MSC骨向分化扮演者不同的角色,本文对miRNA在MSC成骨分化中的作用进行如下进行阐述。
2.1 miRNA促进MSC骨向分化的机制 不同的miRNA作用靶点不同,其作用机制也各有差异。下面详细介绍一些miRNA促进MSC成骨分化的作用靶点及信号通路。
2.1.1 BMP信号传导通路 骨形成蛋白家族(BMP)对于干细胞骨向分化具有促进作用,是经典传导通路之一。BMP2、BMP4、BMP7可通过细胞膜上的跨膜受体,磷酸化smad1/5/7与smad4形成共价物进入细胞核内促进干细胞骨向分化[7]。2009年Kim等[8]在实验中使用慢病毒转载miR-196a在ADSC中过表达,发现降低了ADSC的增殖,但对于ADSC骨向分化具有促进作用,对脂向分化无任何影响。实验发现miR-196a通过靶向作用于HOXC8 3’UTR抑制HOXC8的蛋白和转录水平。HOXC8降低碱性磷酸酶(ALP)活性,对于骨分化具有抑制作用。2014年廖雅馨等[9]利用杆状病毒介导BMP2+miR-148b的共表达植入小鼠头盖骨4 mm缺损,发现BMP2+miR-148 b具有协同作用,促进骨缺损愈合,修复骨面积、骨量、骨密度分别为 (94.7±0.8)%,(89.4 ±11.1)%和(95.7±3.9)%。
2.1.2 TGF-β信号传导通路 TGF超家族广泛参与细胞的增殖、分化和胚胎的发育。主要分为TGF-β1、TGF-β2、TGF-β3其中BMP信号通路属于TGF-β1家族。2012年研究发现,hADMSC中过表达miR-22、过表达阴性对照、以及不作处理对照组,发现miR-22促进骨分化。进一步研究发现miR-22作用于TGF-β信号通路,通过抑制成骨相关转录因子(RUNX2)的抑制剂HDAC6促进骨分化[10]。成骨早期阶段,MIR-29b通过靶向调节WNT/smad/TGF-β信号通路抑制剂HDAC4,TGFbeta3,ACVR2A,CTNNBIP1和DUSP2,晚期成骨阶段,参与控制分化成骨细胞中的胶原合成,并且使用PCR定量分析成骨标志物,成骨标志物的水平随着miR-29b浓度的增加而增加[11]。
2.1.3 GSK信号传导通路 GSK-3是一种多功能的丝/苏氨酸蛋白激酶,GSK信号通路是将胞外信号转导至胞内,从而引起细胞反应的重要信号转导。系统主要有GSK-3α和GSK-3β两种亚型。采用人BMSC过表达miR-346,其作用靶点GSK-3β,耗尽GSK-3β促进骨分化,而过表达GSK-3β发现miR-346表达降低并且对于骨分化具有抑制作用。同时还发现miR-346对于WNT/βcatenin具有激活作用,促进骨分化[12]。2015年,Meng等[13]使用志愿者的MSC作为研究对象, 分别进行阴性对照、miR-21过表达、MiRNA-21基因沉默分组研究发现。miR-21过表达GSK-3β磷酸化,72 h后相对于阴性对照组,βcatenin表达增加,并且RUNX2蛋白表达量增加3倍。
2.1.4 Notch信号通路 是一种复杂的信号通路,具有双向作用,在脂肪分化过程中Notch显示出通过抑制WNT/βcatenin抑制骨向分化[13,14]。同时也有研究表明Notch信号通路具有促进骨分化的作用。Notch信号通路其受体与配体在骨分化中起重要作用,抑制Notch1活性能抑制BMP9诱导的MSC增殖和成骨分化中;DLL1增加BMP9诱导的MSC增殖和成骨分化,Jagged1能增加BMP9诱导的MSC增殖和体外成骨分化[15]。通过jag1的处理激活Notch信号通路,检测出miR-34a表达增加。随后研究发现,在根尖乳头干细胞(SCAP)中转染过表达miR-34a,导致NOTCH2, N2ICD, and HES1蛋白表达降低,但RUNX2, 锌指结构转录因子OSX, 骨钙素(OCN)和骨桥蛋白(OPN)蛋白水平上升,促进骨分化,转染2周后,SCAP的矿化导致miR-34a下调;SCAP 转染表达anti-miR-34a, NOTCH2, N2ICD, and HES1蛋白表达升高,然而RUNX2, OSX, OCN, 和OPN蛋白水平水平降低[16]。
2.2 miRNA直接作用于骨分化特异性转录因子 某些miRNA直接作用于特异性转录因子,RUNX2又称为核心结合因子,是骨分化的特异性转录因子,促进OCN、ALP和Ⅰ型胶原等成骨基因的表达,在骨分化的过程中RUNX2处于核心地位(表1)。
miR-9具有促进骨分化的作用,观察miR-9与RUNX2之间的相互关系。罗红等[17]取人的骨髓MSC(hBMSC)在成骨诱导液中培养观察miR-9的表达情况,以及过表达miR-9和正常组对照表明,miR-9促进RUNX2的表达,促进骨分化。 miR-22在成骨分化过程中表达升高,在成脂分化过程中降低。MiR-22作用机制为:miR-22与HDAC6的3’端UTR结合,阻遏HDAC6的翻译,对于RUNX2的抑制作用减弱,促进骨分化[10]。
3 miRNA抑制MSC骨向分化的作用
miR NA对于骨分化也可以发挥抑制作用,主要是通过阻碍信号传导通路的激活和抑制转录因子的翻译。以下介绍一些Micro RNA作用靶点及信号通路。
3.1 BMP信号传导通路 骨分化的经典信号通路,作用于信号通路的靶点不同其作用也有所差异。BMPR2是BMP信号通路的重要受体,对于激活BMP通路起重要作用。miR-542-3p作为已知的肿瘤抑制剂,在促进骨分化的过程中发现miR-542-3p表达量降低明显。发现miR-542-3p对于骨分化具有抑制作用,利用荧光素酶测定其作用的靶点为BMP-7,抑制BMP-7及其控制的BMP-7/PI3K/AKT信号通路进而抑制骨分化。动物实验注射miR-542-3p、anti-miR-542-3p进一步验证,得出anti-miR-542-3p促进骨分化,增加骨密度和骨强度,进一步验证生物力学指标值,如极限力、能量和刚度[24]。
3.2 TGF-β信号传导通路 作为信号传导通路中的大家族,smad是TGF-β受体信号转导的中介物质。miR-155转染BMP2诱导的成骨细胞系MC3T3-E1,利用qRT-PCR,14 d不同时间测量miR-155的表达,miR-155呈现一种降低趋势,在第7天降低尤为明显,并且呈现时间依赖性下调ALP活性和茜素红染色降低。并使用荧光素酶测量证实miR-155结合于smad5 mRNA 3’端UTR结合,阻滞信号通路的传导[25]。
3.3 Wnt/βcatenin信号传导通路 LRP受体在Wnt/βcatenin起重要的作用。在成骨成脂诱导分化过程中,miR-30大家族具有明显的促进脂肪分化,抑制成骨方向分化的作用。前成骨细胞MC3T3-E1过表达miR-30e 72 h后,抑制细胞的生长,并显著降低RUNX2、ALP、osterix,而在miR-30e抑制剂转染的前成骨细胞MC3T3-E1中出现相反的结果。通过荧光素酶测定其靶点为LRP6下调β-catenin抑制成骨方向分化[26]。2016年有实验研究发现,miR-23a转染人BMSC,明显抑制RUNX2、ALP、骨钙素的表达,ALP染色,茜素红染色减弱,通过targetscan粗略分析以及荧光素酶检测miR-23a作用靶点LRP5,进一步过表达miR-23a蛋白和RNA含量LRP5、β-catenin、Axin2都有所降低,证明miR-23a通过靶向LRP5抑制Wnt/βcatenin信号通路抑制成骨[27]。
3.4 直接作用于骨分化特异性转录因子 RUNX2、OSX作为检测骨分化的特异标志蛋白,同时促进骨分化。在敲除RUNX2基因的小鼠中,其成骨分化受到完全抑制,软骨内和膜内骨化均不能发生,Osterix 缺失的小鼠无骨形成,但是具有软骨内骨结构。说明RUNX2、OSX在骨分化起着关键作用。
在主动脉瓣间质细胞中发现miR-204过表达导致BMP-2诱导骨分化过程中RUNX2、ALP活性、OCN表达均有所降低,在成骨诱导细胞中qRT-PCR检测miR-204的表达量约为正常对照组的15%,miR-204对于骨分化具有抑制作用。利用荧光素酶进一步检测其作用靶点,检测结果显示miR-204靶向结合RUNX2,抑制miR-204表达则出现相反的结果[28](表2)。
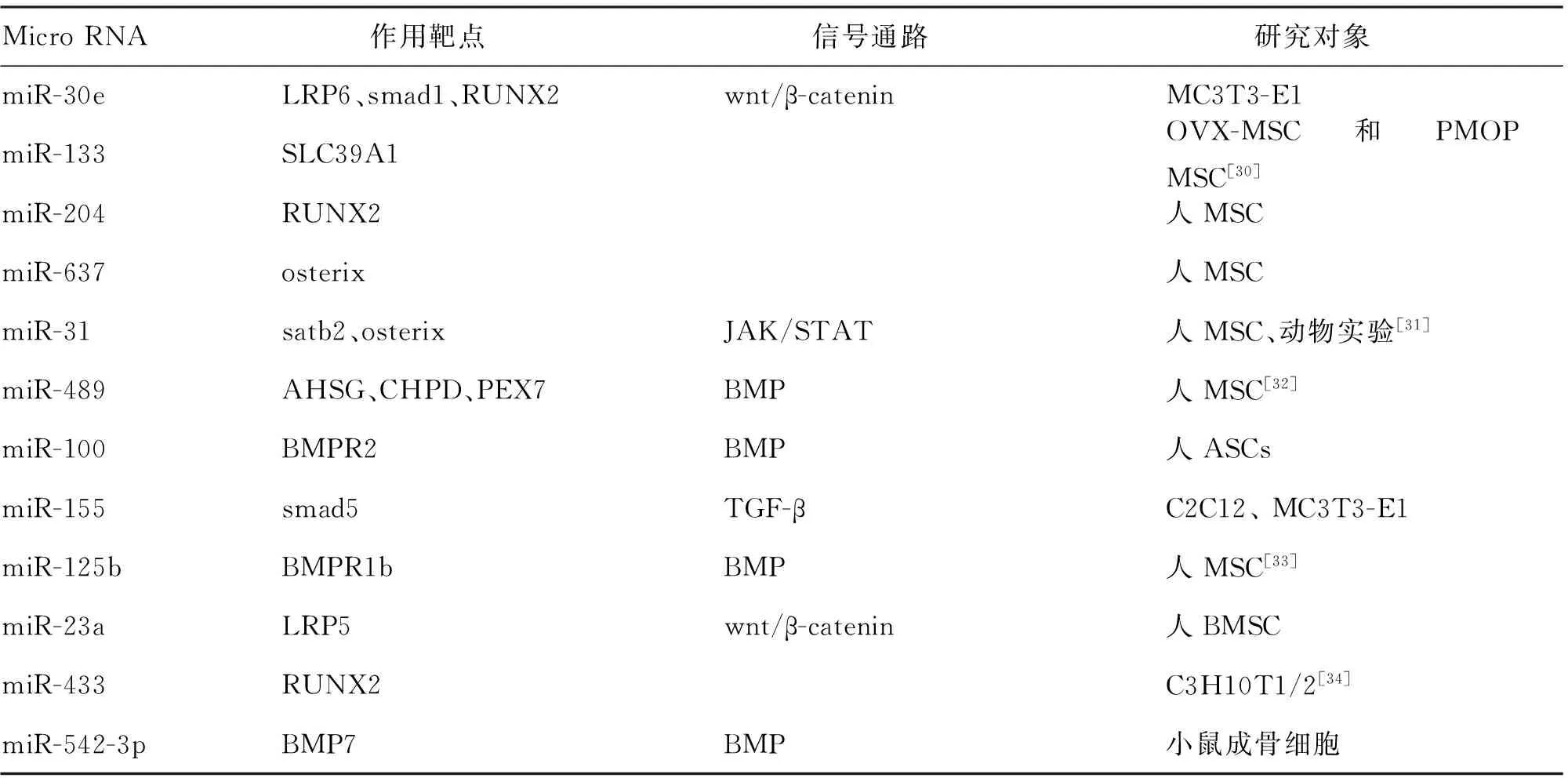
表2 具有抑制作用的miRNA
文献[29]利用miR-637、anti- miR-637、NC对照组瞬时转染到人MSC中,测定细胞生长率以及检测细胞周期分布,miR-637在人MSC中细胞生长抑制率为23%,anti- miR-637生长促进率为17%,NC对照组没有明显差异性,miR-637抑制hMSC生长并且诱导S期生长停滞。进而使用慢病毒载体稳定恢复和沉默hMSCs中miR-637的表达,有研究发现,过表达miR-637转染的细胞中,ALP活性显示降低32%,钙结节被抑制,而在沉默miR-637转染的细胞中,ALP活性增加22%,并且增强钙结节的形成,促进BMP2、RUNX2蛋白的表达。Targetscan、miRanda、Findtar推定以及荧光素酶验证,miR-637靶向结合OSX。
综上所述,近年来的研究发现,microRNA在干细胞分化过程中起着稳定而复杂的作用。microRNA主要通过为作用于成骨相关的信号通路分子和直接作用于骨分化特异性转录因子从而对MSC成骨分化发挥促进/抑制作用。miRNA的高效,低损伤,低成本等优点为临床治疗方法提供了一个全新的方向。但由于实验动物种属的差别和一些miRNA的作用机制尚不完全清楚。仍需大量的实验检测出高效、不良反应少的miRNA,并希望早日用于临床骨修复的治疗。
[1] Friedenstein A J, Piatetzky-Shapiro I I, Petrakova K V. Osteogenesis in transplants of bone marrow cells[J]. J Embryol Exp Morphol, 1966,16(3):381-390.
[2] Caplan A I. Mesenchymal stem cells[J]. J Orthop Res, 1991,9(5):641-650.
[3] Pittenger M F, Mackay A M, Beck S C,etal. Multilineage potential of adult human mesenchymal stem cells[J]. Science, 1999,284(5411):143-147.
[4] 朱 彪,赵 刚,徐红梅,等.以BMSCs为基础构建组织工程骨修复种植区骨量不足的实验研究[J].武警医学, 2015,26(9):895-899.
[5] 陈 冲,闫俊灵,李 梁,等.人脂肪来源间充质干细胞的制备及其质量检验方法[J].武警医学, 2015,26(2):170-174.
[6] 高 锋,张晓峰,段艳伟,等.经骨髓间充质干细胞诱导分化的神经样细胞对大鼠脊髓损伤的修复作用[J].武警医学, 2016,27(3):285-288.
[7] Carreira A C, Zambuzzi W F, Rossi M C,etal. Bone Morphogenetic Proteins: Promising Molecules for Bone Healing, Bioengineering, and Regenerative Medicine[J]. Vitam Horm, 2015,99:293-322.
[8] Kim Y J, Bae S W, Yu S S,etal. miR-196a regulates proliferation and osteogenic differentiation in mesenchymal stem cells derived from human adipose tissue[J]. J Bone Miner Res, 2009,24(5):816-825.
[9] Liao Y H, Chang Y H, Sung L Y,etal. Osteogenic differentiation of adipose-derived stem cells and calvarial defect repair using baculovirus-mediated co-expression of BMP-2 and miR-148b[J]. Biomaterials, 2014,35(18):4901-4910.
[10] Huang S, Wang S, Bian C,etal. Upregulation of miR-22 promotes osteogenic differentiation and inhibits adipogenic differentiation of human adipose tissue-derived mesenchymal stem cells by repressing HDAC6 protein expression[J]. Stem Cells Dev, 2012,21(13):2531-2540.
[11] Suh J S, Lee J Y, Choi Y S,etal. Peptide-mediated intracellular delivery of miRNA-29b for osteogenic stem cell differentiation[J]. Biomaterials, 2013,34(17):4347-4359.
[12] Wang Q, Cai J, Cai X H,etal. miR-346 regulates osteogenic differentiation of human bone marrow-derived mesenchymal stem cells by targeting the Wnt/beta-catenin pathway[J]. PLoS One, 2013,8(9):e72266.
[13] Meng Y B, Li X, Li Z Y,etal. microRNA-21 promotes osteogenic differentiation of mesenchymal stem cells by the PI3K/beta-catenin pathway[J]. J Orthop Res, 2015,33(7):957-964.
[14] Song B Q, Chi Y, Li X,etal. Inhibition of Notch Signaling Promotes the Adipogenic Differentiation of Mesenchymal Stem Cells Through Autophagy Activation and PTEN-PI3K/AKT/mTOR Pathway[J]. Cell Physiol Biochem, 2015,36(5):1991-2002.
[15] 张文文. BMP9需通过调控Notch信号通路诱导间充质干细胞成骨分化及其作用机制研究[D].重庆:重庆医科大学, 2013.
[16] Sun F, Wan M, Xu X,etal. Crosstalk between miR-34a and Notch Signaling Promotes Differentiation in Apical?Papilla Stem Cells (SCAPs)[J]. J Dent Res, 2014,93(6):589-595.
[17] Luo H, Gao H, Liu F,etal. Regulation of Runx2 by microRNA-9 and microRNA-10 modulates the osteogenic differentiation of mesenchymal stem cells[J]. Int J Mol Med, 2017,39(4):1046-1052.
[18] Gamez B, Rodriguez C E, Bartrons R,etal. MicroRNA-322 (miR-322) and its target protein Tob2 modulate Osterix (Osx) mRNA stability[J]. J Biol Chem, 2013,288(20):14264-14275.
[19] Jeong B C, Kang I H, Hwang Y C,etal. MicroRNA-194 reciprocally stimulates osteogenesis and inhibits adipogenesis via regulating COUP-TFII expression[J]. Cell Death Dis, 2014,5:1532.
[20] Li J, Dong J, Zhang Z H,etal. miR-10a restores human mesenchymal stem cell differentiation by repressing KLF4[J]. J Cell Physiol, 2013,228(12):2324-2336.
[21] Yang N, Wang G, Hu C,etal. Tumor necrosis factor alpha suppresses the mesenchymal stem cell osteogenesis promoter miR-21 in estrogen deficiency-induced osteoporosis[J]. J Bone Miner Res, 2013,28(3):559-573.
[22] Zhang W B, Zhong W J, Wang L. A signal-amplification circuit between miR-218 and Wnt/beta-catenin signal promotes human adipose tissue-derived stem cells osteogenic differentiation[J]. Bone, 2014,58:59-66.
[23] Yang M, Pan Y, Zhou Y. miR-96 promotes osteogenic differentiation by suppressing HBEGF-EGFR signaling in osteoblastic cells[J]. FEBS Lett, 2014,588(24):4761-4768.
[24] Kureel J, Dixit M, Tyagi A M,etal. miR-542-3p suppresses osteoblast cell proliferation and differentiation, targets BMP-7 signaling and inhibits bone formation[J]. Cell Death Dis, 2014,5:1050.
[25] Gu Y, Ma L, Song L,etal. miR-155 Inhibits Mouse Osteoblast Differentiation by Suppressing SMAD5 Expression[J]. Biomed Res Int, 2017,2017:1893520.
[26] Wang J, Guan X, Guo F,etal. miR-30e reciprocally regulates the differentiation of adipocytes and osteoblasts by directly targeting low-density lipoprotein receptor-related protein 6[J]. Cell Death Dis, 2013,4:e845.
[27] Li T, Li H, Wang Y,etal. microRNA-23a inhibits osteogenic differentiation of human bone marrow-derived mesenchymal stem cells by targeting LRP5[J]. Int J Biochem Cell Biol, 2016,72:55-62.
[28] Wang Y, Chen S, Deng C,etal. MicroRNA-204 Targets Runx2 to Attenuate BMP-2-induced Osteoblast Differentiation of Human Aortic Valve Interstitial Cells[J]. J Cardiovasc Pharmacol, 2015,66(1):63-71.
[29] Yang M, Pan Y, Zhou Y. miR-96 promotes osteogenic differentiation by suppressing HBEGF-EGFR signaling in osteoblastic cells[J]. FEBS Lett, 2014,588(24):4761-4768.
[30] Lv H, Sun Y, Zhang Y. MiR-133 is Involved in Estrogen Deficiency-Induced Osteoporosis through Modulating Osteogenic Differentiation of Mesenchymal Stem Cells[J]. Med Sci Monit, 2015,21:1527-1534.
[31] Weilner S, Schraml E, Wieser M,etal. Secreted microvesicular miR-31 inhibits osteogenic differentiation of mesenchymal stem cells[J]. Aging Cell, 2016,15(4):744-754.
[32] Schoolmeesters A, Eklund T, Leake D,etal. Functional profiling reveals critical role for miRNA in differentiation of human mesenchymal stem cells[J]. PLoS One, 2009,4(5):5605.
[33] Wang H, Xie Z, Hou T,etal. MiR-125b Regulates the Osteogenic Differentiation of Human Mesenchymal Stem Cells by Targeting BMPR1b[J]. Cell Physiol Biochem, 2017,41(2):530-542.
[34] Kim E J, Kang I H, Lee J W,etal. MiR-433 mediates ERRgamma-suppressed osteoblast differentiation via direct targeting to Runx2 mRNA in C3H10T1/2 cells[J]. Life Sci, 2013,92(10):562-568.
