手足口病病原体EV71的检测方法学比较
2018-03-05安丽娜彭碧波
付 辉,安丽娜,彭碧波
近30年来,全球新发传染性疾病达40余种,中国目前发现20多种[1]。传染病的暴发对人类的生命健康会造成严重威胁,已成为灾害救援医学领域的研究热点。其中,肠道病毒71型(enterovirus type 71,EV71)是人类肠道病毒之一,可通过粪口途径或直接接触感染者的呼吸道飞沫在人群中传播[2]。EV71感染的临床表现通常为手足口病(hand-foot and mouth disease,HFMD),多感染5岁以下的儿童,受影响儿童经常出现3~4 d发烧和手、脚、肘、膝和颊黏膜等部位的疱疹[3]。在大多数情况下,这种疾病是温和、自限的。然而,EV71感染有时会导致严重的神经系统疾病,如无菌性脑膜炎、脑炎、小儿麻痹症样瘫痪,甚至死亡。即便存活下来的患儿也会有神经系统后遗症[4]。因此,对于HFMD病原体EV71的快速准确检测对于临床诊断治疗尤为重要。本研究通过比较四种不同的方法对EV71感染的检测,期望为临床检测提供参考。
1 材料与方法
1.1 材料 非洲绿猴肾细胞(Vero)购自美国标准生物品收藏中心(American type culture collection,ATCC),完全培养液为10%胎牛血清(fetal bovine serum,FBS),1%双抗(pen-strep)的MEM培养液,所有细胞均在含5% CO2的37 ℃ 孵箱中培养并传代。病毒株EV71(H)株购自ATCC,于Vero细胞中传代。
1.2 试剂耗材和仪器 一步法荧光定量试剂盒购自Invitrogen公司,总RNA提取试剂盒(RNeasy Mini Kit)购自QIAGEN公司,MEM液体培养液、青链霉素、胰酶、磷酸盐缓冲液(phosphate buffered saline,PBS)和FBS购自Invitrogen公司,蛋白提取试剂和蛋白酶抑制剂购自Thermo公司,β-actin单抗和辣根过氧化物酶(horseradish peroxidase,HRP)标记羊抗鼠二抗购自cell signaling公司,羊抗鼠绿色荧光二抗和免疫染色固定液购自碧云天生物技术研究所,EV71抗体购自Abnova公司。二氧化碳孵箱购自Thermo公司,倒置显微镜和荧光显微镜购自Olympus公司,Bio-Rad湿转系统和凝胶成像系统购自BIO-RAD公司,ABI 7500 Fast 实时荧光定量聚合酶链式反应(real time polymerase chain reaction,Real-Time PCR)仪,购自ABI公司。
1.3 检测方法
1.3.1 细胞病变效应(cytopathic effect,CPE)法测定50%组织细胞感染量(50% tissue culture infective dose,TCID50) 将3×104个/孔的Vero细胞接种于96孔板内,待到细胞增长至75%的孔面积时,吸弃旧的培养液。将病毒原液按照10倍梯度依次稀释10-1、10-2、10-3、10-4、10-5、10-6、10-7、10-8。用不同稀释度的病毒液100 μl/孔感染细胞1 h。1 h后吸弃病毒液,加入维持液100 μl/孔,将细胞放入37 ℃、5% CO2中继续培养。观察不同病毒浓度72 h的CPE,对观察结果进行记录。
将病毒感染细胞与正常细胞作对比,以细胞状态改变或死亡比例分别标记为4(细胞死亡比例76%~100%)、3(细胞死亡比例51%~75%)、2(细胞死亡比例26%~50%)、1(细胞死亡比例0~25%)、0(细胞形态未发生变化或全部存活),采用Reed & Muench方计算TCID50。
1.3.2 Real-Time PCR检测 将9×105个/孔的Vero细胞接种于6孔板中,温度37 ℃、 5% CO2孵箱中培养。24 h后感染100 TCID50EV71,1 h后换液,继续培养24 h后,吸去细胞培养液,使用RNeasy Mini Kit提取细胞总RNA,使用一步法荧光定量试剂盒进行RT-PCR检测,特异引物序列见表1。25 μl反应体系,反应条件50 ℃ 3 min,95 ℃ 10 min,40个循环(95 ℃ 15 s,60 ℃ 30 s)。采用Sybr-GreenER荧光检测系统对目的基因进行相对定量分析, 采用看家基因β-actin作为内参照对Ct值进行归一化处理,基因表达差异计算方法采用ΔΔCt法。实验重复3批,每批次3个复孔。

表1 特异引物序列
1.3.3 Western blot检测 将9×105个/孔的Vero细胞接种于6孔板中,37 ℃、 5% CO2孵箱中培养。24 h后感染100 TCID50EV71,1 h后换液,继续培养24 h后,吸去细胞培养液,使用蛋白提取试剂提取细胞总蛋白后进行检测。20 μg总蛋白上样电泳后,转膜至PVDF膜上,经5%脱脂奶粉室温封闭1 h,加入EV71一抗(1∶1000)和β-actin一抗(1∶1000),室温孵育2 h后经TBST洗脱,再孵育HRP标记羊抗鼠二抗(1∶5000),室温孵育1 h后经TBST洗脱显影。
1.3.4 免疫荧光法检测 将9×105个/孔的Vero细胞接种于6孔板中,37 ℃、 5% CO2孵箱中培养。24 h后感染100 TCID50EV71,1 h后换液,继续培养24 h后,吸去细胞培养液,4 ℃ PBS洗3次。加入300 μl/孔固定液,固定10 min。4 ℃ PBS漂洗2次。加入0.5% Triton 穿孔15 min。4 ℃ PBS漂洗3次。1% BSA封闭1 h。TBST洗3次,加入含1% BSA的TBST稀释的EV71抗体(1∶500),于37 ℃杂交2 h。TBST漂洗3次,加入TBST稀释的羊抗鼠荧光二抗(1∶500),于37 ℃杂交1 h。TBST漂洗3次,观察照像。
1.4 统计学处理 采用SPSS 13.0统计软件进行数据分析,不同感染量的病毒RNA改变水平的比较采用方差分析,以P<0.05为差异有统计学意义。
2 结 果
2.1 TCID50测定结果 首先利用CPE法检测EV71病毒毒力,病毒感染72 h后观察记录细胞病变见表2,经计算其TCID50为10-4。
2.2 Western blot检测结果 如图1所示,利用Western blot检测EV71蛋白的表达,发现EV71感染24 h后即可检测到明显的病毒蛋白表达,并且病毒感染量越高, 检测到的条带越清晰。 而10-5感染量的病毒24 h无法检测病毒蛋白的条带。
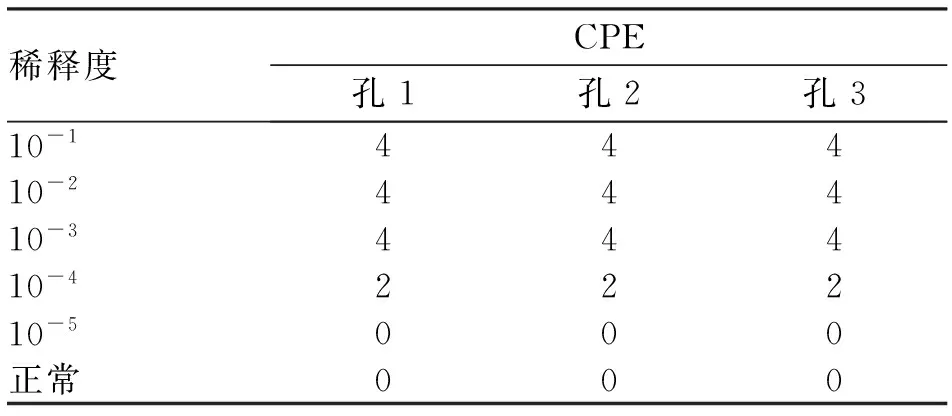
表2 不同稀释浓度手足口病病原体EV71病毒液感染校后72 h的CPE
注:CPE, 细胞病变效应;10-6、10-7和10-8组CPE观察结果均记作0
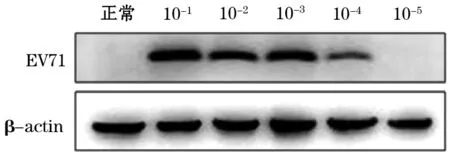
图1 手足口病病原体EV71感染24 h后各病毒量病毒蛋白的表达
2.3 免疫荧光法检测结果 如图2所示,利用免疫荧光法检测EV71蛋白的表达,发现EV71感染24 h后即可检测到明显的病毒蛋白表达,并且病毒感染量越高,检测到的荧光越多。而10-5感染量的病毒24 h只能检测到较少荧光。
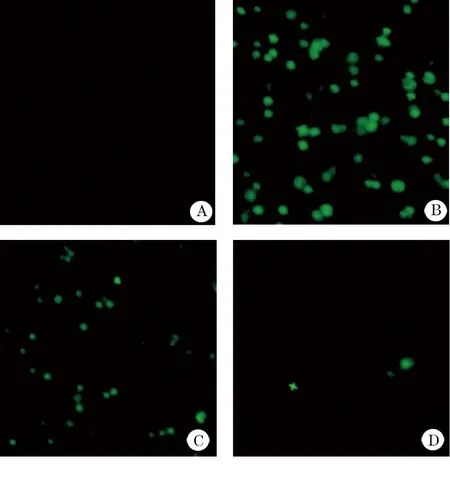
图2 手足口病病原体EV71感染24 h后各病毒量病毒蛋白的表达
2.4 Real-Time PCR检测结果 如图3所示,采用Real-Time PCR检测,可以灵敏地检测到病毒RNA,即使其他方法检测不到的10-5感染量,Real-Time PCR法也可以检测到。
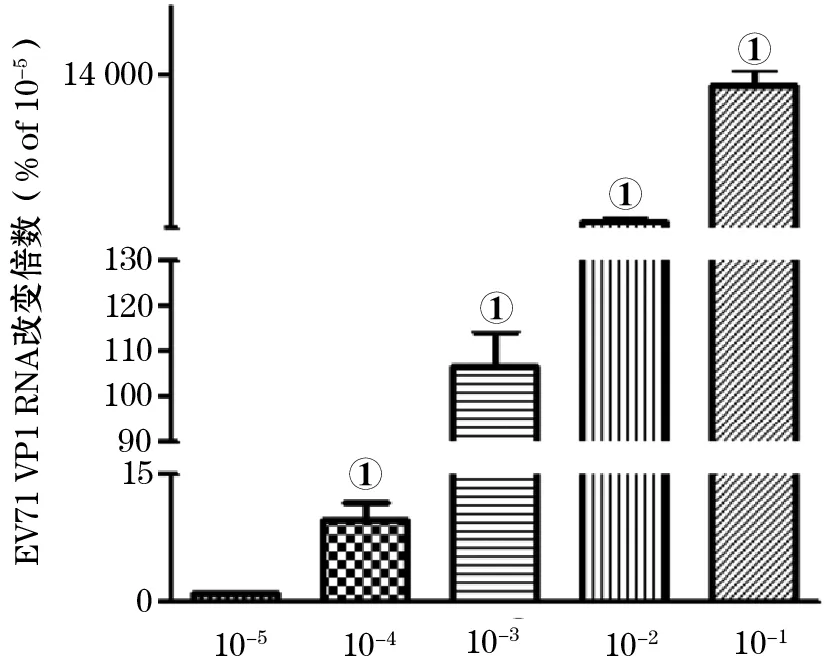
图3 手足口病病原体EV71不同感染量病毒的RNA的水平
3 讨 论
EV71于1969年首次从美国加州患者身上分离得到,随后在全球范围内多次暴发[5-9]。EV71感染引起的HFMD主要临床症状为手、足和口腔黏膜的疱疹病变,少数重症感染者还可引起脑炎、无菌性脑膜炎、脑干脑炎、脊髓炎等神经系统组织的病变,甚至死亡[10,11]。自2008 年以来,中国HFMD发病人数和死亡人数呈逐年上升趋势,将会严重影响社会的稳定与发展[12]。对于EV71的早期、快速、准确诊断对于临床治疗十分重要,在病毒感染尚未对神经系统造成严重损害之前进行治疗,防止神经系统后遗症的发生对于儿童的成长发育至关重要。本研究通过对不同方法学的比较来研究适合不同情况EV71感染的诊断,旨在为临床有效快速检测和治疗提供依据。
目前对于EV71的检测有各种不同的方法,均有各自的优缺点,以便于EV71感染不同阶段的检测。本研究利用4种不同实验方法对EV71的感染进行了检测,发现4种方法都可检测到EV71的感染,只是不同的方法对病毒感染量的敏感性不同,整个实验周期也不同,对实验人员的操作要求也不同。其中,CPE法是最容易、简便的方法,但是实验周期太长且灵敏度低。Western blot方法对于病毒感染量有一定要求,较低的感染量无法检测病毒,但是相对于CPE方法全程至少96 h,Western blot法所需时间减少。免疫荧光法和Western blot法所需时间和检测到的结果基本一致,对于病毒感染量同样有一定要求,较低的感染量无法检测病毒。Real-Time PCR是4种方法中最灵敏,同时也是最快速的方法,48 h即可完成检测。因此,对于临床就诊的患者可以根据已经发病的程度选择一种或几种合适的方法对病原体进行快速、准确的确定,为临床用药治疗提供依据。
除了本研究所利用的实验方法,目前还有基因微阵列检测[13]和酶联免疫吸附法(enzyme linked imnnosoboynt assay,ELISA)两种检测方法,可用于EV71感染的测定,这两种方法同样有着各自优缺点。目前临床上应用较多的还是Real-Time PCR和ELISA这两种方法,随着实验技术的不断创新,相信在不久的将来会有更多更加完善的适合临床检测的方法被应用到实践中,为一线医护工作者提供更好的诊断支撑,为HFMD的预防和治疗提供更好的保障。
[1] 吴改娥,郭建勋. 近五年全球主要新发感染性疾病防治现状[J]. 中华灾害救援医学, 2014, 2(10): 592-599.
[2] Zhu M, Duan H, Gao M,etal. Both ERK1 and ERK2 are required for enterovirus 71 (EV71) efficient replication [J]. Viruses, 2015, 7(3): 1344-1356.
[3] McMinn P C. Recent advances in the molecular epidemiology and control of human enterovirus 71 infection [J]. Curr Opin Virol, 2012, 2(2): 199-205.
[4] Wang X, Zhu C, Bao W,etal. Characterization of full-length enterovirus 71 strains from severe and mild disease patients in northeastern China [J]. PLoS One, 2012, 7(3): e32405.
[5] Wang H Q, Meng S, Li Z R,etal. The antiviral effect of 7-hydroxyisoflavone against Enterovirus 71 in vitro [J]. J Asian Nat Prod Res, 2013, 15(4): 382-389.
[6] Blomberg J, Lycke E, Ahlfors K,etal. Letter: New enterovirus type associated with aseptic meningitis and/or hand, foot and mouth disease [J]. Lancet, 1974, 2(7872): 112.
[7] Hagiwara A, Tagaya I, Yoneyama T. Epidemic of hand, foot and mouth disease associated with enterovirus 71 infection [J]. Intervirology, 1978, 9(1): 60-63.
[8] Wang J R, Tuan Y C, Tsai H P,etal. Change of major genotype of enterovirus 71 in outbreaks of hand-foot-and-mouth disease in taiwan between 1998 and 2000 [J]. J Clin Microbiol, 2002, 40(1): 10-15.
[9] Huang S W, Hsu Y W, Smith D J,etal. Reemergence of enterovirus 71 in 2008 in Taiwan: dynamics of genetic and antigenic evolution from 1998 to 2008 [J]. J Clin Microbiol, 2009, 47(11): 3653-3662.
[10] Chen S G, Cheng M L, Chen K H,etal. Antiviral activities of Schizonepeta tenuifolia Briq. against enterovirus 71 in vitro and in vivo [J]. Sci Rep, 2017,20(7): 935.
[11] Yi E J, Shin Y J, Kim J H,etal. Enterovirus 71 infection and vaccines [J]. Clin Exp Vaccine Res, 2017, 6(1): 4-14.
[12] Yang F, Ren L, Xiong Z,etal. Enterovirus 71 outbreak in the People’s Republic of China in 2008 [J]. J Clin Microbiol, 2009, 47(7): 2351-2352.
[13] Chen T C, Chen G W, Hsiung C A,etal. Combining multiplex reverse transcription-PCR and a diagnostic microarray to detect and differentiate enterovirus 71 and coxsackievirus A16 [J]. J Clin Microbiol, 2006, 44(6): 2212-2219.
