急性缺血性脑卒中早期神经功能恶化的影响因素
2018-03-05董秋艳樊丽娟白智华
董秋艳,樊丽娟,苏 慧,白智华
脑卒中是神经内科常见疾病之一,在全球居死因第二位,在中国近年已跃升为首位死因,且是导致成年人长期残疾的主要原因[1],其中急性缺血性卒中(acute ischemic stroke, AIS)占70%~80%。目前,rt-PA静脉溶栓也是唯一经FDA批准的治疗AIS的方法。但治疗时间窗狭窄(<4.5 h)、大血管再通率低及出血风险[2],限制了rt-PA的使用。随着人类在缺血性卒中治疗的探索,尤其是2014年底到2015年间先后发布的MR CLEAN、ESCAPE、EXTEND-IA、SWIFT PRIME以及REVASCAT几项血管内治疗阳性结果的公布[3-7],促进了指南的更新,也标志着缺血性卒中急性期血管内治疗取得重大进展。与静脉溶栓比较,血管内治疗能否减少患者早期神经功能恶化的发生呢?本研究旨在探索影响患者早期神经功能恶化的因素。
1 对象与方法
1.1 对象 选择2012-01至2015-10收治的AIS患者112例,其中男 60例,女52例,年龄(61±11 )岁。患者自发病至入院治疗不超过4.5 h,首选rt-PA静脉溶栓治疗,剂量(0.9±0.1) mg/kg,发病6 h内的急性前循环大血管闭塞卒中或24 h内的后循环患者,在静脉溶栓的基础上采用血管内治疗。排除标准:(1)碘过敏或造影剂过敏;(2)金属和造影器材过敏;(3)有严重出血倾向或出血性疾病,血小板计数≤50×103/L;(4)全身感染未控制或穿刺点局部感染;(5)严重心、肝、肾功能不全;(6)并发脑疝或其他危及生命的情况。本研究经院伦理委员会通过,所有患者或家属签署知情同意书。
1.2 诊断方法 患者入院即刻采用美国国立卫生研究院卒中量表(National Institutes of Health Stroke Scale,NIHSS)评分对神经功能缺失进行评估,连续评估3 d,3 d内NIHSS 最高分较入院时增加2分或以上为早期脑卒中(early neurological deterioration,END)[8]。以上评估由 1名对患者神经影像资料不知情的医师进行。
1.3 相关因素分析方法 将112例入组患者按照是否有END分为END组和非END组。比较两组患者人院时的临床资料,包括性别、年龄、血压(收缩压、舒张压)、血脂(三酰甘油、总胆固醇、高密度脂蛋白、低密度脂蛋白)、空腹血糖、血清纤维蛋白原、同型半胱氨酸、C反应蛋白、尿酸、合并症(高血压、糖尿病、高脂血症、冠心病)、吸烟史、治疗前神经功能评分、TOAST病因学分型、来院到开始治疗的时间,以及不同治疗方式(静脉溶栓与桥接治疗)。
1.4 统计学处理 采用SPSS 18.0 统计软件。组间均数比较采用独立样本t检验或单因素方差分析,非正态分布计量资料比较用Kruskal-Wallis或Mann-Whitney U检验,计数资料比较用χ2检验或Fisher检验。将单因素分析中P<0.20的观察指标纳入Logistic回归模型(Forward法)以确定急性缺血性卒中患者发生END的影响因素。P<0.05为差异有统计学意义。
2 结 果
112例AIS患者中,END组为34例,该组中单纯静脉溶栓病例为27例(79.41%);其余78例为非END组,其中单纯静脉溶栓有73例(93.58%)。由表1可见,有效观察指标包括年龄、性别、入院时NIHSS评分、血脂异常、空腹血糖、DNT(Door to Needle Time)、糖尿病及不同治疗方式。二元Logistic回归分析结果显示,不同治疗方式(OR=6.67,95%CI1.24~34.93,P=0.025)、血脂水平(总胆固醇、HDL及LDL)(OR=1.03,95%CI1.01~1.06,P= 0.034)及糖尿病控制情况(既往糖尿病及空腹血糖水平),OR=1.16,95%CI1.03~1.31,P=0.017是END的独立预测因素(表2)。

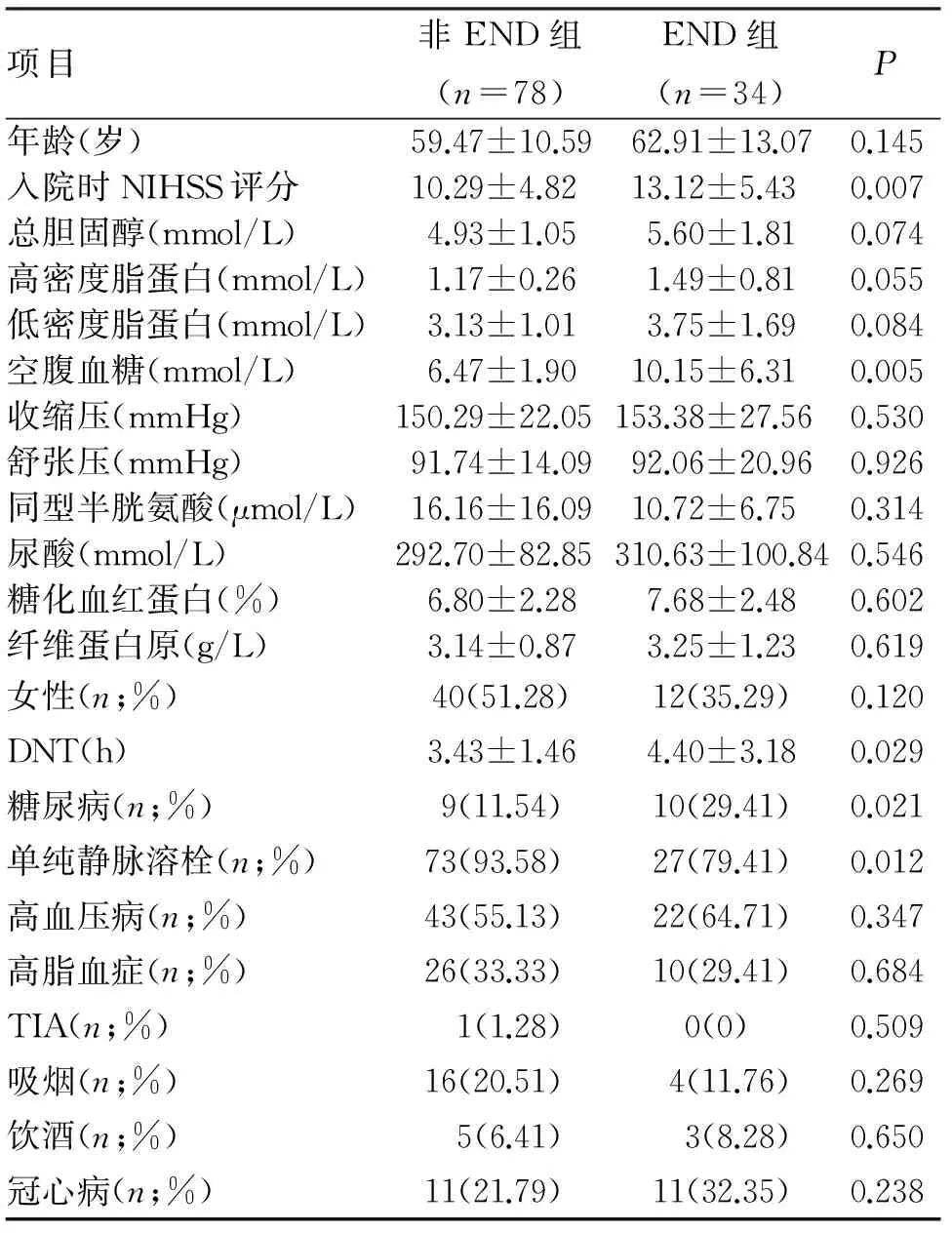
项目非END组(n=78)END组(n=34)P年龄(岁)59.47±10.5962.91±13.070.145入院时NIHSS评分10.29±4.8213.12±5.430.007总胆固醇(mmol/L)4.93±1.055.60±1.810.074高密度脂蛋白(mmol/L)1.17±0.261.49±0.810.055低密度脂蛋白(mmol/L)3.13±1.013.75±1.690.084空腹血糖(mmol/L)6.47±1.9010.15±6.310.005收缩压(mmHg)150.29±22.05153.38±27.560.530舒张压(mmHg)91.74±14.0992.06±20.960.926同型半胱氨酸(μmol/L)16.16±16.0910.72±6.750.314尿酸(mmol/L)292.70±82.85310.63±100.840.546糖化血红蛋白(%)6.80±2.287.68±2.480.602纤维蛋白原(g/L)3.14±0.873.25±1.230.619女性(n;%)40(51.28)12(35.29)0.120DNT(h)3.43±1.464.40±3.180.029糖尿病(n;%)9(11.54)10(29.41)0.021单纯静脉溶栓(n;%)73(93.58)27(79.41)0.012高血压病(n;%)43(55.13)22(64.71)0.347高脂血症(n;%)26(33.33)10(29.41)0.684TIA(n;%)1(1.28)0(0)0.509吸烟(n;%)16(20.51)4(11.76)0.269饮酒(n;%)5(6.41)3(8.28)0.650冠心病(n;%)11(21.79)11(32.35)0.238
注:DNT(door to needle time),进入医院到治疗(静脉溶栓或桥接治疗)的时间
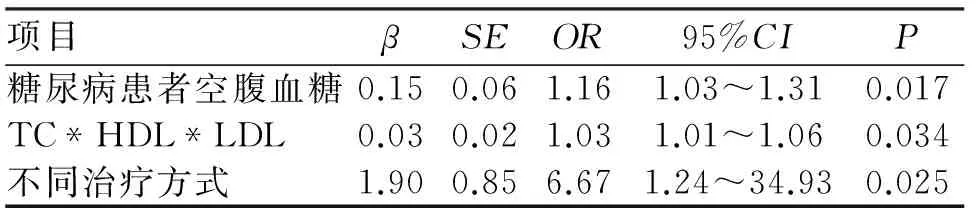
表2 急性缺血性卒中患者早期脑卒中的影响因素,Logistic回归分析结果
注:TC,总胆固醇;HDL,高密度脂蛋白胆固醇;LDL,低密度脂蛋白胆固醇
3 讨 论
研究表明,脑的重量占体重的2%~3%,但其所需要的血流量则占心输出量的15%~20%。脑组织几乎没有氧和葡萄糖的储备,对缺血、缺氧性损伤非常敏感,当平均半球血流量减少到每分钟25~30 ml/100 g,可发生精神错乱,甚至意识丧失。脑部血液供应的障碍可造成缺氧和葡萄糖不足,迅速引起脑功能紊乱和脑组织的破坏,30 s后脑电图即呈“平线”,1 min后神经元功能的恢复就缓慢;3~4 min后脑组织内游离葡萄糖均消耗殆尽,脑神经元细胞功能难望完全恢复正常;停止4~5 min后脑神经元细胞开始坏死。急性脑梗死病灶由中心坏死区及周围的缺血半暗带组成,半暗带内的脑细胞,还存在着大量处于休眠状态或半休眠状态的脑细胞,这些细胞仅能维持自身形态的完整,由于缺少能量的供应,无法行使原有的正常功能。因此,如何挽救“缺血半暗带”,成为目前临床治疗的关键。通过治疗,使原来栓塞的脑动脉血管重新通畅或建立新的侧支循环,使原来处于缺血状态的大面积脑细胞恢复血液供应,增加能量物质的供应,休眠与半休眠的脑细胞就会被重新激活,逐渐恢复正常的脑功能。因此缺血半暗带脑细胞损伤的可逆性是临床溶栓治疗的病理学基础。
随着我国人口老龄化进程加快,缺血性卒中已成为中老年人群的常见病和多发病,具有致残率高、临床预后不佳等特点。由于END患者病情出现阶梯式恶化,导致更加严重的功能障碍,从而使得病死率和致残率急剧上升,严重影响患者的生活质量。文献[9, 10]报道,缺血性脑卒中患者END发生率为10%~40%,与本研究数据(30.4%)相吻合。既往研究发现以下几个因素与END密切相关:入院时神经功能缺损程度、收缩压、纤维蛋白原水平、治疗的延误,以及既往糖尿病病史[11-13]。本研究发现,血脂控制不佳是END的危险因素之一(OR=1.03,95%CI1.01~1.06,P=0.034)(表2)。既往研究提示,高脂血症与缺血性脑卒中之间的关联是有争议的,但有越来越多的证据表明两者之间呈正相关[14],因为大多研究发现治疗高脂血症可降低缺血性卒中的风险[15]。高脂血症促进动脉粥样硬化和血栓形成,其机制包括内皮功能障碍、氧化应激、内皮源性血管舒张功能受损、增加血液黏度,以及纤维蛋白原水平[16]。然而,高脂血症对缺血性脑卒中急性期的影响不明确。在以往研究中发现,高血脂水平与入院时神经功能缺损的严重程度正相关[17];而高脂血症与END相关,可能是告知血脂促进血液凝固,影响侧支循环的建立,以及影响微循环。最终导致脑梗死面积扩大及神经元坏死。
本研究另一发现与既往研究大致相同,即糖尿病是卒中及高血压主要的独立危险因素之一,与卒中后神经功能缺损的严重程度密切相关[18]。糖尿病患者出现END的原因可能有以下几种可能:(1)文献[19, 20]发现,糖尿病小鼠卒中模型缺血后炎性反应强烈,以及神经保护热休克蛋白基因表达衰减;(2)其他的研究表明,糖尿病促进基质金属蛋白酶-9(MMP-9),增加血脑屏障(BBB)的通透性和更多的炎性细胞浸润,导致缺氧缺血性损伤后的神经元死亡数量增加[21];此外,高凝状态也是2型糖尿病患者主要血管并发症之一,也是导致AIS患者预后的相关因素[21];(3)糖耐量异常的患者存在高血糖和胰岛素抵抗,长期暴露在高血糖的环境中,导致广泛的血管病变和血液高凝状态,也是导致缺血性卒中后更广泛的神经损伤的主要原因[22, 23]。总之,糖尿病及高血糖状态是导致急性缺血性卒中后早期神经功能恶化的因素之一。
本研究首次发现不同的治疗方式也是影响缺血性卒中END恶化的因素之一。笔者认为,脑血管闭塞是END最重要的独立预测因素之一。血管闭塞导致远端低灌注,如果能够建立及时有效的侧支循环将有助于缺血性卒中的快速恢复,在急性脑卒中的早期磁共振成像研究中也证明大血管闭塞和侧支循环衰竭是END的主要因素之一[10, 24],但血管内治疗再通率明显高于静脉溶栓,从而导致不同的END的发生率。约34%静脉溶栓的患者发生早期再闭塞,尤其合并同侧颈动脉重度狭窄的大脑中动脉rt-PA溶栓后更容易发生再闭塞,而血管内治疗可避免此类事件[25, 26]。因此,与单纯静脉溶栓比较,选择合适的病例采用血管内治疗可降低END。
本研究存在以下不足,首先本研究是回顾性研究,那些没有接受rt-PA或桥接治疗的患者没有纳入该项研究中;其次,本研究是以医院为基础的单中心研究,病例选择可能存在着偏移,但可提示缺血性卒中后早期功能恶化的相关影响因素;再次,笔者发现在本研究中AIS的短期预后不确定,因此,有必要长期随访后进一步的研究结果。
综上所述,缺血性卒中患者常发生END,与预后不良和死亡密切相关。若能够早期识别和管理高血糖、高脂血症及大动脉闭塞能够减少END的发生,虽然高血糖是预测END的指标,但通过控制高血糖能否改善脑卒中预后的相关证据不足。同样,不同治疗方式(静脉溶栓或桥接治疗)能否降低END的发生亦缺乏前瞻性研究的有效证据。进一步探讨这些问题的研究可能会提高我们对END的理解,从而降低END的发生,进一步提高AIS患者的预后。
[1] 高一鹭,王文志. 脑血管病流行病学研究进展[J]. 中华神经科杂志,2015,48(4):337-340.
[2] Hennerici M G, Kern R, Szabo K. Non-pharmacological strategies for the treatment of acute ischaemic stroke[J]. Lancet Neurol,2013,12(6):572-584.
[3] Berkhemer O A, Fransen P S, Beumer D,etal. A randomized trial of intraarterial treatment for acute ischemic stroke[J]. N Engl J Med,2015,372(1):11-20.
[4] Goyal M, Demchuk A M, Menon B K,etal. Randomized assessment of rapid endovascular treatment of ischemic stroke[J]. N Engl J Med,2015,372(11):1019-1030.
[5] Campbell B C, Mitchell P J, Kleinig T J,etal. Endovascular therapy for ischemic stroke with perfusion-imaging selection[J]. N Engl J Med,2015,372(11):1009-1018.
[6] Saver J L, Goyal M, Diener H C. Stent-Retriever Thrombectomy for Stroke[J]. N Engl J Med,2015,373(11):1077.
[7] Jovin T G, Chamorro A, Cobo E,etal. Thrombectomy within 8 hours after symptom onset in ischemic stroke[J]. N Engl J Med,2015,372(24):2296-2306.
[8] Nagakane Y, Naritomi H, Oe H,etal. Neurological and MRI findings as predictors of progressive-type lacunar infarction[J]. Eur Neurol,2008,60(3):137-141.
[9] Helleberg B H, Ellekjaer H, Rohweder G,etal. Mechanisms, predictors and clinical impact of early neurological deterioration: the protocol of the Trondheim early neurological deterioration study[J]. BMC Neurol,2014,14:201.
[10] Nacu A, Bringeland G H, Khanevski A,etal. Early neurological worsening in acute ischaemic stroke patients[J]. Acta Neurol Scand,2016,133(1):25-29.
[11] Nannoni S, Del B A, Palumbo V,etal. Predictors of progression in patients presenting with minor subcortical stroke[J]. Acta Neurol Scand,2015,132(5):304-309.
[12] Chung J W, Kim N, Kang J,etal. Blood pressure variability and the development of early neurological deterioration following acute ischemic stroke[J]. J Hypertens,2015,33(10):2099-2106.
[13] Li H, Qiu W, Hu B,etal. Ischemic volumes and early neurologic deterioration in acute brainstem infarctions with hemoglobin A1c[J]. Eur Neurol,2013,70(3-4):225-232.
[14] Kjaergaard A D, Johansen J S, Bojesen S E,etal. Elevated plasma YKL-40, lipids and lipoproteins, and ischemic vascular disease in the general population[J]. Stroke,2015,46(2):329-335.
[15] Stone N J, Robinson J G, Lichtenstein A H,etal. 2013 ACC/AHA guideline on the treatment of blood cholesterol to reduce atherosclerotic cardiovascular risk in adults: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines[J]. J Am Coll Cardiol,2014,63(25 Pt B):2889-2934.
[16] Yuan B B, Luo G G, Gao J X,etal. Variance of Serum Lipid Levels in Stroke Subtypes[J]. Clin Lab,2015,61(10):1509-1514.
[17] Pikija S, Trkulja V, Juvan L,etal. Higher on-admission serum triglycerides predict less severe disability and lower all-cause mortality after acute ischemic stroke[J]. J Stroke Cerebrovasc Dis,2013,22(7):e15-e24.
[18] Tanaka R, Ueno Y, Miyamoto N,etal. Impact of diabetes and prediabetes on the short-term prognosis in patients with acute ischemic stroke[J]. J Neurol Sci,2013,332(1-2):45-50.
[19] Tureyen K, Bowen K, Liang J,etal. Exacerbated brain damage, edema and inflammation in type-2 diabetic mice subjected to focal ischemia[J]. J Neurochem,2011,116(4):499-507.
[20] Yang H, Ma S, Liu Y,etal. Poor outcome of experimental ischemic stroke in type 2 diabetic rats: impaired circulating endothelial progenitor cells mobilization[J]. J Stroke Cerebrovasc Dis,2015,24(5):980-987.
[21] Mishiro K, Imai T, Sugitani S,etal. Diabetes mellitus aggravates hemorrhagic transformation after ischemic stroke via mitochondrial defects leading to endothelial apoptosis[J]. PLoS One,2014,9(8):e103818.
[22] Ozkul A, Ayhan M, Akyol A,etal. The effect of insulin resistance on inflammatory response and oxidative stress in acute cerebral ischemia[J]. Neuro Endocrinol Lett,2013,34(1):52-57.
[23] Liu A, Carmichael K A, Schallom M E,etal. Detecting and Managing Diabetes Mellitus and Prediabetes in Patients With Acute Stroke[J]. Diabetes Educ,2015,41(5):592-598.
[24] Kim J P, Kim S J, Lee J J,etal. Diffusion-Perfusion Mismatch in Single Subcortical Infarction: A Predictor of Early Neurological Deterioration and Poor Functional Outcome[J]. Eur Neurol,2015,73(5-6):353-359.
[25] Alexandrov A V, Grotta J C. Arterial reocclusion in stroke patients treated with intravenous tissue plasminogen activator[J]. Neurology,2002,59(6):862-867.
[26] Cohen J E, Gomori J M, Rajz G,etal. Extracranial carotid artery stenting followed by intracranial stent-based thrombectomy for acute tandem occlusive disease[J]. J Neurointerv Surg,2015,7(6):412-417.
