一测多评法测定金银花中咖啡酰奎尼酸类化学成分的含量
2018-03-05徐玉平蒋向辉
徐玉平,蒋向辉,王 翔
(凯里学院化学与材料工程学院,贵州凯里 556011)
金银花别称忍冬(Lonicerajaponica),是忍冬科忍冬属药用植物[1]。金银花作为一种常用中药,已有上千年的使用历史。长期以来,绿原酸与木犀草苷的含量被作为评价金银花质量的标志性成分,而近年来的研究发现,金银花中富含有机酸、黄酮、挥发油等多种生物活性成分[2],因此,找到更多的能全面反映金银花质量的活性成分很有必要。金银花的花蕾与叶片中富含咖啡酰奎尼酸,咖啡酰奎尼酸是奎尼酸与咖啡酸形成的酯,由于咖啡酸的数目与位置不同,咖啡酰奎尼酸包括绿原酸、果酸、隐绿原酸、异绿原酸A、异绿原酸B、异绿原酸C等6种不同单体[3]。咖啡酰奎尼酸有清热、解毒等功效[4-5],被广泛应用于医疗保健、食品和化妆品行业中[6-7]。
近年来,已有采用外标法同时测定金银花中绿原酸、果酸、隐绿原酸、异绿原酸A、异绿原酸B、异绿原酸C等成分含量的相关报道[3,8],由于异绿原酸A、B、C对照品的价格昂贵且不容易获得,导致外标法难以在实际工作中广泛应用,限制了金银花多指标成分质量控制模式的实现。随着通过测定一种成分来实现对多个成分含量检测的一测多评法(quantitative analysis of multi-components by single-marker,简称QAMS)在药材或复方制剂含量测定中的应用[9-11],一测多评法的优势突显。本课题组已经发现并证实绿原酸与异绿原酸A、B、C间存在相互转化,为更合理地评价金银花药材的品质,以绿原酸为对照品,采用一测多评法,同时测定金银花中果酸、隐绿原酸、异绿原酸A、异绿原酸B与异绿原酸C等成分的含量,为金银花药材的质量控制提供参考和依据。
1 材料与方法
1.1 试验仪器
主要仪器有Waters2695高效液相色谱仪、极管阵列检测器(photo-diode array,简称PDA)、EmpowerTM色谱工作站软件,均购自美国Waters公司;Hypersil ODS-2色谱柱(5 μm,4.6 mm×250.0 mm)(美国Thermo公司)、Hypersil ODS-2色谱柱(5 μm,4.6 mm×250.0 mm)(大连依利特分析仪器有限公司)、Fisher ODS-2色谱柱(5 μm,4.6 mm×250.0 mm)(北京赛维特姆科技有限公司)与Spherisorb ODS-2色谱柱(5 μm,4.6 mm×250.0 mm)(美国Waters公司)等4种色谱柱;KQ-500DE型数控超声波清洗器(东莞市科桥超声波设备有限公司);Milli-Q超纯水机(德国Merck公司)。
1.2 试验试剂
主要试剂有甲醇、冰醋酸,均为色谱纯,其他试剂为优级纯;绿原酸、果酸、隐绿原酸、异绿原酸A、异绿原酸B与异绿原酸C标准品均购自湖南省食品药品检验研究院。定量测定的金银花样品分别采自山东省临沂市平邑县、湖南省邵阳市隆回县与河南省新乡市封丘县,经怀化学院刘光华教授鉴定为忍冬属植物金银花初期开的花。
2 结果与分析
2.1 一测多评方法的考察
2.1.1 色谱条件 采用高效液相色谱法(high performance liquid chromatography,简称HPLC)[12]测定混合对照品溶液及供试品溶液样品中各成分的含量(图1),色谱检测条件:反相C18柱(5 μm,250.0 mm × 4.6 mm),流动相为甲醇-0.5 %冰醋酸(体积比为30 ∶70),流速为1.0 mL/min,进样量为20 μL,柱温为30 ℃。
2.1.2 混合对照品溶液的制备 分别称取10 mg绿原酸、果酸、隐绿原酸、异绿原酸A、异绿原酸B、异绿原酸C对照品,用甲醇溶解,制成质量浓度分别为195.20、205.40、194.30、192.30、207.60、188.30 μg/mL的混合对照品溶液,避光保存,放于4℃冰箱中备用。
2.1.3 供试品溶液的制备 取金银花药材,在60℃条件下烘干至恒质量,粉碎以后过20目筛。精确称取5 g金银花粉末,放入250 mL具塞锥形瓶中,按料液比1 g ∶15 mL加入70%的乙醇溶液浸泡1 h,在55 ℃超声(60 kHz)提取1 h,加70%的乙醇补足减失的质量,摇匀,抽滤。再减压抽滤3次,旋转蒸发回收乙醇至干,残渣加适量95%甲醇溶解,转移至10 mL量瓶中,继续加95%甲醇至刻度,搅拌均匀,用 0.45 μm 的微孔滤膜过滤,取续滤液作为供试品溶液。
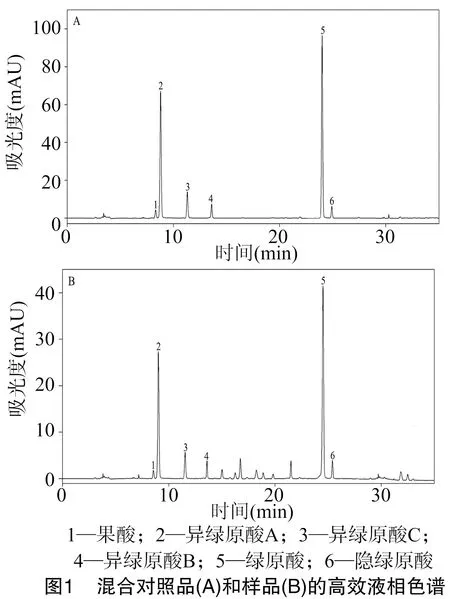
2.1.4 标准曲线的制备 精确吸取0.5、1.0、2.0、4.0、6.0、8.0、10.0 mL混合对照品溶液至10 mL量瓶中,分别加95%甲醇至刻度,摇匀,用0.45 μm的微孔滤膜过滤后,分别取 20 μL 滤液注入液相色谱仪,按“2.1.1”节色谱条件测定各成分含量。以浓度(C)的对数值对峰面积(A)的对数值进行线性回归处理,得到绿原酸、果酸、隐绿原酸、异绿原酸A、异绿原酸B、异绿原酸C的回归方程。结果表明,6种咖啡酰奎尼酸成分在相应范围内线性关系良好(表1)。
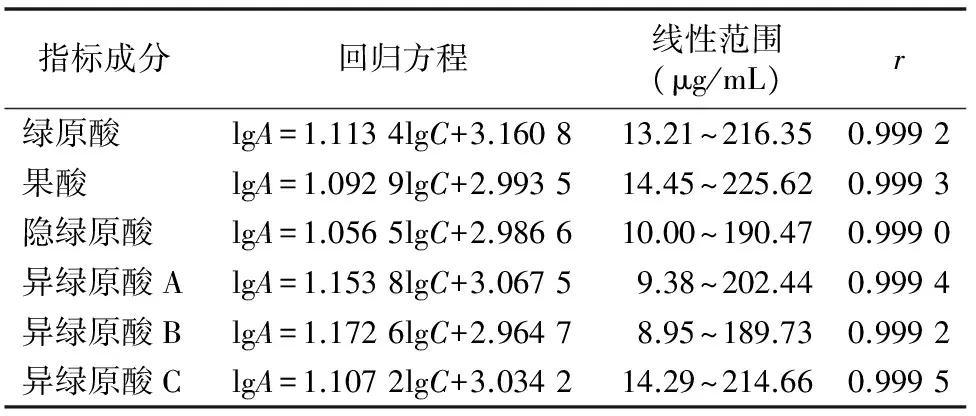
表1 6种咖啡酰奎尼酸类成分的线性关系和范围
2.1.5 相对校正因子(fsi)的计算 参照郭盛等的方法[13],以绿原酸为内参物,计算fsi=fs/fi=(lgAs×lgCi)/(lgCs×lgAi)。As为内参物绿原酸峰面积(mAu);Cs为绿原酸质量浓度(%);Ai为某待测成分i的峰面积(mAu);Ci为待测成分i的质量浓度(%);fs为lgAs与lgCi的乘积;fi为lgAi与lgCi的乘积。结合“2.1.4”节系列质量浓度对照品溶液所得峰面积数据,分别计算绿原酸对果酸、隐绿原酸、异绿原酸A、异绿原酸B、异绿原酸C的fsi,结果如表2所示。
2.1.6 精密度试验 精确吸取混合对照品溶液20 μL,按“2.1.1”节色谱条件连续进样6次,记录色谱峰的峰面积。结果表明,绿原酸、果酸、隐绿原酸、异绿原酸A、异绿原酸B与异绿原酸C峰面积的相对标准偏差(relative standard deviation,简称RSD)分别为1.56%、2.06%、2.34%、1.78%、2.13%、1.96%,均小于2.50%,表明仪器精密度较好。
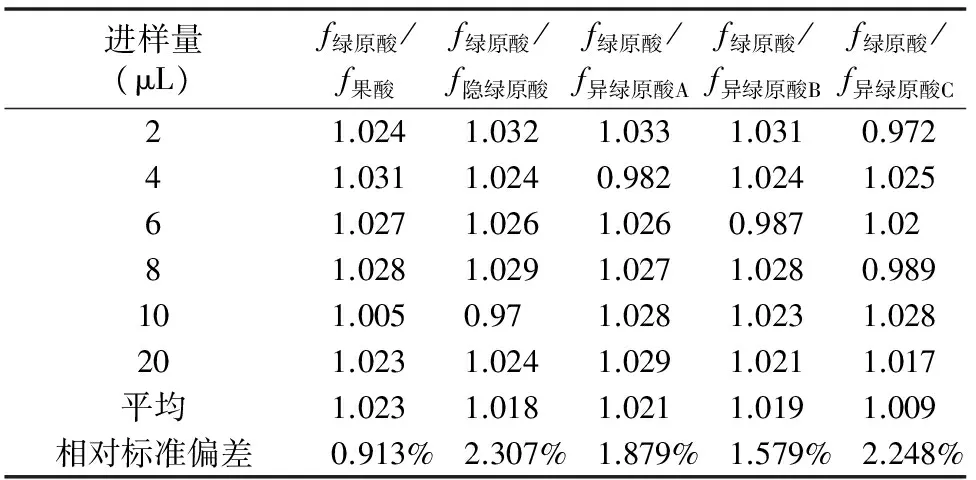
表2 5种咖啡酰奎尼酸的相对校正因子
2.1.7 稳定性试验 分别取产自山东省临沂市平邑县、湖南省邵阳市隆回县与河南省新乡市封丘县的金银花供试品溶液各3份,分别于制备后0、2、4、8、16、20、24 h进样测定咖啡酰奎尼酸类成分含量,结果表明绿原酸、果酸、隐绿原酸、异绿原酸A、异绿原酸B与异绿原酸C峰面积的RSD值分别为1.87%,2.32%、1.99%、2.23%、1.76%、1.86%,均小于2.50%。说明供试品溶液稳定性良好。
2.1.8 重复性试验 精确称取3个产地的金银花供试样品各3份,按“2.1.3”节的方法制备供试品溶液,并测定质量分数,绿原酸、果酸、隐绿原酸、异绿原酸A、异绿原酸B与异绿原酸C质量分数的RSD值分别为2.42%、1.88%、2.38%、1.97%、2.45%、2.39%,均小于2.5%,表明本方法重复性良好。
2.1.9 加样回收率试验 精确称取已测定质量分数的约2.5 g金银花花蕾粉末,平行6份,分别加入相当于药材中各指标成分量的对照品溶液,依“2.1.3”节方法制备供试品溶液,进样测定,计算加样回收率。结果表明,绿原酸、果酸、隐绿原酸、异绿原酸A、异绿原酸B与异绿原酸C的加样回收率分别为99.36%、98.75%、102.9%、98.89%、99.76%、103.39%,RSD值分别为1.76%、2.48%、2.55%、2.06%、1.95%、2.82%。
2.2 一测多评法耐用性和系统适应性评价
2.2.1 校正因子的重现性考察 按照朱粉霞等的方法[14]取系列混合对照溶液,混合对照品溶液为1号,稀释倍数为2、10、20、40倍的分别为2号、3号、4号和5号,在HPLC考察Hypersil ODS-2色谱柱(5 μm,4.6 mm×250.0 mm)、Hypersil ODS-2色谱柱(5 μm,4.6 mm×250.0 mm)、Fisher ODS-2色谱柱(5 μm,4.6 mm×250.0 mm)与Spherisorb ODS-2色谱柱(5 μm,4.6 mm×250.0 mm)4种色谱柱后所得的相对校正因子及其相对标准偏差如表3所示,结果表明,不同色谱柱所测得各成分的相对校正因子无显著差异,相对标准偏差均小于2%。

表3 不同色谱柱对fsi的影响
注:同列数据后相同小写字母表示在0.05水平上差异不显著。
2.2.2 待测组分色谱峰的定位 通过计算在不同色谱柱中各待测成分色谱峰与绿原酸色谱峰的相对保留时间(rsi),对各待测成分进行定位,结果(表4)表明,不同仪器和色谱柱测得的rsi相对标准偏差均小于2%,表明利用rsi进行峰的定位是可行的。

表4 不同色谱柱对rsi的影响
2.2.3 一测多评法与外标法测定结果的比较 取采自不同产地的金银花花蕾与幼叶粉末,按“2.1.3”节方法制备供试品溶液,精确吸取20 μL溶液注入液相色谱仪,按“2.1.2”节色谱条件测定各成分含量。分别采用外标法和一测多评法计算金银花花蕾与幼叶中绿原酸、果酸、隐绿原酸、异绿原酸A、异绿原酸B与异绿原酸C的含量。由表5可知,对QAMS与外标法所测得的各指标成分含量进行t检验所得的P值均大于0.05,表明2种测定方法得到的含量之间无显著差异,说明QAMS用于金银花花蕾与幼叶中多种咖啡酰奎尼酸类成分质量评价是可行的。
3 讨论
咖啡酰奎尼酸类化学成分作为金银花的生物活性成分,有很好的抑菌、消炎与抗病毒的作用[15],为金银花药材的主要活性成分。由于绿原酸在咖啡酰奎尼酸类成分含量相对较高,2015年版《中国药典》规定绿原酸为金银花药材的主要考察指标,而由于异绿原酸和隐绿原酸在金银花中含量相对较低[14],并且异绿原酸类同分异构体结构相似,获得单一的异绿原酸通常比较困难,导致在考察金银花药材质量时异绿原酸类成分的含量通常被忽视。大量研究表明,异绿原酸A、异绿原酸B与异绿原酸C具有较强的抗病毒、抗氧化、抗真菌和抗人类免疫性缺陷病毒的作用[15]。因此,同时检测多种咖啡酰奎尼酸类化学成分的含量是合理和有效地考察金银花药材质量的方法。Guo等采用高速逆流色谱技术与制备高效液相色谱技术成功地建立了异绿原酸A与异绿原酸C的分离技术体系[16],为一测多评法在金银花药材质量控制中的应用打下了较好的基础。
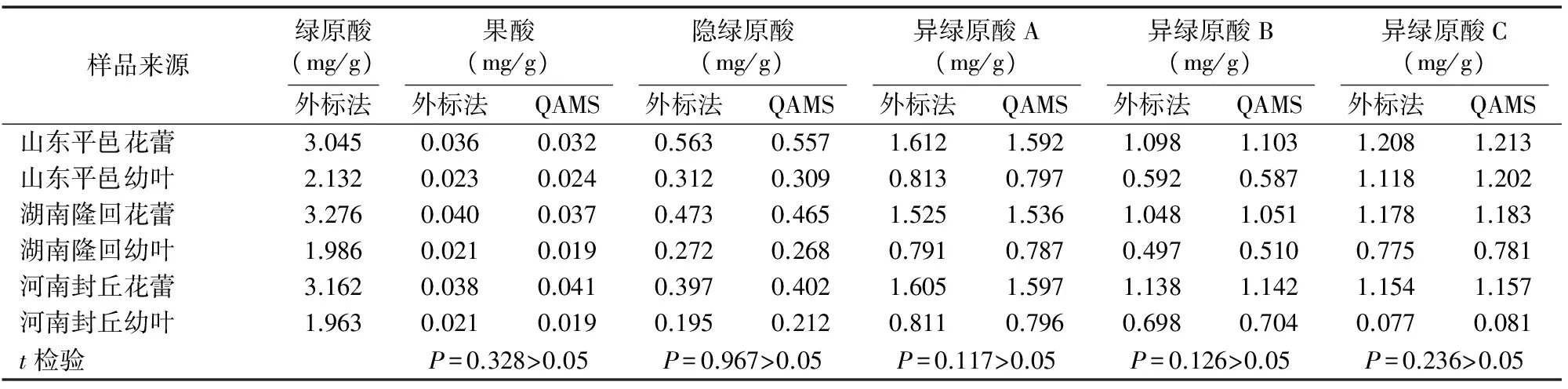
表5 QAMS与外标法测定金银花咖啡酰奎尼酸类成分含量比较
本研究测定的6种成分中,以绿原酸相对含量较高,且在各样品中含量差异较小,绿原酸对照品易得,故以其作为内参物建立金银花药材的QAMS法,该方法所得到的6种咖啡酰奎尼酸含量的计算值与传统外标法所得实测值之间进行t检验,所得的P值均大于0.05,显示2种测定方法得到的含量之间无显著差异,表明QAMS法可以在缺失对照品的情况下,以绿原酸为对照对金银花药材中多种咖啡酰奎尼酸类成分进行分析评价。本研究在建立的相对校正因子评价中,考察4种不同品牌、型号的色谱柱对各指标成分之间相对校正因子重现性的影响,相对标准偏差均小于2%,结果表明不同色谱柱所测得各成分的相对校正因子之间差异未达到显著水平,说明一测多评法可以同时测定金银花药材绿原酸、果酸、隐绿原酸、异绿原酸A、异绿原酸B与异绿原酸C含量。
一测多评法是使用单一的标准品去同时检测多种成分的含量,其中目标分析物的相对转换因子是根据其紫外吸收与标准品紫外吸收的相对比率来确定的,这种方法适用于有相似紫外吸收特性的多种化合物的分析。在植物药中同时进行多种有效成分含量的检测将是药材质量控制发展的趋势。在金银花类药材分析中同时检测黄酮、皂苷、环烯醚萜苷等多类成分的含量是当前研究的重点[17]。但是,由于缺乏稳定可靠的标准对照品,限制了一测多评法的广泛应用与推广,这有待药用植物有效成分提取分离与纯化鉴定技术的进一步发展。
[1]Lu H X,Zhang L,Huang H.Study on the isolation of active constituents inLonicerajaponicaand the mechanism of their anti-upper respiratory tract infection action in children[J].African Health Sciences,2015,15(4):1295-1301.
[2]李 娜,阮文辉,杨莹莹,等.金银花成分分析的研究进展[J].2011,21(18):178-181.
[3]Yan K,Cui M X,Zhao S J,et al.Salinity stress is beneficial to the accumulation of chlorogenic acids in honeysuckle (LonicerajaponicaThunb.)[J].Front Plant Science,2016(7):1563-1569.
[4]Gordon M H,Wishart K.Effects of chlorogenic acid and bovine serum albumin on the oxidative stability of low density lipoproteinsinvitro[J].Journal of Agricultural and Food Chemistry,2010,58(9):5828-5833.
[5]Xu J G,Hu Q P,Liu Y.Antioxidant and DNA-protective activities of chlorogenic acid isomers[J].Journal of Agricultural and Food Chemistry,2012,60(46):11625-11630.
[6]Oksana S,Marian B,Mahendra R,et al.Plant phenolic compounds for food,pharmaceutical and cosmetiсs production[J].Journal of Medicinal Plant Research,2012,6(13):2526-2539.
[7]Sun P C,Liu Y,Yi Y T,et al.Preliminary enrichment and separation of chlorogenic acid fromHelianthustuberosusL.leaves extract by macroporous resins[J].Food Chemistry,2015,168(9):55- 62.
[8]Li J,Jin S,Zu Y G,et al.Rapid preparative extraction and determination of major organic acids in honeysuckle (LonicerajaponicaThunb.) tea[J].Journal of Food Composition and Analysis,2014,33(2):139-145.
[9]徐文芬,杨 雯,何顺志,等.一测多评法测定淫羊藿中淫羊藿苷和朝藿定A、B、C[J].中草药,2016,47(1):130-137.
[10]郝盛源,王 磊,李 红,等.一测多评法测定红曲及脂必妥片中洛伐他汀和洛伐他汀酸[J].中国实验方剂学杂志,2017,23(5):74-78.
[11]黄玉瑶,张洪坤,路 丽,等.一测多评法评价不同主产区春知母片的质量[J].中药材,2017,40(2):387-391.
[12]蒋向辉.金银花绿原酸合成途径关键酶基因克隆与功能分析[D].长沙:湖南大学,2013.
[13]郭 盛,段金廒,朱邵晴,等.基于一测多评法的大枣药材三菇酸类化学成分检测分析方法的建立[J].中草药,2016,47(21):3884-3889.
[14]朱粉霞,张亚丽,汪 晶,等.一测多评法测定金银花复方制剂中新绿原酸、绿原酸和隐绿原酸[J].中成药,2013,35(12):2666-2671.
[15]Li Y L,But P P H,Ooi V E C.Antiviral activity and mode of action of caffcoylquinic acids fromScheffleraheptaphylla(L.) Frodin[J].Antiviral Research,2005,68 (1):1-9.
[16]Guo W,Wang L,Gao Y,et al.Isolation of isochlorogenic acid isomers in flower buds ofLonicerajaponicaby high-speed counter-current chromatography and preparative high performance liquid chromatography[J].Journal of Chromatography B,2015,981/982:27-32.
[17]Chen J,Song Y,Li P.Capillary high-performance liquid chromatography with mass spectrometry for simultaneous determination of major flavonoids,iridoid glucosides and saponins in flos lonicerae[J].Journal of Chromatography A,2007,1157(1/2):217-226.
