杆状病毒AcMNPV中Ac109蛋白的抗虫功能分析
2018-03-03许书美付月君
许书美,付月君
(山西大学生物技术研究所,山西 太原 030006)
杆状病毒属于环状双链超螺旋DNA病毒,有囊膜包被,呈杆状形态,不同病毒的基因组大小为80~180kbp。其宿主昆虫主要是鳞翅目、膜翅目及双翅目昆虫。苜蓿银纹夜蛾核型多角体病毒(Autographacalifornicamultiple nucleopolyhedrovirus,AcMNPV)是首先完成基因组测序的杆状病毒,基因组大小为133 890 bp,有156个开放阅读框[1-3]。在所有杆状病毒的生活史中均包含2种病毒粒子形态:出芽型病毒粒子BVs和包埋型病毒粒子ODVs,其中,BVs主要介导细胞与细胞间的感染,ODVs主要介导虫体与虫体间的感染[4]。甜菜夜蛾(Spodoptera exiguaHubner)隶属于鳞翅目夜蛾科,是一种世界性分布、间歇性大发生的以危害蔬菜为主的杂食性害虫。
AcMNPV基因组包含ac109基因,推测这个基因与子代病毒的增殖有关。ac109属于杆状病毒AcMNPV的156个开放性阅读框之一,ac109为逆时针方向编码的基因,在AcMNPV基因组的逆转录编码序列的38 002~39 174 nt位置,全长1 173 bp,编码390个氨基酸的多肽,有且仅拥有一个典型的晚期或极晚期启动子元件(GTAAG),序列具有高度保守性[5]。蛋白质保守结构域预测表明,390个氨基酸都与未知功能病毒蛋白质家族DUF673有很高的同源性,而这个家族并未在相关文献中报道[6]。在所有目前提交已测序的53株杆状病毒的全基因组序列中,有52种杆状病毒全基因组都具有ac109的同源物。有研究证明,ac109核心基因是杆状病毒核衣壳正常组装过程中所必需的基因,表达产物为病毒粒子结构蛋白,该蛋白对于病毒在细胞间的传播至关重要。它的缺失不影响病毒DNA的复制,但能够影响病毒正常的转运以及影响BV进入细胞核[7]。
本研究为进一步明确在病毒感染宿主昆虫过程中Ac109蛋白的功能,采用Bac-to-Bac杆状病毒表达系统[8-10]构建了重组的杆状病毒AcMNPVAc109-EGFP,并检测了AcMNPV-Ac109-EGFP对甜菜夜蛾幼虫的抗虫效率,旨在为研发和应用高抗虫活性的重组病毒杀虫剂提供了试验依据。
1 材料和方法
1.1 试验材料
供试草地贪夜蛾卵母细胞株Sf9由山西大学细胞分子生物学课题组保存并培养;AcMNPV、大肠杆菌DH10 Bac菌株和pFastBac Dual-egfp由山西大学细胞分子生物学实验室保存。受试虫为甜菜夜蛾(Spodoptera exigua Hubner),虫卵购自河南省济源白云实业有限公司。
1.2 主要试剂
限制性内切酶Sam I,Xho I和T4 DNA连接酶从宝生物(大连)技术公司购买;抗体anti-β-actin和anti-GFP从上海生工生物工程有限公司购买;细胞裂解液和BCA蛋白分析试剂购自碧云天生物技术公司(江苏);所有的化学药品都是分析级别,购自上海生工生物工程有限公司。
1.3 方法
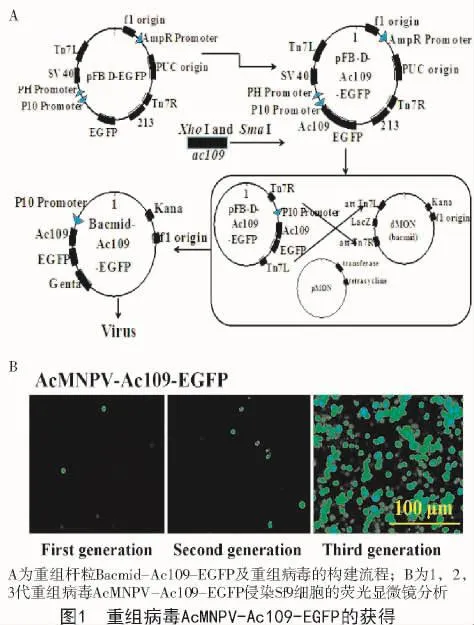
1.3.1 重组杆粒Bacmid-Ac109-EGFP的构建 为构建重组杆粒Bacmid-Ac109-EGFP,首先构建了重组中间载体pFastbacdual-Ac109-EGFP。首先,从AcMNPV的基因组中扩增ac109基因片段,PCR引物序列为 ac109-Sma I-F(5′-ACCCGGGATGGAGT GCCCGTTT-3′,划线部分表示SamI位点)和ac109-Xho I-R:(3′-CCGCTCGAGCCAAATAATAGTTGTA C-5′,划线部分表示Xho I位点)。PCR反应产物被克隆到pFastBac Dual-EGFP载体的Sam I位点与Xho I位点中间。构建好的中间载体经测序证明构建成功。将构建好的中间载体pFastBac Dual-Ac109-EGFP转化进Escherichia coli strain DH10 Bac(DH10B),与 AcMNPV 基因进行转座重组。通过特异引物M13-F(5′-CGCCAGGGTTTTCC CAGTCACGAC-3′)和 M13-R(5′-CACACAGGAAA CAGCTATGAC-3′)进行PCR鉴定,确定重组杆粒Bacmid-Ac109-EGFP是否构建成功(图1-A)。
1.3.2 重组病毒AcMNPV-Ac109-EGFP的构建将生长状态良好的(对数生长期的)Sf9细胞均匀铺入96孔板中,待细胞长至80%后,将重组杆粒Bacmid-Ac109-EGFP(0.2 μg)和脂质体转染试剂liposome TransFastTMTransfection Reagent(0.6 μL)(美国Promega公司)混匀后,转染Sf9细胞。转染24 h后,用荧光显微镜检测Ac109-EGFP的表达,转染3~4 d后收集上清液,即为第1代重组病毒。然后,再用第1代病毒液侵染新铺板的Sf9细胞,3~4 d后再次收集上清液,即为第2代重组病毒,依次类推,获得了第3代重组病毒AcMNPV-Ac109-EGFP(荧光显微镜观察如图1-B所示)。第3代重组病毒即可用于后期活性检测试验。
1.3.3 蚀斑试验 将生长状态良好的Sf9细胞均匀铺入6孔细胞培养板中,待细胞汇合度达到80%后,分别用不同稀释度的1 mL病毒液AcMNPVAc109-EGFP侵染Sf9细胞2 h,然后移去病毒液,并用PBS清洗,加入1.8%的营养琼脂,待其凝固后倒置。感染4~5 d后,用荧光显微镜检测并统计AcMNPV-Ac109-EGFP处理组细胞形成的绿色荧光斑。根据绿色荧光斑数计算得出具有侵染活性的芽生型病毒滴度。
病毒滴度(pfu/mL)=最高稀释倍数的蚀斑数×最高稀释倍数×接种病毒量(mL/孔) (1)
感染复数(multiplicity of infection,MOI)=病毒滴度(pfu/mL)×接种病毒量(mL)/感染细胞总数(2)
1.3.4 Western blot免疫印迹分析与荧光显微镜观察 将生长状态良好的Sf9细胞按6×106个/孔铺入6孔板中,然后用5 MOI(multiplicity of infection,感染复数)的AcMNPV-Ac109-EGFP分别侵染12~72 h,荧光显微镜观察Ac109-EGFP的表达情况。同时,Western blot定量分析Ac109-EGFP的表达量。收集侵染的细胞、裂解液裂解细胞,并收集蛋白样,再通过BCA蛋白分析试剂测定总蛋白样品浓度。然后,经SDS-PAGE电泳,再将目标蛋白转入PVDF膜上。PVDF膜经5%的脱脂奶粉封闭液封闭1h后,4℃过夜孵育一抗(anti-β-actin和anti-GFP),之后用PBST清洗4次,每次15 min,然后再次孵育荧光二抗(IRDye680LT)1h,然后PBST再清洗4次,每次15 min。最终将PVDF膜置于ODSSY CLx中检测。一抗anti-β-actin和anti-GFP均按1∶2 000稀释,二抗IRDye 680LT(Li-COR有限公司,美国)按 1∶20 000 稀释[11-12]。
1.3.5 抗虫活性分析 采用人工饲喂病毒法经口感染甜菜夜蛾幼虫,检测重组病毒AcMNPV-Ac109-EGFP对宿主甜菜夜蛾的致死作用。幼虫孵化后即移入装有27 mm3小块人工饲料的12孔板内,每孔1头,成长为2龄幼虫即可用于试验。试验设置了1个PBS缓冲液对照组和2个病毒处理组(AcMNPV-EGFP和AcMNPV-Ac109-EGFP),每组60头幼虫。待虫体成长为二龄幼虫时,每天将20 μL1×107pfu/mL的2种病毒分别滴加到试验组培养基上,连续滴加5d。对照组滴加PBS缓冲液,然后逐天记录虫体的质量,并统计死亡率、蛹化率及羽化率。
1.4 数据分析
每个试验都进行3个独立试验,使用Excel进行t检验,评估其统计学意义(P<0.05为显著,P<0.01或P<0.001为极显著)。
2 结果与分析
2.1 Western blot免疫印迹和荧光显微镜检测Sf9细胞内Ac109的表达量
荧光显微镜观察结果表明,在试验时间段内,随着AcMNPV-Ac109-EGFP侵染时间的延长,荧光强度显著增加,侵染72 h时侵染率达到最高(图2-A);Western blot免疫印迹结果如图2-B所示,其中,融合蛋白Ac109-EGFP的大小为69 ku,β-actin的大小为42 ku,与免疫印迹条带大小一致,这进一步验证了我们的构建是成功的。这一结果同样表明,随着时间增加,Ac109的表达量显著增加,在侵染后的72 h时,Ac109-EGFP表达量增大。

2.2 重组病毒AcMNPV-Ac109-EGFP抗虫活性分析
由图3可知,2组病毒处理组中的甜菜夜蛾幼虫与PBS对照组相比生长缓慢,并且有低的蛹化率和羽化率以及高的致死率,说明该类病毒对甜菜夜蛾幼虫有较强的致敏性。如图3-A所示,2组病毒处理组的幼虫质量均低于PBS处理组的虫体质量,其中,重组病毒AcMNPV-Ac109-EGFP处理组中虫体质量又略低于AcMNPV处理组;如图3-D所示,AcMNPV与重组病毒处理组AcMNPV-Ac109-EGFP的甜菜夜蛾的半致死时间(LT50)分别为20,16 d,说明重组病毒AcMNPV-Ac109-EGFP与AcMNPV相比,影响了虫体生长,且对甜菜夜蛾有更快的致死效果。
蛹化率也是检测抗虫效率的一个重要标志。AcMNPV与AcMNPV-Ac109-EGFP病毒处理组的蛹化率分别为41.67%与25.00%(图3-B),羽化率分别为20.00%和11.67%(图3-C)。这些结果都表明,过表达ac109使得重组病毒AcMNPV-Ac109- EGFP具有更高的抗虫效应。

3 结论与讨论
本试验结果证实,过表达Ac109蛋白的重组病毒AcMNPV-Ac109-EGFP的抗虫效率相较于野生型杆状病毒更强。ac109基因是一种结构基因,是杆状病毒科中31个核心基因之一,是病毒复制的必需基因[13]。杆状病毒核心基因对它的生命活动有重要影响,它们对病毒DNA复制、基因转录和核衣壳组装等过程有关键作用。理论上,侵染性BV产量越高将导致越高的细胞毒性,进而产生高的杀虫效率。用重组病毒AcMNPV-Ac109-EGFP经口服感染甜菜夜蛾幼虫,幼虫致死率明显高于AcMNPV的致死率,病毒处理的幼虫体质量均低于PBS处理组的幼虫体质量,且化蛹率和羽化率也明显低于对照组病毒及PBS处理组,说明重组病毒AcMNPVAc109-EGFP在进入幼虫体内提高了子代侵染性病毒BV增殖率,从而使其在虫体细胞内产生更高的毒性。先前研究结果表明,AcMNPVac109核心基因编码晚期结构蛋白,是杆状病毒核衣壳正常组装过程中所必需的基因,表达产物为病毒粒子结构蛋白,该蛋白对于病毒在细胞间的传播至关重要[14]。ac109基因的缺失不影响病毒DNA的复制,但是会影响病毒正常的转运以及影响BV进入细胞核[15]。因此认为,过表达Ac109可以增强杆状病毒的转运以及加快出芽型病毒BV进入细胞核的过程,从而使子代病毒增殖加快,进而导致更高的杀虫效率。
本研究结果明确了Ac109对宿主昆虫的杀虫效率,为揭示AcMNPV的抗虫机制和本文构建的重组病毒潜在的抗虫应用价值提供了试验依据。过表达ac109基因的病毒可提高杆状病毒的杀虫效率,因此,可单独或联合其他抗虫基因(重组形成多价病毒)作为重组微生物杀虫剂。同时,ac109基因是病毒自身基因,因此,从生物安全性方面考虑是安全的。
[1] AYRES M D,HOWARD S C,KUZIO J,et al.The complete DNA sequence of Autographa californica nuclear polyhedrosis virus[J].Virology,1994,202:586-605.
[2] JAKUBOWSKA A K,PETERS S A,ZIEMNICKA J,et al.Genome sequence of an enhancin gene-rich nucleopolyhedrovirus(NPV)from Agrotis segetum:collinearity with Spodoptera exiguamultiple NPV[J].J Gen Virol,2006,87:537-551.
[3]HERNIOU E A,OLSZEWSKI J A.The genome sequence and evolution of baculoviruses[J].AnnuRevEntomol,2003,48:211-234.
[4] WILLIAMS GV,FAULKNER P.Cytological changes and viral morphogenesis duringbaculovirus infection[M].NewYork:Plenum Press,1997:61-107.
[5]JIANGS S,CHANGI S,HUANG L W,et al.Temporal transcription program of recombinant Autographa californica multiple nucleopolyhedrosis virus[J].J Virol,2006,80:8989-8999.
[6]VANARSDALLAL,PEARSONMN.Characterization of baculovirus constructs lacking either the Ac 101,Ac 142,or the Ac 144 open readingframe[J].Virology,2007,367(1):187-195.
[7]CHRISTOPHER J L,WENBI W,MARCELO F B,et al.Autographa californica M nucleopolyhedrovirus open reading frame 109 affects infectious budded virus production and nucleocapsid envelopment in the nucleus of cells[J].Virology,2013,435:442-452.
[8]曹建斌,范晓军,付月君.紫外对重组杆状病毒(AcMNPV-BmK IT-Chi)稳定性的影响[J].山西农业科学,2009,37(4):63-65.
[9]范晓军,曹建斌.重组杆状病毒(AcMNPV-BmK IT-Chi)的杀虫活性和安全初步研究[J].华北农学报,2007,22(5):161-164.
[10]凌同,余黎.昆虫杆状病毒表达系统的研究进展与应用[J].微生物学免疫学进展,2014,42(2):70-78.
[11]付月君,林桃桃.重组病毒AcMNPV-BnKIT侵染Sf9细胞后凋亡相关基因的表达分析[J].植物保护,2015,41(1):23-27.
[12]赵洁,梁爱华.AcMNPV介导BmKIT和组织蛋白酶协同表达对 Sf9 细胞凋亡的分析[J].华北农学报,2015,30(1):118-122.
[13]MCCARTHYCB,DAI X,DONLYC,et al.Autographa californica multiple nucleopolyhedrovirus ac142,a core gene that is essential for BV production and ODV envelopment[J].Virology,2008,372(2):325-339.
[14] LIN L,JINWEN W,RIQIANG D,et al.ac109 is required for the nucleocapsid assembly of Autographa californica multiple nucleopolyhedrovirus[J].Virus Research,2009,144:130-135.
[15]VICTORIA A,GUILLERMO A M,SOL R R,et al.AcMNPV core gene ac109 is required for budded virion transport to the nucleus and for occlusion ofviral progeny[J].Plos One,2012,7:e46146.
