医疗器械标准体系进展
2018-03-03许慧雯王越杨晓芳李静莉中国食品药品检定研究院北京市102629
【作 者】许慧雯,王越,杨晓芳,李静莉中国食品药品检定研究院,北京市,102629
医疗器械标准是医疗器械监管的技术依据,在指导医疗器械设计、生产、使用和服务于监管等方面均发挥着重要作用。在国际贸易中,标准是贸易仲裁的依据。医疗器械标准具有特殊性,根据性质分为强制性医疗器械标准和推荐性医疗器械标准。根据《医疗器械监督管理条例》(国务院令第650号),医疗器械产品应当符合医疗器械强制性国家和行业标准。医疗器械推荐性标准为鼓励采用。而国际标准除被法规引用外均为推荐性的。因此,为了保证医疗器械国际标准合理转化,我们从标准法规支撑体系、组织管理体系、技术管理体系三方面加强自身建设,切实提升标准管理质量和水平。
1 医疗器械标准法规支撑体系更加完善
我国医疗器械标准工作是在相关的法律法规以及规范性工作文件的指导下完成的。为了进一步完善我国医疗器械标准的法规支撑体系,更好地发挥标准的行业指导作用,国家食品药品监督管理总局(以下简称“总局”)委托医疗器械标准管理中心(以下简称“标管中心”)组织开展了《医疗器械标准管理办法》以及《医疗器械行业标准制修订工作规范(试行)》的制修订工作。目前,新修订的《医疗器械标准管理办法》已于2017年4月26日发布,2017年7月1日正式实施。
2 医疗器械标准的组织管理体系更加合理
2009年6月,为进一步加强对医疗器械标准化工作的宏观管理和技术指导,中央机构编制委员会办公室(中编办)批复成立标管中心。2010年3月,标管中心正式挂牌成立。形成了总局—标管中心—标准化(分)技术委员会三级标准组织结构。
在明确组织结构的基础上,标管中心一方面深入开展基础研究,完善标准组织管理体系。强化医疗器械标准体系的顶层设计和宏观规划,提出了医疗器械标准体系建设思路,合理构建了标准体系框架。另一方面注重合理布局,统筹技委会建设工作。标管中心发挥指导作用,协调解决技委会发展问题,从全系统、全体系的角度,统筹新技委会筹建工作。在国家发展战略部署和监管亟需领域积极筹建新技委。截止到2016年6月,我国共有24个医疗器械领域的专业标准化(分)技术委员会,有源植入物、纳米医疗器械生物学评价、卫生材料及敷料、光辐射安全和激光设备、中医诊疗设备以及医用电声6个分技委的筹建申请已进入国家标准化管理委员会审批阶段。
3 医疗器械标准的技术管理体系更加完备
3.1 基本实现标准全过程精细化管理
为保证医疗器械标准制修订更好地反映产业发展现状和监管需求,标管中心致力于加强标准制修订的全过程及关键环节的精细化管理。一是公开公正,开展标准立项工作。根据工作实际,制定立项指南,明确立项要求,合理把握强制性行业标准制定范围。立项草案面向全社会公开征求意见,实现立项工作公平、公正、科学、合理。二是多措并举,提高标准质量。制定《医疗器械标准报批材料审核工作管理规定》、《医疗器械标准审核内部程序管理规范》、《归口单位标准管理规定》等规章文件,严格程序,提高标准审查质量,总结问题,落实关口前置。
3.2 基本完成医疗器械强制性标准评估
根据医疗器械监管的定位,强制性标准立足服务监管,作为保障医疗器械安全有效的准入门槛;推荐性标准主要在提升产品质量,引导产业健康发展发挥指导性、带动性作用。为了满足监管和产业的需求,标管中心组织各医疗器械标准化技术委员会,对截止到2016年6月,我国现行有效的488项医疗器械强制性标准以及91项已获立项正在进行中或已完成尚未发布的强制性标准计划项目开展整合精简工作。提出了作为强制性标准应限定在保障人体健康和生命安全、医疗器械的安全有效等基本要求的范围内的基本原则。不符合此项原则的,建议转化为推荐性标准,并对部分老旧标准已不适应产业发展的予以废止。以此为契机,逐步解决了我国现行强制性标准存在的交叉、重复、矛盾和超范围制定等主要问题,从而构建出了结构合理、规模适度、内容科学的新型强制性医疗器械标准体系。
根据医疗器械强制性标准整合精简结果,其中废止21项,占总数的4%;转化64项,占总数的11%;整合67项,占总数的12%;修订100项,占总数的17%;保留317项,占总数的54%;建议由强制性行业标准改为强制性国家标准的10项,占总数的2%。详见表1。
3.3 基本缓解了“十一五”标准存在的突出问题
遵循“服务监管、面向产业、自主研究、适时推出”的原则,采取有效措施,医疗器械技术标准体系更加完善,基本解决了“十一五”期间医疗器械标准存在的突出问题。
3.3.1 标准制修订更加及时,老旧标准问题得到缓解
在《中华人民共和国标准化法》要求5年标准复审的基础上,严格要求各标委会每年对归口标准内容进行复审,并在“医疗器械标准制修订信息系统”中注明复审结论,确保归口标准的有效性、先进性和适用性。截止到2016年9月,医疗器械行业标准平均标龄为6.5年,5年内标准数占43.6%,5~10年内标准数占42%(见图1)。医疗器械国家标准平均标龄为9.5年,5年内标准数占31.1%,10年内标准数占33.8%(见图2)。每年持续复审工作保证了医疗器械标准的有效性、及时性和稳定性。
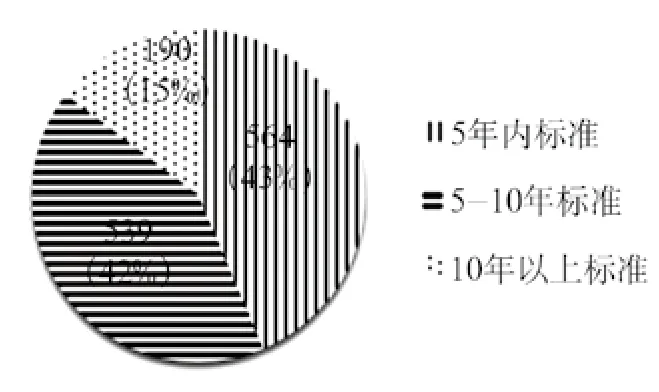
图1 医疗器械行业标准标龄统计图Fig.1 Age scale chart of medical device professional standards

图2 医疗器械国家标准标龄统计图Fig.2 Age scale chart of medical device state standards
3.3.2 标准覆盖更加全面,标准缺失问题得到缓解
医疗器械标准数量逐年增加,标准覆盖更加全面。截止到2016年9月,我国共发布医疗器械标准1 515项(见表2),其中国家标准222项(强制93项,推荐127项,指导性文件2项),行业标准1 293项(强制390项,推荐903项)。建立了涉及医用电气设备、手术器械、外科植入物等多个技术领域的医疗器械标准体系,基本覆盖了医疗器械产品各技术领域,高风险领域基本实现全覆盖。
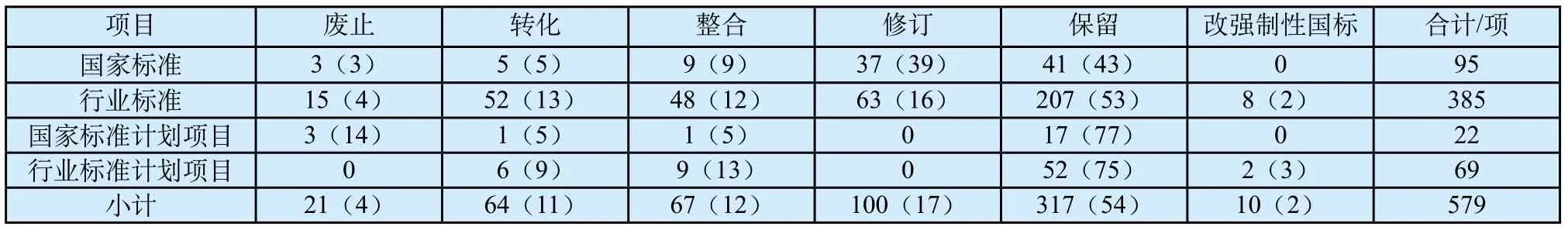
表1 医疗器械强制性标准整合精简结果[n(%)]Tab.1 Results of integration of mandatory medical device standards
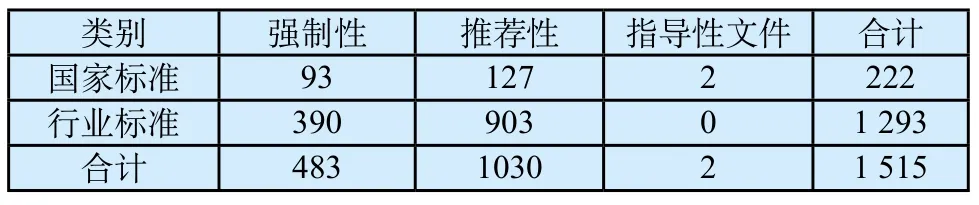
表2 医疗器械标准发布情况表Tab.2 Statistics of medical device state and professional standards
3.3.3 标准管理更加专业,标准协调性问题逐年缓解
通过制定医疗器械标准制修订规划、计划和对标准组织实施全过程的专业管理,深入把握国家标准改革要求,梳理标准和法规的关系,结合《医疗器械标准管理办法》修订工作,深入研究医疗器械标准层级和性质划分依据和原则,逐步优化GB 9706“医用电气设备”系列标准、GB/T 16886《医疗器械生物学评价》系列标准以及YY 0505—2012《医用电气设备第1-2部分:安全通用要求 并列标准:电磁兼容 要求和试验》和YY/T 0640—2016《无源外科植入物 通用要求》等医疗器械基础通用标准、YY/T 0287—2003《医疗器械 质量管理体系 用于法规的要求》、YY/T 1000《医疗器械行业标准的制定》系列标准等管理标准、方法标准和产品标准占比,提高医疗器械标准和法规的协调性、国家标准和行业标准的协调性、强制性标准和推荐性标准之间的协调性(见表3、表4)。
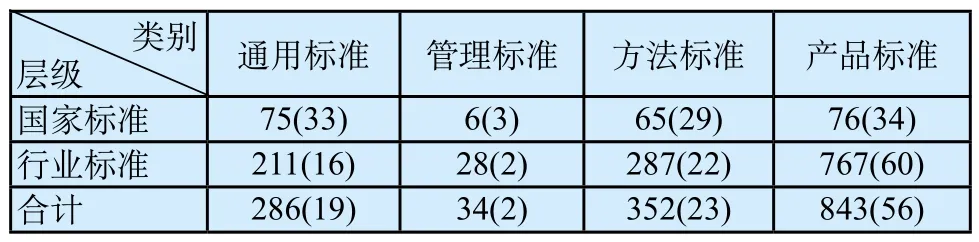
表3 医疗器械标准分类按层级统计情况表[n(%)]Tab.3 Medical device standards classif i ed by rank
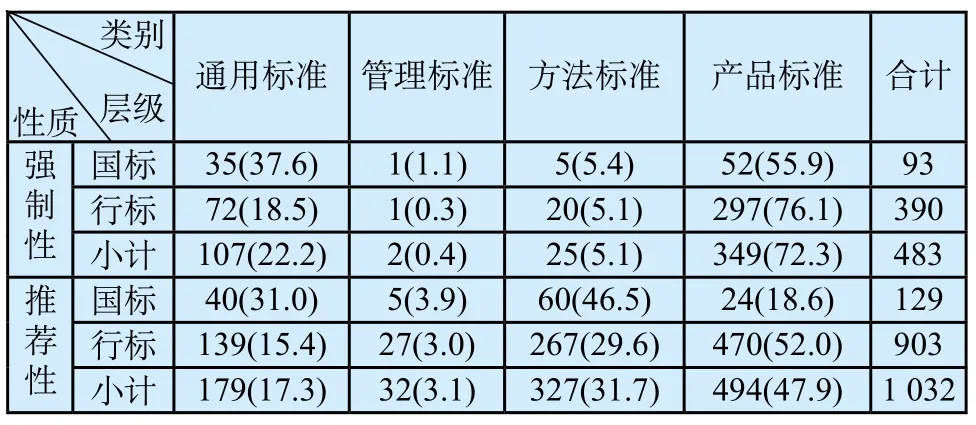
表4 医疗器械标准分类按性质统计情况表[n(%)]Tab.4 Medical device standards classif i ed by characteristics
3.4 国际标准化工作更加深入
3.4.1 开展国际标准研究工作
为了更好地与国际接轨,按照总局医疗器械国际监管法规研究组的部署,标管中心组织开展了医疗器械国际标准研究工作,梳理国际医疗器械监管者论坛(International Medical Device Regulators Forum,IMDRF)认可的国际标准,梳理国际标准和我国现行法规之间的关系,开展国际重要基础标准研究工作,拟筹备成立医疗器械国际标准研究小组。
3.4.2 重大标准转化前开展专题研究
对我国行业影响面大量广的重大国际标准(如IEC 60601-1第三版等)在转化前,开展专题调研研究,深入了解标准转化和我国法规的关系,掌握标准转化实施对国内器械产品的设计、生产乃至监管部门的技术审评、行政审批工作带来的影响。制定转化实施工作方案,对转化实施工作目标、组织保障、具体要求及工作时间与安排进行了总体部署,保证标准顺利转化、平稳实施。
3.4.3 及时跟踪对口国际标准化组织工作动态
积极参与标准国际交流活动,与美国电器制造协会(MITA)专家协商推进DICOM标准转化事宜;提出中德医疗器械标准化交流重点项目和中法标准化合作中电子医疗领域合作项目。为相关国际标准的转化、实质性参与国际标准制修订活动创建了交流平台,为国家提供监管技术夯实了技术基础。及时跟踪了解对口国际标准化组织工作动态,及时掌握国际标准制修订状态,积极参与国际标准制修订工作,为推动国际标准适时合理转化奠定基础。
4 下一步标准工作思路和措施
一是继续完善医疗器械标准法规体系。结合新修订《医疗器械标准管理办法》的发布实施,继续推进《医疗器械行业标准制修订工作规范》修订工作,准确把握国家标准化改革精神,结合医疗器械行业监管特点,完善医疗器械标准法规体系。二是深度优化医疗器械标准组织架构。统筹考虑、全盘规划,结合医疗器械强制性标准精简和推荐性标准复审工作,协调解决一部分涉及技术归口交叉的标准,废止部分不符合现有医疗器械监管要求的标准,进一步厘清现有标准体系。依托标委会考核评价工作,加强对现有标委会的指导管理,协调解决各医疗器械标委会之间、行业内外标准化组织之间的归口交叉等问题, 加强在薄弱和监管亟需领域的标委会筹建以及标准体系建立工作,深度优化医疗器械标准组织架构。三是结合需求开展医疗器械标准研究。加强对医用生物材料、医用机器人等新领域标准质量和标准需求的调研,密切跟踪产业发展动态,准确把握监管需求,开展医疗器械标准科研和关键技术等标准研究工作。四是继续深化医疗器械国际标准工作。建立有利于参与医疗器械国际标准化工作的管理机制,建立实质性参与医疗器械国际标准制修订工作的单位和个人的奖励机制,及时跟踪把握重大国际医疗器械标准制修订动态,结合我国法规、标准体系特点,制定合理的标准转化工作计划,做到合理规划、及时转化、质量优化。
面对医疗器械监管新要求,国家标准化改革新趋势,医疗器械产业发展新需求以及医疗器械标准面临的新任务,医疗器械标准管理进入发展关键时期。未来,要继续充分发挥标管中心的统筹协调和技术管理作用,坚持以管理促进标准提升,以需求引领标准提升,以科技支撑标准提升的理念,持续提高医疗器械标准的科学性和适用性。
[1] 肖忆梅, 欧阳昭连, 白杨, 等. 欧盟医疗器械标准体系发展现状探析[J]. 医学信息学杂志, 2016(11): 66-69.
[2] 陈静, 廖晓曼. 《医疗器械行业标准制修订工作规范》在标准制修订全过程管理中的应用[J]. 医疗装备, 2016(15): 38-40.
[3] 肖忆梅, 李军. 医疗器械专用标准体系研究[J]. 中国医疗器械杂志, 2016, 40(3): 198-201.
[4] 肖忆梅, 李军. 医疗器械通用标准体系研究[J]. 中国医疗器械杂志, 2015, 39(2): 128-131.
[5] 李悦菱, 廖晓曼, 刘毅. 我国医疗器械标准现状及问题分析[J]. 医疗装备, 2014(12): 36-38.
[6] 杜然然, 欧阳昭连, 郭柯磊, 等. 我国医疗器械标准现状与存在问题探讨[J]. 医学研究杂志, 2012(11): 201-204.
[7] 母瑞红, 肖忆梅. 我国医疗器械标准现状分析与建议[J]. 中国药事, 2011(7): 657-658.
[8] 李军. 我国医疗器械标准现况调研[J]. 中国医疗器械杂志, 2009,33 (5): 362-368.
[9] 曹晨光. 医疗器械标准化工作的现状与发展[J]. 中国标准化,2001(8): 6-7.
[10] 武俊华. 医疗器械标准化工作的新阶段[J]. 中国标准化, 2001(8): 12-13.
