动态增强MRI定量评价缺血性脑白质病患者血脑屏障通透性
2018-03-02刘明熙胡文立
李 曼,李 悦,高 帅,刘明熙,周 洋,左 龙,胡文立,蒋 涛*>
(1.首都医科大学附属北京朝阳医院放射科,2.神经内科,北京 100020)
缺血性脑白质病变好发于侧脑室周围或皮层下脑白质区,T2WI及FLAIR序列图像呈高信号,T1WI呈等或低信号,是脑小血管病的MRI表现之一[1]。血脑屏障(blood-brain barrier, BBB)通透性改变是缺血性脑白质病的发病机制之一[2]。动态对比增强磁共振成像(dynamic contrast-enhanced MRI, DCE-MRI)可观察T1WI信号强度变化,还可采用药代动力学模型计算反映局部组织微血管通透性的定量参数,从而定量评价BBB通透性[3-5]。本研究采用DCE-MRI技术,定量评价缺血性脑白质病变患者BBB通透性改变。
1 资料与方法
1.1 一般资料 招募2016年4月—2017年1月于我院接受查体的中老年人顺序入组,入组标准:①年龄≥50岁;②同意接受常规MR及DCE-MR检查。排除标准:①脑卒中病史、颈动脉狭窄≥50%、冠状动脉病变、阿尔兹海默病、癫痫、神经退行性病变及多发性硬化等中枢神经系统疾病;②外伤、肿瘤、感染、系统性病变;③MR检查及对比剂禁忌证;④滥用药物及酒精依赖病史、精神障碍性疾病。最终纳入受试者71人,男32人,女39人,年龄53~81岁,平均(68.9±8.0)岁。对所有受试者行颅脑常规MRI及DCE-MRI检查,并采用简易智力状况检查(mini-mental state examination, MMSE)量表评价认知功能。以2017年美国心脏协会(American Heart Association, AHA)及美国卒中协会(American Stroke Association, ASA)发布的《无症状脑血管病患者的卒中预防》指南[6]中推荐的改良Fazekas量表对受试者进行评分,并根据评分将其归入病例组(Fazekas评分3~6分)或对照组(Fazekas评分0~2分,认为是年龄增长相关改变)。本研究经我院伦理委员会审查通过,所有受试者均签署知情同意书。
1.2 仪器与方法 采用Siemens Prisma 3.0T MR扫描仪,64通道头部线圈。常规MR扫描序列:轴位及矢状位T1W序列(TR 2 000 ms,TE 9 ms),轴位T2W序列(TR 5 000 ms,TE 94 ms),轴位FLAIR序列(TR 9 000 ms,TE 81 ms),DWI (TR 4 000 ms,TE 86 ms);FOV均为230 mm×230 mm,层厚5 mm。DCE-MRI采用vibe技术,主要扫描参数:TR 5.08 ms,TE 1.8 ms,翻转角15°,FOV 230 mm×230 mm,分辨率1.2 mm×1.2 mm×3.0 mm。DCE-MRI共采集60个时相,于第5个时相经肘静脉团注Gd-DTPA(0.1 mmol/kg体质量),流率2.5 ml/s,随后注入10 ml生理盐水,采集时间6 min 31 s。
1.3 图像分析 采用Nordic ICE(Nordic Neuro Lab, Bergen, Norway)软件进行图像后处理。于DCE-MRI上手动勾画上矢状窦轮廓[7],应用Patlak模型[8]获得动脉输入函数(arterial input function, AIF)及时间-信号强度曲线,经图像平滑、校正后,软件自动生成DCE-MRI各项定量参数伪彩图,并与原始图像进行匹配。由1名高年资放射科医师于侧脑室周围及深部白质FLAIR高信号区及周围脑白质正常区勾画ROI,大小为5~10 mm2,测量渗透率(Ktrans)、血浆容积分数(Vp)及渗透曲线下面积(AUC)值,测量3次取平均值。对Fazekas评分为0分的受试者,将ROI放置于侧脑室周围脑白质区域。
1.4 统计学分析 采用SPSS 20.0统计分析软件,正态分布的计量资料以±s表示,组间比较采用独立样本t检验;非正态分布的计量资料以中位数(上下四分位数)表示,组间比较采用Mann-WhitneyU检验。计数资料以频数(百分比)表示,组间比较采用χ2检验。以Spearman相关分析评价Ktrans、Vp、AUC值与MMSE评分的相关性。P<0.05为差异有统计学意义。
2 结果
病例组共纳入35例患者,其中10例Fazekas评分3分,12例4分,9例5分,4例6分;对照组共纳入36名,其中5名Fazekas评分0分,17名1分,14名2分。病例组与对照组间MMSE评分差异有统计学意义(P<0.001);2组间性别、年龄、高血压、糖尿病、高脂血症、吸烟及教育年限差异均无统计学意义(P均>0.05),见表1。
2组间脑白质FLAIR高信号区Ktrans、AUC值差异均有统计学意义(P均<0.001),Vp值差异无统计学意义(P=0.296);周围脑白质表现正常区Ktrans、AUC及Vp值差异均有统计学意义(P均<0.001)。见表2、图1。
病例组脑白质FLAIR高信号区Ktrans、AUC值与MMSE评分呈负相关(r=-0.440、-0.540,P均<0.001);Vp值与MMSE评分间无相关性(r=0.114,P=0.344)。
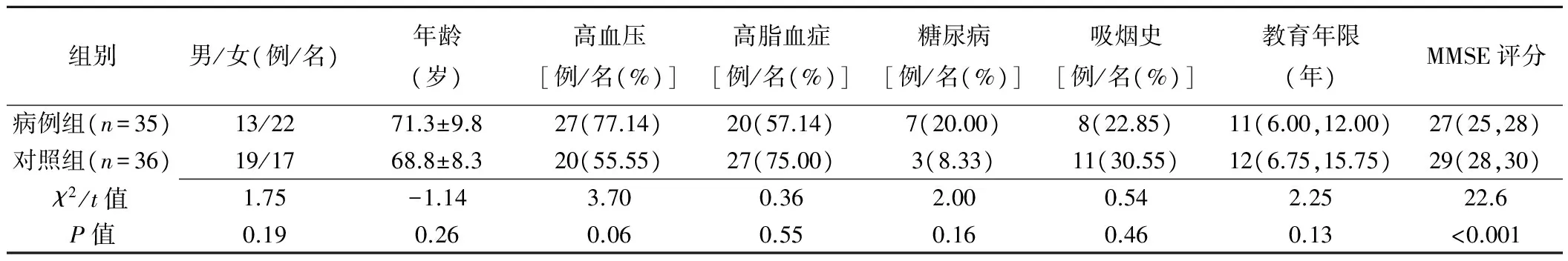
表1 2组受试者一般资料比较
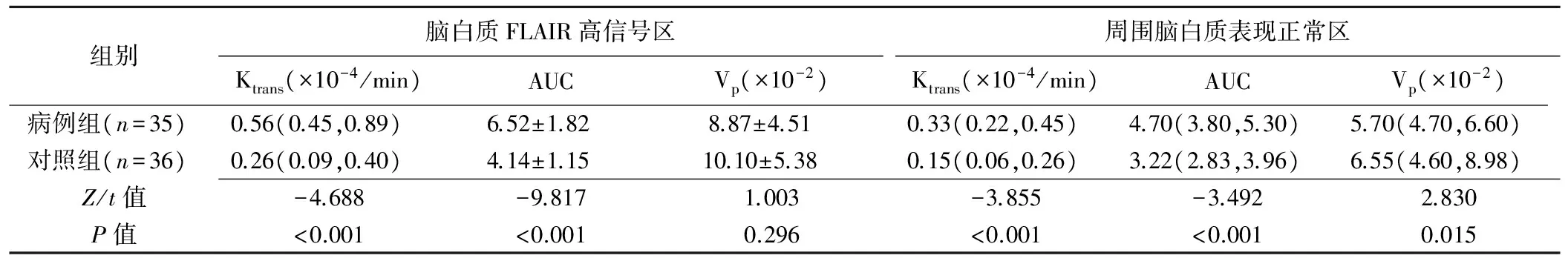
表2 2组脑白质FLAIR高信号区及周围脑白质表现正常区Ktrans、AUC及Vp值比较

图1 患者女,81岁,Fazekas评分5分 A.FLAIR图像示双侧侧脑室周围及皮层下脑白质多发高信号区; B~D.依次为Ktrans、AUC及Vp伪彩图
3 讨论
Ktrans为对比剂渗透分数,AUC为渗透曲线下面积,表示渗透容积。本研究结果显示,病例组FLAIR高信号区和周围脑白质表现正常区Ktrans、AUC值均高于对照组,表明缺血性脑白质病变患者BBB通透性增加,提示BBB破坏不仅累及脑白质病变区,亦累及常规MRI表现正常的脑白质区,即脑小血管病患者BBB通透性增加早于脑白质信号的改变。BBB由毛细血管内皮细胞、细胞间紧密连接、基底膜、周细胞和星形胶质细胞等构成[9]。BBB破坏使血管内神经毒性蛋白漏出[10-11],介导炎性反应[12],导致血管周围间质水肿、神经元损伤,继发神经纤维破坏、轴索断裂及星形胶质细胞增生,从而损伤脑白质纤维[13]。有学者[14]对脑小血管病及轻度认知障碍患者行DCE-MR检查,发现脑白质FLAIR高信号区及常规MRI上表现正常的脑白质区AUC均增高,提示BBB通透性增加,但Ktrans值无明显变化,与本研究结果有所不同;分析原因,可能在于本研究排除了症状性脑卒中患者,且采用64通道线圈及Patlak模型对数据进行采集和分析,提高了测量数据的准确性。本研究发现病例组脑白质FLAIR高信号区BBB通透性与患者认知功能呈负相关。Wardlaw等[15]采用增强MRI观察基底核、灰质、白质区域BBB通透性,发现BBB通透性增加与脑小血管病患者的预后不良相关,提示BBB通透性增加可能加重脑小血管病患者脑功能损害。另一项动物实验研究[13]表明,BBB通透性增加可导致白质纤维断裂,使脑白质网络储备能力下降,提示此类改变可能是导致认知功能减低的原因[16]。
Vp反映局部脑血流灌注情况。本研究中,病例组常规MRI表现正常的脑白质区域Vp减低,提示局部脑血流灌注减低;究其原因,一方面可能是缺血性脑白质病变患者脑体积萎缩,脑组织耗氧量及代谢率均减低,局部血流灌注减少[17];另一方面,脑白质高信号区域一氧化氮合成酶受损,内皮细胞功能破坏,引起血管平滑肌细胞松弛,导致灌注压下降[18]。本研究中,病例组与对照组脑白质FLAIR高信号区的Vp值差异无统计学意义,提示脑白质高信号区血流灌注未见明显减低。既往研究者[19]将脑白质作为一个整体而未区分脑白质高信号区域与常规MRI表现正常脑白质。因此,脑白质高信号区血流灌注情况尚待扩大样本量进一步研究。
本研究的局限性:①DCE-MR扫描时间相对较短,可能会低估脑白质高信号区域BBB的渗漏率;②采用手动勾画ROI的方式进行数据测量,可能会影响数据的准确性;③本研究为横断面研究,BBB通透性增加与脑白质高信号进展之间是否有关,还需要进一步随访研究。
综上所述,本研究采用DCE-MRI定量分析,发现缺血性脑白质病变患者脑白质FLAIR高信号区及周围脑白质常规MRI表现正常区BBB通透性均增加,提示BBB通透性增加可能是缺血性脑白质病变的发病机制之一。
[1] Debette S, Markus HS. The clinical importance of white matter hyperintensities on brain magnetic resonance imaging: Systematic review and meta-analysis. BMJ, 2010,341:c3666.
[2] Farrall AJ, Wardlaw JM. Blood-brain barrier: Ageing and microvascular disease--systematic review and meta-analysis. Neurobiol Aging, 2009,30(3):337-352.
[3] Larsson HB, Stubgaard M, Frederiksen JL, et al. Quantitation of blood-brain barrier defect by magnetic resonance imaging and gadolinium-DTPA in patients with multiple sclerosis and brain tumors. Magn Reson Med, 1990,16(1):117-131.
[4] Hanyu H, Asano T, Tanaka Y, et al. Increased blood-brain barrier permeability in white matter lesions of Binswanger's disease evaluated by contrast-enhanced MR. Dement Geriatr Cogn Disord, 2002,14(1):1-6.
[5] Lecler A, Fournier L, Diard-Detoeuf C, et al. Blood-brain barrier leakage in early Alzheimer disease. Radiology, 2017,282(3):923-925.
[6] Smith EE, Saposnik G, Biessels GJ, et al. Prevention of stroke in patients with silent cerebrovascular disease: A scientific statement for healthcare professionals from the American Heart Association/American Stroke Association. Stroke, 2017,48(2):e44-e71.
[7] Lavini C, Verhoeff JJ. Reproducibility of the gadolinium concentration measurements and of the fitting parameters of the vascular input function in the superior sagittal sinus in a patient population. Magn Reson Imaging, 2010,28(10):1420-1430.
[8] Heye AK, Thrippleton MJ, Armitage PA, et al. Tracer kinetic modelling for DCE-MRI quantification of subtle blood-brain barrier permeability. Neuroimage, 2016,125:446-455.
[9] Zhao Z, Nelson AR, Betsholtz C, et al. Establishment and dysfunction of the blood-brain barrier. Cell, 2015,163(5):1064-1078.
[10] Østergaard L, Engedal TS, Moreton F, et al. Cerebral small vessel disease: Capillary pathways to stroke and cognitive decline. J Cereb Blood Flow Metab, 2016,36(2):302-325.
[11] Saunders NR, Daneman R, Dziegielewska KM, et al. Transporters of the blood-brain and blood-CSF interfaces in development and in the adult. Mol Aspects Med, 2013,34(2-3):742-752.
[12] Sagare AP, Bell RD, Zhao Z, et al. Pericyte loss influences Alzheimer-like neurodegeneration in mice. Nat Commun, 2013,4:2932.
[13] Rosenberg GA, Wallin A, Wardlaw JM, et al. Consensus statement for diagnosis of subcortical small vessel disease. J Cereb Blood Flow Metab, 2016,36(1):6-25.
[14] Zhang CE, Wong SM, van de Haar HJ, et al. Blood-brain barrier leakage is more widespread in patients with cerebral small vessel disease. Neurology, 2017,88(5):426-432.
[15] Wardlaw JM, Doubal FN, Valdes-Hernandez M, et al. Blood-brain barrier permeability and long-term clinical and imaging outcomes in cerebral small vessel disease. Stroke, 2013,44(2):525-527.
[16] Farrar DC, Mian AZ, Budson AE, et al. Retained executive abilities in mild cognitive impairment are associated with increased white matter network connectivity. Eur Radiol, 2018,28(1):340-347.
[17] van der Veen PH, Muller M, Vincken KL, et al. Longitudinal relationship between cerebral small-vessel disease and cerebral blood flow: The second manifestations of arterial disease-magnetic resonance study. Stroke, 2015,46(5):1233-1238.
[18] Nezu T, Yokota C, Uehara T, et al. Preserved acetazolamide reactivity in lacunar patients with severe white-matter lesions:15O-labeled gas and H2O positron emission tomography studies. J Cereb Blood Flow Metab, 2012,32(5):844-850.
[19] Shi Y, Thrippleton MJ, Makin SD, et al. Cerebral blood flow in small vessel disease: A systematic review and meta-analysis. J Cereb Blood Flow Metab, 2016,36(10):1653-1667.
