Lys490饱和突变提高海藻糖合酶转化率的研究
2018-02-28吕鑫王腾飞汪俊卿刘洪玲王瑞明
吕鑫,王腾飞,汪俊卿,刘洪玲,王瑞明*
1(齐鲁工业大学 生物工程学院,山东 济南,250353) 2(天津科技大学 生物工程学院,天津,300222)
海藻糖是自然界中天然存在的一种非还原性二糖,是麦芽糖的同分异构体,由两分子的葡萄糖通过α,α-1,1-糖苷键连接构成[1-2]。在细菌、真菌、昆虫和一些无脊椎动物中都发现了海藻糖的存在[3-5],其主要功能是作为储能物质和细胞壁的组成成分[6-7]。随着研究的不断深入,海藻糖在食品、药品、化妆品及农业领域得到了广泛的应用[8-9]。
海藻糖合酶(Treshalose synthase, TreS)能够专一性水解麦芽糖生成海藻糖[10],其底物专一性强,为廉价的麦芽糖[11]。目前已经有多种来源的海藻糖合酶基因被发现并进行了异源表达,但TreS转化底物麦芽糖生产海藻糖的转化率较低,因此,对海藻糖合酶进行分子改造是非常必要的。目前,有3种不同来源的TreS进行了结构解析,分别是来源于Deinococcusradiodurans(PDB ID:4tvu)[12]、Mycobacteriumtuberculosis(PDB ID:4lxf)[13]、Mycobacteriumsmegmatis(PDB ID:3zo9)[14]的海藻糖合酶。TreS属于糖苷水解酶13家族(GH13),包含ABC 3个结构域,其A结构域内的(α/β)8桶状区域是催化主体结构,其内部主要由两个天冬氨酸(Asp)和一个谷氨酸(Glu)构成催化三联体[12]。相比随机突变,通过同源建模得到蛋白质的预测结构,结合分子对接技术及氨基酸序列比对方法,理性设计突变位点,能够在较小的突变库中得到性质提高的突变体,被广泛应用于蛋白质分子改造[15-16]。目前有多种来源的TreS通过分子改造提高了酶的特性,如李珍珍等人对来源于PseudomonasstutzeriQLU3的海藻糖合酶进行结构预测及分子对接,发现底物进出通道是海藻糖合酶反应的限速步骤,通过改变通道大小,将底物进出口的一些氨基酸定点突变后,得到一个转化率提高4.5%的突变体[17]。宿玲怡等人通过多序列比对和同源建模的方法,将来源于Thermusthermophilus的TreS活性中心保守区附近的氨基酸突变后,突变体转化率达到62%比原始酶提高13%[18]。
本研究室筛选得到的PseudomonasputidaP06,其产生的海藻糖合酶温度和pH耐受性比较强,在40 ℃以下,pH 8.0~9.0条件下表现出较高的酶活[19]。通过基因工程手段,已经将该TreS基因成功导入到大肠杆菌中,使蛋白表达量得到大幅提高[20]。但因该酶的转化率难以满足工业化生产的需要,因此有必要通过蛋白质工程手段改造TreS提高其酶促反应的转化率。本实验通过同源建模得到海藻糖合酶的预测结构,并与底物麦芽糖进行了分子对接,结合多序列比对结果,构建饱和突变库,筛选得到了转化率提高的突变体并对突变体的酶学性质进行了研究,为下一步海藻糖合酶的改造和工业化应用提供了实验基础。
1 材料和方法
1.1 材料
1.1.1 菌株与质粒
E.coliDH5α(含pET-15b-TreS质粒)为本实验室前期构建;E.coliBL21(DE3) 超级感受态细胞为克隆表达宿主菌,购自Vazyme公司。
1.1.2 试剂及培养基
2xPhanta®Max Master Mix购自Vazyme公司;Dpn I限制性内切酶购自Takara公司;TaqDNA聚合酶购自Thermo Fisher Scientific公司;DNA Marker、质粒提取试剂盒购自北京艾德莱生物有限公司;其他试剂为国产分析纯。
培养基:LB液体培养基:蛋白胨10 g/L、酵母浸粉5 g/L、NaCl 10 g/L,用于大肠杆菌的培养及诱导。LB固体培养基在液体培养基的基础上添加20 g/L琼脂粉。
1.1.3 仪器
Veriti PCR仪;上海知楚ZQZY-CS恒温振荡培养箱;美国SONICS超声破碎仪;日本岛津LC-20A高效液相色谱。
1.2 海藻糖合酶及突变酶的结构分析和同源序列比对
利用I-TASSER进行TreS的三维结构预测,模板为来源于Mycobacteriumtuberculosis的海藻糖合酶H37Rv (PDB登录号:4LXF_A)[13]。TreS与底物麦芽糖的柔性对接利用AUTODOCK4.0软件进行,结构分析及突变位点预测通过PyMOL v1.6软件完成。利用DNAMAN6.0软件进行氨基酸序列比对分析。通过分析TreS突变前后氨基酸性质变化、疏水相互作用等,分析突变对转化率的影响。
1.3 全质粒PCR法构建饱和突变库
定点饱和突变采用全质粒PCR方法进行,以提取自E.coliDH5α的PET-15b-TreS质粒为模板,以含简并引物的 LYS490-F、LYS490-R为引物,引物序列见表1。利用2×Phanta®Max Master Mix高保真聚合酶进行突变质粒扩增,其中PCR反应体系为:2×Phanta®Max Master Mix 25μL,上下游引物各2 μL,模板DNA 1 μL,ddH2O补齐至50 μL。PCR反应程序为:95 ℃ 3 min;95 ℃ 15 s,68 ℃ 8 min,30个循环;72 ℃ 10 min。反应结束后,取5 μL产物以1%琼脂糖凝胶电泳检测。

表1 LYS490饱和突变引物
注:下划线序列代表突变氨基酸密码子序列: N=A/T/C/G, K=G/T
将得到的PCR扩增产物利用Dpn I内切酶消化30 min,模板质粒是经dam甲基化修饰的对Dpn I敏感而被切碎。酶切产物转化E.coliBL21(DE3) 超级感受态细胞,转化液涂布于含50 μg/mL氨苄青霉素的LB固体培养基,37 ℃过夜培养,随机挑取单克隆至含1 mL LB培养基(含100 μg /mL 氨苄青霉素)的甘油管中,过夜培养,构建饱和突变体库,库容96个。
1.4 突变体库的诱导表达
将突变体接种于50 mL LB液体培养基(含100 μg/mL 氨苄青霉素),37 ℃,200 r/min培养至OD600 nm达到2.5~3.0时,添加诱导剂乳糖至终浓度4 g/L,27 ℃,200 r/min条件下诱导8 h。发酵液于4 ℃,8 000 r/min条件下离心10 min,5 mL 10 mmol/L PBS(pH 8.0)重悬菌体,利用超声破碎仪提取突变酶,破碎条件:300 W,工作时间5 s,间歇5 s,全程15 min。破碎液4 ℃,8 000 r/min离心10 min,收集上清液,上清液用0.22 μm滤膜过滤除菌。
1.5 突变酶活性检测及转化率计算
取5 mL粗酶液转化底物浓度300 g/L的麦芽糖溶液(pH 8.0),25 ℃条件下反应8 h,沸水浴15 min终止反应。室温13 000 r/min离心15 min,取上清利用高效液相色谱(High Performance Liquid Chromatography ,HPLC)检测转化体系中海藻糖、葡萄糖、麦芽糖含量。同一突变子重复3次,测定值差异小于5%,取平均值。
HPLC测定方法:色谱柱Inertsil NH2(4.6 mm×250 mm,5 μm);流动相(乙腈∶水=3∶1);流速(1.0 mL/min);检测器:示差折光检测器;进样量10 μL;柱温40 ℃。
海藻糖合酶转化率计算公式:
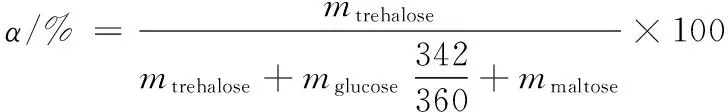
(1)
其中,mtrehalose、mglucose、mmaltose分别代表转化体系中海藻糖、葡萄糖、麦芽糖的质量。
1.6 突变酶最适温度及热稳定性分析
分别在不同温度(20~65 ℃)下,pH 8.0转化1 h,以最高酶活为100%,测定原始酶与突变酶的最适反应温度。分别在不同温度(20~65 ℃)下保温60 min后,25 ℃、pH 8.0条件下转化1 h,测定剩余酶活力,比较原始酶与突变酶的热稳定性。
海藻糖合酶酶活力定义:每小时转化麦芽糖生成1 μmol的海藻糖所需的酶量定义为1个酶活单位(U)。
1.7 突变酶最适pH及pH耐受性分析
分别在不同pH(4.0~10)条件下,25 ℃转化1 h,以最高酶活为100%,测定原始酶与突变酶的最适反应pH。分别在pH(4.0~10)条件下,25 ℃保温60 min后25 ℃、pH 8.0条件下反应1 h,计算剩余酶活力,比较原始酶与突变酶的pH稳定性。
2 结果与分析
2.1 TreS活性中心分析及饱和突变位点的选择
通过模拟预测的海藻糖合酶的三维结构(如图1-a所示),其活性中心与来源于Mycobacteriumtuberculosis的海藻糖合酶一致,包含1个(α/β)8桶状催化区域,依据相关文献报道,位于该口袋底部的氨基酸残基是参与底物结合和亲核催化的关键氨基酸[21]。为进一步分析TreS的活性中心,通过AUTODOCK 4.0进行小分子配体与酶的柔性对接,对接结果如图1-b所示。通过PyMOL软件分析酶-底物对接结果,发现海藻糖合酶活性中心的9个氨基酸(D294、E338、D403、D112、F115、F223、F255、Q259、R535)参与底物结合,前期研究发现,D294可能是参与亲核催化的关键氨基酸[22]。
活性中心附近的氨基酸,虽然不直接参与底物结合和催化反应,但其对催化过程起到很大的辅助作用,并在酶促反应过程中,对酶的构象变化起到一定作用。通过分析TreS活性中心4 Å范围左右的氨基酸(图2-a),发现490位赖氨酸位于活性中心附近,靠近可能的催化位点Asp294,并且其位于α螺旋末端,与α螺旋上H493、L494和底物麦芽糖形成4个氢键,其空间位置如图2-b所示。
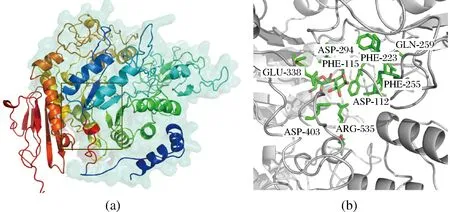
a-图中黑框所示活性中心区域;b-活性中心参与麦芽糖分子结合的氨基酸残基图1 TreS的三维结构及分子对接结果Fig.1 Three-dimensional structure of TreS and the molecular docking results
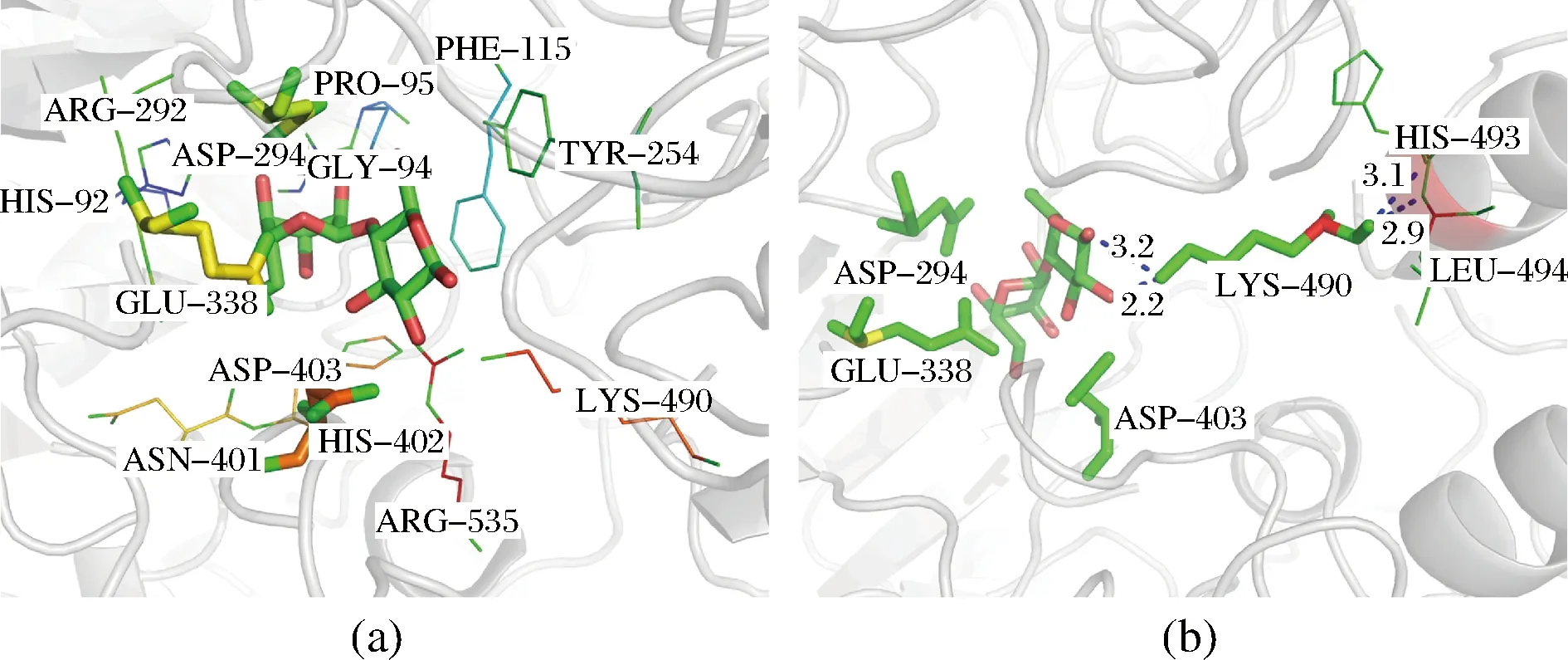
a-TreS活性中心4Å范围左右的氨基酸;b-Lys 490空间位置及形成的氢键图2 TreS分子对接结果分析Fig.2 Analysis of TreS Molecular Docking Results
通过分析来源于PseudomonasputidaS1、Pseudomonasmonteilii、Pseudarthrobactersiccitolerans等的海藻糖合酶氨基酸序列比对结果(图3),发现K490位点并非高度保守,不同来源的海藻糖合酶基因在此位置表现出差异。综合以上结果,认为K490位点的突变可能会对TreS的催化中心产生一定的影响,对其催化能力带来一定的提高,故选择该位点进行饱和突变,筛选高转化率突变子。
图3 不同来源的海藻糖合酶序列比对Fig.3 Alignment of the amino acid sequence of TreS from different microorganism
2.2 饱和突变库的构建
利用突变引物以PET-15b-TreS质粒为模板,PCR成功对K490位点进行了饱和突变,PCR产物电泳结果显示条带大小约为7 750 bp,符合模板质粒大小(如图4-a所示)。将经过Dpn I酶切处理的片段转化至E.coliBL21(DE3)感受态细胞中,通过抗性筛选得到饱和突变体库,利用PCR随机验证突变子TreS基因,电泳显示符合目的条带大小(如图4-b所示)。

M-DNA分子量标准;a-泳道1,饱和突变PCR产物电泳图;b-泳道1~5,突变子随机验证PCR电泳图图4 目的基因PCR产物电泳图Fig.4 DNA electrophoresis of PCR product
2.3 突变子的筛选
按照1.3、1.4所述方法进行突变库的筛选,经过HPLC检测得到两株海藻糖产量明显提高的突变体,经过基因测序及序列分析,发现突变位点由Lys(赖氨酸)分别变为Leu(亮氨酸)和Ile(异亮氨酸)。HPLC结果计算得到,原始酶转率为50%,突变酶K490L转化率为68%,K490I转化率为65%,分别比原始酶提升了18%和15%(如图5所示)。
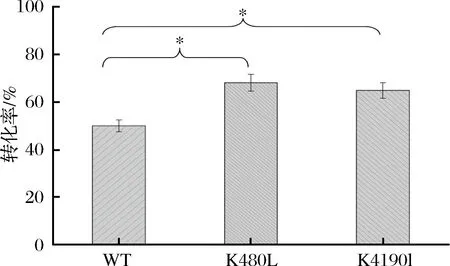
图5 原始酶及突变酶的转化率Fig.5 Conversion rate of primitie enzyme and mutant enzyme
2.4 突变酶的最适反应温度及热稳定性
突变酶及原始酶的最适反应温度如图6-a所示,突变酶K490L,K490I的最适反应温度与原始酶一致,为25 ℃,这说明突变氨基酸的引入并不会改变催化反应的最适温度。原始酶在40 ℃以下具有较好的热稳定性,而K490L,K490I在45 ℃保温1 h后,剩余酶活力仍能保持在80%以上,相比原始酶得到大幅度的提高,在超过50 ℃时酶活迅速下降(图6-b)。
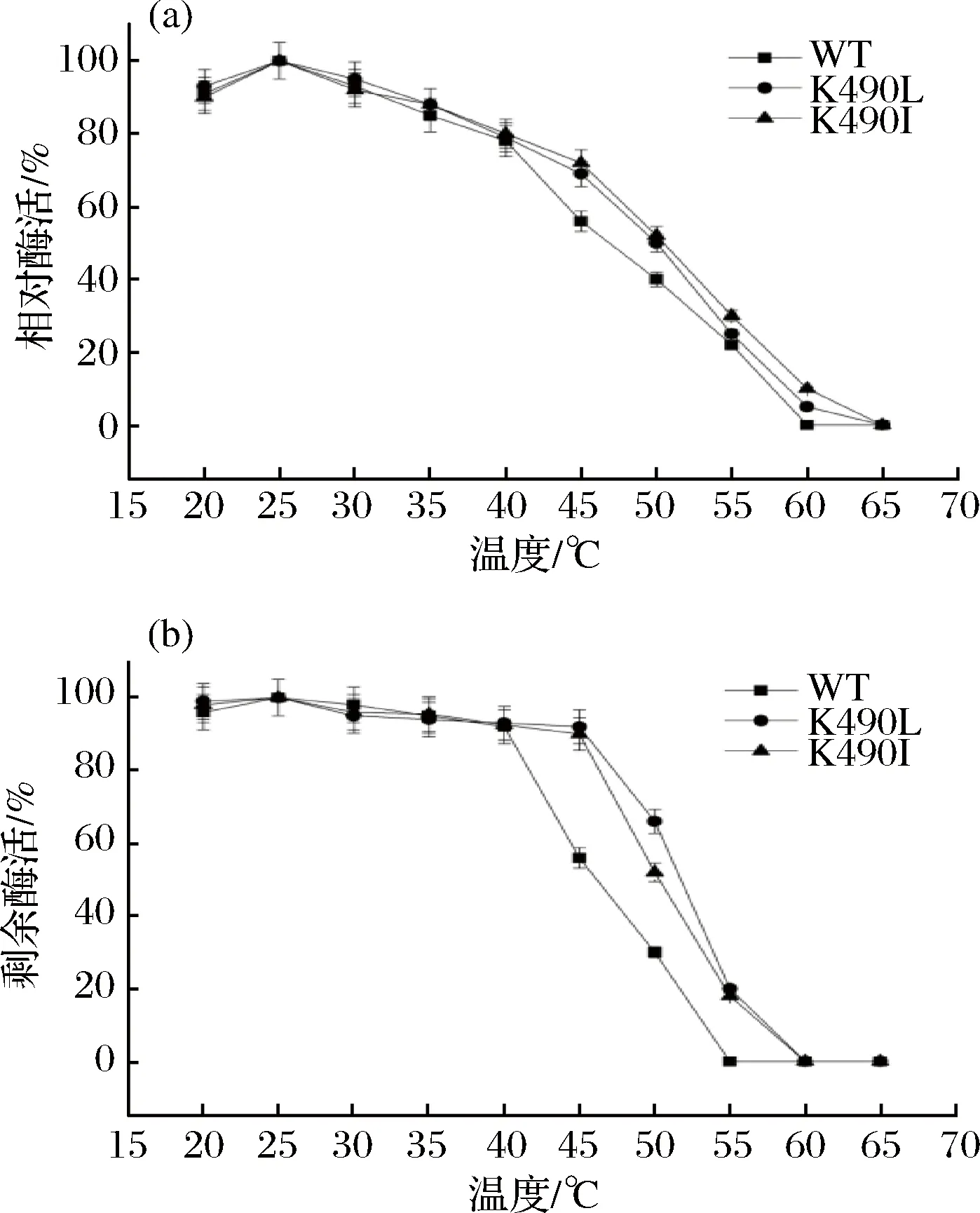
图6 突变酶的最适反应温度(a)及热稳定性(b)Fig.6 The optimum reaction temperature (a) and thermal stability (b) of mutant enzyme
2.5 突变酶的最适反应pH及pH稳定性
原始酶和突变酶的最适反应pH如图7-a所示,突变酶K490L,K490I的最适反应pH没有发生迁移,在pH8.0时表现出最大酶活力。原始酶在pH 7.5~9.0之间时保持较高酶活,而突变酶K490L,K490I在pH 7.0保温1 h时仍保持80%以上酶活力,当pH低于7.0时,酶活迅速降低,在较低的pH条件下,酶活直接丧失(如图7-b)。
2.6 突变位点的分析
亮氨酸和异亮氨酸都是非极性的疏水性氨基酸,二者的化学性质极为相似。通过PyMOL软件分析突变后的TreS活性中心发现,490位氨基酸由Lys(图8a)突变为Leu(图8b)和Ile(图8c)后,氨基酸性质发生了改变,活性中心的疏水作用得到增强,对于提高底物结合能力和催化反应具有一定的帮助。Leu和Ile较Lys疏水性增强,提高了该位点附近的结构稳定性[23],使形成的结合口袋更加紧密,对转化过程中形成的葡萄糖分子形成了有效的空间位阻,进而促进产物海藻糖的形成,提高了反应的转化率。490位点位于α螺旋末端,在α螺旋引入强疏水性氨基酸,对海藻糖合酶的稳定性和底物结合能力都有重要的影响,疏水作用的增强也会增加蛋白的稳定性[24],因此K490L和K490I的热稳定性也有所提高。张悦等人对嗜热栖热菌(Thermusthermophilus)海藻糖合酶α螺旋末端的Pro突变为Leu后,延长了螺旋结构提高了结构稳定性,该酶的转化率得到提升[25]。

图7 突变酶的最适反应pH (a)及pH稳定性(b)Fig.7 The optimum reaction pH (a) and pH stability(b) of mutant enzymes
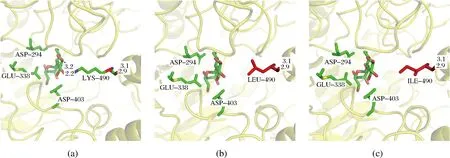
a-Lys; b-Leu; c-Ile图8 突变位点的模拟分析Fig.8 Simulation analysis of mutation sites
3 结论
本研究对来源于PseudomonasputidaP06的海藻糖合酶进行了蛋白质水平的改造,通过对Lys490位点的饱和突变,利用HPLC筛选得到了2株转化率提高的突变体K490L和K490I,两株突变体的转化率分别为68%和65%,比原始酶提升了18%和15%。酶学性质研究发现,K490L和K490I的热稳定性(20~45 ℃)和耐酸性(pH 7.0~9.0)比原始酶显著增强。通过PyMOL模拟了突变位点的改变,分析了K490L和K490I转化率提高的原因。该研究表明,Lys490位点的分子改造能够显著提高TreS的转化率,且改造后TreS酶学性质实用性增强,为以后海藻糖合酶的进一步改造奠定了理论基础。
[1] ELBEIN A D, PAN Y T, PASTUAZAK I, et al. New insights on trehalose: a multifunctional molecule[J]. Glycobiology, 2003, 13(4): 17-27.
[2] AVONCE N, MENDOZA V A, MORETT E, et al. Insights on the evolution of trehalose biosynthesis[J]. Bmc Evolutionary Biology, 2006, 6(1): 1-15.
[3] ELBEIN A D, The metabolism of a,a-trehalose[J]. Advances in Carbohydrate Chemistry and Biochemistry, 1974(30): 227-256.
[4] MULLER J, AESCHBACHER R A, WINGLER A, et al. Trehalose and trehalase in Arabidopsis[J]. Plant Physiology, 2001, 125(2): 1 086-1 093.
[5] Becker A, SCHLOEDER P, STEELE J E, et al. The regulation of trehalose metabolism in insects[J]. Experientia, 1996, 52(5): 433-439.
[6] BENAROUDJ N, LEE D H, GOLDBERG A L. Trehalose accumulation during cellular stress protects cells and cellular proteins from damage by oxygen radicals[J]. Biol Chem, 2001, 276(26): 24 261-24 267.
[7] HOTTINGER T, BOLLER T, WIEMKEN A. Rapid changes of heat and desiccation tolerance correlated with changes of trehalose content inSaccharomycescerevesiae[J]. FEBS Letters, 1987, 220(1): 113-115.
[8] 靳文斌,李克文,胥九兵,等.海藻糖的特性、功能及应用[J]. 精细与专用化学品,2015,23(1): 30-33.
[9] RICHARDS AB, KRAKOWKA S, Dexter LB, et al. Trehalose: a review of properties,history of use and human tolerance,and results of multiple safety studies[J]. Food and Chemical Toxicology, 2002, 40(7): 871-898.
[10] ZHANG Q, WANG C, MA Y, et al. Cloning and expression of maltooligosyltrehalose synthase from Sulfolobus acidocaldarius inEscherichiacoli[J]. Journal of Shihezi University(NaturalScience), 2006, 17(3): 339-341.
[11] 薛鸿毅,张莉,徐汝意,等.酶法生产海藻糖研究进展[J].中国食品添加剂,2011,(4) : 159-162.
[12] WANG Y L, CHOW S Y, LIN Y T, et al. Structures of trehalose synthase fromDeinococcusradioduransreveal that a closed conformation is involved in catalysis of the intramolecular isomerization[J]. Acta Crystallogr D Biol Crystallogr, 2014, 70(Pt12): 3 144-3 154.
[13] ROY R, USHA V, KERMANI A, et al. Synthesis of α-glucan inMycobacteriainvolves a hetero-octameric complex of trehalose synthase TreS and maltokinase Pep2[J]. ACS Chem Biol, 2013, 8(10): 2 245-2 255.
[14] SAMI C, NHAM N, RAN Z H, et al. The structure of theMycobacteriumsmegmatistrehalose synthase reveals an unusual active site configuration and acarbose-binding mode[J]. Glycobiology, 2013, 23(9): 1 075-1 083.
[15] REETZ MT, CARBALLEIRA JD. Iterative saturation mutagenesis (ISM) for rapid directed evolution of functional enzymes[J]. Nat Protoc, 2007, 2(4): 891-903.
[16] LI G X, XU Z, LI S, et al. Probing the essential catalytic residues and substrate affinity in thermophilicL-arabinose isomerase by homology modeling and site-directed mutagenesis[J]. Chinese Journal of Catalysis, 2012, 33(10): 1 717-1 723.
[17] 李珍珍. 施氏假单胞菌海藻糖合酶性质及其活性改造的研究[D].济南: 齐鲁工业大学, 2016.
[18] 宿玲恰,张悦,吴敬.嗜热栖热菌海藻糖合酶的分子改造及其应用[J].食品与发酵工业, 2015,41(12):1-5.
[19] CHEN PT, CHANG CJ, CHEN YT, et al. Strategy for stable and high level expression of recombinant trehalose synthase inEscherichiacoli[J]. Journal of Agricultural & Food Chemistry, 2012, 60(23): 6 063-6 068.
[20] 薛鸿毅. 恶臭假单胞菌海藻糖合酶基因在大肠杆菌中的表达[D].济南:山东轻工业学院, 2012.
[21] GERLT JA, RAUSHEL FM. Evolution of function in(α/β)8-barrel enzymes. Curr Opin Chem Biol, 2003, 7(2): 252-264.
[22] SU J, WANG T F, MA Ch L, et al. Homology modeling and function of trehalose synthase fromPseudomonasputidaP06[J]. Biotechnol Lett, 2014(36): 1 009-1 013.
[23] GRIBENKO A V, PATEL M M, LIU J, et al. Rational stabilization of enzymes by computational redesign of surface charge-charge interactions[J]. Proceedings of the National Academy of Sciences, 2009, 106(8): 2 601-2 606.
[24] YUTANI K, OGASAHARA K, TSUJITA T, et al. Dependence of conformational stability on hydrophobicity of the amino acid residue in a series of variant proteins substitute at a unique position of tryptophan synthase alpha subunit[J]. Proceedings of the National Academy of Sciences, 1987, 84(13): 4 441-4 444.
[25] 张悦. 嗜热栖热菌海藻糖合酶的表达、分子改造及其应用研究[D].无锡:江南大学, 2015.
