零上低温胁迫对药蒲公英亚显微结构和生理特性的影响
2018-02-13乔永刚王勇飞崔芬芬曹亚萍
乔永刚, 王勇飞, 陈 亮, 崔芬芬, 曹亚萍, 宋 芸
(山西农业大学生命科学学院, 山西 太谷 030801)
蒲公英为常用清热解毒中药材[1],也是重要的食药兼用植物。随着蒲公英的多元化开发利用,市场需求量增大,蒲公英的规模化种植也应运而生[2]。药蒲公英(TaraxacumofficinaleF. H. Wigg.)株型大,产量高,品质优,是中药材蒲公英主要的栽培物种。栽培植物生长发育过程中经常会遭受水分、温度等条件胁迫,会严重影响农业生产[3]。药蒲公英返青早,早春易受“倒春寒”影响,直接影响其产量与品质[4]。低温会影响植物体内渗透压平衡,破坏膜结构及其组成,影响光合作用[5]。活体叶绿素荧光是光合作用的有效探针,可以探测植物光合作用过程的变化[6]。为了抵抗低温胁迫,植物已经发展了许多策略,包括积累渗透调节物质和提高抗氧化酶活性等方式[7]。植物体内的渗透调节物质如脯氨酸可以使细胞保持水分吸收和膨胀,从而进行正常的生理代谢,保护细胞免受损害[8]。低温也导致大量活性氧(Reactive oxygen species,ROS)生成,ROS可引起植物中的脂质过氧化和氧化损伤[9]。为了避免ROS诱导的氧化损伤,植物可以积累抗氧化酶。过氧化物酶(Peroxidase,POD)、过氧化氢酶(Catalase,CAT)和超氧化物歧化酶(Superoxide dismutase,SOD)是植物重要的抗氧化酶,其活性与植物的抗寒性相关[10]。植物细胞的内部结构与其低温抗性密切相关,叶片的组织结构对生长条件反应较为敏感。低温胁迫会对细胞中各种结构造成伤害,尤其是叶片中细胞器和膜结构[11]。胞质分离现象也在低温胁迫时经常发生[12]。
目前蒲公英在干旱胁迫[13]、盐碱胁迫[14]方面的研究较多,低温胁迫研究较少。本文探究药蒲公英幼苗在零上低温胁迫下显微结构和生理的变化,为揭示药蒲公英低温胁迫研究与耐低温机制提供细胞学与生理学基础。
1 材料和方法
1.1 试验材料
本研究采用药蒲公英幼苗为试验材料。药蒲公英种子为山西农业大学培育的“铭贤1号”药蒲公英种子。挑选籽粒饱满的供试种子,将其在25℃蒸馏水中浸泡12 h,播种于装有蛭石的营养钵(9 cm×9 cm)。在昼温25±2℃,夜温20±2℃,光照强度12 000 lx(16 h光照/8 h黑暗),65%相对湿度的人工气候室中培养。出苗后,用Hoagland完全营养液培养,每营养钵定苗1株。在6~7叶期进行低温胁迫试验。
1.2 试验方法
1.2.1低温胁迫 选取长势一致、健康的幼苗进行低温胁迫试验,4℃(16 h光照/8 h黑暗)环境下分别处理0 h,3 h,6 h,12 h,24 h,48 h。每组10株,3次重复。
1.2.2叶片亚显微结构观察 分别在药蒲公英低温胁迫的0 h,3 h,6 h,12 h,24 h,48 h 6个时间点取材,取第二节位叶片,用2.5%戊二醛固定,按范华[15]方法制备透射电镜样品,利用透射电子显微镜(JEM-100CX II型)观察并拍照。
1.2.3叶绿素荧光参数的测定 使用叶绿素荧光仪(OS5p+)对叶片的叶绿素荧光参数进行测量。测量前暗适应30 min。测定初始荧光值Fo(Initial fluorescence)、最大光化学量子产量Fv/Fm(Variable fluorescence / maximal fluorescence)、光系统II(Photosystem II,PSII)潜在光化学效率Fv/Fo(Variable fluorescence / initial fluorescence)、实际光化学量子产量ΦPSII(PSII actual photochemical quantum yield)、非光化学淬灭NPQ(Non-photochemical fluorescence quenchin)以及相对电子传递速率ETR(Electron transport rate)[16]。每个处理重复5次。
1.2.4生理指标分析 低温胁迫处理0 h和48 h时取叶片材料,分别测量脯氨酸、丙二醛(MDA)的含量、抗氧化物酶(POD、CAT、SOD)的活性以及相对电导率的大小,测量方法参照李莎莎等[17]的方法,每个处理3次重复。
1.3 数据分析
用Microsoft Excel 2016和SPSS 23.0进行数据处理和分析。
2 结果与分析
2.1 低温胁迫对药蒲公英叶片细胞亚显微结构的影响
观察药蒲公英在不同时间低温胁迫后的亚显微结构,结果如下:0 h时,药蒲公英叶片细胞结构完整,细胞质中间有大液泡;在细胞质中有圆形线粒体和梭形的叶绿体;叶绿体类囊体片层清晰可见;线粒体出现在叶绿体周围(图1-A)。低温处理3 h后,细胞质中出现少量膜泡,线粒体的数量增加(图1-B)。处理6 h后,叶绿体形态开始扭曲,类囊体片层部分减少,淀粉粒积累明显(图1-C)。胁迫12 h后,叶绿体外膜开始溶解,基粒片层和类囊体片层稀疏(图1-D),核膜比较稳定(图1-G)。胁迫24 h后,液泡膜开始溶解,线粒体数量较之前增加,有比较明显的内嵴,线粒体膜变得模糊不清(图1-E),没有出现明显的破裂,说明线粒体受伤害较叶绿体小。胁迫48 h后,叶绿体膜和片层溶解严重,液泡膜溶解(图1-F);出现比较明显的胞质分离现象(图1-H);此外,在细胞质中出现一种双层膜的结构(图1-I)。随着低温胁迫时间的延长,药公英叶片亚显微结构遭到明显破坏,叶片受到损伤。
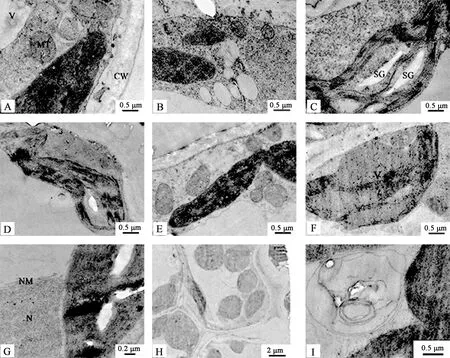
图1 不同低温胁迫处理时间对药蒲公英叶片细胞亚显微结构的影响Fig.1 The influence of low temperature treatment time on ultrastructure of leaves of T. officinale注:A:0 h,B:3 h,C:6 h,D:12 h;E:24 h;F:48 h;G:12 h;H:48 h;I:48 h;Ch:叶绿体;MT:线粒体;V:液泡;CW:细胞壁;SG:淀粉粒;细胞核:N;核膜:NMNote:A:0 h;B:3 h;C:6 h;D:12 h;E:24 h;F:48 h;G:12 h;H:48 h;I:48 h;Ch:chloroplast;MT:mitochondrion;V:vacuole;CW:cell wall;SG:starch giains;N:nucleus;NM:nuclear membrane
2.2 低温胁迫对药蒲公英叶绿素荧光参数的影响
利用叶绿素荧光仪测定药蒲公英不同时间的叶绿素荧光参数。与0 h相比,低温胁迫3 h时,Fo呈上升趋势,在3 h~48 h呈下降的趋势,其中在3 h~12 h时下降缓慢(图2-A),Fo降低说明低温胁迫可能会降低药蒲公英的叶绿素浓度。随着低温胁迫时间的延长,Fv/Fm、Fv/Fo及ΦPSII呈下降的趋势,但在6 h~12 h均有较小幅度上升(图2-B、图2-C、图2-D),说明低温影响PSII光能转化率,使得药蒲公英PSII的光化学反应速率下降。从图2-E可以看出,药蒲公英的ETR在0 h~3 h呈上升趋势,3 h~48 h呈下降趋势,说明低温影响药蒲公英的光合电子传递速率的快慢,电子传递速率减小,影响其光合作用。NPQ在0 h~12 h呈上升的趋势,在12 h~48 h,NPQ呈下降趋势(图2-F)。
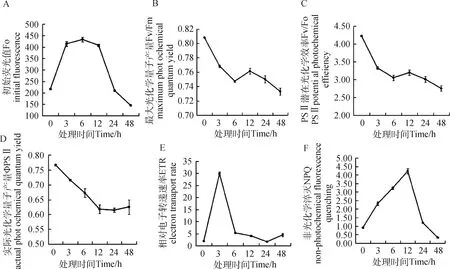
图2 不同低温胁迫时间对叶绿素荧光的影响Fig.2 The influence of low temperature treatment time on chlorophyll fluorescence parameters of T. officinale注:A:初始荧光值Fo;B:最大光化学量子产量Fv/Fm;C:PSII潜在光化学效率Fv/Fo;D:实际光化学量子产量ΦPSII;E:相对电子传递速率ETR;F:非光化学淬灭NPQNote:A:initial fluorescence;B:maximum photochemical quantum yield;C:PSII potential photochemical efficiency;D:actual photochemical quantum yield;E:electron transport rate;F:non-photochemical fluorescence quenching
2.3 低温胁迫对药蒲公英生理特性的影响
通过测量脯氨酸、MDA含量、POD、CAT、SOD活性以及相对电导率的大小,结果表明:低温胁迫48 h,叶片中MDA、相对电导率的含量以及脯氨酸的水平与0 h相比增加(图3-A、图3-B、图3-C),说明低温胁迫下,药蒲公英叶片细胞膜受到损伤,并且渗透调节物质脯氨酸在药蒲公英抵抗低温胁迫过程中起调节作用。低温处理48 h后,叶片的CAT、SOD活性与0 h相比下降(图3-D、图3-E),POD活性升高(图3-F)。说明药蒲公英抗氧化酶对低温胁迫有一定的保护作用。
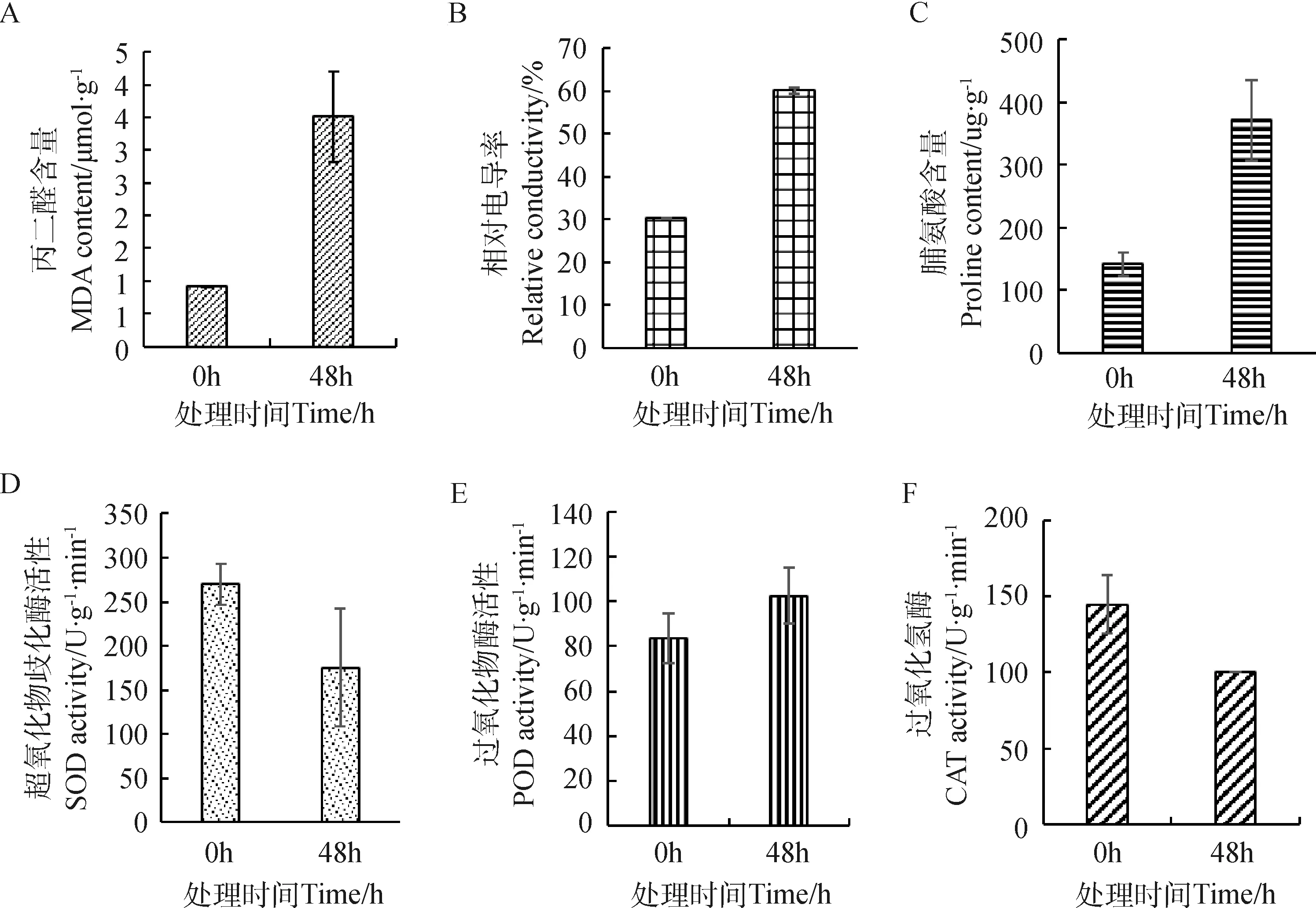
图3 低温胁迫对药蒲公英生理特性的影响Fig.3 Effects of low temperature on physiological characteristics of T. officinale
3 讨论
本研究中探讨了低温胁迫对药蒲公英叶片亚显微结构和光合作用的影响。在进行低温胁迫处理后,药蒲公英的叶片逐渐萎缩,叶片细胞器的形态结构发生变化,叶片细胞出现胞质分离,细胞液外渗减少,受到一定损害。另外,药蒲公英叶片线粒体在叶绿体周围分布并且数量增加,叶绿体中的淀粉粒数量也增加,这些可能有助于缓解低温造成的叶片损伤。在细胞中观察到一些双层膜结构,猜测这种未知结构对药蒲公英应对低温胁迫有重要的作用,需进一步深入研究。马铃薯[3]、紫花苜蓿[18]以及棉花[19]在低温胁迫时也有相似的结构变化。
叶绿素荧光参数是反映植物体内光合作用变化的指标[20]。Fo可以反应植物叶绿素浓度[21],且其变化与PSII反应中心的失活有关[22]。试验结果表明药蒲公英Fo在3~48 h下降,可能由于低温破坏了PSII反应中心,从而使叶绿素含量降低。Fv/Fm代表PSII反应中心吸收光量子的最大比例,其主要是用来反映PSII复合物的光抑制伤害程度[23]。此外,药蒲公英低温胁迫后Fv/Fm、Fv/Fo及ΦPSII基本呈下降的趋势,PSII的光化学反应速率下降可能与光抑制有关。ETR的高低可以反映出其潜在最大光合能力的大小。在正常情况下,植物的ETR值通常处于动态平稳状态,但在遭受低温等逆境胁迫后,ETR出现下降[23]。低温胁迫使药蒲公英的电子传递速率降低,减弱CO2的同化能力,限制光合碳代谢的电子供应和光合效率,产生光抑制,进而作用于其光合作用,原因可能是低温导致叶绿体类囊体的膜结构或构象发生变化,最终对PSII的功能产生抑制[24]。植物遭受低温胁迫时,其自我保护机制被激发,大量由天线色素吸收的光能转化为热能散发,叶绿体等光合作用器官的损伤程度减小[25]。NPQ能体现PSII反应中心内将光能转化为热能的能力,它是一种自我保护机制,对光合器官具有保护作用[26]。本研究中药蒲公英的NPQ在胁迫12 h内呈升高趋势,可能是药蒲公英在低温胁迫中启动了自我保护机制,其天线色素将吸收的光能以热能形式散发,保护了自身的细胞器结构。但在胁迫12 h后呈下降趋势,说明其自我保护有一定的限度,超过这个度将会影响光合作用。NPQ降低可能由于低温条件下光合相关酶的活性降低,从而影响光反应。
植物可以通过增加渗透调节物质的含量来增强其抗胁迫的能力。正常生长环境下,植物体内游离脯氨酸含量低,但遭受低温、水分胁迫等逆境时,游离脯氨酸会大量积累,且积累含量与植物抗逆性密切相关[27]。药蒲公英脯氨酸含量在低温胁迫后增加,其增加可能会增强植物的抗逆性。有研究表明植物在逆境环境中膜结构会受损甚至破坏,导致其通透性增大,细胞内物质会出现外渗的状况[28],本研究中药蒲公英的电导率、MDA增大恰好反应其膜结构受损的状态。此外,植物抗氧化酶活性的增强,可以增强其膜保护系统,降低膜脂过氧化的程度,使其抗逆性提高[29]。药蒲公英在低温胁迫后,POD的活力升高,可见POD在低温胁迫响应中发挥着积极作用;SOD和CAT的活力呈下降趋势,这可能是由于胁迫时间较长,蒲公英体内的自由基含量增加活性氧平衡系统遭到破坏,致使酶活性下降。低温环境时紫花苜蓿的抗氧化酶活性也有类似变化[29]。
4 结论
零上低温胁迫影响药蒲公英叶片亚显微结构、叶绿素荧光参数以及生理特性。随着胁迫时间的延长,药蒲公英叶片膜通透性增加,光合能力下降,亚显微结构受到明显破坏,叶片受到损伤,影响生长发育。
