Ghrelin水平与T2DM患者认知功能的相关性研究
2018-02-06许静
许静
(河北省唐山市工人医院,河北 唐山 063000)
糖尿病(diabetes mellitus,DM)是以慢性血糖水平增高为特征的代谢性疾病,长期的高血糖状态不仅可以导致机体出现肾病、视网膜病、心血管病及神经损伤等并发症,还可以对大脑产生影响,表现为代谢、功能及结构的改变[1-2]。近年来DM与认知功能障碍的关系成为了研究热点,与非DM人群相比,DM患者发生轻度认知功能障碍的危险性增加了1.2倍,发生阿尔茨海默病的危险性增加了1.5倍,发生血管性痴呆的危险性增加了2.5倍,因此DM是认知功能障碍发生的危险因素[3]。胃饥饿素(Ghrelin)是机体内产生的脑肠肽,它参与了生长激素的释放、摄食及能量代谢的调节,与肥胖、糖尿病等内分泌疾病密切相关[4]。有研究表明Ghrelin具有神经保护作用,参与了机体学习、记忆及情绪等脑活动的调节[5-6]。因此本研究旨在探讨血清Ghrelin与2型糖尿病(type 2 diabetes mellitus,T2DM)患者认知功能之间的联系。
1 资料与方法
1.1 一般资料
选取2015年6月-2016年8月于唐山工人医院内分泌科就诊的195例T2DM患者作为研究对象,均符合1999年世界卫生组织糖尿病诊断标准。所有入组患者均排除以下情况:①糖尿病急性并发症及严重的肾病(≥3期)、视网膜病(增殖期)等慢性并发症;②急、慢性感染性疾病;③甲状腺、甲状旁腺及其它与内分泌相关疾病;④癌症、严重的肝功能(肝酶≥正常2倍)肾功能(肾小球滤过率估算值≤60)异常、冠心病、严重的高血压(3级)、脑卒中、神经精神异常及其它中枢神经系统疾病;⑤酗酒;⑥应用成瘾性药物。
1.2 方法
1.2.1 一般临床资料收集记录患者资料,包括:年龄、性别、教育、体重指数(body mass index,BMI)、病程、空腹血糖(fasting plasma glucose,FPG)、糖化血红蛋白(glycosylated hemoglobin A1c,HbA1c)、总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、高密度脂蛋白(high-density lipoprotein,HDL)及低密度脂蛋白(low-density lipoprotein,LDL)。
1.2.2 血清Ghrelin检测患者于晨起6~7点抽取空腹静脉血5 ml,室温放置30min后3 000 r/s离心15min,收集上清液放入-80℃冰箱中待用。采用酶联免疫吸附法检测血清Ghrelin水平,该试剂盒购自台湾Abnova公司,批内变异系数<15%,批间变异系数<10%。
1.2.3 认知功能评定①采用简易精神状态量表(minimum mental state examination,MMSE)对 T2DM患者进行认知功能评定,根据测定结果进一步区分是否存在认知功能障碍。该量表简单易行,国内外广泛应用,是痴呆筛查的首选量表,但是其对认识功能的评定较为粗略。包括以下5个方面:定向力、记忆力、注意力及计算力、回忆能力、语言能力。共30项题目,每项回答正确得1分,量表总分为30分。认知功能障碍评判标准:≥28分为认知功能正常,≤27分为认知功能障碍;②同时采用重复性成套神经心理状态测验量表(repeatable battery for the assessment of neuropsyehological status,RBANS)对认知功能进行详细多维度的评定。该表由RANDOLPH等于1998年设计完成,用于评定20~89岁人群的神经心理功能状况,目前已经被翻译成中文,并且在汉族人群中试用的结果表明其具有良好的信度和效度,是评价认知功能的敏感工具[7]。它包括5个分测验,每个分测验下设两个子测验:即时记忆(包括词汇学习和故事复述)、视觉广度(包括图形临摹和线条定位)、言语功能(包括图画命名和语义流畅)、注意力(包括数字广度和编码任务)及延迟记忆(包括词汇回忆、故事回忆、图形回忆及词汇再识)。将以上5个测验得分相加,经查表以后获得认知总分。
1.3 分组
依据MMSE评定结果将所有患者分为认知功能障碍组(以下称为CI组)和非认知功能障碍组(以下称为NCI组),比较两组患者一般资料、血清Ghrelin水平及RBANS认知功能量表评分是否存在差异。
1.4 统计学方法
数据分析采用SPSS 17.0统计软件,计量资料以均数±标准差(±s)表示,用t检验,非正态数据用中位数(四分位数间距)[M(P25,P75)]表示,用秩和检验;计数资料以构成比表示,用χ2检验。单因素相关性分析采用Pearson或Spearman相关分析,多因素相关分析采用多元逐步回归分析(引入水准为0.05,排除水准为0.10),危险因素筛查采用非条件一般Logistic回归分析。P<0.05为差异有统计学意义。
2 结果
2.1 两组患者一般资料比较
两组患者年龄、受教育水平、HbA1c及Ghrelin水平比较,差异有统计学意义(P<0.05),CI组患者比NCI组年龄大、受教育水平低、HbA1c和Ghrelin水平高。两组性别、病程、BMI、FPG、TC、TG、HDL及LDL比较,差异无统计学意义(P>0.05)。见表1。
2.2 两组患者RBANS量表评分比较
两组患者即刻记忆、视觉广度、言语功能、注意力、延迟记忆及总分比较,差异有统计学意义(P<0.05)。见表 2。
2.3 T2DM患者认知功能障碍危险因素的Logistic回归分析
在T2DM患者中,以是否合并认知功能障碍为因变量,以年龄、性别、病程、BMI、FPG、HbA1c、TC、TG、HDL、LDL及Ghrelin为自变量,经Logistic回归分析发现,年龄、HbA1c为T2DM患者出现认知功能障碍的危险因素(P<0.05),而受教育水平、Ghrelin为保护因素(P<0.05)。见表3。
2.4 Ghrelin与T2DM患者一般资料的相关性
两组患者合并,单因素相关分析发现,Ghrelin与 BMI、HbA1c呈 负 相 关(r=-0.116和 -0.232,P=0.001和0.027);以年龄、性别、受教育水平、病程、BMI、FPG、HbA1c、TC、TG、HDL及LDL为自变量,Ghrelin为因变量进行多元逐步回归分析发现,BMI、HbA1c是Ghrelin的影响因素(P<0.05)。见表4。
2.5 Ghrelin与T2DM患者RBANS量表评分的相关性
两组患者合并,单因素相关分析发现,Ghrelin与即刻记忆、言语功能、注意力、延时记忆及总分呈正相关(r=0.301、0.228、0.212、0.274和 0.352,P=0.000、0.001、0.000、0.000和 0.000),与视觉广度得分无相关性(P>0.05);以年龄、性别、受教育水 平、 病 程、BMI、FPG、HbA1c、TC、TG、HDL、LDL及Ghrelin为自变量,分别以各子项认知评分为因变量进行多元逐步回归分析发现:Ghrelin、HbA1c是即刻记忆评分的影响因素(P<0.05);受教育水平是视觉广度评分的影响因素(P<0.05);Ghrelin、受教育水平是言语功能评分的影响因素(P<0.05);Ghrelin、HbA1c是注意力评分的影响因素(P<0.05);Ghrelin、年龄是延迟记忆评分的影响因素(P<0.05);Ghrelin、HbA1c、受教育水平及年龄是量表总分的影响因素(P<0.05)。见表 5。
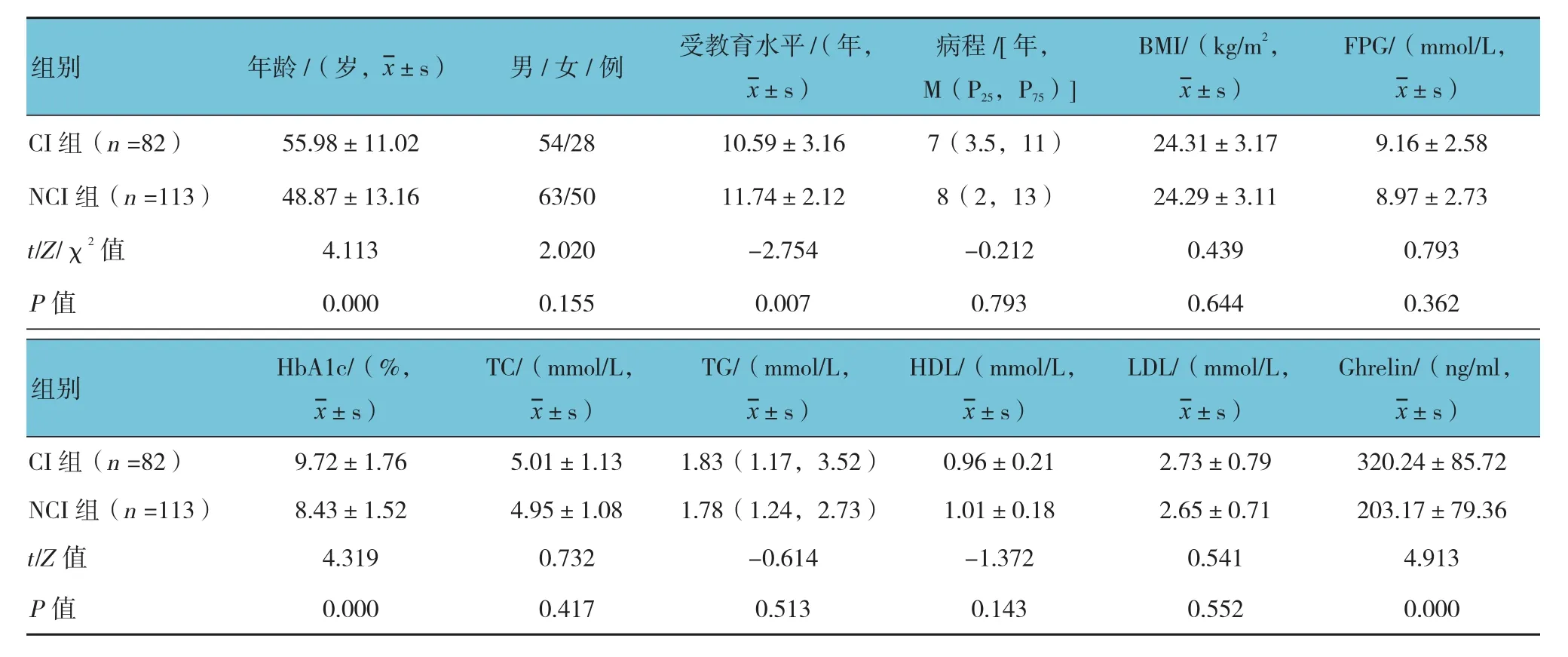
表1 两组患者一般资料比较
表2 两组患者RBANS量表评分比较 (分,±s)
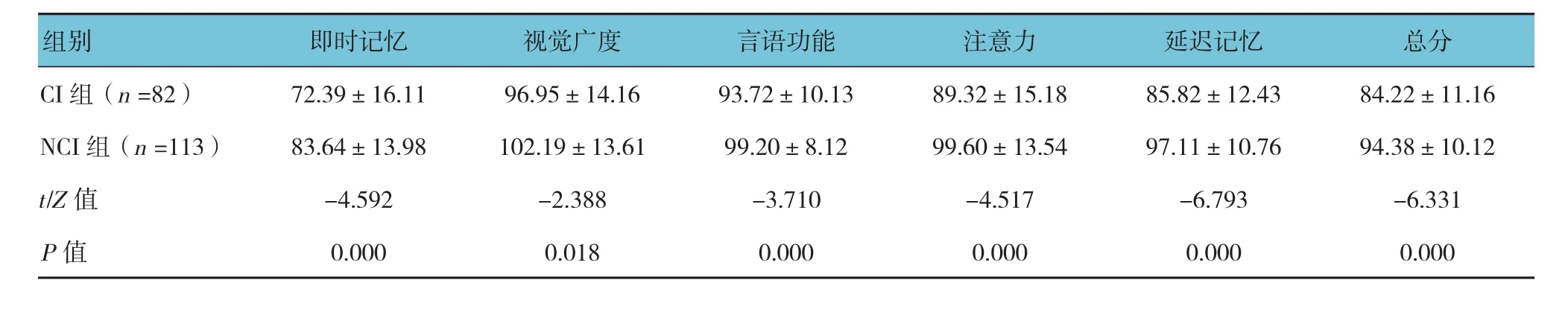
表2 两组患者RBANS量表评分比较 (分,±s)
CI组(n =82) 72.39±16.11 96.95±14.16 93.72±10.13 89.32±15.18 85.82±12.43 84.22±11.16 NCI组(n =113) 83.64±13.98 102.19±13.61 99.20±8.12 99.60±13.54 97.11±10.76 94.38±10.12 t/Z值 -4.592 -2.388 -3.710 -4.517 -6.793 -6.331
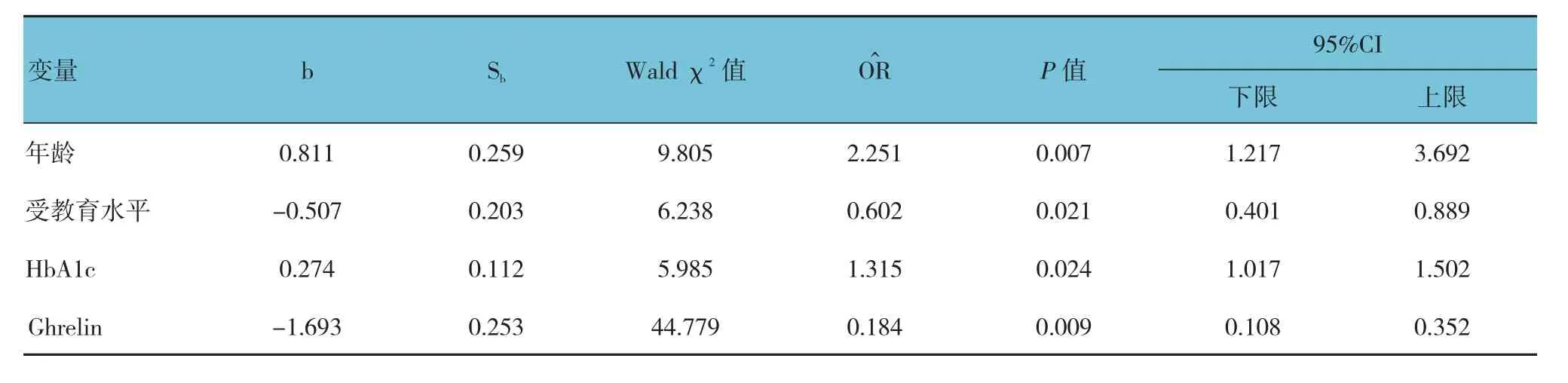
表3 T2DM患者认知功能障碍危险因素的Logistic回归分析
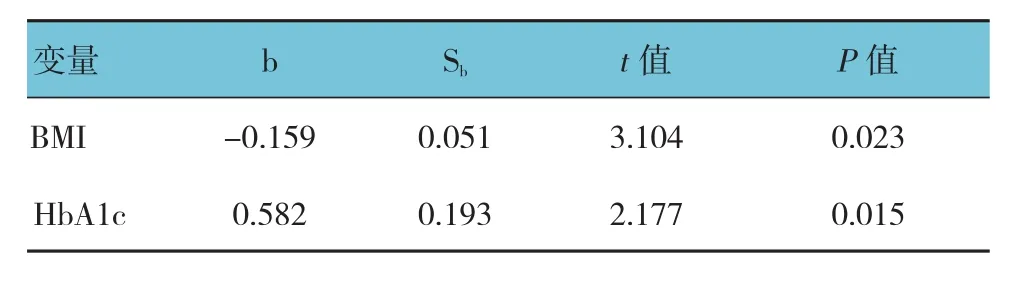
表4 Ghrelin与T2DM患者一般资料的相关性
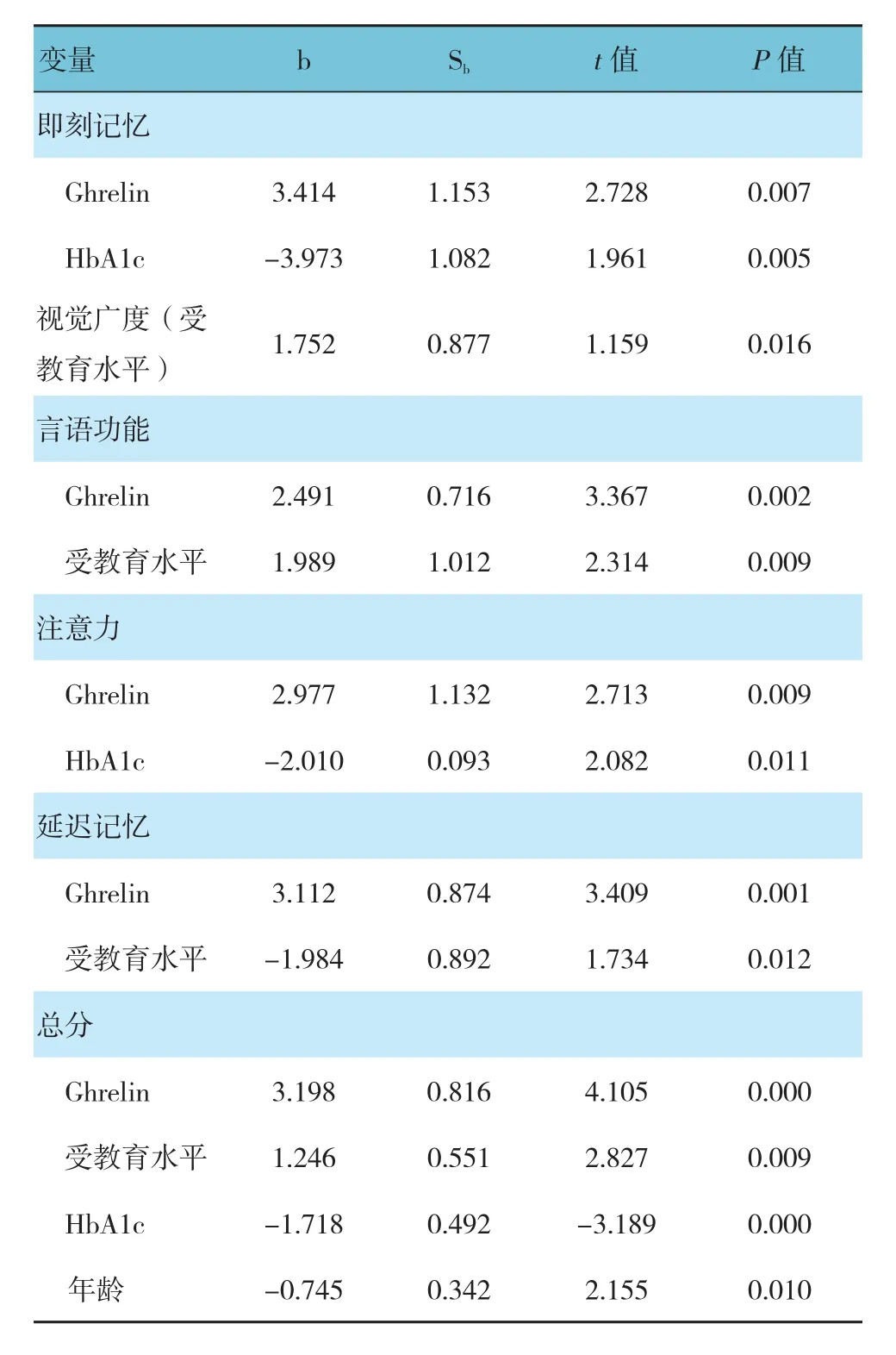
表5 Ghrelin与T2DM患者RBANS量表评分的相关性
3 讨论
随着社会老龄化和城市化的加快,DM患者的数量在不断地增加,据IDF统计,预计到2030年全球DM患者人数将达到5.52亿[8]。越来越多的证据表明T2DM是认知功能障碍的重要危险因素,与正常人相比,T2DM患者发生痴呆的风险增加50%,估计到2040年,全球痴呆总人数将达到0.8亿,其中约有10%的痴呆可能是由T2DM引起的,如果加上糖尿病前期患者的话,这个比例可以达到14.3%[9-10]。T2DM导致的认知功能障碍,表现为注意力、记忆力、执行力、处理速度及精神活动下降[11]。本研究结果显示,与T2DM非认知功能障碍组相比较,认知功能障碍组患者RBANS认知功能量表评分包括即刻记忆、视觉广度、言语功能、注意力及延迟记忆及总分均降低,与上述结果相似。T2DM导致的认知功能障碍给患者及社会带来很大的负担,因此寻找有效的改善T2DM患者认知功能药物或方法十分重要。
Ghrelin是由胃底部X/A样细胞分泌的一种由28个氨基酸残基组成的脑肠肽,是生长激素促分泌物受体(growth hormone secretagogue receptor,GHS-R)的内源性配体。Ghrelin和GHS-R广泛分布于外周组织及中枢神经系统中,如大脑、垂体、肠、肾、肺、心脏、卵巢及胰岛等器官[4]。许多人体研究表明,Ghrelin参与了人体生长激素、食物摄取、体重、能量消耗、葡萄糖稳态及胃肠运动的调节[4]。有研究结果显示当机体外源性输注胰岛素时,可抑制Ghrelin水平,认为胰岛素可以生理性及动力性调节Ghrelin的浓度[12]。此外,多囊卵巢症及肢端肥大症患者Ghrelin水平也降低,提示高胰岛素水平对于Ghrelin具有抑制作用,而T2DM患者常常伴有胰岛素抵抗,因此这可能是T2DM患者血清Ghrelin降低的可能机制[13-14]。本研究发现,在T2DM患者中,血清Ghrelin与BMI、HbA1c呈负相关,与目前研究结果基本一致[15]。
大量的研究表明,Ghrelin具有改善学习和记忆的作用。CAHILL等[16]发现,Ghrelin受体基因敲除的大鼠海马齿状回神经元的形成及树突的密度均减少,同时在学习记忆试验中能力下降。对于阿尔茨海默病大鼠模型,当侧脑室注射酰基化的Ghrelin,可以抑制脑内β淀粉样蛋白质的沉积,降低tau蛋白磷酸化,行为学实验中的短时及空间记忆均得到了改善[17]。WEI等[18]研究发现Ghrelin可以降低脓毒症大鼠海马炎症因子的表达,抑制Caspase-3的激活,从而起到改善认知功能的作用。但有的研究者得出了相反的结论,ZHAO等[19]发现对于成年大鼠,当外源性给予Ghrelin,虽然可以促进神经元形成,但是可以使其空间学习和记忆能力受损。同样,ALBARRANZECKLER等[20]也发现,Ghrelin受体敲除的小鼠,表现为空间记忆能力提高,但是情景记忆受损。目前关于Ghrelin与认知功能的研究多数为动物试验,但是也有少数的人体研究。DAVID等[21]发现在健康老年人群中,血清Ghrelin与其词汇记忆能力呈正相关。本研究结果也提示血清Ghrelin是T2DM患者发生认知功能障碍的保护因素,此外Ghrelin还与认知功能评分包括即可记忆、言语功能、注意力、延迟记忆及认知总分呈正相关。但是KUNATH等[22]发现对于人体,Ghrelin参与了脑编码功能的调节,但是不具有提高认知功能的作用。而SPITZNAGEL等[23]甚至得出了相反的结论,他们发现对于非痴呆老年人群,血清Ghrelin与其认知功能呈负相关。
由上面这些研究结果可以看出,Ghrelin与认知功能之间的关系仍具有不确定性,存在诸多矛盾及争议。本研究以T2DM作为出发点,对Ghrelin与其认知功能之间的关系进行了探讨,为T2DM认知功能障碍机制的研究提供了重要线索。由于本试验属于回顾性研究,此外参与糖尿病认知功能损伤的因素较多,包括氧化应激、胰岛素抵抗以及多种神经营养因子的下降等,因此对于血清Ghrelin下降与认知功能受损是否存在因果关系,还需要大样本前瞻性临床实验来进一步证实。
[1]MANSCHOT S M, BIESSELS G J, RUTTEN G, et al. Peripheral and central neurologic complications in type 2 diabetes mellitus: no association in individual patients[J]. Journal of The Neurological Sciences, 2008, 264(1): 157-162.
[2]VERDILE G, FULLER S J, MARTINS R N. The role of type 2 diabetes in neurodegeneration[J]. Neurobiology of Disease, 2015,84: 22-38.
[3]CHENG G, HUANG C, DENG H, et al. Diabetes as a risk factor for dementia and mild cognitive impairment: a meta-analysis of longitudinal studies[J]. Internal Medicine Journal, 2012, 42(5):484-491.
[4]MÜLLER T D, NOGUEIRAS R, ANDERMANN M L, et al.Ghrelin[J]. Molecular Metabolism, 2015, 4(6): 437-460.
[5]WEI H, CAO X, ZENG Q, et al. Ghrelin inhibits proin fl ammatory responses and prevents cognitive impairment in septic rats[J].Critical Care Medicine, 2015, 43(5): 143-150.
[6]HANSSON C, HAAGE D, TAUBE M, et al. Central administration of ghrelin alters emotional responses in rats: behavioural,electrophysiological and molecular evidence[J]. Neuroscience,2011, 180(2): 201-211.
[7]RANDOLPH C, TIERNEY M C, MOHR E, et al. The repeatable battery for the assessment of neuropsychological status (RBANS):preliminary clinical validity[J]. Journal of Clinical And Experimental Neuropsychology, 1998, 20(3): 310-319.
[8]SHORR R I, DE REKENEIRE N, RESNICK H E, et al. Glycemia and cognitive function in older adults using glucose-lowering drugs[J]. the Journal of Nutrition, Health & Aging, 2006, 10(4):297.
[9]FERRI C P, PRINCE M, BRAYNE C, et al. Global prevalence of dementia: a delphi consensus study[J]. The Lancet, 2006,366(9503): 2112-2117.
[10]BIESSELS G J, STRACHAN M W J, VISSEREN F L J, et al.Dementia and cognitive decline in type 2 diabetes and prediabetic stages: towards targeted interventions[J]. the Lancet Diabetes &Endocrinology, 2014, 2(3): 246-255.
[11]KODL C T, SEAQUIST E R. Cognitive dysfunction and diabetes mellitus[J]. Endocrine Reviews, 2008, 29(4): 494-511.
[12]ANDERWALD C, BRABANT G, BERNROIDER E, et al.Insulin-dependent modulation of plasma ghrelin and leptin concentrations is less pronounced in type 2 diabetic patients[J].Diabetes, 2003, 52(7): 1792-1798.
[13]CAPPIELLO V, RONCHI C, MORPURGO P S, et al. Circulating ghrelin levels in basal conditions and during glucose tolerance test in acromegalic patients[J]. European Journal of Endocrinology,2002, 147(2): 189-194.
[14]SCHÖFL C, HORN R, SCHILL T, et al. Circulating ghrelin levels in patients with polycystic ovary syndrome[J]. Journal of Clinical Endocrinology & Metabolism, 2002, 87(10): 4607-4610.
[15]SHIIYA T, NAKAZATO M, MIZUTA M, et al. Plasma ghrelin levels in lean and obese humans and the effect of glucose on ghrelin secretion[J]. Journal of Clinical Endocrinology &Metabolism, 2009, 87(1): 240-244.
[16]CAHILL S P, HATCHARD T, ABIZAID A, et al. An examination of early neural and cognitive alterations in hippocampal-spatial function of ghrelin receptor-de fi cient rats[J]. Behavioural Brain Research, 2014, 264(5): 105-115.
[17]KANG S, NA R M, DA S K, et al. Central acylated ghrelin improves memory function and hippocampal AMPK activation and partly reverses the impairment of energy and glucose metabolism in rats infused with β-amyloid[J]. Peptides, 2015,71(5): 84-93.
[18]WEI H, CAO X, ZENG Q, et al. Ghrelin inhibits proin fl ammatory responses and prevents cognitive impairment in septic rats[J].Critical Care Medicine, 2015, 43(5): 143-150.
[19]ZHAO Z, LIU H, XIAO K, et al. Ghrelin administration enhances neurogenesis but impairs spatial learning and memory in adult mice[J]. Neuroscience, 2014, 257(C): 175-185.
[20]ALBARRAN-ZECKLER R G, BRANTLEY A F, SMITH R G.Growth hormone secretagogue receptor (GHS-R1a) knockout mice exhibit improved spatial memory and de fi cits in contextual memory[J]. Behavioural Brain Research, 2012, 232(1): 13-19.
[21]DAVID B, ELLEN L G, LAWRENCE W J. Serum ghrelin is associated with verbal learning and adiposity in a sample of healthy, fi t older adults[J]. Biomed Research International, 2013,2013(4): 119-144.
[22]KUNATH N, MÜLLER N C J, TONON M, et al. Ghrelin modulates encoding-related brain function without enhancing memory formation in humans[J]. Neuroimage, 2016, 142: 465-473.
[23]SPITZNAGEL M B, ANDREANA BENITEZ M A, UPDEGRAFF J, et al. Serum ghrelin is inversely associated with cognitive function in a sample of non-demented elderly[J]. Psychiatry &Clinical Neurosciences, 2010, 64(6): 608-611.
