MRI评价抗肿瘤中药康莱特注射液疗效的实验研究
2018-02-06李晓琴朱红革刘春玲
李晓琴,朱红革,刘春玲
(新疆医科大学附属肿瘤医院 肺内二科,新疆 乌鲁木齐 830011)
康莱特对于中晚期肺癌、肝癌及结直肠癌等具有一定的疗效,同时还能调节机体的免疫系统,增强放、化疗杀伤肿瘤细胞的效果。大量研究表明,其具有抑制肿瘤细胞增殖和调节免疫等综合效果[1]。随着现代医药研发和中医药逐步结合,将有大量的抗癌中药用于肿瘤患者[2]。抗肿瘤药物的研发和临床实验需要确定肿瘤药物治疗的最佳作用时间和药物浓度、药物疗效和机体副作用间的平衡,以及杀伤肿瘤细胞的机制,因此需要进行实时有效的监测肿瘤变化,这些都是病理学检测所不具备的[3]。分子影像学技术是将一种或者几种具有成像功能的分子标志物打入到体内,这些标志物能够与体内肿瘤细胞特异性结合,在影像学下显示肿瘤病变的各种信息[4]。现在很多抗肿瘤药物就是基于肿瘤的血管依赖性进行设计的[5]。目前,诊断血管新生的金标准是微血管密度(microvascular density,MVD),然而其测量方法创伤大,不能实时监测和反复测量,不能应用于抗肿瘤药物疗效的检测[6-7]。临床上,MRI广泛用于评价肿瘤的生成状况,可作为一种有效的手段,持续评价抗肿瘤药物的疗效[8]。
1 材料与方法
1.1 实验试剂
免疫组织化学染色试剂盒、DAB浓缩试剂盒、PBS浓缩粉末、枸橼酸修复液购自北京中杉金桥生物科技有限公司,CD34、血管内皮生长因子(vascular endothelial growth factor,VEGF)、增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)抗体购自美国Abcom生物技术公司,Aneexin-V FITC/PI凋亡流式细胞术检测试剂盒(上海碧云天生物科技有限公司),VEGF酶联免疫吸附法(enzyme-linked immunosorbent assay,ELISA)检测试剂盒、癌胚抗原ELISA检测试剂盒购自广州慧嘉生物科技公司。
1.2 实验动物、细胞及分组
康莱特注射液(浙江康莱特药业有限公司)。实验动物采用BALB/c-nu裸鼠,共20例,均为雄性,鼠龄6~8周,体重约18 g。
人结肠癌细胞株HT-29(上海生命科学研究院的细胞库)。取4~6代处于对数生长期的细胞,生长状态差或者代数高的细胞均不用于实验。
裸鼠的右后肢皮下接种人结肠癌HT-29细胞成瘤,其中10例为对照组,腹腔注射0.9%氯化钠注射液1 ml/(d·只);10例为治疗组,腹腔注射1 ml康莱特注射液1 ml/(d·只),两组治疗时间均为7 d。
1.3 方法
1.3.1 细胞复苏、培养与传代复苏后的细胞传代≥1代后用于实验,以减少冻存液对细胞的损伤和对实验结果的影响。本实验选取第4~6代对数生长期的细胞进行实验研究。
1.3.2 细胞增殖与凋亡细胞增殖与凋亡采用5-乙炔基-2’脱氧尿嘧啶核苷(5-ethynyl-2’-deoxyuridine,EDU)细胞增殖检测及Annexin-V FITC/PI凋亡的流式细胞术检测
1.3.3 HT-29细胞成瘤接种液的制备及皮下接种取对数生长期的人结肠癌HT-29细胞,PBS清洗3次后,用无菌PBS制成接种肿瘤细胞悬液,在洁净操作室中接种1 ml至裸鼠的右后肢皮下组织,接种时注意无菌操作。由2位测量者用游标卡尺测量肿瘤底部的最大(a)和最小直径(b),按照公式体积(V)=ab2π/6,计算各组裸鼠皮下成瘤的体积大小,对照组皮下成瘤体积>200 mm3表明本实验成瘤操作成功。
1.4 MRI的检测方法
1.4.1 MRI的检测时间和设备待裸鼠右下肢的皮下成瘤大小达到模型复制成功的标准,10~15 d时进行MRI扫描检测。采用1.5T Tim Avanto 磁共振扫描仪(德国西门子公司)检测肿瘤的大小和血管情况,采用上海辰光医疗科技公司研发的25 mm实验动物专用射频线圈进行裸鼠的MRI扫描(专利号:ZL201020236347.3)。
1.4.2 裸鼠的麻醉采用10%水合氯醛进行麻醉,麻醉前在天平上精确测量裸鼠的体重,按照0.4 ml/100 g的剂量进行腹腔麻醉。
1.4.3 MRI成像参数设定MRI的具体参数根据扫描序列进行相应调整。根据预实验所得的MRI扫描序列、参数及图像,T1WI-TSE序列:TR=280,TE=18,层厚2 mm,层间距0.0 mm,层数10层,FOV=70,信号平均次数(number of signal averaged,NSA)3次,矩阵256×256;T2WI-TSE序列:TR=3 000,TE=82,层厚2 mm,层间距0.0 mm,层数10层,FOV=70,NSA 3次,矩阵512×512;磁共振弥散加权成像(diffusion weighted imaging,DWI)序列:10个扩散敏感梯度因子b值,分别为0、50、100、150、200、250、300、500、750 和 1 000 s/mm2,TR=24 00,TE=101,层厚2 mm,层间距0.0 mm,层数10层,FOV=60,NSA 6次,矩阵80×80。
1.4.4 图像的处理和分析采用Biomap软件处理DWI图像,首先计算出ADC值并绘出ADC图像,先根据10个b值拟合出ADC10b图,再分别取3个低b值(0、50和100 s/mm2)拟合出ADClow图,提取3个高b值(500、750和1 000 s/mm2)拟合出ADChigh图,将ADClow与ADChigh的差值定义为ADCperf值。根据0、500和1 000 s/mm2拟合出ADC3b图,每个ADC值的计算提取≥3个不同的b值,以便提高结果的准确性,最后分析出肿瘤组织的感兴趣区及其像素分布。
1.5 瘤体的大小与取材
接受结肠癌HT-29细胞注射的裸鼠采用单个笼喂养,并坚持每隔一段时间更换垫料和食物,保证裸鼠喂养环境的洁净和干燥,并预防各种病原体的感染。一段时间后,根据实验需要,用10%水合氯醛0.4 ml/100 g腹腔注射麻醉裸鼠后,用相机拍照,记录成瘤体的大小。用IPP 6.0软件计算各组瘤体的大小及组间差异。每次拍照后,用剪刀分离皮下的成瘤体,取下整个成瘤体,PBS清洗后,用4%多聚甲醛固定。根据MRI扫描图像,实验选取与横断位对应的肿瘤最大横径切面进行石蜡切片。每个样本切6张组织切片,切片厚度4μm。
1.6 免疫组织化学法
包埋成瘤体组织,石蜡切片,切片脱蜡。封闭抗原,孵育一抗、二抗。抗原、抗体结合显色,切片复染、脱水、封片。
1.7 MVD的测定
使用CD34抗体染色,判定标准采用Weidner改进式方法。先在低倍镜(×100)下扫视整个玻片,找出MVD最大的热点后,变换高倍镜(×200)观察并计数。任何被抗体染成棕色的单个细胞或细胞团,不管有无形成管腔,只要与周围的微血管、肿瘤组织及其他结缔组织界限清楚,都作为1条可计数的血管。肿瘤内硬化区,以及与肿瘤交界处软组织内的微血管不作计数;具有厚的平滑肌或管腔面积>8个红细胞直径的血管也排除在外。记录5个视野的微血管数,取其平均数作为MVD。
1.8 VEGF的测定
使用VEGF单克隆抗体染色,采用兼顾VEGF阳性染色强度和阳性细胞百分比作为判断标准。在排除非特异染色前提下,按染色强度计分:0分为无色,1分为淡黄色,2分为棕黄色,3分为棕褐色;按阳性细胞百分比计分:阴性为0分,阳性细胞百分比<10%为1分,11%~50%为2分,51%~75%为3分,>75%为4分。染色强度与阳性细胞百分比的乘积>3分为免疫反应阳性。并按乘积分数分为4个等级:0~2分为阴性(-)、3~5分为弱阳性(+)、6~8分为阳性(++)、9~12分为强阳性(+++)。
1.9 统计学方法
数据分析采用SPSS 18.0统计软件,计量资料以均数±标准差(±s)表示,用t检验或方差分析;计数资料以率表示用χ2检验;相关分析用Pearson法,P<0.05为差异有统计学意义。
2 结果
2.1 康莱特注射液对人结肠癌HT-29细胞增殖的影响
加入康莱特注射液作用7 d后,两组人结肠癌HT-29细胞增殖率比较,经t检验,差异有统计学意义(P<0.05),治疗组较对照组降低33.113%。见表1和图1。
2.2 康莱特注射液对人结肠癌HT-29细胞凋亡的影响
两组人结肠癌HT-29细胞凋亡率比较,经t检验,差异有统计学意义(P<0.05),治疗组较对照组升高28.243%。见表2和图2。
2.3 康莱特抑制裸鼠皮下移植瘤的生长
在裸鼠皮下接种人结肠癌HT-29细胞后5 d,裸鼠在右后肢出现米粒大小的小成瘤体,未见溃疡,皮肤光滑完整,证明模型复制成功。接种15 d后,接种部位出现明显隆起,其体积均达到300 mm3,瘤体质地硬,活动度差,与皮肤紧密结合,证明模型复制成功,成功率为100%。康莱特注射后7 d,皮下移植瘤体积下降,相对于对照组,体积下降49%。
2.4 康莱特注射液对裸鼠结肠癌皮下移植瘤DWI的影响
MRI的b值增加使两组皮下移植瘤DWI的清晰程度逐渐降低,并出现图像变形,同时肿瘤信号增加强度也不清晰,与周围组织的边界也逐渐模糊。康莱特注射液治疗后引起肿瘤坏死区域变得模糊。在两组ADC显示图表明,肿瘤呈低信号,边界清晰;而康莱特注射液治疗后7 d存在高信号斑点或片状局部液性暗区。治疗组DWI指标与对照组比较,经t检验,差异有统计学意义(P<0.05)。见表3。
表1 两组人结肠癌HT-29细胞增殖率比较(n =10,%,±s)
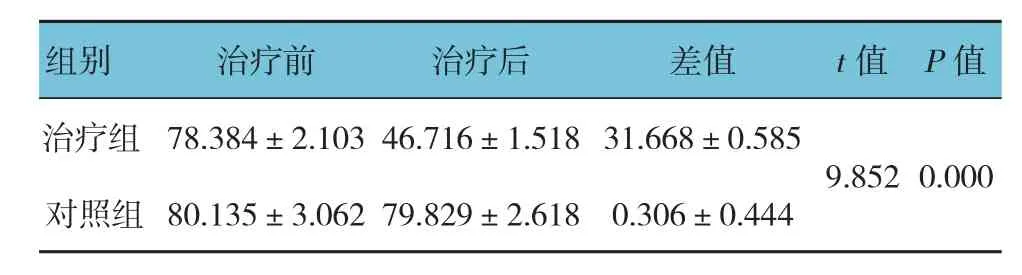
表1 两组人结肠癌HT-29细胞增殖率比较(n =10,%,±s)
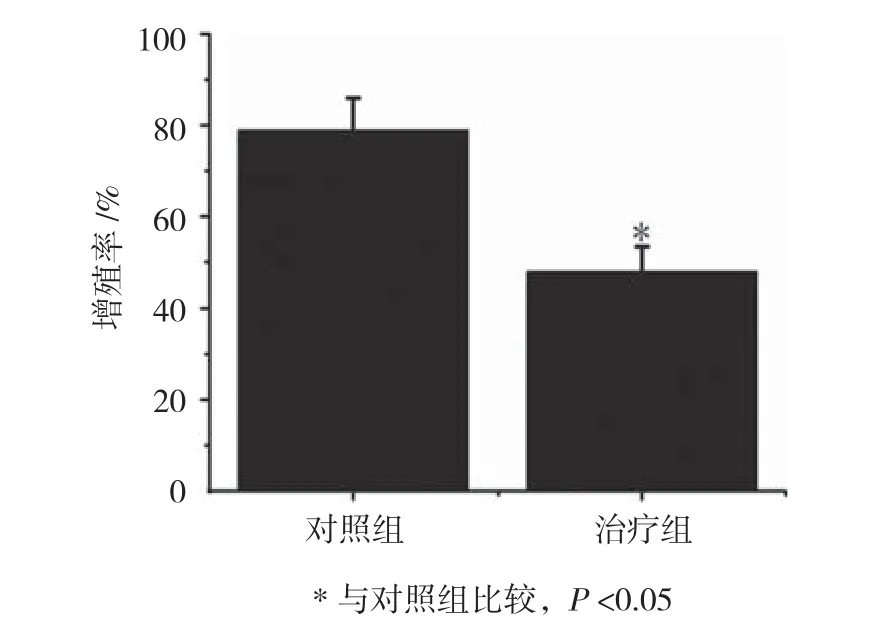
图1 两组人结肠癌HT-29细胞增殖率比较(n =10,±s)
2.5 康莱特注射液抑制裸鼠结肠癌皮下移植瘤血管的生成
治疗后7 d,治疗组、对照组的VEGF阳性表达的率分别为43%和58%,经χ2检验,差异有统计学意义(χ2=3.306,P=0.021)。治疗组CD34染色阳性的新生血管降低,仅在肿瘤的边缘部分可见。两组MVD计数、VEGF计分、PCNA阳性细胞百分比比较,经t检验,差异有统计学意义(P<0.05),治疗组PCNA阳性细胞百分比较对照组下降55%。见表4和图 3、4。
2.6 MVD参数与DWI的相关性
治疗后7 d,两组ADCperf值与MVD呈正相关,ADC10b与 MVD 呈负相关(P<0.05)。见表 5、6。
表2 两组人结肠癌HT-29细胞凋亡率比较(n =10,%,±s)
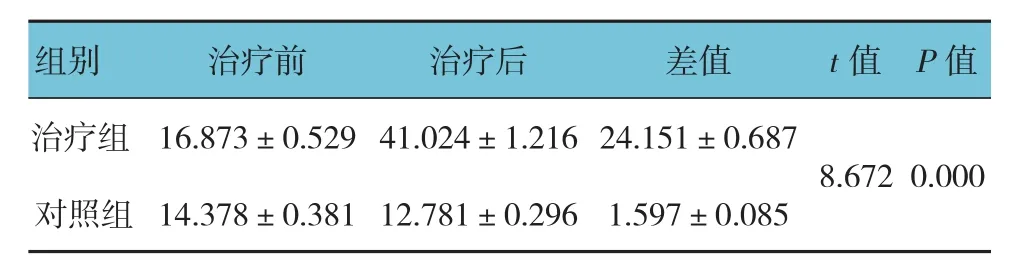
表2 两组人结肠癌HT-29细胞凋亡率比较(n =10,%,±s)
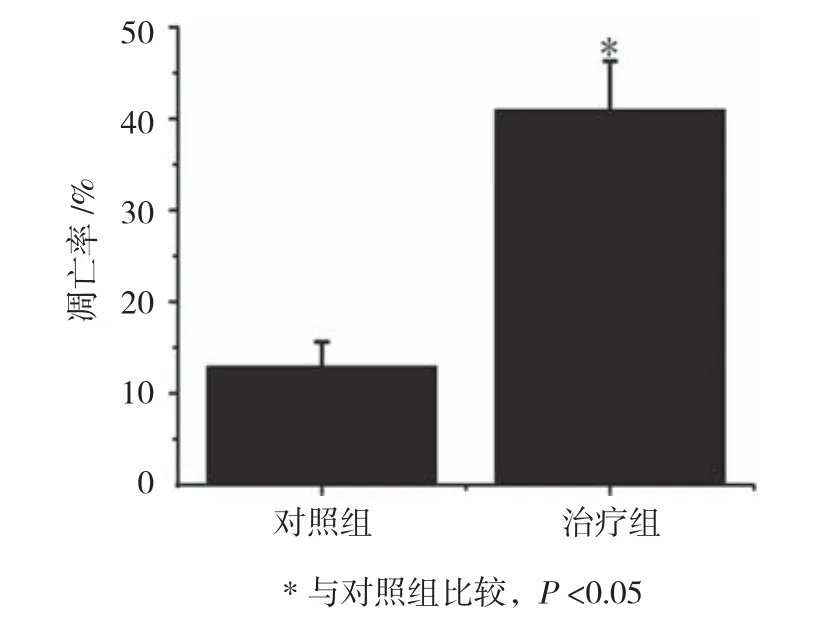
图2 两组人结肠癌HT-29细胞凋亡率比较(n =10,%,±s)
表3 两组治疗后DWI指标比较 (n =10,×10-3 mm2/s,±s)
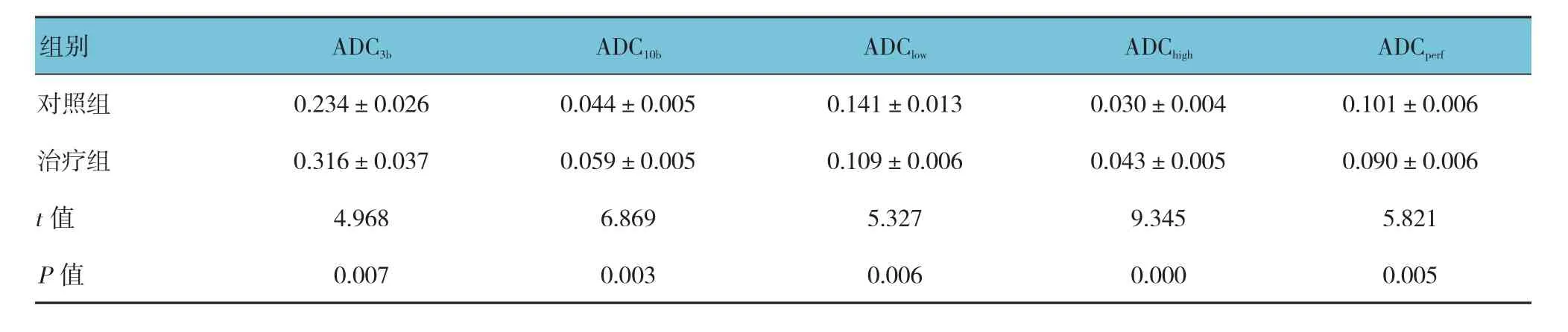
表3 两组治疗后DWI指标比较 (n =10,×10-3 mm2/s,±s)
对照组 0.234±0.026 0.044±0.005 0.141±0.013 0.030±0.004 0.101±0.006治疗组 0.316±0.037 0.059±0.005 0.109±0.006 0.043±0.005 0.090±0.006 t值 4.968 6.869 5.327 9.345 5.821
表4 两组治疗后MVD计数、VEGF计分、PCNA阳性细胞百分比比较 (n =10,±s)
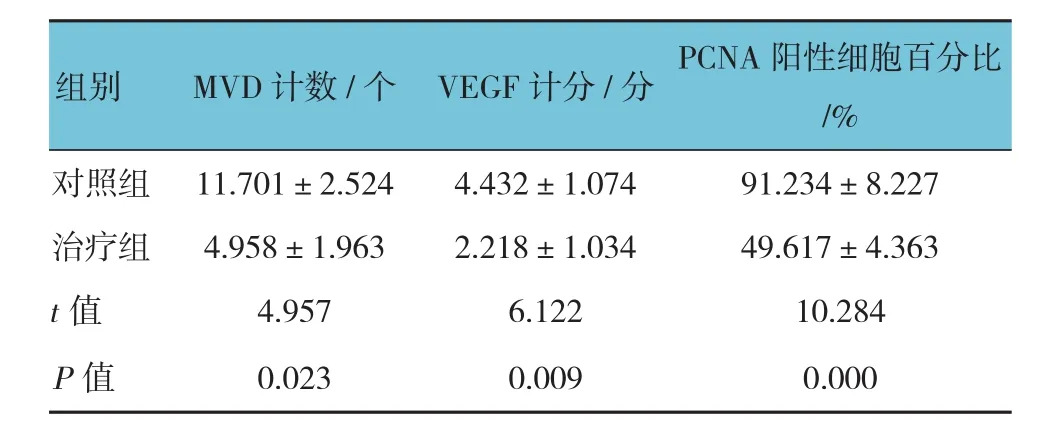
表4 两组治疗后MVD计数、VEGF计分、PCNA阳性细胞百分比比较 (n =10,±s)
对照组 11.701±2.524 4.432±1.074 91.234±8.227治疗组 4.958±1.963 2.218±1.034 49.617±4.363 t值 4.957 6.122 10.284
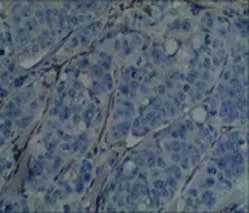
图3 抗肿瘤血管药物治疗前移植瘤组织CD34染色(免疫组织化学法×200)

图4 抗肿瘤血管药物治疗后移植瘤组织CD34染色(免疫组织化学法×200)
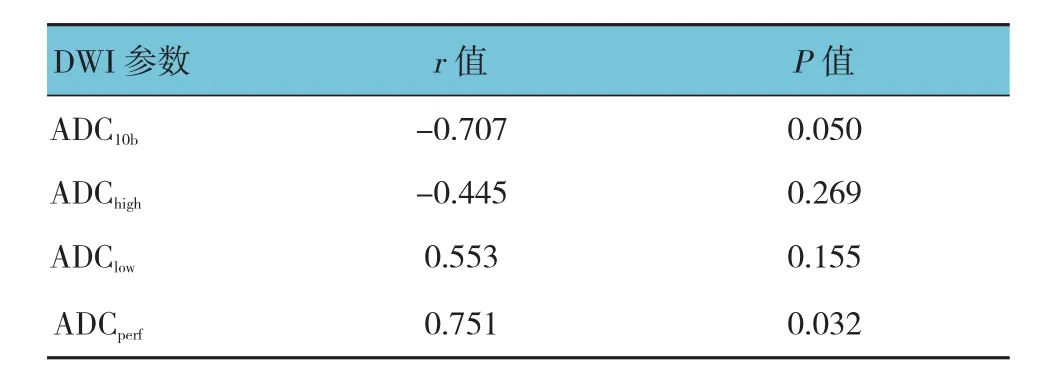
表5 治疗组DWI参数与MVD的相关性分析
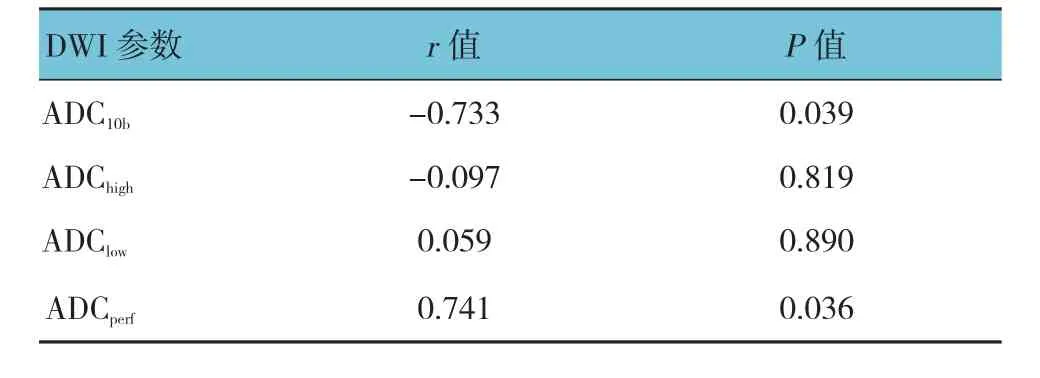
表6 对照组DWI参数与MVD的相关性分析
3 讨论
研究表明,DWI图像可以反映早期肿瘤内部变化及疗效,在评估化学药物治疗肿瘤中具有很好的效果[9-10]。在未治疗的结肠癌皮下移植瘤,ADCperf值与血流灌注紧密相关,随着灌注量的增加,其不断变大,因此可以反映血流的情况。本研究结果发现,康莱特注射液治疗后,ADCperf值下降,这说明中药康莱特注射液可以有效降低结肠癌皮下瘤的血流灌注。同时本研究也结果证实,ADCperf值与MVD计数呈正相关。ADChigh值主要与水分子的运动功能相关密切,因此ADChigh值越高,肿瘤内部血流速度也越快,对营养和氧气的供给也越丰富。本研究结果发现,康莱特注射液治疗后,ADChigh值下降,说明中药康莱特注射液可以降低肿瘤内部营养和氧气的供给,达到进一步抑制肿瘤的目的。本实验结果证明,ADChigh值与MVD计数呈正相关。本研究还发现,康莱特注射液治疗后,VEGF计分与ADClow值呈正相关,其可能的原因是体外实验发现康莱特注射液可以诱导结肠癌细胞的凋亡,水肿是凋亡的一种状态,最终引起细胞内水分子运动减少,即ADClow值的改变。PCNA计分与ADChigh呈负相关。因此,DWI参数特别是ADCperf值、ADC3b及ADC10b,可以作为评估中药抗肿瘤疗效的有效指标,具有很强的临床研究价值。
康莱特注射液能抑制人结肠癌HT-29细胞增殖,用于体内实验将具有很好的疗效。康莱特能促进人结肠癌HT-29细胞的凋亡,在动物实验中均能达到很好的抑制皮下成瘤体生长,以及抑制肿瘤血管生成的作用。
康莱特能抑制裸鼠的人结肠癌皮下移植瘤生长,其机制可能是通过促进其凋亡和抑制增殖来实现的[11-12]。免疫组织化学结果显示,康莱特注射液治疗能抑制新生血管生成和肿瘤细胞的增殖活力。DWI参数可以作为评估抗肿瘤中药疗效的有效手段,其中ADCperf值、ADC3b及ADC10b与康莱特注射液治疗后的免疫组织化学结果有相关性,因此可以作为评估中药抗肿瘤疗效的有效指标,具有很强的临床应用和研究价值。
[1]车晓玲, 李进, 何敬东, 等. 康莱特注射液联合奥沙利铂对SW480细胞株增殖和凋亡的影响[J]. 肿瘤, 2011, 31(4): 321-325.
[2]ZHENG, Q H, WU X L, CHE X L, et al. Chemotherapy combined with target drugs in the treatment of advanced colorectal cancer: a meta-analysis based on Chinese patients[J]. Indian J Cancer, 2014,51(Suppl 3): DOI: 10.4103/0019-509X.154100.
[3]LEUNG D, HAN X, MIKKELSEN T, et al. Role of MRI in primary brain tumor evaluation[J]. J Natl Compr Canc Netw, 2014, 12(11):1561-1568.
[4]LEE J E, KIM C, YANG H, et al. Novel glycosylated VEGF decoy receptor fusion protein, VEGF-Grab, ef fi ciently suppresses tumor angiogenesis and progression[J]. Mol Cancer Ther, 2015, 14(2):470-479.
[5]FU S, BAI R, ZHAO Z, et al. Overexpression of hypoxia-inducible factor-1alpha and vascular endothelial growth factor in sacral giant cell tumors and the correlation with tumor microvessel density[J].Exp Ther Med, 2014, 8(5): 1453-1458.
[6]HONG G, YUAN R, LIANG B, et al. Folate-functionalized polymeric micelle as hepatic carcinoma-targeted, MRI-ultrasensitive delivery system of antitumor drugs[J]. Biomed Microdevices, 2008, 10(5): 693-700.
[7]SUDO S, HATTORI N, MANABE O, et al. FDG PET/CT diagnostic criteria may need adjustment based on MRI to estimate the presurgical risk of extrapelvic infiltration in patients with uterine endometrial cancer[J]. Eur J Nucl Med Mol Imaging, 2015,42(5): 676-684.
[8]王飞, 王亚非, 王以浪, 等. 康莱特对人结肠癌裸鼠种植瘤肝转移的影响[J]. 现代肿瘤医学, 2011, 19(6): 1083-1085.
[9]张金山, 罗良平, 史长征, 等. 99Tcm-Annexin V显像联合MRDWI检测125I内照射后肺腺癌裸鼠移植瘤的细胞凋亡[J]. 中华核医学与分子影像杂志, 2014, 34(5): 385-389.
[10]彭新桂, 柏盈盈, 居胜红, 等. 小鼠下肢急性缺血模型的制作及影像评价[J]. 东南大学学报(医学版), 2014(3): 254-259.
[11]王飞, 王亚非, 王以浪, 等. 康莱特对人结肠癌裸鼠种植瘤肝转移的影响[J]. 现代肿瘤医学, 2011, 19(6): 1083-1085.
[12]印滇, 姚登福, 王亚非, 等. 康莱特抑制结肠癌细胞转移的作用及其分子机制研究[J]. 胃肠病学和肝病学杂志, 2012,21(11): 1005-1010.
