3种亚型IPD患者的T2*值定量研究*
2018-02-06王波任丽香龚霞蓉龚志梅吴昆华张宏江王绍波
王波,任丽香,龚霞蓉,龚志梅,吴昆华,张宏江,王绍波
(云南省第一人民医院 1.磁共振科,2.PET/CT中心,云南 昆明 650032)
原发性帕金森病(idiopathic parkinson’s disease,IPD)是中老年人较为常见的慢性神经系统退行性疾病,依据运动障碍分为震颤主型IPD、混合型IPD和姿势异常、步态障碍型(postural instability and gait disorder,PIGD)IPD[1-2]。本课题应用增强梯度回波T2加权血管成像(enhanced gradient echo T2 starweighted angiography,ESWAN)的T2*值测量来探讨不同运动障碍亚型IPD脑铁沉积的部位,以及脑内铁沉积与IPD发病和进展之间的关系。
1 资料与方法
1.1 一般资料
选取2011年1月-2015年12月于云南省第一人民医院收治的IPD患者122例作为IPD组。其中,男性67例,女性55例;平均年龄60.49岁(30~83岁),平均病程3.02年(0.5~20年)。按照2006年中华医学会神经病学分会运动障碍及帕金森病学组在《中华神经科杂志》刊发的中国帕金森病诊断标准进行诊断[3]。并且排除了帕金森综合征及帕金森叠加综合征患者。所有患者均为右利手,对多巴胺药物有效。选取与IPD组年龄、性别相匹配的健康志愿者122例作为对照组。所有入选者均为右利手,无神经系统、精神疾病病史,无代谢性疾病及可能影响神经系统的系统性疾患。实验前受检者均被告知相关事宜并取得同意。
1.2 分组标准
IPD组患者均在停药12 h后进行Hoehn-Yahr分级及帕金森病评分量表评分,根据主要运动障碍症状类型把IPD分为3组:震颤主型IPD组(平均震颤得分/PIGD得分≥1.5)、PIGD主型IPD组(平均震颤得分/PIGD得分≤1.0)及混合型IPD(1.0<平均震颤得分/PIGD得分<1.5)[4]。其中,震颤主型IPD组患者61例(男性29例,女性32例),混合型IPD组患者33例(男性18例,女性15例),PIGD主型IPD组患者28例(男性20例,女性8例)。
1.3 观察指标
记录IPD组的性别、发病年龄、病程、首发症状、起病部位、起病侧、简易智能状态(mini-mental state examination,MMSE)评分及改良Hoehn-Yahr病情分级等。
1.4 扫描技术
1.4.1 MRI的检查方法扫描使用机型:GE Signa HDXt 3.0T超导型磁共振仪(美国GE医疗集团)。线圈:8通道颅脑线圈。主要检查参数:横轴位自旋回波序列T2加权图像(T2 weighted imaging,T2WI)、T1加权图像(T1 weighted imaging,T1WI)、液体衰减反转恢复成像(fluid attenuated inversion recovery,FLAIR)及ESWAN扫描。其中T2WI:重复时间(repeating time,TR)/回波时间(echo time,TE)=2 820/111 ms;T1WI:TR/TE=1 777-1 823/26.8 ms,反转恢复时间(inversion recovery time,TI):860 ms;FLAIR T2WI:TR/TE=8 002/146~153 ms,TI:2 000 ~ 2 250 ms。ESWAN:快速扰相梯度回波,Oblic 3D Mode,TR/TE=68.2/6.06 ms、13.44、20.81、28.18、35.55、42.92、50.30、57.67 ms,层厚/层间距:2/0 mm,翻转角20°,信号平均次数:1,扫描视野:240 mm,Bandwith 31.25,距阵 512×512。
1.4.2 T22**图像后处理及TT22**值的测量使用aw 4.4工作站的Functool软件对EWSAN图像进行图像后处理后得到T2*图、相位图及幅值图。在后处理的相位图、幅值图上剔除并发基底节区钙化的患者,由2位高年资MRI医师使用多边形测量工具对所有数据的双侧额叶白质区、红核、黑质网状带、黑质致密带、尾状核头、壳核、苍白球及丘脑进行测量后得出T2*值,为减少人为误差取其均值,且对不同的意见共同协商处理。见附图。
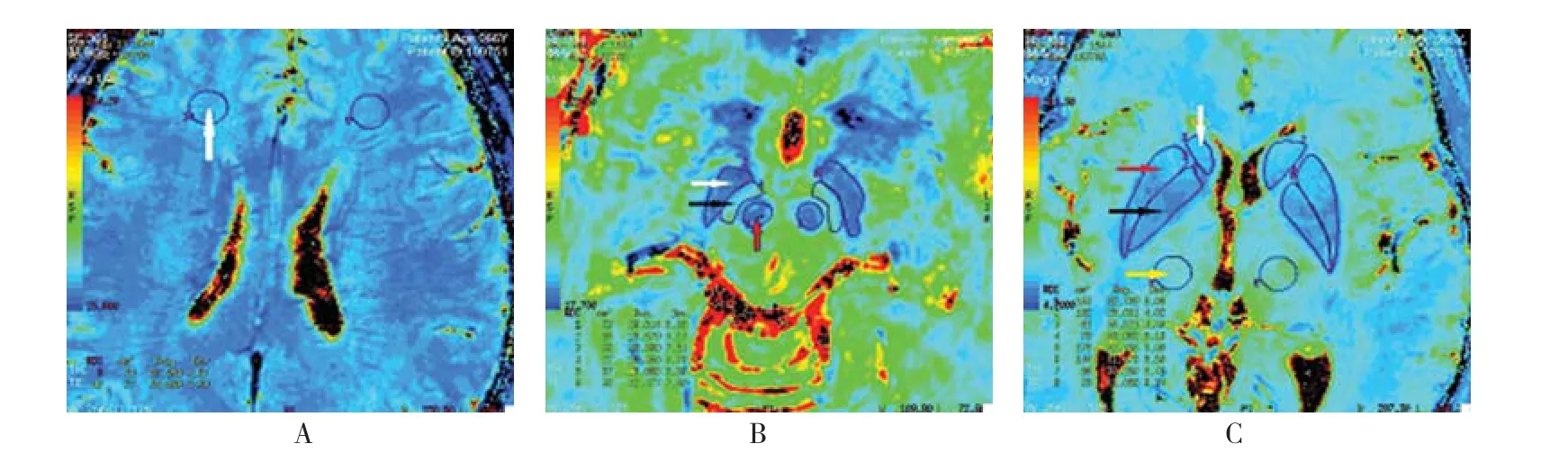
附图 T2*图像各感兴趣区的测量示意图
1.5 统计学方法
数据分析采用SPSS 17.0统计软件,计量资料以均数±标准差(±s)表示,采用独立样本t检验和方差分析,方差分析有差异进行两两比较;等级资料比较用Mann-WhitneyU检验;计数资料以构成比表示,用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 3种亚型IPD组患者性别构成分布比较
在本组122例IPD患者中,震颤主型IPD患者占50%,混合型IPD组患者数占27%,PIGD主型IPD组患者占23%,组间比较,差异无统计学意义(P>0.05)。即以震颤主型IPD为主,混合型IPD次之,PIGD主型IPD最少;其中震颤主型IPD组患者女性多于男性,而混合型IPD、PIGD主型IPD组患者男性多于女性。见表1。
2.2 震颤主型IPD与PIGD主型IPD患者临床异质性比较
震颤主型IPD组患者与PIGD主型IPD组患者的震颤和强直、步态障碍比较,差异有统计学意义(P<0.05),震颤主型IPD患者的首发症状多为震颤,而PIGD主型IPD患者的首发症状多为强直、步态障碍;震颤主型IPD组患者与PIGD主型IPD组患者的MMSE评分、改良Hoehn-Yahr病情分级比较,差异有统计学意义(P<0.05),即震颤主型IPD患者的MMSE评分比PIGD主型PD患者高,而震颤主型IPD患者改良Hoehn-Yahr病情分级比PIGD主型PD患者轻。两组IPD患者在发病年龄、平均病程、起病侧及混合症状比较,差异无统计学意义(P>0.05)。见表2。
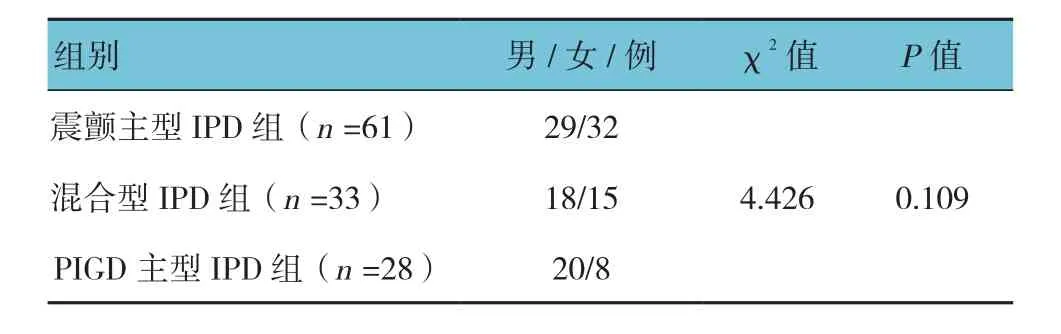
表1 3种亚型IPD患者性别构成比较
2.3 3种亚型IPD组患者分别与对照组各感兴趣区的T2*值比较
对照组苍白球的T2*值最低,其次为黑质网状带、红核,额叶白质区的T2*值最高,说明对照组苍白球脑铁含量最高,其次为黑质网状带、红核,额叶白质区的脑铁含量最少。PIGD主型IPD组患者与对照组患者在红核、黑质致密带的T2*值比较,差异有统计学意义(P<0.05),余组各感兴趣区与对照组T2*值比较,差异无统计学意义(P>0.05),说明PIGD为主型IPD组较对照组在红核、黑质致密带有较为异常脑铁沉积。见表3~5。
2.4 3种亚型IPD组患者各感兴趣区的T2*值比较分析
3种亚型IPD组患者红核、黑质网状部、壳核、苍白球及丘脑的T2*值比较,差异有统计学意义(P<0.05),3种亚型IPD组患者余感兴趣区的T2*值比较,差异无统计学意义(P>0.05)。两两比较显示,PIGD主型IPD组患者与混合型IPD组患者在红核、黑质网状部、壳核、苍白球及丘脑的T2*值比较,差异有统计学意义(P=0.003、0.002、0.004、0.020和0.025),即PIGD主型IPD患者较混合型IPD患者相比在红核、黑质网状部、壳核及苍白球异常脑铁沉积较多,在丘脑沉积较少;PIGD主型IPD组患者与震颤主型IPD组患者在丘脑的T2*值比较,差异有统计学意义(P=0.023),即PIGD主型IPD患者比震颤主型IPD患者在丘脑铁沉积多;震颤主型IPD组患者与混合型IPD组患者在黑质网状部、壳核的T2*值比较,差异有统计学意义(P=0.001和0.000),即震颤主型IPD患者比混合型IPD患者在黑质网状部、壳核脑铁沉积多。见表6。

表2 震颤主型IPD组与PIGD主型IPD组患者临床异质性比较
表3 震颤为主型IPD组与对照组患者各感兴趣区的T2*值比较 (±s)
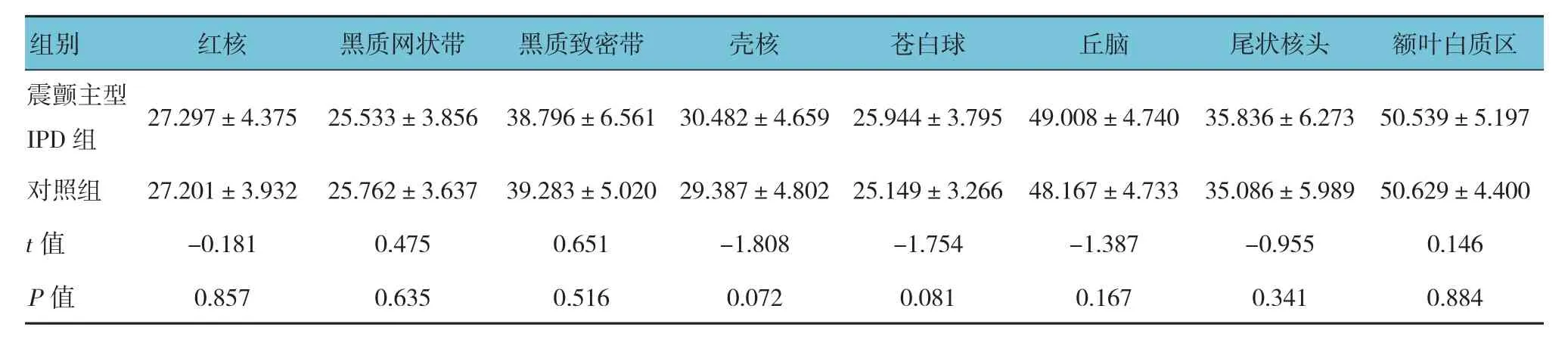
表3 震颤为主型IPD组与对照组患者各感兴趣区的T2*值比较 (±s)
震颤主型IPD 组 27.297±4.375 25.533±3.856 38.796±6.561 30.482±4.659 25.944±3.795 49.008±4.740 35.836±6.273 50.539±5.197对照组 27.201±3.932 25.762±3.637 39.283±5.020 29.387±4.802 25.149±3.266 48.167±4.733 35.086±5.989 50.629±4.400 t值 -0.181 0.475 0.651 -1.808 -1.754 -1.387 -0.955 0.146
表4 PIGD为主型IPD组与对照组患者各感兴趣区的T2*值比较 (±s)
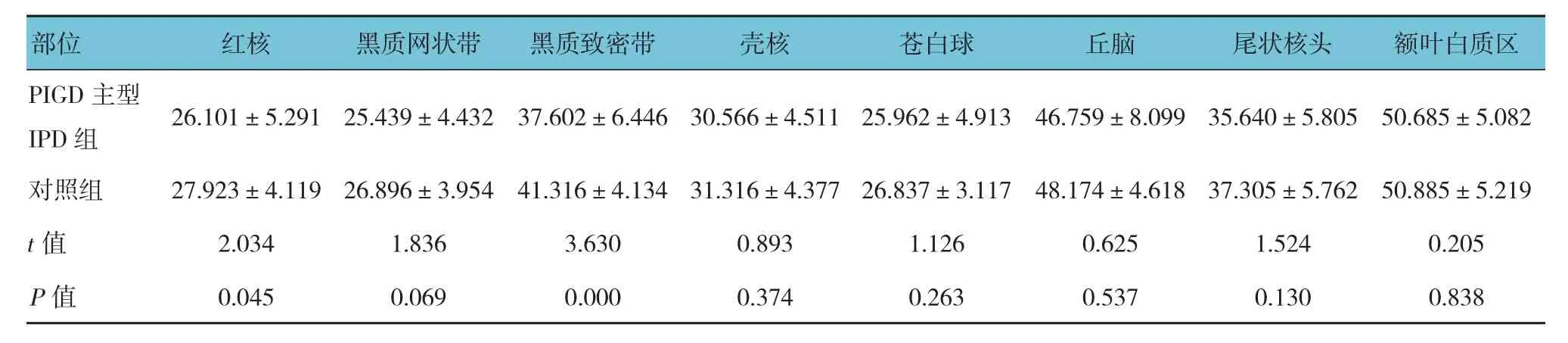
表4 PIGD为主型IPD组与对照组患者各感兴趣区的T2*值比较 (±s)
表5 混合型IPD组与对照组患者各感兴趣区的T2*值比较 (±s)
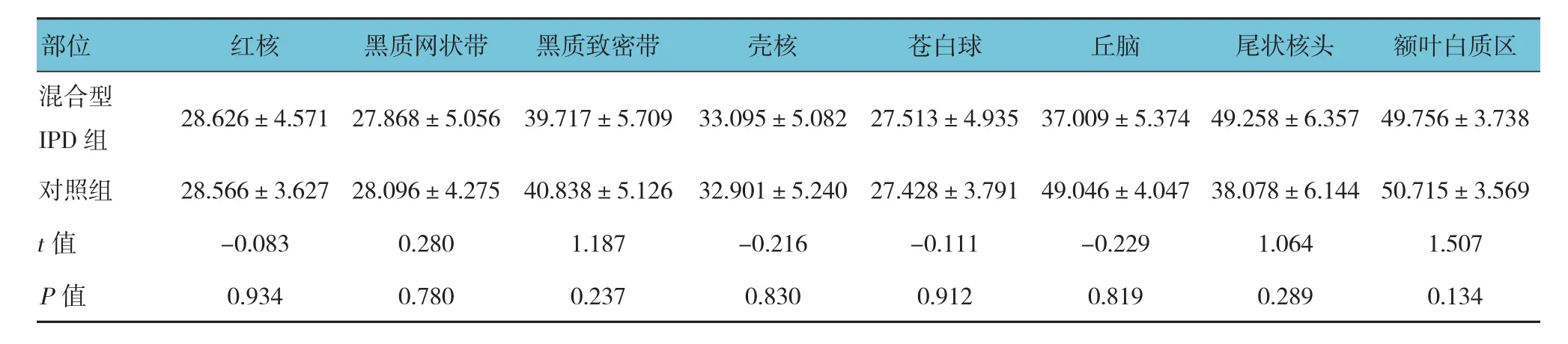
表5 混合型IPD组与对照组患者各感兴趣区的T2*值比较 (±s)
混合型IPD 组 28.626±4.571 27.868±5.056 39.717±5.709 33.095±5.082 27.513±4.935 37.009±5.374 49.258±6.357 49.756±3.738对照组 28.566±3.627 28.096±4.275 40.838±5.126 32.901±5.240 27.428±3.791 49.046±4.047 38.078±6.144 50.715±3.569 t值 -0.083 0.280 1.187 -0.216 -0.111 -0.229 1.064 1.507
表6 3种亚型IPD组患者各感兴趣区的T2*值比较 (±s)
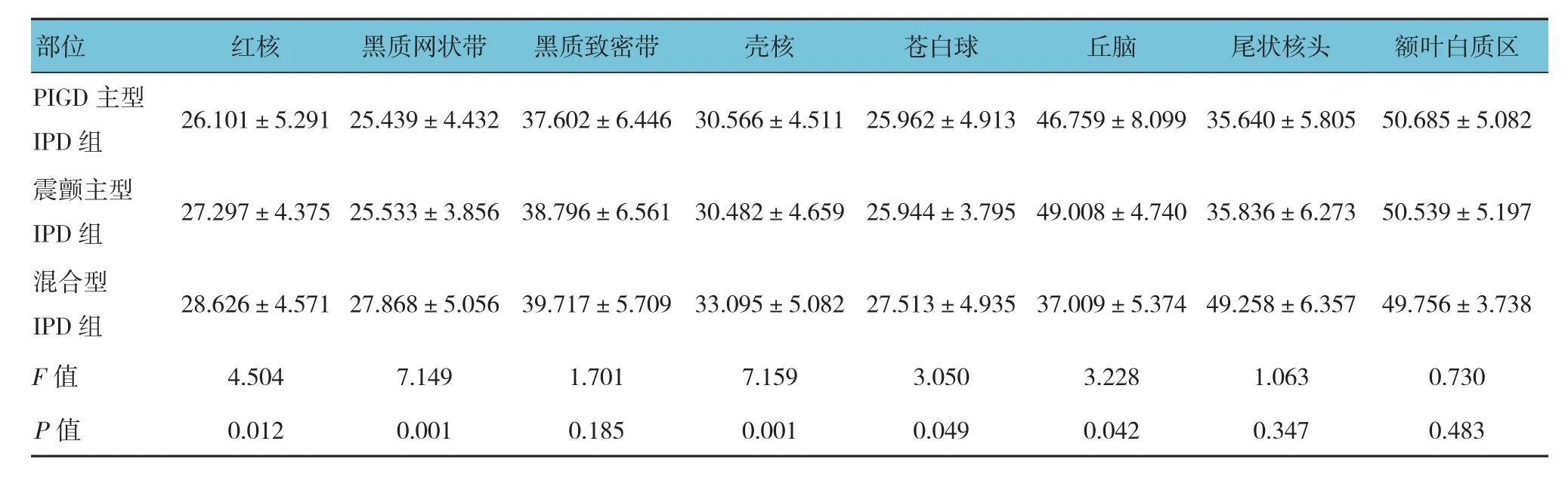
表6 3种亚型IPD组患者各感兴趣区的T2*值比较 (±s)
PIGD主型IPD 组 26.101±5.291 25.439±4.432 37.602±6.446 30.566±4.511 25.962±4.913 46.759±8.099 35.640±5.805 50.685±5.082震颤主型IPD 组 27.297±4.375 25.533±3.856 38.796±6.561 30.482±4.659 25.944±3.795 49.008±4.740 35.836±6.273 50.539±5.197混合型IPD 组 28.626±4.571 27.868±5.056 39.717±5.709 33.095±5.082 27.513±4.935 37.009±5.374 49.258±6.357 49.756±3.738 F值 4.504 7.149 1.701 7.159 3.050 3.228 1.063 0.730
3 讨论
3.1 ESWAN的T2*值在检测脑铁含量的可靠性及可行性分析
ESWAN是利用了局部磁场的不均匀来显示脑铁分布的区域[5-6]。其采用薄层三维容积成像,与常规磁共振检查相比更能清晰的显示脑内深部核团的细微解剖及形态结构,为本课题提供了较好的图像质量进行更为准确的数据测量。铁的顺磁效应缩短T2弛豫时间,导致T2*的缩短、信号降低,从而脑铁沉积与T2*值密切相关[7]。本课题通过直接测量脑内结构的T2*值来推测脑铁沉积的分布变化,为反映不同运动障碍亚型IPD脑铁沉积的部位,以及脑内铁沉积与IPD发病和进展之间的关系提供了可靠的活体检测方法。
3.2 脑铁的分布及含量
在脑组织新陈代谢所必需的微量元素中,铁是必需的。铁参与着体内多项重要的生理功能(细胞的有氧代谢活动、氧气运输等),以及髓鞘中胆固醇、脂质的合成,并为许多重要酶发挥正常功能提供了必要的基础[8]。就摄取铁的能力而言,不同的脑细胞亦存在差异性;且不同位置脑区铁的密度亦存在差异性,因此脑铁存在不均衡性的分布,即不同位置脑区对铁的需求量差异性形成了不一样的功能区,尤其是黑质网状部与苍白球的铁含量最多,反应了铁在锥体外系具有重要意义[9]。SPATZ[10]于1922年采用Perls染色法首先进行脑铁含量的系统研究,发现人体脑铁分布不一致,深部核团最高,皮质次之,白质最低。HALLGREN等[11]对死者81位脑标本的组织化学分析亦得出相似结论,锥体外系脑铁含量最高,其次是灰质,白质脑铁含量最低。本研究亦发现在健康志愿者中苍白球脑铁含量最高,其次为黑质网状带、红核,额叶白质区的铁含量最少,与文献报道一致[10-12]。
3.3 3种亚型IPD的临床异质性
许多临床研究发现,IPD患者在发病后可能仅出现肢体强直的症状,而不出现震颤的临床表现,他们从而推测IPD患者的肢体震颤与强直可能是两种互不依赖的临床表现[13]。随着人们对于IPD临床异质性的关注,对于静止性震颤、肌强直、运动迟缓及姿势反射障碍四主征之间的相关性研究也在进一步加大。SCHRAG等[14]学者指出:IPD患者的震颤严重性与肢体强直、运动迟缓、MMSE评分及改良Hochn-Yahr病情分级之间没有任何联系,而患者肢体强直的进展程度与其运动迟缓的进展程度具有密切的正相关,但未发现震颤进展的规律性。从而推断出震颤是独立于IPD其他症状的1种比较特殊的生理、病理过程。有的学者认为以震颤为首发症状患者的步态障碍是1种良性病程,预后效果较好[15]。本组研究得出:震颤多为震颤为主型IPD的首发症状,而强直、运动迟缓及步态障碍多为PIGD主型IPD患者的首发症状;震颤主型与PIGD主型IPD患者在发病年龄、病程、性别构成及起病侧等方面相比无差异。PIGD主型IPD患者与广泛的认知障碍有关,而震颤主型IPD患者与认知障碍无关。震颤主型IPD患者较PIGD主型IPD患者病情进展慢、预后好,与文献报道一致[16-17]。
不同运动障碍亚型IPD的诊断与脑铁沉积的异常增加、病理性沉积的部位IPD的诊断主要依据临床症状、体征及对多巴胺制剂的治疗敏感确诊,容易误诊。据SNYDER等[18]对近期两组临床-病理系列研究结果发现,经神经专科医师根据临床症状、体征及对左旋多巴治疗敏感确诊的IPD患者,尸解的诊断正确率最终却仅有85%。现在国内外要对IPD的亚型做出准确的诊断、治疗更是难以达到,尚需寻找更敏感的特异性指标。
目前大量尸检、动物实验和病理生理研究均证实脑铁在深部灰质核团的异常沉积、增加与IPD具有密切的相关性,尤以黑质致密带的脑铁含量更为明显。推断与黑质铁增加诱导自由基产生、介导氧化应激损伤致黑质多巴胺能神经元凋亡有关[19]。其中PIGD主型IPD患者在中脑黑质神经元的丢失比震颤主型IPD患者更明显,而震颤主型IPD患者在丘脑、下丘脑、脑桥及前运动皮质代谢更明显,黑质致密带神经元丢失的数量与痴呆发生率、程度相关性密切。另外迷走神经背核、Meynert核、蓝斑、下丘脑后外侧及边缘叶等黑质外结构损伤,多巴胺、肾上腺及胆碱能等系统的神经递质受累,导致IPD临床的异质性[20-21]。本研究显示:PIGD主型IPD患者较对照组患者在红核、黑质致密带脑铁异常沉积明显;PIGD主型IPD患者与混合型IPD患者相比在红核、黑质网状部、壳核、苍白球异常铁沉积较多,在丘脑铁沉积较少;PIGD主型IPD患者与震颤主型IPD患者相比在丘脑铁沉积较多;震颤主型IPD患者较混合型IPD患者相比在黑质网状部、壳核铁沉积较多。
目前采用ESWAN的T2*值检测PD脑铁含量的有关报道较少,而且未对不同运动障碍亚型IPD进一步研究。本组患者未对不同运动障碍亚型IPD的左右两侧、病情轻重及病程长短进一步细化分析,因此尚需扩大样本进行进一步细化研究。
[1]BROWN M T, HENNY P, BOLAM J P, et al. Activity of neurochemically heterogeneous dopaminergic neurons in the substantia nigra during spontaneous and driven changes in brain State[J]. J Neurosci, 2009, 29(9): 2915-2925.
[2]刘中霖, 王丽敏, 陶恩祥. 帕金森病患者运动障碍的临床异质性[J]. 南方医科大学学报, 2008, 28(3): 447-448.
[3]中华医学会神经病学分会运动障碍及帕金森病学组.帕金森病治疗指南[J].中华神经科杂志, 2006, 39(6): 409-412.
[4]FOLTYNIE T, BRAYNE C, BARKER R A. The heterogeneity of idiopathic parkinson’s disease[J]. J Neurol, 2002, 249(2): 138-145.[5]HAACKE E M, CHENG N Y, CHENG Y C, et al. Susceptibility weighted imaging(SWI)[J]. MagnReson Med, 2004, 52(3): 612-618.
[6]SEHGAL V, DELP5ROPOSTO Z, HAACKE E M, et al. Clinical applications of neuroimaging with susceptibility-weighted imaging[J]. Magn Reson Imaging, 2005, 22(4): 439-450.
[7]王波, 马莎, 戴敏方, 等. 原发性单侧症状帕金森病SWI脑铁沉积的定量研究[J]. 中国临床医学影像杂志, 2013, 24(4): 234-238.
[8]张静, 张云亭,何宁, 等. 磁敏感加权成像对帕金森病患者丘脑底核的显示价值初探[J]. 磁共振成像, 2011, 2(5): 353-357.
[9]MOOS T, NIELSEN T R, SKJORRINGE T, et a1. Iron traf fi cking inside the brain[J]. J Neurochem, 2007, 103(5): 1730-1740.
[10]SPATZ H. Über den eisennachweis im gehirn, besonders in zentren des extrapyramidal-motorischen systems. I. Teil[J]. Zeitschrift für die gesamte Neurologie and Psychiatrie, 1922, 77(1): 261-290.
[11]HALLGREN B, SOURANDER P. The effect of age on the nonhaemin iron in the human brain[J]. J Neurochem, 1958, 3(1): 41-51.
[12]夏爽, 柴超, 沈文, 等. MR定量磁敏感图评估正常人脑铁含量的初步研究[J]. 中华放射学杂志, 2014, 48(9): 730-735.
[13]李玮, 赵建华, 孙圣刚, 等. 美金刚改善帕金森病认知功能和运动障碍的疗效分析[J]. 中华医学杂志, 2011, 91(5): 301-303.
[14]SCHRAG A, DODEL R, SPOTTKE A, et al. Rate of clinical progression in parkinson’s disease. a prospective study[J]. Mov Disord, 2007, 22(7): 938-945.
[15]LINAZASORO G. Classical parkinson disease versus parkinson complex reflections against staging and in favour of heterogeneity[J]. Eur J Neurol, 2007, 14(7): 721-728.
[16]VERLEDEN S, VINGERHOETS G, SANTENS P. Heterogeneity of cognitive dysfunction in Parkinson’s disease: a cohort study[J].Eur Neurol, 2007, 58(1): 34-40.
[17]潘晓波, 卓文燕, 杜中立, 等. 帕金森病异质性的质子磁共振波谱研究[J]. 中国实用神经疾病杂志, 2015, 18(12): 1-3.
[18]SNYDER L R, CRUZ AGUADO R, SADILEK M. Parkinsondementia complex and development of a new stable isotope dilution assay for BMAA detection in tissue[J]. Toxicol Appl Pharmacol, 2009, 240(2): 180-188.
[19]MICHAELI S, OZ G, SORCE D J, et al. Assessment of brain iron and neuronal integrity in patients with parkinson’s disease using novel MRI contrasts[J]. Mov Disord, 2007, 22(3): 334-340.
[20]BODNER C R, MALTSEV A S, DOBSON C M, et al. Differential phospholipid binding of alpha-synuclein variants implicated in Parkinson’s disease revealed by solution NMR spectroscopy[J].Biochemstry, 2010, 49(5): 862-871.
[21]LEMKAU L R, COMELLAS G, LEE S W, et al. Site-specific perturbations of alpha-synuclein fi bril structure by the parkinson’s disease associated mutations A53T and E46K[J]. PLoS one, 2013,8(3): DOI: 10.1371/journal.pone.0049750.
