SOCS2、SOCS5在儿童过敏性紫癜中的表达及其意义
2018-02-06王凤英黄路圣徐康叶林华黄云李钊徐进
王凤英,黄路圣,徐康,叶林华,黄云,李钊,徐进
(扬州大学附属泰兴医院 儿科,江苏 泰兴 225400)
过敏性紫癜(henoch-schoenlein purpura,HSP)是一种以小血管为主要病变的全身性血管炎,是儿童最常见的血管炎。至今HSP的发病机制尚未完全清楚[1]。研究表明,HSP急性期存在明显的免疫功能异常,包括体液免疫紊乱、T细胞亚群功能失调及细胞因子异常分泌等。细胞因子信号传导抑制蛋白2(suppressors of cytokine signaling,SOCS2)和 SOCS5是SOCS家族家族中重要的分子,研究发现其可调节免疫功能,影响免疫性疾病的发生、发展。本研究旨在研究SOCS2、SOCS5在儿童HSP中的表达及其意义。
1 资料与方法
1.1 临床资料
选取2014年9月-2015年6月扬州大学附属泰兴医院住院或门诊的HSP新发患者,对照组为门诊健康体检儿童。HSP患儿36例,诊断均符合中华医学会儿科学分会免疫学组制定的儿童HSP循证诊治建议[2]。HSP患儿均为初次发病,病程≤3 d,在受检前4周内未使用任何糖皮质激素或细胞毒性药物。其中,男性21例,女性15例;年龄(7.8±3.2)岁;单纯皮肤型8例,混合型28例(23例伴关节症状,16例伴消化道症状,5例伴肾脏损害)。对照组儿童17例均为无过敏性疾病史的健康儿童。其中,男性10例,女性7例;年龄(7.5±2.5)岁。正常受试者无严重心、肝疾患及恶性肿瘤病史,近期无呼吸道感染病史及免疫抑制剂应用史。两组儿童年龄、性别比较,差异无统计学意义(t=0.190和0.010,P=0.871和0.931)。本研究经本院伦理委员会批准,所有受试对象家长知情同意。
1.2 材料与试剂
人外周血淋巴细胞分离液(北京索莱宝科技有限公司),Trizol试剂(美国Invitrogen公司),以甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)作为内参基因,SOCS2、SOCS5、GAPDH的引物设计和合成由上海生工生物工程有限公司完成,目的基因和内参基因的引物序列见表1。逆转录试剂、SYBR Green Ⅰ实时荧光定量聚合酶链反应(quantitative real-time polymerase chain reaction,qRT-PCR)试剂盒购自美国Thermo公司。
1.3 仪器与设备
低速离心机、TDZ5WS购自长沙湘智离心机仪器有限公司,低温高速离心机、Heraeus Multifuge XIR Thermo Fisher购自上海赛默飞世尔仪器有限公司,分光光度计、Eppendorf Biophotometer plus购自德国eppendorf公司,PCR仪为伯乐C1000 Thermal Cycle(美国Bio Rad公司),凝胶成像仪、Tanon3 500购自上海天能科技有限公司。

表1 PCR引物序列
1.4 方法
1.4.1 提取外周血单个核细胞(peripheral blood mononuclear cells,PBMC)使用肝素钠抗凝管采集HSP患儿治疗前和对照组儿童外周静脉血2 ml,用密度梯度离心法分离出PBMC,用Trizol悬浮,置于-80℃冰箱保存,待测SOCS2和SOCS5 mRNA含量。
1.4.2 mRNA提取和脱氧核糖核酸cDNA合成严格按照Trizol试剂盒说明书步骤,用PBMC提取总mRNA,然后将mRNA逆转录为cDNA,逆转录反应总体系为20μl,在0.2ml EP管中进行。
1.4.3 SOCS22、SOCS5基因表达检测反应体系为25μl,其中 SYBR Green Ⅰ 12.5μl,cDNA 0.3μl,正反向引物各0.3μl,加去核酸水至25μl。PCR反应条件:95℃预变性3min,95℃变性30 s,60℃退火30 s,72℃延伸60 s,共39个循环。
1.5 统计学方法
数据处理采用SPSS 19.0统计软件,计量资料以均数±标准差(±s)表示,用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 两组患儿SOSC2和SOCS5 mRNA表达水平比较
两组患儿SOCS2和SOCS5 mRNA的表达量比较,经t检验,差异有统计学意义(P<0.05),HSP组较对照组高。见表2。
2.2 不同临床类型HSP患儿SOSC2和SOCS5 mRNA表达水平比较
混合型HSP患儿SOCS2和SOCS5 mRNA表达水平与单纯型HSP患儿比较,经t检验,差异有统计学意义(P<0.05),混合型HSP患儿SOCS2和SOCS5 mRNA表水平较单纯型患儿高。见表3。
2.3 不同性别HSP患儿SOSC2和SOCS5 mRNA表达水平比较
不同性别HSP患儿SOCS2和SOCS5 mRNA表达水平比较,经t检验,差异无统计学意义(P>0.05)。见表4。
表2 两组患儿SOSC2和SOCS5 mRNA表达水平比较(±s)

表2 两组患儿SOSC2和SOCS5 mRNA表达水平比较(±s)
HSP组(n =36) 20.995±7.571 7.253±1.036对照组(n =17) 6.603±1.566 3.992±0.817 t值 2.152 2.47
表3 不同临床类型HSP患儿SOSC2和SOCS5 mRNA表达水平比较 (±s)

表3 不同临床类型HSP患儿SOSC2和SOCS5 mRNA表达水平比较 (±s)
混合型(n =28) 26.926± 9.930 10.536 ±4.992单纯型(n =8) 4.050±1.176 3.060±2.263 t值 2.288 3.791
表4 不同性别HSP患儿SOSC2和SOCS5 mRNA表达水平比较 (±s)
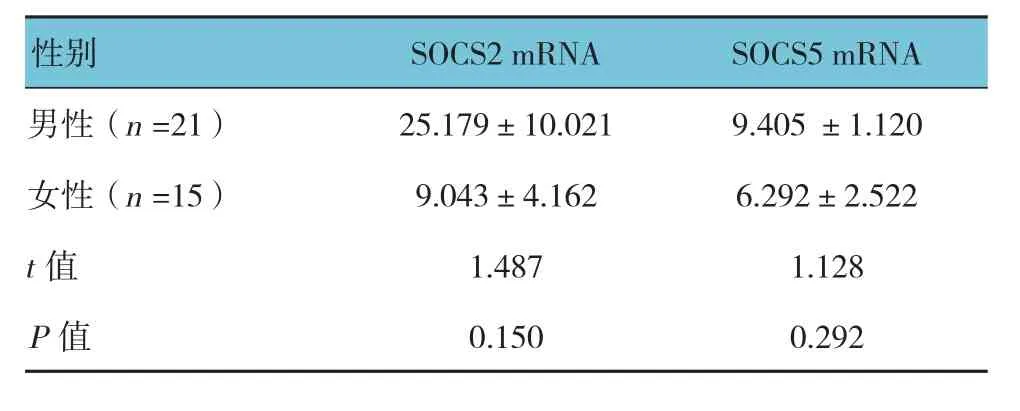
表4 不同性别HSP患儿SOSC2和SOCS5 mRNA表达水平比较 (±s)
?
3 讨论
HSP是儿童的常见病、多发病,发病率逐年增加,其发病原因目前认为非单一因素所致,是多种因素综合作用的结果。其可能机制为环境中的各种刺激因子作用于具有遗传背景的个体,引起T、B淋巴细胞免疫功能紊乱,激发B细胞克隆扩增,导致免疫球蛋白A介导的广泛的白细胞碎裂性小血管炎;血清中多种炎症细胞因子升高;凝血因素也参与其中,小血管局部可有血栓形成。近年来对T淋巴细胞亚群的研究较多,结果报道也不一致,但比较一致的是发现HSP患者存在Th细胞免疫功能紊乱,急性期体内存在Th1/Th2失衡,主要表现为Th2的优势活化[3-4]。Th细胞是免疫反应重要的调控/效应细胞,Th细胞失衡则引起免疫功能紊乱,协同其他因子导致免疫性疾病发生。新近发现的T细胞亚群CD4+CD25+调节性T细胞(regulatory T cells,Treg)和Th17细胞亦是导致HSP免疫失衡的重要原因[5-6]。
研究证实,SOCS1、SOCS2、SOCS3、SOCS5等均可参与Th细胞平衡的调节。SOCS1在Thl细胞中高表达,可抑制Th2细胞分化,促进Thl细胞的分化;SOCS3在Th2细胞中高表达,可通过抑制Thl细胞分化,促进Th2细胞的分化,使Th2型反应增强[7-8]。SOCS2可抑制Th2细胞的分化和发育,影响Ⅱ型过敏反应等免疫反应的发生,对Treg的稳定也发挥重要作用[9-10];SOCS5主要表达在Th1细胞,正向调控Th1细胞分化,负向调控Th2细胞分化[11-12]。SOCS各分子间有相互作用,SOCS1、SOCS2、SOCS3、SOCS5间存在相互作用。SOCS2能抑制SOCS1或SOCS3的表达[13]。TANNAHILL等[14]研究认为,SOCS2的表达可显著减少细胞因子刺激产生的SOCS3水平,促进白细胞介素2(Interleukin-2,IL-2)和IL-3信号,影响T淋巴细胞的增生;Thl细胞分泌SOCS1造成炎症发生的同时,SOCS5也升高,可能对机体起保护作用。SOCS分子是JAK-STAT信号通路重要的负反馈调节者,通过下调该信号通路调节单核巨噬细胞、树突细胞、淋巴细胞等多种免疫细胞的发育、分化、活化和功能[15-18],从而影响多种炎症因子的表达与释放,参与免疫性、炎症性疾病的发生、发展[19]。SOCS在免疫过敏性疾病的发生、发展中起重要作用[19],研究证实,SOCS2、SOCS5参与类风湿性关节炎、哮喘等疾病的发病过程,SOCS1、SOCS3也参与多种免疫性疾病的发病[20-21]。
本研究检测36例HSP儿童急性期SOCS2、SOCS5基因的表达,与对照组相比,发现HSP组患儿SOCS2和SOCS5 mRNA表达升高,且混合型HSP较单纯型HSP患儿的表达量升高。结合前期研究,HSP患儿体内SOCS1、SOCS3表达升高,尤其以SOCS3升高更明显[22],笔者分析,在HSP患儿体内多种因素的影响下,SOCS3的表达升高,促使HSP患儿表现为Th2的优势活化,SOCS1、SOCS2、SOCS5的表达适应性增高,但SOCS1、SOCS2、SOCS5的升高不足以抑制SOCS3引起的Th2细胞分化和活化。OHSHIMA等[23]研究发现,在哮喘动物模型中,SOCS5的过表达不能抑制TH2反应。本研究结果同样提示,在HSP中SOCS1、SOCS2、SOCS5等表达升高未能抑制Th2的优势活化。本研究同时发现,HSP病情越重,SOCS2、SOCS5的升高越明显,提示SOCS2、SOCS5与HSP患儿的病情有关。周月宏等[24]研究发现,SOCS2过表达可通过抑制肾小球系膜细胞炎症因子IL-6、肿瘤坏死因子α的表达,而抑制其炎症反应;在HSP患儿中,尚不清楚SOCS2、SOCS5通过何种机制发挥抑制Th2型细胞反应。不同的SOCS成员可作为药物治疗的靶分子,药物通过干预SOCS蛋白的表达,影响细胞因子的分泌,从而治疗免疫相关性疾病[21]。由于发病机制和机体免疫系统网络自身调整功能的复杂性,上述SOCS分子在HSP患儿中升高的始动因素、参与HSP发病的分子机制,以及相互作用机制还有待进一步深入研究,为SOCS治疗HSP等免疫性疾病的临床应用提供实验和理论基础。
[1]RIGANTE D, CASTELLAZZI L, BOSCO A, et al. Is there a crossroad between infections, genetics, and Henoch-Schonlein purpura[J]. Autoimmun Rev, 2013, 12(10): 1016-1021.
[2]中华医学会儿科学分会免疫学组, 《中华儿科杂志》编辑委员会.儿童过敏性紫癜循证诊治建议[J]. 中华儿科杂志, 2013, 51(7):502-507.
[3]李秋, 杨锡强, 李永柏, 等. 过敏性紫癜T淋巴细胞功能状态的研究[J]. 中华儿科杂志, 2001, 39(3): 157-159.
[4]LI Y Y, LI C R, WANG G B, et al. Investigation of the change in CD4+T cell subset in children with Henoch-Schonlein purpura[J].Rheumatol Int, 2012, 32(12): 3785-3792.
[5]CHEN O, ZHU X B, REN H, et al. The imbalance of Th17/Treg in Chinese children with Henoch-Schonlein purpura[J]. Int Immunopharmacol, 2013, 16(1): 67-71.
[6]王强, 史洋溢, 曹玫, 等. Thl7细胞/Treg细胞失衡在儿童过敏性 紫癜发病机制中的作用[J]. 中国实验血液学杂志, 2015,23(5): 1391-1396.
[7]YAMAMOTO K, YAMAGUCHI M, MIYASAKA N, et al. SOCS-3 inhibits IL-12-induced STAT4 activation by binding through its SH2 domain to the STAT4 docking site in the IL-12 receptor beta2 subunit[J]. Biochem Biophys Res Commun, 2003, 310(4): 1188-1193.
[8]YOSHIMUR A. Negative regulation of cytokine signaling[J]. Clin Rev Allergy Immunol, 2005, 28(3): 205-220.
[9]COOKE N, JACKSON R, SWIFT, et al. SOCS2 regulates T helper type 2 differentiation and the generation of type 2 allergic responses[J]. J Exp Med, 2011, 208(7): 1523-1531.
[10]KNOSP C A, SCHIERING C, SPENCE S, et al. Regulation of Foxp3+inducible regulatory T cell stability by SOCS2[J]. J Immunol, 2013, 190(7): 3235-3245.
[11]SEKI Y, HAYASHI K, MATSUMOTO A, et al. Expression of the suppressor of cytokine signaling-5 (SOCS5) negatively regulates IL-4-dependent STAT6 activation and Th2 differentiations[J].Proc Natl Acad Sci USA, 2002, 99(20): 13003-13008.
[12]EGWUAGU C E, YU C R, LI Z, et al. SOCS5 mRNA levels in peripheral blood mononuclear cells (PBMC): a potential biomarker for monitoring response of uveitis patients to Daclizumab therapy[J]. J Autoimmun, 2005, 24(1): 39-46.
[13]邢长英, 归绥琪, 王海燕. 人早孕母胎界面SOCS1、SOCS2、SOCS3表达[J]. 中国免疫学杂志, 2006, 22(6): 538-544.
[14]TANNAHILL G M, ELLIOTT J, BARRY A C, et al. SOCS2 can enhance interleukin-2 (IL-2) and IL-3 signaling by accelerating SOCS3 degradation[J]. Mol Cell Biol, 2005, 25(20): 9115-9126.
[15]LABUZEK K, SUCHY D, GABRYEL B, et al. Role of the SOCS in monocytes/macrophages-related pathologies. Are we getting closer to a new pharmacological target[J]. Pharmacol Rep, 2012,64(5): 1038-1054.
[16]YOSHIMURA A, SUZUKI M, SAKAGUCHI R, et al. SOCS,in fl ammation, and autoimmunity[J]. Front Immunol, 2012, 12(3):20.
[17]POSSELT G, SCHWARZ H, DUSCHL A, et al. Suppressor of cytokine signaling 2 is a feedback inhibitor of TLR-induced activation in human monocyte-derived dendritic cells[J]. J Immunol, 2011, 187(6): 2875-2884.
[18]SPENCE S, FITZSIMONS A, BOYD C R, et al. Suppressors of cytokine signaling 2 and 3 diametrically control macrophage polarization[J]. Immunity, 2013, 38(1): 66-78.
[19]MAHLAB-GURI K, ASHER I, STHOEGER Z, et al. SOCS-suppressor of cytokine signaling proteins and their role in the pathogenesis of allergic and autoimmune disorders[J]. Harefuah,2013, 152(8): 464-499.
[20]黄元兰, 闫伟, 付兆强, 等. 细胞细胞因子信号传导抑制蛋白(SOCS)与免疫调节[J]. 分子诊断与治疗杂志, 2015, 7(3):205-210.
[21]LIANG Y, XU W D, PENG H, et al. SOCS signaling in autoimmune diseases: molecular mechanisms and therapeutic implications[J]. Eur J Immunol, 2014, 44(5): 1265-1275.
[22]王凤英, 鲁曼. 过敏性紫癜患儿外周血单个核细胞细胞因子信号传导抑制蛋白1、3mRNA的表达[J]. 临床儿科杂志, 2015,33(1): 60-63.
[23]OHSHIMA M, YOKOYAMA A, OHNISHI H, et al.Overexpression of suppressor of cytokine signalling-5 augments eosinophilic airway inflammation in mice[J]. Clin Exp Allergy,2007, 37(5): 735-742.
[24]周月宏, 田坚, 沈静雪, 等. 过表达SOCS2体外抑制人肾小球系膜细胞炎症反应及纤维化的研究[J]. 现代中西医结合杂志,2016, 25(4): 343-346.
