黑米花色苷对哮喘小鼠气道炎症的影响
2018-02-05姜京植延光海李良昌
车 楠,叶 晶,姜京植,延光海,李良昌
延边大学医学院解剖学教研室 吉林延吉 133002
过敏性哮喘是一种复杂的炎症气道疾病,最常见的症状特点是气道炎症、黏液分泌过多、气道高反应[1]。辅助性T细胞2型(T-helper type 2,Th2)细胞因子介导的炎症在哮喘过程中发挥重要作用,如白细胞介素4(interleukin-4,IL-4)刺激免疫球蛋白E(IgE)的产生,参与过敏炎症和气道重塑;IL-5能够促进嗜酸性粒细胞的聚集和生长[2]。而在哮喘中Th1细胞通过分泌干扰素(interferon,IFN)抑制Th2细胞因子介导的免疫反应。因此,Th1/Th2细胞因子失平衡是哮喘发病的免疫学机制之一[3]。黑米花色苷(anthocyanin-rich extract from black rice,AEBR)属黄酮多酚类化合物,近年来研究[4-5]发现,AEBR能够通过抑制肥大细胞的活化而发挥抗过敏作用,抑制脂多糖(lipopolysaccharide,LPS)诱导RAW264.7细胞分泌肿瘤坏死因子和IL-6,在抗炎方面也具有不可忽视的作用。但AEBR对哮喘的作用还缺乏深入的研究。本实验将利用鸡卵白蛋白(ovalbumin,OVA)诱导建立小鼠哮喘模型,观察AEBR对哮喘小鼠炎症的影响,确定AEBR的抗哮喘作用及其可能的作用机制。
1 材料与方法
1.1药品、试剂和仪器OVA、氢氧化铝粉(分析纯)(购自美国Sigma公司),IL-4、IL-5、IFN-γ和NF-κB p65(购自美国Cell Signaling公司),Histon和β-actin(购自美国Santa Cruz公司), IL-4、IL-5和IFN-γ ELISA试剂盒(购自美国Invitrogen公司),黑米花色苷(由延边大学药学院提取);402型超声雾化器(上海四菱医疗器械厂生产),RT-2100C酶联免疫检测仪(美国Rayto公司),电泳仪及电泳槽、Western blot转膜仪和Gel Doc凝胶成像仪(Bio Rad公司)。
1.2哮喘模型的建立和动物分组雄性BALB/c小鼠50只,体重(18±5)g,由延边大学医学部实验动物中心提供,合格证号SCXK(吉)2003-000。采用随机数字表法将小鼠分为正常对照组、模型组、AEBR低剂量组、AEBR中剂量组、AEBR高剂量组。除正常对照组外,其余各组小鼠分别于第1、14天腹腔注射50 μg OVA+1 mg氢氧化铝和生理盐水的混合液200 μL。第21天将致敏小鼠置于玻璃罩内,每组以0.1 g OVA+10 mL生理盐水雾化激发30 min,1次/d,共5 d。AEBR低、中、高剂量组分别在激发前灌服黑米花色苷提取物50、150或300 mg/(kg·d),共计7 d。
1.3实验样本获取与处理末次激发48 h后处死小鼠,以磷酸盐缓冲液1 mL行支气管肺泡灌洗,收集支气管肺泡灌洗液(broncho-alveolar lavage fluid,BALF)。血细胞计数仪计细胞总数。然后4 ℃、3 000g离心5 min,取上清液,-80 ℃低温保存,待测细胞因子。离心沉淀涂片后Diff-quik染色,镜下进行细胞分类计数。取右肺下叶,用体积分数10%甲醛溶液固定,石蜡包埋后切片,进行HE染色观察肺部炎症情况。其余各肺叶放入液氮中速冻,-80 ℃保存待用。
1.4细胞核蛋白的萃取参照文献[6]方法,细胞破碎后放入2倍体积的1.3 mol/L蔗糖、1.0 mmol/L MgCl2、10 mmol/L PBS缓冲液(pH=7.2),4 ℃、1 000g离心15 min;沉淀再悬浮于2.2 mol/L蔗糖、1.0 mmol/L MgCl2、10 mmol/L PBS缓冲液(pH=7.2)中,1.0×105g离心1 h;获得的细胞核在0.25 mol/L蔗糖、0.5 mmol/L MgCl2的20 mmol/L Tris-HCl缓冲液(pH=7.2)中清洗,然后1 000g离心10 min;所得沉淀在含有0.3 mol/L蔗糖、50 mmol/L Tris-HCl(pH=7.2)、150 mmol/L NaCl、2 mmol/L EDTA、200 g/L甘油、20 g/L Triton X-100、2 mmol/L PMSF和蛋白酶抑制剂混合物中裂解,冰浴1 h后1.2×104g离心30 min,收集上清液作为可溶性核蛋白进行分析。
1.5肺组织中IL-4、IL-5、IFN-γ和NF-κBp65的Westernbot检测参照文献[7]方法。收集细胞进行裂解获取蛋白,BCA方法测定蛋白浓度,每个泳道加样30 μg总蛋白,在100 g/L SDS-PAGE胶上120 V、90 min进行蛋白分离,分离的蛋白在250 mA、90 min电转移至PVDF膜上,50 g/L脱脂奶粉TBS-T缓冲液孵育1 h封闭膜上非特异性位点,分别加入相应的稀释抗体4 ℃过夜。第2天,洗膜后再用HRP标记的二抗杂交,37 ℃孵育1 h。洗膜后加ECL发光试剂,利用Gel Doc进行图像采集。
1.6BALF中细胞因子IL-4、IL-5和IFN-γ含量的ELISA分析具体操作按试剂盒说明书进行,结果的单位以pg/L表示。
1.7统计学处理采用SPSS 14.0进行分析,应用单因素方差分析和SNK-q检验比较各组BALF中细胞数目和炎症细胞因子水平、小鼠肺组织相关细胞因子和NF-κB p65的变化,检验水准α=0.05。
2 结果
2.1各组小鼠BALF中炎症细胞的变化见图1、表1。Diff-quik染色结果显示,正常组以巨噬细胞为主,偶见淋巴细胞和中性粒细胞;模型组和AEBR低剂量组嗜酸性粒细胞数明显增多,占细胞总数的68%以上;AEBR中、高剂量组嗜酸性粒细胞明显减少,以巨噬细胞为主。各组BALF中细胞变化。与正常对照组比较,模型组BALF中炎症细胞总数和淋巴细胞、中性粒细胞、嗜酸性粒细胞计数明显升高(P<0.05);AEBR中、高剂量组能明显降低哮喘小鼠BALF中炎症细胞总数和淋巴细胞、中性粒细胞、嗜酸性粒细胞数目(P<0.05);单核细胞数目在各组之间无明显变化(P>0.05)。
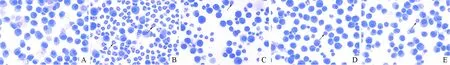
A:正常组;B:模型组;C:AEBR低剂量组;D:AEBR中剂量组;E:AEBR高剂量组;箭头所示为嗜酸性粒细胞图1 各组小鼠BALF中炎症细胞变化(Diff-quik染色,×200)
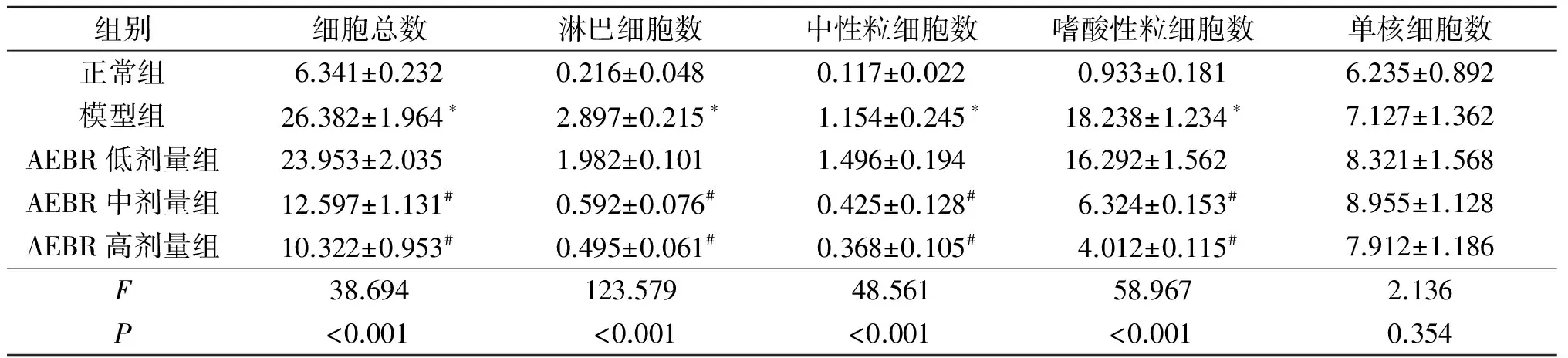
×104/mL
*:与正常组比较,P<0.05;#:与模型组比较,P<0.05
2.2AEBR对BALF中IL-4、IL-5和IFN-γ水平的影响见表2。
2.3AEBR对小鼠肺部炎症的影响见图2。HE染色结果显示,正常对照组气道壁及气道软组织结构完整。模型组和AEBR低剂量组气道黏膜水肿,气道的平滑肌增厚明显,可见气道上皮脱落,在小的气管和血管周围可见大量的炎症细胞浸润,炎症细胞多层围绕着管腔周围。AEBR中、高剂量组气道和血管周围的炎症细胞明显减少,气道平滑肌增生不明显。气道结构性比较完整,结果表明AEBR能够明显抑制哮喘小鼠的肺部炎症。
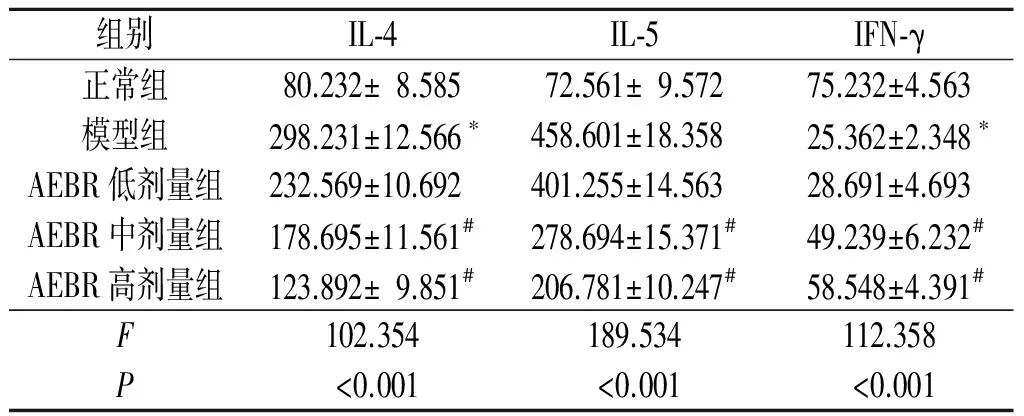
表2 各组小鼠BALF中IL-4、IL-5和IFN-γ水平的变化(n=10) pg/L
*:与正常组比较,P<0.05; #:与模型组比较,P<0.05

A:正常组;B:模型组;C:AEBR低剂量组;D:AEBR中剂量组;E:AEBR高剂量组图2 各组小鼠肺部炎症的变化(SP,×200)
2.4AEBR对肺组织细胞因子IL-4、IL-5、IFN-γ蛋白表达水平的影响见图3、表3。与正常组相比,模型组小鼠肺组织中IL-4、IL-5蛋白表达增高,而IFN-γ蛋白表达降低(P<0.05);AEBR中、高剂量组IL-4、IL-5蛋白表达明显降低,而IFN-γ蛋白表达明显升高(P<0.05)。AEBR低剂量组小鼠肺组织中IL-4、IL-5和IFN-γ蛋白表达水平与哮喘模型组相比差异无统计学意义(P>0.05)。
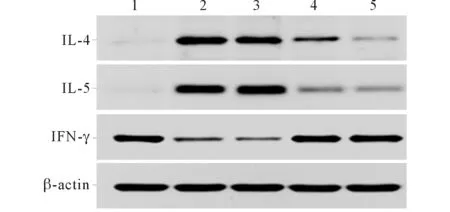
1:正常组;2:模型组;3:AEBR低剂量组;4:AEBR中剂量组;5:AEBR高剂量组图3 各组小鼠肺组织IL-4、IL-5和IFN-γ 蛋白的表达
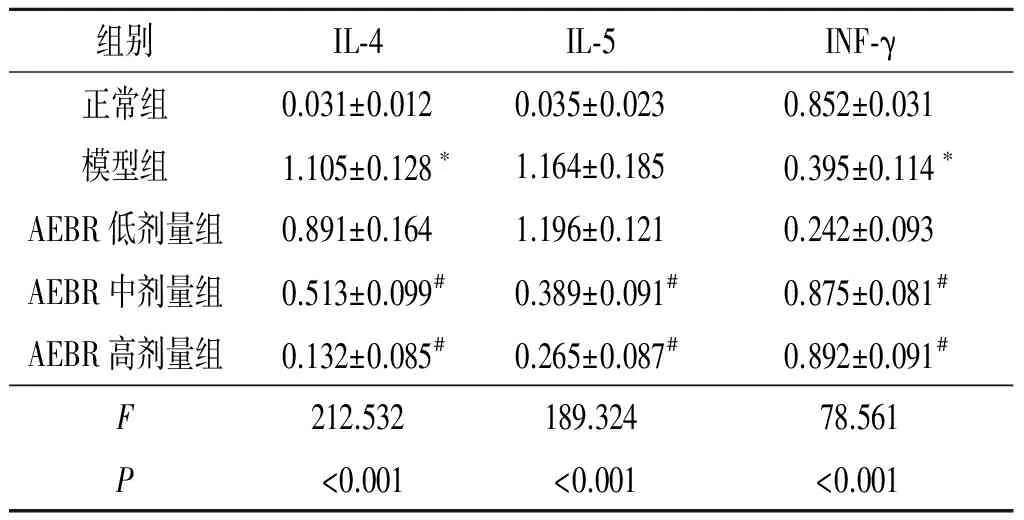
组别IL⁃4IL⁃5INF⁃γ正常组0.031±0.0120.035±0.0230.852±0.031模型组1.105±0.128∗1.164±0.1850.395±0.114∗AEBR低剂量组0.891±0.1641.196±0.1210.242±0.093AEBR中剂量组0.513±0.099#0.389±0.091#0.875±0.081#AEBR高剂量组0.132±0.085#0.265±0.087#0.892±0.091#F212.532189.32478.561P<0.001<0.001<0.001
*:与正常组比较,P<0.05; #:与模型组比较,P<0.05
2.5AEBR对肺组织细胞质和细胞核中NF-κBp65表达的影响图4、表4。与正常组相比,模型组NF-κB p65核转位明显增加,细胞质中NF-κB p65明显减少(P<0.05)。AEBR中、高剂量组NF-κB p65核转位减少,细胞质中NF-κB p65表达明显增加(P<0.05)。AEBR低剂量组细胞质NF-κB p65和细胞核内NF-κB p65表达与哮喘模型组相比差异无统计学意义(P>0.05)。

1:正常组;2:模型组;3:AEBR低剂量组;4:AEBR中剂量组;5:AEBR高剂量组图4 各组小鼠肺组织中NF-κB蛋白的表达
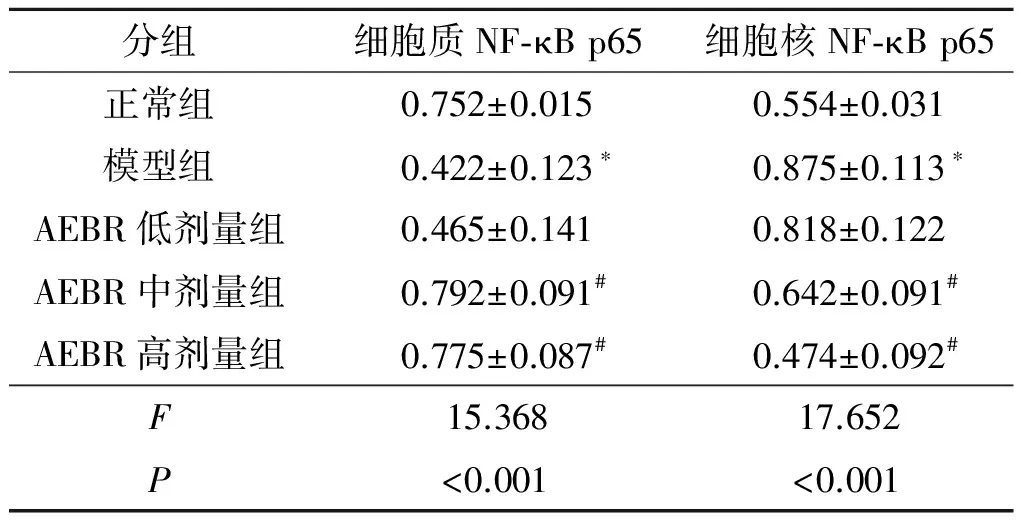
分组细胞质NF⁃κBp65细胞核NF⁃κBp65正常组0.752±0.0150.554±0.031模型组0.422±0.123∗0.875±0.113∗AEBR低剂量组0.465±0.1410.818±0.122AEBR中剂量组0.792±0.091#0.642±0.091#AEBR高剂量组0.775±0.087#0.474±0.092#F15.36817.652P<0.001<0.001
*:与正常组比较,P<0.05; #:与模型组比较,P<0.05
3 讨论
哮喘气道炎症反应机制是复杂的多种炎症细胞反应。在过敏性气道疾病中,嗜酸性粒细胞浸润非常明显,被认为是哮喘的一个标志性病理特征[8-9]。本实验研究发现,给予150和300 mg/kg的AEBR灌胃治疗,能明显降低BALF中嗜酸性粒细胞数,同时细胞总数、中性粒细胞数和淋巴细胞数也明显降低。同时AEBR能明显降低哮喘下滑所的肺部炎症反应,表明AEBR能明显抗哮喘作用。
现在研究[10]普遍认为哮喘发病与Th1/Th2细胞失平衡有关。Th2分泌的细胞因子包括IL-4、IL-5和IL-13等,是体液免疫应答的重要介质,能够诱导IgE产生、促进气道嗜酸性粒细胞的浸润。此外,Th2细胞因子诱导组胺和白三烯释放与AHR相关联。Th1细胞因子如IFN-γ参与细胞免疫反应,这些细胞因子能够对抗Th2介导的免疫反应和减少IgE合成从而抑制哮喘的发生[11]。本实验结果表明,给予150和300 mg/kg的AEBR灌胃后,能明显提高哮喘小鼠肺组织IFN-γ蛋白表达并降低IL-4、IL-5蛋白表达,表明AEBR能够影响IFN-γ、IL-4和IL-5的表达,改变Th1/Th2细胞因子失衡,从而影响哮喘小鼠肺部炎症。暗示AEBR可能通过影响Th1/Th2细胞因子失衡来减轻哮喘小鼠肺部炎症。
NF-κB是非常重要的一种核转录因子,研究[12]表明,当包括T淋巴细胞等炎症细胞的NF-κB被激活后,能明显提高IL-4和IL-5蛋白质表达。本实验结果显示,OVA诱导建立的哮喘模型小鼠肺组织细胞质内NF-κB p65蛋白水平明显降低,而细胞核蛋白中NF-κB p65蛋白水平明显升高,提示哮喘过程中NF-κB被激活,由细胞质转位到细胞核中,启动包括IL-4和IL-5等靶基因的转录。而给予150和300 mg/kg的AEBR灌胃治疗后,AEBR能够提高哮喘小鼠肺组织细胞质内NF-κB p65的表达,减少了哮喘小鼠细胞核内的NF-κB p65的表达。提示AEBR能够抑制哮喘过程中NF-κB的活化,阻止NF-κB向细胞核内转位、抑制NF-κB p65活化转录功能,直接或间接影响Th1/Th2细胞因子失衡。
综上所述,AEBR能抑制哮喘小鼠气道和肺部炎症细胞浸润,AEBR的抑制哮喘炎症作用机制可能是通过抑制NF-κB活化从而影响Th1/Th2细胞因子失衡。
[1] GALLI SJ,TSAI M,PILIPONSKY AM.The development of allergic inflammation[J].Nature,2008,454(7203):445
[2] PELAIA G,VATRELLA A,BUSCETI MT,et al.Molecular and cellular mechanisms underlying the therapeutic effects of budesonide in asthma[J].Pulm Pharmacol Ther,2016,40:15
[3] HUANG X,TANG L,WANG F,et al.Astragaloside IV attenuates allergic inflammation by regulation Th1/Th2 cytokine and enhancement CD4(+)CD25(+)Foxp3 T cells in ovalbumin-induced asthma[J].Immunobiology,2014,219(7):565
[4] 李良昌,延光海,秦向征,等.黑米花色苷提取物对大鼠抗过敏作用[J].中国公共卫生,2011,27(5):613
[5] LIMTRAKUL P,YODKEEREE S,PITCHAKARN P,et al.Suppression of inflammatory responses by black rice extract in RAW 264.7 macrophage cells via downregulation of NF-kB and AP-1 signaling pathways[J].Asian Pac J Cancer Prev,2015,16(10):4277
[6] LI LC,PIAO HM,ZHENG MY,et al.Sesamin attenuates mast cell-mediated allergic responses by suppressing the activation of p38 and nuclear factor-kappa B[J].Mol Med Rep,2016,13(1, A):536
[7] 李良昌,金光玉,郑明昱,等.Rottlerin在哮喘气道重塑模型中对PKC-δ/mTOR/NF-κB信号通路的影响[J].免疫学杂志,2013,29(7):588
[8] VENGE P.The eosinophil and airway remodelling in asthma[J].Clin Respir J,2010,4(Suppl 1):15
[9] WEGMANN M.Targeting Eosinophil Biology in Asthma Therapy[J].Am J Respir Cell Mol Biol,2011,45(4):667
[10]BAE H,PARK N,KIM Y,et al.The modulative effect of Cyperi Rhizoma on Th1/Th2 lineage development[J].Cytokine,2010,51(3):259
[11]ORSATTI CL,MISSIMA F,PAGLIARONE AC,et al.Th1/Th2 cytokines' expression and production by propolis-treated mice[J].J Ethnopharmacol,2010,129(3):314
[12] WANG J, FU Y, WEI Z,et al. Anti-asthmatic activity of osthole in an ovalbumin-induced asthma murine model[J].Respir Physiol Neurobiol,2017,239:64