RNAi沉默Nrf2基因增强煤焦沥青烟提取物对BEAS-2B细胞的毒性作用
2018-02-05曹会敏玉崧成冯斐斐吴拥军
曹会敏,倪 静,玉崧成,冯斐斐,吴拥军
郑州大学公共卫生学院卫生毒理学教研室 郑州 450001
多环芳烃类混合物(polycyclicaormatic hydorcarbons, PAHs)是煤焦沥青(coal tar pitch,CTP)的主要成分,长期接触大量PAHs,可产生多种损伤,如氧化应激、加合物形成、微核率增加[1]、炎性反应等,最终引起癌症或其他疾病[2]。接触CTP早期可致肺部的炎症反应,长期刺激可诱导细胞发生恶性转化、引发肺癌[3]。而人体持续暴露于内源性或外源性的氧化剂或亲电子剂化学物,使机体内活性氧或活性氮升高,破坏机体的氧化还原平衡,导致细胞结构损伤(包括脂肪、蛋白质和核酸),引起慢性炎症[4-5],继而引发一系列疾病,如癌症、心血管疾病、神经性病变、炎性疾病等[6-7]。细胞可通过各种修复和抗氧化防御机制抵抗各种氧化刺激[8]。研究[9]表明,转录因子E2相关因子2(Nrf2)可以保护细胞和器官免受多种多样的毒性损伤。醌氧化还原酶1[NAD(P)H quinone dehydrogenase 1, NQO1]在调节细胞内氧化还原状态方面具有重要作用[10]。Logsdon等[11]研究发现,在人胰腺癌细胞中NQO1的表达是正常组织细胞的12倍,认为NQO1是胰腺癌的生物学标志物。其他研究[12-13]发现NQO1在肺癌、乳腺癌等肿瘤细胞中也处于异常高表达状态,且与Nrf2通路其他下游靶向基因的表达水平保持一致。Nrf2基因缺乏小鼠表现出对肿瘤基因的高度灵敏性[14],在肺癌中发现Nrf2基因的异常,而该变化能对化学治疗与放射治疗产生抵抗作用[15-16],且有利于肿瘤的生长,影响预后。因此,深入了解Nrf2在细胞保护中的调节作用可以对肺癌的发生机制及新型的抗肿瘤药物的探索提供线索。该研究应用RNA干扰技术(RNA interfering, RNAi)沉默BEAS-2B细胞中Nrf2基因的表达,建立Nrf2基因沉默稳定表达株,并利用煤焦沥青烟提取物(coal tar pitch smoke extract,CTPE)作为诱导剂,体外建立BEAS-2B细胞恶性转化模型,动态观察不同代次细胞中Nrf2基因及蛋白的表达,探讨CTPE可能的致癌机制以及Nrf2在致细胞发生恶性改变过程中的作用,为探索肺癌的发生机制提供线索。
1 材料与方法
1.1主要试剂与细胞CTPE由中国铝业股份有限公司河南分公司提供;G418、琼脂糖(美国Invitrogen公司);定量PCR试剂盒、反转录试剂盒[宝生物工程(大连)有限公司];兔抗Nrf2、NQO1、β-actin一抗和辣根过氧化物酶标记的羊抗兔-IgG(英国Abcam公司)。BEAS-2B细胞由郑州大学特聘教授吴卫东老师馈赠,用含体积分数12%胎牛血清的RPMI 1640完全培养基,常规培养于体积分数5% CO2、37 ℃饱和湿度的恒温培养箱中培养。倒置显微镜下观察细胞融合至90%时传代。
1.2RNAi沉默Nrf2细胞的建立筛选BEAS-2B细胞株对氨基糖苷类抗生素G418最低耐受浓度;对GenBank 上公布的人 Nrf2核苷酸序列设计4条RNA抑制靶序列(分别标记Nrf2-1、Nrf2-2、Nrf2-3、Nrf2-4),1条阴性对照序列(记为shNC)及1条阳性对照序列(记为shGAPDH)进行RNAi-Mate转染,筛选出沉默Nrf2基因的最佳序列,荧光显微镜观察及RT-PCR验证其结果。利用最佳浓度的G418筛选细胞转染si-Nrf2重组质粒,将细胞分为目的基因实验组、空白对照组、G418对照组和转染试剂对照组。由RT-PCR测定Nrf2 mRNA相对表达量,将稳定转染的细胞移至细胞培养瓶中继续培养并冻存。
1.3细胞染毒及恶性转化细胞株的建立当BEAS-2B细胞生长融合至70%左右时,PBS冲洗2遍,更换新的完全培养基5 mL,将细胞分为二甲基亚砜(DMSO)阴性对照组、B(a)P阳性对照组、CTPE染毒组和Nrf2转染组。分别吸取10 μL的DMSO 溶液、以10 μL 2.5g /L DMSO为溶剂配制的B(a)P母液、7.5 μL 2 g/L的CTPE,加入到5 mL新鲜完全培养基充分混合的溶液,反复吹打使培养基与该染毒物充分混匀后处理上述分组的细胞。24 h后常规传代培养,如此反复3次,最后一次染毒结束后首次传代定为第1代。Nrf2转染组在传代过程中每隔5代进行一次转染,并一直应用半数抑制浓度60%的G418完全培养基维持。
1.4软琼脂克隆形成实验用3 g/L胰蛋白酶消化对数生长期细胞,并用含体积分数20%胎牛血清的RPMI-1640培养基轻轻吹打,使之成为单细胞,用PBS制备12和7 g/L 2个质量浓度的低熔点琼脂糖液,按11(体积比)比例使12 g/L的琼脂糖和2×培养基(含有2×抗生素和体积分数20%的小牛血清)混合后,6孔板中每孔注入2 mL作底层琼脂,置于CO2培养箱中;按11比例使7 g/L的琼脂糖和2×培养基在15 mL离心管中混匀,再向管中加入单细胞悬液0.2 mL,吹打混匀,缓慢注入铺有12 g/L琼脂糖的6孔板中,琼脂凝固后,每孔加入完全培养基2 mL,置CO2温箱中培养10~14 d;于倒置显微镜下观察计数,观察克隆形成率。
1.5各组细胞mRNA的提取和Nrf2和NQO1的RT-PCR检测各组转染细胞培养24~48 h后提取细胞总RNA,细胞总RNA的提取严格按照RNAiso Plus试剂说明书进行,引物寡核苷酸序列参照GenBank中Nrf2和NQO1的DNA序列,委托宝生物工程(大连)有限公司设计并合成,以GAPDH作内参照。同一样本均设3个平行样,PCR仪自动绘制扩增曲线和溶解曲线。反应程序设定:预变性95 ℃,10 min,然后95 ℃,5 s;55 ℃,15 s;72 ℃,15 s,扩增20~30个循环。溶解曲线程序设定:95 ℃,1 min;55 ℃,30 s;95 ℃,30 s,1个循环。采用2-ΔΔCt法计算目的基因在各组细胞中的相对表达量。
1.6各组细胞中Nrf2和NQO1蛋白表达的Westernblot检测各组细胞按试剂盒说明书提取细胞总蛋白,各组标本加入蛋白上样缓冲液行SDS-PAGE电泳、转膜、封闭、一抗孵育、二抗孵育、ECL发光显色。采用KONDA2000凝胶成像系统成像,用 GENESNAP 软件统计各条带灰度值,以GAPDH为内参照,计算目的基因与内参照吸光度的相对比值。
1.7统计学处理采用SPSS 21.0进行分析,应用单因素方差分析和LSD-t检验比较各组细胞克隆形成率、不同代次各组细胞中Nrf2、NQO1 mRNA和蛋白表达的差异,检验标准α=0.05。
2 结果
2.1Nrf2抑制基因的筛选及细胞转染成功的验证结果见图1。 倒置显微镜下观察细胞形态及生长情况,第1天各孔细胞生长良好,形态正常;第7天浓度为400 mg/L的孔中细胞密度低于50%;第13天细胞全部凋亡、脱壁;因此400 mg/L为G418最佳筛选浓度。Nrf2-1组(0.150±0.009)、Nrf2-2组(0.345±0.014)、Nrf2-3组(0.414±0.016)、Nrf2-4组(0.237±0.014)Nrf2 mRNA表达水平均明显低于阴性对照组(1.001±0.107),差异均有统计学意义(F=149.399,P<0.001),Nrf2-1组与阳性对照组(0.144±0.015)比较,差异无统计学意义(P>0.05);故选Nrf2-1组为RNAi最佳序列。转染的细胞经传代培养后,siRNA组(0.147±0.002)Nrf2 mRNA相对表达水平明显低于空白对照(1.026±0.297)、G418对照组(0.993±0.032)和转染试剂对照组(1.211±0.085),差异均有统计学意义(F=28.291,P<0.001)。
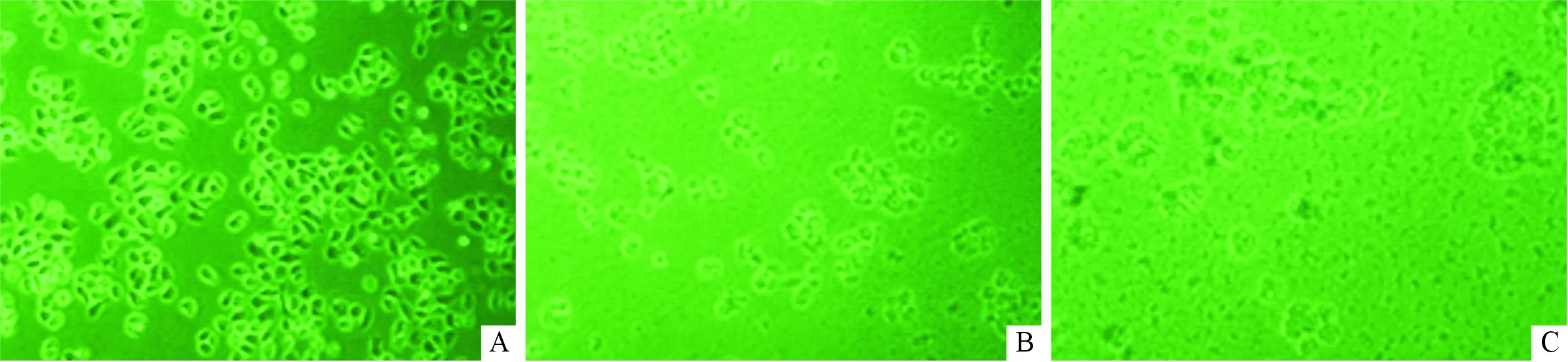
A:400 mg/L G418处理1 d后;B:400 mg/L G418处理7 d后;C:400 mg/L G418处理13 d后图1 G418处理BEAS-2B细胞不同时期细胞形态变化(×100)
2.2软琼脂克隆形成实验见表1。
2.3不同代次各组细胞中Nrf2、NQO1mRNA的表达情况见表2。

表1 各组细胞克隆形成率比较(n=3)
*:与DMSO组比较,P<0.001,#:与B(a)P组比较,P<0.001,▲:与CTPE组比较,P<0.001
2.4不同代次各组细胞中Nrf2、NQO1蛋白的表达情况见图2及表3。诱导后(CTPE组)第10代、20代、30代细胞中Nrf2与NQO1的蛋白表达呈正相关(rS=0.913,P<0.001)。
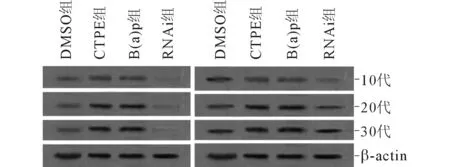
图2 不同代次各组 细胞中Nrf2(左)、NQO1(右)蛋白的表达

基因组别10代20代30代FPNrf2DMSO组1.001±0.1071.000±0.0320.998±0.0220.0020.988B(a)P组1.097±0.0451.260±0.1051.279±0.0814.5800.062CTPE组1.090±0.0221.248±0.0911.264±0.1612.3550.176RNAi组0.151±0.0090.139±0.0130.144±0.0081.0490.407F169.125164.980103.038P<0.001<0.001<0.001NQO1DMSO组1.003±0.0290.970±0.0451.003±0.0500.6040.577B(a)P组2.373±0.0583.056±0.3003.374±0.31612.1900.008CTPE组2.167±0.2323.461±0.1663.512±0.23338.582<0.001RNAi组1.147±0.0461.272±0.0131.566±0.18111.8230.008F97.481144.544101.924P<0.001<0.001<0.001

表3 不同代次各组细胞中Nrf2、NQO1蛋白的表达情况(n=3)
3 讨论
环境中毒物的种类众多,如空气污染物、有机溶剂、金属和类金属等,其中,多数毒物均可引起机体的氧化应激反应。为应对外来有毒化学物质对机体的损害,哺乳动物在不断进化过程中体内逐渐形成了一套复杂的抗氧化应激系统。而 Nrf2是经典的调控机体抗氧化应激反应的关键因子,Nrf2在激活后可诱导抗氧化蛋白的表达,提高机体的抗氧化应激能力,在保护细胞和组织免受活性氧自由基损害中起着重要的作用[17-18]。研究[19]发现,应用致癌物4-硝基喹啉-1-氧化物(4-Nitroquinoline 1-oxide, 4NQO)诱导Nrf2基因敲除(Nrf2-KO)小鼠和野生型小鼠癌变过程中,与野生型小鼠相比,Nrf2-KO小鼠对4NQO更加敏感,更容易患口腔癌和食管癌,说明了Nrf2在癌症预防方面的重要性。本研究采用RNAi技术建立Nrf2沉默的BEAS-2B细胞稳定表达株。siRNA组Nrf2 mRNA相对表达水平明显低于空白对照、G418对照组和转染试剂对照组,说明成功进行了细胞转染。在经CTPE刺激后的传代过程中,RNAi组从20代起软琼脂克隆形成率就显著高于CTPE组和B(a)P组,说明Nrf2沉默增强了CTPE诱导的细胞毒性作用,使细胞恶变提前发生,提示Nrf2在预防癌症发生过程中具有重要作用,与文献[19]的研究结果一致。RT-PCR及Western blot检测结果显示,随传代次数增加,B(a)P组和CTPE组Nrf2 mRNA及蛋白表达逐渐升高,而DMSO组Nrf2 mRNA虽然能检测到,但Nrf2蛋白却几乎检测不到,提示Nrf2蛋白在正常生理状态下被迅速泛素化而降解,以维持机体内环境的稳定,而当受CTPE刺激后,Nrf2稳定性及含量均增加,在CTPE诱导BEAS-2B细胞发生恶变中发挥保护作用。而第10代细胞各组间克隆形成率差异无统计学意义,说明在细胞癌前病变阶段Nrf2即有了较明显的表达特点,其可能是焦炉工等罹患肺癌的早期生物标志。有研究[16, 20]显示,尽管Nrf2表现出对肿瘤基因的抵制作用,但是Nrf2 水平的升高却表现出对肿瘤细胞的保护作用并影响预后,且肺癌上皮间质转化后可能通过Nrf2通路介导了癌细胞的多药耐药性[21]。后期实验将继续探讨Nrf2对CTPE所致BEAS-2B细胞恶性转化后细胞的生长与增殖的影响。
NQO1是一种重要黄素腺嘌呤二核苷酸依赖的黄素蛋白酶类,能够调控磺胺类、苯醌类以及多环芳烃类化合物等的代谢,具有多重细胞保护作用。B(a)P作用于小鼠主动脉内皮细胞后,可以通过增强Sp1-AhR-Nrf2信号级联反应使过氧化氢酶过度表达从而上调NQO1的表达[22]。Kim等[23]研究发现,NQO1在肺癌尤其是肺鳞癌的发生发展过程中起着重要作用,而且吸烟与NQO1的相关性是肺癌的危险因素。作者分别采用RT-PCR和Western blot检测NQO1 mRNA和蛋白的表达水平,发现在细胞第10代、20代、30代均表现为B(a)P组和CTPE组表达量高于DMSO组,且随传代次数增加,B(a)P组、CTPE组和RNAi组的表达量均逐渐升高,且NQO1和Nrf2的蛋白表达呈正相关;另外RNAi组NQO1的表达量低于CTPE组,提示CTPE刺激细胞后,Nrf2可参与NQO1的调控来保护细胞。研究[24]发现,Keap1-Nrf2/ARE通路调控NQO1的表达对肺癌的发生发展具有重要的作用。但RNAi组在细胞传代过程中NQO1表达量也呈上升趋势,提示在CTPE诱导BEAS-2B细胞发生恶性转化过程中NQO1并非仅受Nrf2调控。
综上所述,Nrf2在CTPE诱导BEAS-2B细胞发生恶变过程中是抑癌基因;且NQO1和Nrf2蛋白表达呈正相关,表明Nrf2可能通过上调 NQO1的表达对抗CTPE对BEAS-2B细胞的毒性作用,发挥细胞保护功能。而且NQO1与Nrf2均具有在细胞形态学发生变化但未发生癌变时表达量即明显增加的特点,说明在癌前病变阶段两者即发生变化以应对CTPE对细胞的毒性作用,可能有助于接触CTPE高危人群罹患肺癌的预警及筛查。
[1] 张笑,关蕾,黄坤,等.外周血淋巴细胞微核率对多环芳烃接触工人早期健康监护的意义[J].中华劳动卫生职业病杂志,2012,30(12):968
[2] FENG FF,YANG YL,LI ZT,et al.Changes in telomere length and telomerase activity in human bronchial epithelial cells induced by coal tar pitch extract[J].Toxicol Res (Camb),2015,4(6):1535
[3] 宋金燕,冯亚男,杜丽鹏,等.煤焦沥青烟提取物诱导人支气管上皮细胞发生炎性凋亡的研究[J].中华劳动卫生职业病杂志,2013,31(1):53
[4] ANDREOLI R,PROTANO C,MANINI P, et al. Association between environmental exposure to benzene and oxidative damage to nucleic acids in children[J].Med Lav,2012,103(5):324
[5] JUNG MH,KIM HR,PARK YJ, et al.Genotoxic effects and oxidative stress induced by organic extracts of particulate matter (PM10) collected from a subway tunnel in Seoul, Korea[J].Mutat Res,2012,749(1/2):39
[6] GORUDKO IV,KOSTEVICH VA,SOKOLOV AV,et al.Functional activity of neutrophils in diabetes mellitus and coronary heart disease: role of myeloperoxidase in the development of oxidative stress[J].Bull Exp Biol Med,2012,154(1):23
[7] GOLDSCHMIDT R,ARCE PM,KHDOUR OM,et al.Effects of cytoprotective antioxidants on lymphocytes from representative mitochondrial neurodegenerative diseases[J].Bioorg Med Chem,2013,21(4):969
[8] SEN S,CHAKRABORTY R,SRIDHAR C, et al. Free radicals, antioxidants, diseases and phytomedicines:current status and future prospect[J].IJPSRR,2010,3(3):91
[9] AHMED A. Review of NRF2-regulated genes induced in response to antioxidants[J].JMRHS,2014,3(2):428
[10]LI Z, ZHANG Y,JIN T, et al. NQO1 protein expression predicts poor prognosis of non-small cell lung cancers[J]. BMC Cancer,2015,15:207
[11]LOGSDON CD,SIMEONE DM,BINKLEY C,et al.Molecular profiling of pancreatic adenocarcinoma and chronic pancreatitis identifies multiple genes differentially regulated in pancreatic cancer[J].Cancer Res,2003,63(10):2649
[12]GLORIEUX C,SANDOVAL JM,DEJEANS N,et al.Overexpression of NAD(P)H:quinone oxidoreductase 1 (NQO1) and genomic gain of the NQO1 locus modulates breast cancer cell sensitivity to quinones[J].Life Sci,2016,145:57
[13]MADAJEWSKI B,BOATMAN MA,CHAKRABARTI G, et al.Depleting tumor-NQO1 potentiates anoikis and inhibits growth of NSCLC[J].Mol Cancer Res,2015,14(1):14
[14]CHEUNG KL,LEE JH,KHOR TO,et al.Nrf2 knockout enhances intestinal tumorigenesis in apcmin mice due to attenuation of anti-oxidative stress pathway while potentiates inflammation[J].Mol Carcinog,2014,53(1):77
[15]JI L,LI H,GAO P,et al.Nrf2 pathway regulates multidrug-resistance-associated protein 1 in small cell lung cancer[J].PLoS One,2013,8(5):e63404
[16]KAWASAKI Y,OKUMURA H,UCHIKADO Y,et al.Nrf2 is useful for predicting the effect of chemoradiation therapy on esophageal squamous cell carcinoma[J].Ann Surg Oncol,2014,21(7):2347
[17]曹惠敏,余刚.Nrf2在阿尔茨海默病中的研究现状[J].生物化学与生物物理进展,2015,42(6):533
[18]聂慧芳,李冰.核转录因子Nrf2信号通路在环境毒物暴露中的作用研究进展[J].环境与健康杂志,2015,32(2):179
[19]OHKOSHI A,SUZUKI T,ONO M, et al.Roles of Keap1-Nrf2 system in upper aerodigestive tract carcinogenesis[J].Cancer Prev Res,2013,6(2):149
[20]KANAMORI M,HIGA T,SONODA Y,et al.Activation of the NRF2 pathway and its impact on the prognosis of anaplastic glioma patients[J].Neuro Oncol,2015,17(4):555
[21]崔小川,丁军利,万小蔹,等.肺癌上皮间质转化后引发Nrf2介导的多药耐药的研究[J].肿瘤防治研究,2015,42(5):432
[22]LIN X,YANG H,ZHOU L, et al.Nrf2-dependent induction of NQO1 in mouse aortic endothelial cells overexpressing catalase[J].Free Radic Biol Med,2011,51(1):97
[23]KIM JH,HONG YC.Interactive effect of smoking and NQO1 haplotypes on lung cancer risk[J].J Korean Med Sci,2015,30(3):221
[24]倪静,秦丽娟,吴拥军,等.肺癌组织中Nrf2、Keap1和NQO1蛋白的表达[J].郑州大学学报(医学版),2012,47(4):456