酵母培养物添加方式对哺乳期犊牛生长性能、粪便菌群及血清免疫指标的影响
2018-01-30徐晓锋金亚东张力莉张珠明
徐晓锋, 金亚东, 张力莉, 王 芬, 张珠明
(1.宁夏大学农学院,宁夏银川 750021;2.北京英惠尔生物科技有限公司,北京海淀 100083)
有研究发现,给反刍动物饲喂酵母培养物会降低其粪便中大肠杆菌的数量,增加有益菌群的数量,并且越早的饲喂动物酵母培养物,越有利于酵母培养物作用的发挥 (Swyers等2014)。另外,研究表明,饲喂酵母培养物能够提高动物的采食量,增强机体免疫力等(Gerritsen等,2012)。本文旨在研究酵母培养物不同添加方式对犊牛生长性能、粪便菌群以及机体免疫力的影响,从而为实际生产养殖提供理论依据,以期通过营养调控与饲养管理来实现对哺乳期犊牛以及后备牛培育质量的提升。
1 材料与方法
1.1 试验动物与设计 本试验于2015年9~11月份,在宁夏平吉堡奶牛场进行。采用单因素试验设计,按出生日龄、体重相近原则选择28头健康状况良好的荷斯坦公犊牛,随机分为4组,每组7个重复,Ⅰ组为对照组,饮用乳及日粮中均不添加酵母培养物;Ⅱ组在饮用乳中添加20 g酵母培养物,日粮中不添加酵母培养物;Ⅲ组在日粮中添加20 g酵母培养物,饮用乳中不添加酵母培养物;Ⅳ组在饮用乳和日粮中各添加10 g酵母培养物。
酵母培养物由北京英惠尔生物科技股份有限公司提供。
1.2 饲养管理 犊牛出生后及时清除全身黏液,并对其进行断脐和脐带药浴消毒。在犊牛出生2 h内,按其体重的8%饲喂初乳。待其可以站立后,将其移入1.5×3.0 m2犊牛岛内。每天分两次饲喂混合牛乳,分别为早上7:00和下午6:00。各组犊牛的牛乳饲喂量一致,1周龄4 kg/d·头;2周龄 5 kg/d·头;3周龄 6 kg/d·头;4 ~ 8周龄 7 kg/d·头。开食料及饮水任其自由采食。试验于第7天正式开始,整个试验周期为56 d,整个试验期内定期对犊牛岛进行消毒处理。开食料组成及营养水平见表1。
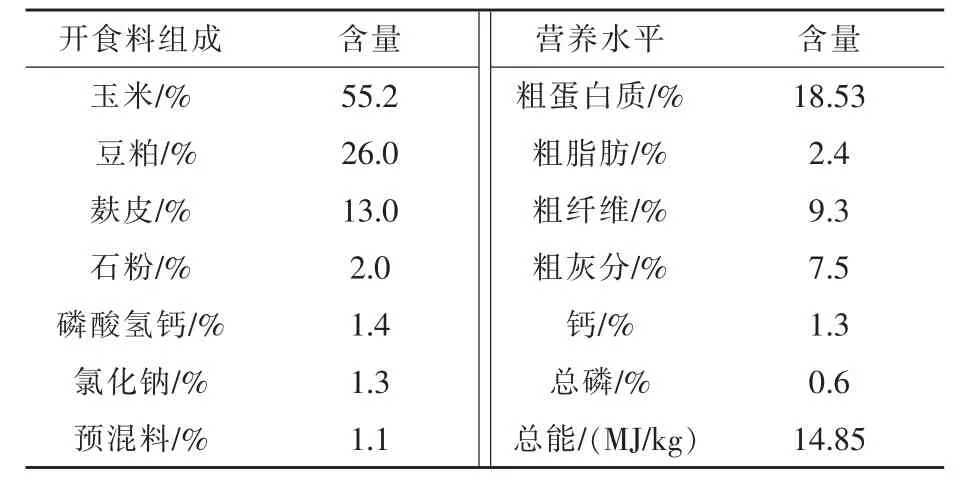
表1 开食料组成及营养水平(风干基础)
1.3 测定指标和方法
1.3.1 生长性能统计 分别于试验第0、21、42、56天晨饲前测定各组犊牛的体重;同时在当天测定每头犊牛的胸围、体斜长和体高,用以计算体躯指数和体长指数,计算公式如下:
体长指数/%=体斜长/体高×100;体躯指数/%=胸围/体斜长×100。
每天统计每头牛的采食量;并分别记录各组犊牛腹泻头数以及腹泻天数,用以计算每组犊牛的腹泻指数,计算公式如下:
腹泻指数=(腹泻头数×腹泻天数)/(试验天数×试验头数)。
1.3.2 直肠大肠杆菌和双歧杆菌数量的测定在犊牛21日龄和56日龄,分别从每组选取3头犊牛,用无菌塑料小勺从犊牛直肠内取其粪便,装入无菌试管中,并立即封口,在30 min内带回实验室进行检测。在无菌操作环境内,分别取粪样1 g,装入盛有9 mL生理盐水的无菌稀释管中,在漩涡振荡器上振荡2~3 min,将其配制成1∶10的匀浆稀释液;用移液枪取该匀浆液1 mL加入盛有9 mL生理盐水的稀释管内,用漩涡振荡器振荡1~2 min,配制成10-2的稀释液,再按照上述方法配制10-3~10-5的稀释液备用。
选取适宜的稀释度,分别涂布在伊红美蓝选择性培养 (EMB)和双歧杆菌选择性培养基(BBL)表面(两种培养基均购自青岛高科园海博生物技术有限公司),每个梯度做3个平行。将接种过的大肠杆菌培养皿倒置放入37℃恒温培养箱中,在有氧环境下培养24 h;双歧杆菌采用李伏夫法,在37℃恒温培养箱中连续培养72 h。以1 g肠道内容物中细菌个数的对数 (lg cfu/g)来表示粪便中细菌数量。
1.3.3 血清样品采集与指标测定 分别与试验的第21天以及第56天晨饲前用含肝素钠的真空采血管颈静脉采血5 mL,室温下静置30 min,然后3000 r/min离心15 min,取血清装入1.5 mL的冻存管中,-20℃下保存备测血清中IgA、IgG、IgM、IL-1β和TNF-α的浓度。血清中各免疫指标浓度的测定,均采用牛免疫球蛋白双抗一步夹心ELISA法,并严格按照试剂盒说明书上的操作步骤进行规范操作,所有试剂盒均够自南京建成生物工程研究所。
1.4 统计分析 用Excel 2007对数据进行基本的分类统计,然后用SAS 8.0软件对数据进行深度分析。以P<0.05作为差异显著的判断标准,结果以“平均值±标准差”来表示。
2 结果与分析
2.1 酵母培养物对犊牛生长性能的影响
2.1.1 酵母培养物对犊牛体尺指数的影响 由表2可知,在整个试验周期内,犊牛体躯指数的组间差异不显著(P>0.05);并且犊牛体躯指数的变化不受试验天数的影响(P>0.05)。而犊牛体长指数则随着试验天数的延长而增加,天数对犊牛体长指数的增加有显著的影响 (P<0.05);但各处理组间的体长指数差异不显著(P>0.05)。试验后期,试验组的体长指数较对照组均有一定的增加,但差异不显著(P>0.05)。表明添加酵母培养物对提高犊牛的体长指数有一定的作用。
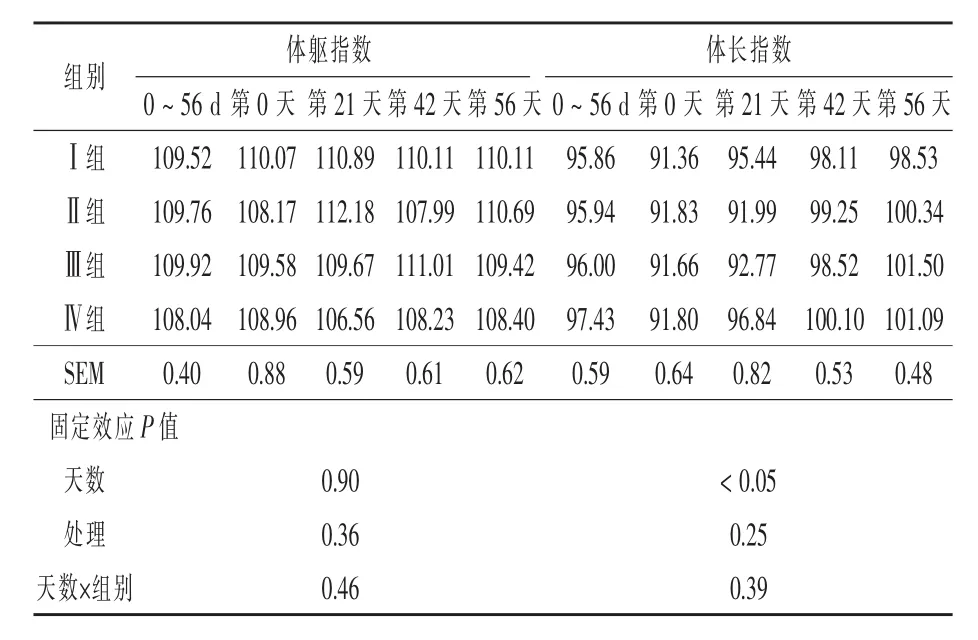
表2 酵母培养物对犊牛体尺指数的影响
2.1.2 酵母培养物对犊牛采食量、日增重和饲料转化效率的影响 由表3可知,在0~21 d这一阶段,各试验组ADMI量均高于对照组,但差异不显著(P>0.05);而ADG除Ⅱ组高于Ⅰ组外,Ⅲ组和Ⅳ组均低于Ⅰ组,各处理组间差异不显著(P>0.05);此阶段的F/G则是以Ⅱ组为最低,Ⅰ组次之,各处理组间差异不显著(P>0.05)。在22~42 d这一阶段,各试验组ADMI和ADG均高于对照组,但差异不显著(P>0.05);此阶段的F/G则是以Ⅳ组为最低,Ⅱ组次之,各试验组F/G均低于Ⅰ组,但差异不显著(P>0.05)。在43~56 d这一阶段中,各试验组ADMI均高于Ⅰ组,但差异不显著(P>0.05);除Ⅳ组外,此阶段各试验组ADG均高于Ⅰ组,但差异不显著(P>0.05);此阶段,各试验组F/G均低于Ⅰ组,各处理组间差异不显著(P>0.05)。在整个试验周期内,各试验组ADMI分别比对照组提高8.95%、15.19%和10.89%(P>0.05);各试验组ADG分别比对照组提高24.83%、21.48%和19.46%(P>0.05), 各试验组F/G分别比对照组降低12.00%、5.33%和8.00%(P > 0.05)。
2.2 酵母培养物对犊牛粪便中细菌数量的影响由表4可知,在试验第21天时,Ⅱ、Ⅲ、Ⅳ组粪样中的大肠杆菌的数量显著低于Ⅰ组(P<0.05),3个试验组中大肠杆菌数以Ⅱ组为最低,各试验组大肠杆菌数无显著差异(P>0.05);Ⅱ、Ⅲ、Ⅳ组粪样中双歧杆菌的数量显著高于Ⅰ组 (P<0.05),各试验组双岐杆菌数无显著差异 (P>0.05),但Ⅱ组的双歧杆菌数在3个试验组中为最高。在试验第55天,Ⅱ、Ⅲ、Ⅳ组粪样中双歧杆菌的数量略高于Ⅰ组,但无显著差异 (P>0.05);而粪样中大肠杆菌数则是Ⅰ组最高,且显著高于试验Ⅱ组(P<0.05),各试验组间大肠杆菌数差异不显著(P>0.05)。整个试验周期内,试验组犊牛腹泻指数分别比对照组降低88.89%、78.89%和83.33%。
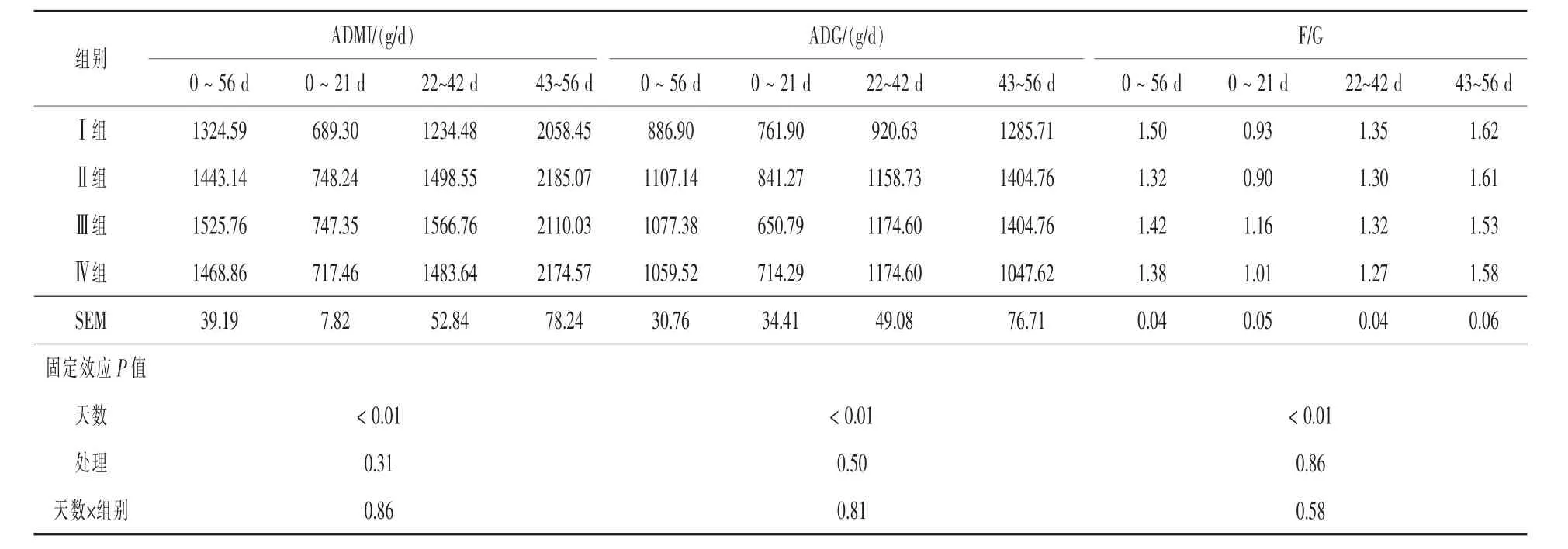
表3 酵母培养物对犊牛平均日增重、采食量和料重比的影响
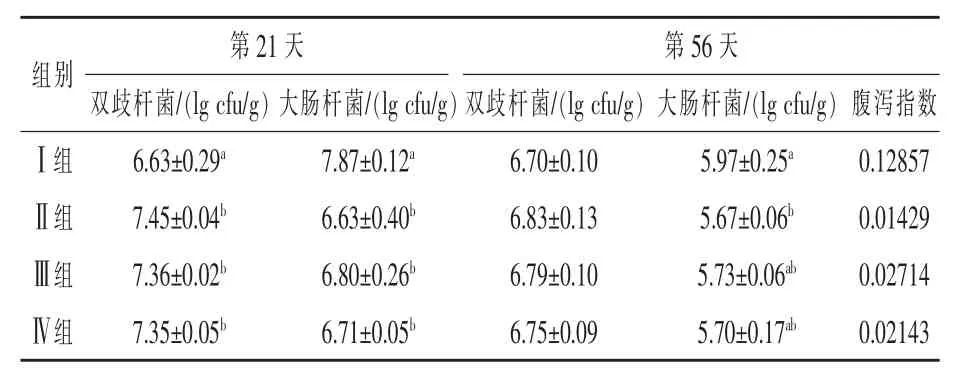
表4 酵母培养物对犊牛粪便微生物菌群的影响
2.3 酵母培养物对犊牛血清免疫指标的影响由表5可知,在试验开始的第21天,各试验组犊牛血清中IgA的浓度均高于Ⅰ组 (P<0.05),且各试验组间差异均不显著(P>0.05);与Ⅰ组相比,试验组IgA的浓度分别提高22.23%、10.12%、9.52%。血清中IgM的变化规律与IgA一致;与Ⅰ组相比,各试验组IgM的浓度分别提高18.21%、9.59%、6.14%(P< 0.05)。在试验的第21天,各试验组犊牛血清中IgM的浓度均高于Ⅰ组,且Ⅱ组和Ⅳ组血清中IgM的浓度显著高于Ⅰ组(P<0.05),而Ⅲ组血清中IgM的浓度与Ⅰ组差异不显著 (P>0.05);各试验组血清中IgM的浓度分别比Ⅰ组提高21.05%、3.07%、9.81%。各试验组血清中IL-1β的浓度均高于Ⅰ组,且差异显著(P<0.05);Ⅱ组与Ⅲ组和Ⅳ组间差异不显著(P>0.05),但Ⅲ组和Ⅳ组间的差异显著 (P<0.05);各试验组分别比对照提高24.02%、32.90%、22.13%。各处理组间血清中TNF-α的浓度无显著差异;各试验组TNF-α浓度分别比Ⅰ组提高10.14%、15.31%、15.31%。
在试验开始的第55天,各处理组血清中I-gA、IgM、IgG和IL-1β浓度之间的差异不显著;且Ⅱ组和Ⅲ组IgA、IgM、IgG和IL-1β均高于Ⅰ组;而Ⅳ组除IgA浓度比Ⅰ组高外,其IgM和IgG浓度分别比Ⅰ组降低0.23%和3.05%。试验组血清中TNF-α的浓度均低于Ⅰ组,各试验组间差异不显著(P>0.05);Ⅰ组与Ⅱ组和Ⅲ组间差异显著 (P<0.05);与Ⅰ组相比,各试验组TNF-α的浓度分别降低10.18%、9.92%、7.58%。
3 讨论
3.1 酵母培养物对犊牛生长性能的影响 体躯指数是用来反映躯体容量的相对发育情况,而体长指数是用来反映体格长度和高度的相对发育情况。体长指数以及体躯指数主要受遗传因素的影响,但后天管理水平对其也有一定程度的影响。犊牛体躯指数受外界影响较小,但体长指数则与后期的饲养管理之间有密切关系。如果犊牛在生长发育期的管理水平过低,就会造成犊牛生长发育不完全,其体长指数就会低于同期牛群体长指数的平均值。犊牛在哺乳早期时,其身体发育的重点是骨骼,中期则为体长。本试验发现,添加酵母培养物提高了犊牛的ADMI及饲料转化效率,相对的提高了犊牛的营养水平,满足了自身生长发育对营养物质的需要,从而促进了其体尺的发育。
众多研究表明,饲喂动物酵母培养物可以提高动物的ADMI、F/G以及ADG。Tripathi研究发现,添加酵母培养物可以提高羔羊的日采食量(Tripathi等,2010);耿春银(2015)认为,添加酵母培养的并非增加了犊牛采食量本身,而是增加了犊牛的采食次数(耿春银等,2015)。因为添加酵母培养物会缩短犊牛的采食间隔,其采食频率有一定程度的增加。本研究结果表明,添加酵母培养对犊牛饲料转化率产生了积极影响。添加酵母培养物可以增加瘤胃挥发酸的浓度(Santos等,2015),而挥发酸中的乙酸和丁酸可以促进瘤网胃的发育(Mentschel等,2001),进而增加犊牛对营养物质的消化吸收。另外,本研究发现,添加酵母培养物组的犊牛腹泻发生率低于Ⅰ组,这就减少了犊牛因为腹泻而造成的营养损失,相对增加了犊牛饲料的转化效率;而犊牛腹泻率的降低,则相对提高了犊牛的采食欲望,从而增加了犊牛的ADMI。犊牛ADG的提高,则是其采食量以及饲料转化效率都提高的必然结果。
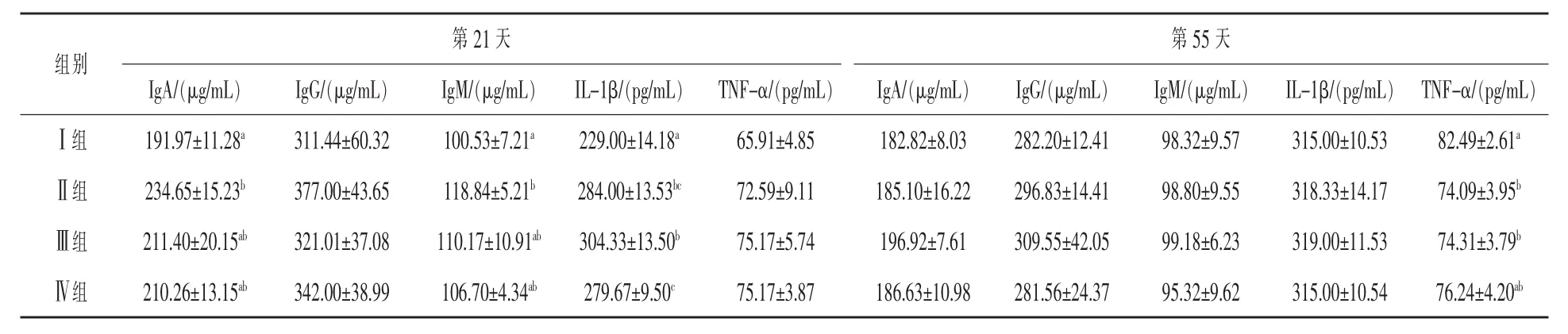
表5 酵母培养物对犊牛血清免疫指标的影响
3.2 酵母培养物对犊牛粪便菌群个数的影响犊牛在哺乳早期,由于自身免疫力低下,加上饮用牛乳由初乳过渡到常乳,还有外界的各种应激环境,极易造成犊牛肠道菌群的紊乱,进而导致腹泻的发生。而引起犊牛腹泻的常见致病菌为大肠杆菌。研究表明,酵母培养物能促进动物肠道有益菌群的增殖,并降低致病菌的数量(Magalhaes 等,2008),从而减小动物腹泻发生的几率。而酵母培养物作用的发挥,则主要依赖于其细胞壁中的甘露寡糖和β-葡聚糖两种成分(Jensen 等,2008;Fonty 等,2006)。 研究发现,酵母细胞壁以及其中所含的甘露寡糖对外源致病菌有一定的吸附作用(Perez-Sotelo等,2005),酵母培养物通过甘露寡糖实现对致病菌的特异性结合(White等,2002),竞争性的抑制病原菌在肠道的定植(Daudelin等,2011),并降低肠道pH,避免致病菌通过肠道进入机体从而诱发腹泻;同时酵母培养物中的甘露寡糖和β-葡聚糖,还可作为肠道有益菌群如乳酸杆菌和双岐杆菌的营养物质,从而促进肠道有益菌的增长,相对的降低大肠杆菌等致病菌群的数量。
本研究发现,饲喂犊牛酵母培养物可降低犊牛腹泻发生率,并且哺乳早期在牛奶中添加酵母培养对粪便菌群的影响优于其他两种添加方案。Ⅱ组对粪中双岐杆菌的数量增高百分数,分别比Ⅲ组和Ⅳ组高 1.3%、1.4%(P<0.05);而对粪中大肠杆菌的降低百分数分别比Ⅲ组和Ⅳ组高2.2%、1.1%。其原因可能是,在牛奶中添加酵母培养物增加了酵母培养物与瘤胃壁的接触面积,从而增强了酵母培养物作用的发挥,进而促进了瘤胃微生物区系的建立,增加了瘤胃的消化能力,同时优化了后端肠道的菌群。
3.3 酵母培养物对犊牛血清免疫物质含量的影响 犊牛出生后,其机体免疫获得方式转变为被动获得。在其机体免疫系统建立之前,犊牛主要从母乳中获得所需的免疫球蛋白(Godden等,2008)。研究表明,在犊牛出生后如能饮用经过加热处理的初乳,对降低其腹泻发生率具有一定的作用 (Godden等,2015;Nilusha等,2015)。初乳中所含免疫球蛋白主要为IgA、IgM和IgG。其中IgG为乳中主要的免疫球蛋白,能预防全身和肠道的感染;IgA对机体的黏膜免疫具有显著作用;IgM则可预防3日龄以前出生犊牛的败血症。研究表明,免疫球蛋白在初乳蛋白质中占到23%,而在常乳中仅占3%左右。所以如果犊牛能够长期得到足量的初乳,其腹泻发生率会显著降低。然而在当今的规模化养殖下,犊牛无法长期的从初乳中获得足够的免疫球蛋白,且其血清中的母源抗体量会随着日龄的增加而逐渐的降低,而犊牛哺乳前期是其腹泻的高发期。所以为降低犊牛腹泻发生率,提高其成活率,人为的提高犊牛血清免疫球蛋白的浓度就显得极为重要。本研究显示,饲喂犊牛酵母培养物能够提高犊牛血清免疫球蛋白的含量,且在犊牛饮用奶中添加酵母培养物效果更加显著。Kim等(2011)研究表明,饲喂犊牛酵母培养物能改善机体健康状况,提高血清免疫球蛋白的浓度。黏膜免疫系统是机体的第一道免疫防线,其可以将外来致病菌在侵入机体组织之前被消灭,从而避免机体组织受损。而Yuan等(2015)的研究则证实,添加酵母培养物可以提高机体IgA含量,增强机体黏膜免疫应答能力。
IL-1β主要为巨噬细胞分泌的细胞因子,其含量的高低可以作为评判机体非特异性免疫的指标。TNF-α是由激活的巨噬细胞产生的一种内源性细胞因子,其含量的高低可反映肝损伤的程度。IL-1β的过度分泌可刺激机体产生更多的TNF-α,从而引起细胞损伤。在本试验开始后的第21天,各试验组IL-1β的浓度显著高于Ⅰ组;各处理组血清中TNF-α的浓度差异不显著,且Ⅱ组血清中TNF-α的浓度为3个试验组中最低。这说明添加酵母培养物提高了犊牛的非特异性免疫,且没有对其造成损伤,并且在牛奶中添加酵母培养物的方案优于其他两种添加方案。这一作用在试验开始后的第56天再次得到验证。在试验的第56天,各处理组血清中IL-1β的浓度无显著差异,且试验组高于Ⅰ组;而试验组血清中TNF-α的浓度则显著低于Ⅰ组,且Ⅱ组血清中TNF-α的浓度最低。
4 结论
本试验结果表明,在犊牛饮用奶、开食料或饮用奶和开食料中添加酵母培养物,均对犊牛生长性能、肠道健康以及机体免疫具有促进作用;但综合比较则发现,在牛奶中添加酵母培养物要优于其他两种添加方式。
[1]耿春银,任丽萍,孟庆翔,等.反刍动物酵母菌制剂应用的效果及可能作用机制[J].动物营养学报,2015,27(4):1011 ~ 1020.
[2]Daudelin J F,Lessard M,Beaudoin F,et al.Administration of probiotics influences F4 (K88)positive enterotoxigenic Escherichia coli attachment and intestinal cytokine expression in weaned pigs[J].Veterinary Research,2011,42(1):69.
[3]Fonty G,And Chaucheyras-Durand F.Effects and modes of action of live yeasts in the rumen[J].Biologia,2006,61 (6):741 ~750.
[4]Gerritsen R,Klaassen G J,Schuttert G,et al.The effect of a mixture of dairy-based feed ingredients,vegetable fats,and yeast cell walls on performance and innate immunity of weaned piglets[J].Journal of Animal Science,2012,90:269 ~ 271.
[5]Godden S.Colostrum management for dairy calves[J].Veterinary Clinics North America:Food Animal Practice,2008,24(1):19 ~ 39.
[6]Godden S M,Wells S,Donahue M,et al.Effect of feeding heat-treated colostrum on risk for infection with Mycobacterium avium ssp.paratuberculosis,milk production and longevity in Holstein dairy cows[J].Journal of Dairy Science,2015,98(8):5630 ~5641.
[7]Jensen G S,Patterson K M,Yoon I.Nutritional yeast culture has specific anti~microbial properties without affecting healthy flora.Preliminary results[J].Journal of Animal and Feed Sciences 2008,17(2):247 ~ 252.
[8]Kim M H,Seo J K,Yun C H,et al.Effects of hydrolyzed yeast supplementation in calf starter on immune responses to vaccine challenge in neonatal calves[J].Animal,2011,5(6):953 ~ 960.
[9]Magalhaes V J A,Susca F,Lima F S,et al.Effect of feeding yeast culture on performance,health and immunocompetence of dairy calves[J].Journal of Dairy Science,2008,91(4):1497 ~ 1509.
[10]Mentschel J,Leiser R,Mulling C,et al.Butyric acid stimulates rumen mucosa development in the calf mainly by a reduction of apoptosis[J].Archives of animal nutrition,2001,55(2):85 ~ 102.
[11]Nilusha M,YanhongC,GuanxiangL,etal.Heat-treated colostrum feeding promotes beneficial bacteria colonization in the small intestine of neonatal calves[J].Journal of Dairy Science,2015,98(11):8044 ~ 8053.
[12]Perez-Sotelo,L S,Talavera-Rojas M,Monroy-Salazar H G,et al.In vitro evaluation of the binding capacity of Saccharomyces cerevisiae Sc47 to adhere to the wall of Salmonella spp[J].Revista Latinoamericana de Microbiologia,2005,47(3/4):70 ~ 75.
[13]Santos M C,Lock A L,Mechor G D,et al.Effects of a spoilage yeast from silage on in vitro ruminal fermentation[J].Journal of Dairy Science,2015,98(4):2603 ~ 2610.
[14]Swyers K L,Wagner J J,Dorton K L,et al.Evaluation of Saccharomyces cerevisiae fermentation product as an alternative to monensin on growth performance,cost of gain,and carcass characteristics of heavy-weight yearling beef steers[J].Journal of Animal Science,2014,92(6):2538 ~ 2545.
[15]Tripathi M k,Karim S A.Effect of individual and mixed live yeast culture feeding on growth performance,nutrient utilization and microbial crude protein synthesis in lambs[J].Animal Feed Science and Technology,2010,155(2/4):163 ~ 171.
[16]White L A,Newman M C,Cromwell G L,et al.Brewers dried yeast as a source of mannan oligosaccharides for weanling pigs[J].Journal of Animal Science,2002,80(10):2619 ~ 2628.
[17]Yuan K,Liang T,Muckey M B,et al.Yeast product supplementation modulated feeding behavior and metabolism in transition dairy cows[J].Journal of Dairy Science,2015,98(1):532 ~ 540.
[18]Yuan K,Mendonca L G D,Hulbert L E,et al.Yeast product supplementation modulated humoral and mucosal immunity and uterine inflammatory signals in transition dairy cows[J].Journal of Dairy Science,2015,98(5):3236 ~ 3246.
