一氧化氮供体PABA/NO经线粒体途径诱导HepG2细胞凋亡
2018-01-27黄紫乐王建刚
刘 玲,黄紫乐,王建刚
(河南科技大学医学院药学系,河南洛阳 471003)
一氧化氮(nitric oxide,NO)是一种亲脂性、可扩散的分子,其作用的发挥依赖于NO的浓度和细胞类型。低浓度NO可抑制细胞凋亡;然而,高浓度NO可通过诱导细胞凋亡等方式抑制肿瘤细胞增殖[1]。NO供体是获得高浓度NO的有效途径,能在生理状态下释放游离NO或NO类似物,有效补充体内NO不足以及恢复NO正常信号转导,对多种肿瘤细胞均具有良好的抑制活性,还可提高放化疗的作用效果。现已发现多种结构类型的NO供体,如有机硝酸酯类、亚硝基硫醇、呋咱氮氧化合物和偶氮鎓二醇盐等,其中偶氮鎓二醇盐类在靶向性释放NO方面优势明显[2]。O2-{2,4-二硝基-5-〔4-(N-甲基氨基)苯甲酰氧基〕苯基}-1-(N,N-二甲基氨基)偶氮-1-鎓-1,2-二醇(O2-{2,4-dinitro-5-[4-(N-methylamino)benzoyloxy]phenyl}1-(N,N-dimethyl⁃amino)diazen-1-ium-1,2-diolate,PABA/NO)是偶氮鎓二醇盐的代表化合物之一。Kogias等[3]发现,PABA/NO可浓度依赖性地抑制人神经胶质瘤细胞U87增殖,且与替莫唑胺(temozolomide)也有良好的协同作用;对于颅内脑胶质瘤U87裸鼠模型,皮下或瘤内给PABA/NO均能显著抑制肿瘤的生长。研究显示,PABA/NO衍生物能提高细胞内活性氧(reactive oxygen species,ROS)水平,上调丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)家族中的P38和JNK蛋白,激活胱天蛋白酶9和胱天蛋白酶3,诱导肝癌细胞凋亡[4]。
本研究采用HepG2肝癌细胞,探究PABA/NO经线粒体途径诱导细胞凋亡的作用机制,为进一步阐明PABA/NO诱导HepG2细胞凋亡的可能机制及其相应信号通路提供理论依据。
1 材料与方法
1.1 细胞、药物、试剂和主要仪器
人肝癌HepG2细胞由本实验中心保存,培养于含10%胎牛血清的RPMI 1640培养液中。RPMI 1640培养基、胎牛血清(美国Gibco公司)。PABA/NO按照文献报道方式合成[5](纯度≥98%)。用DMSO溶解配制成0.05 mol·L-1浓度的母液,贮存于4℃冰箱备用。临用现配,DMSO终浓度<0.1%(V/V)。胰酶(北京索莱宝科技有限公司);CCK-8试剂盒(日本同仁化学研究所);膜联蛋白(Annexin)Ⅴ-FITC/PI双染色流式细胞凋亡检测试剂盒(美国BD公司)。罗丹明123(rhodamine123,Rh123)、DAF-FM DA(NO荧光探针)、NO清除剂羧基-PTIO(carboxy-PTIO)、线粒体分离试剂盒、核浆分离试剂盒和BCA蛋白定量试剂盒(江苏海门碧云天生物技术研究所);兔抗人Bax、Bcl-2、活化胱天蛋白酶3、β肌动蛋白、组蛋白H3、细胞色素c(cytochrome c,Cyt c)和细胞凋亡诱导因子(apoptosis inducing factor,AIF)单克隆抗体,以及辣根过氧化物酶标记羊抗兔IgG二抗(均美国Cell Signaling Technology公司)。其他化学试剂均为分析纯。Mini Trans-blot电转膜系统(美国Bio-Rad公司);荧光及化学发光成像系统Clinx Chemi Scope2850(上海勤翔科学仪器有限公司)。
1.2 细胞分组和处理
将对数生长期的细胞消化成单细胞悬液,每孔1 mL接种于6孔板中,调整密度为1.0×109L-1,培养箱内孵育24 h后弃上清,将细胞分为细胞对照组(只加等量DMSO,终浓度<0.01%)和PABA/NO给药组(7.5,15.0和30.0 μmol·L-1),作用24 h后,每孔含有适宜浓度的含药培养基(含2%血清,1%双抗),处理细胞24 h。
1.3 CCK-8法检测细胞存活抑制率
将对数生长期的细胞消化成单细胞悬液,每孔100 μL接种于96孔板中,调整密度为每孔1×104细胞,培养箱内孵育24 h后弃上清,将细胞分为空白对照组(只加等量DMSO,终浓度<0.01%)和PABA/NO给药组(12.5,25.0,50.0,100.0和200.0 μmol·L-1),各组均设6复孔,作用24 h后,每孔加入CCK-8溶液10 μL,37℃孵育2 h后于(美国Bio-Rad公司)450 nm处检测吸光度A450nm。细胞存活抑制率(%)=(细胞对照组A450nm-给药组A450nm)/细胞对照组A450nm×100%。
1.4 倒置显微镜下检测细胞形态
取1.2处理的细胞,药物作用24 h后直接在倒置显微镜下观察细胞形态并拍照。
1.5 DAF-FM DA荧光染色法检测细胞内NO水平
收集1.2处理的细胞,去除细胞培养液,加入终浓度为 5 μmol·L-1的 DAF-FM DA 1mL,37℃细胞培养箱内孵育20 min。每隔5min颠倒混匀一下,使探针和细胞充分接触。用PBS(pH7.4)洗涤细胞3次,以充分去除未进入细胞内的DAF-FM DA。在激发波长495 nm,发射波长515 nm用流式细胞仪检测。用荧光值表示细胞内NO水平。
1.6 AnnexinⅤ-FITC/PI双染法检测细胞凋亡率
收集1.2处理的细胞,预冷PBS洗2次,吸取100 μL的细胞至试管中,加入AnnexinⅤ试剂和PI各5 μL,混匀避光孵育15 min;加入400 μL染色缓冲液,混匀,30 min后流式细胞仪检测,激发波长为488 nm,发射波长535 nm。
1.7 Rh123染色法检测细胞线粒体膜电位
收集1.2处理的细胞,重悬于0.5 mL培养基中,加入终浓度为 10 μmol·L-1的 Rh123 避光孵育20 min,随即用流式细胞仪检测荧光强度。激发波长507 nm,发射波长529 nm,用流式细胞仪分析。
1.8 Western蛋白印迹法检测凋亡蛋白表达
按照1.2处理细胞,同时设carboxy-PTIO 50 μmol·L-1和carboxy-PTIO+PABA/NO 30 μmol·L-1组,carboxy-PTIO加入1 h后再加PABA/NO,继续作用24 h,加入含PMSF的裂解液,冰上裂解并收集细胞,提取线粒体和胞浆蛋白,BCA法进行蛋白定量。经SDS-聚丙烯酰胺凝胶电泳分离后,转移至PVDF膜上,室温下5%脱脂牛奶封闭2 h,加入一抗(1∶1000)4℃过夜;二抗(1∶10 000)室温孵育2 h,ECL化学发光法检测,凝胶成像系统拍照成像。利用凝胶成像系统软件,以目的蛋白吸光度值与内参吸光度值的比值表示目的蛋白相对表达水平。
1.9 统计学分析
实验结果数据以x±s表示,经SPSS13.0软件进行统计分析,组间均数的比较采用t检验,两组以上均数的比较采用方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1 PABA/NO对人肝癌HepG2细胞生长和形态的影响
随着PABA/NO浓度的增加,对人肝癌HepG2细胞生长抑制作用逐渐增强。24 h时IC50值为(10.8±0.6)μmol·L-1。细胞对照组细胞贴壁良好,生长旺盛,呈密集型或重叠生长,大小较一致,形态规则(图1)。随着PABA/NO浓度的增加,24 h后细胞生长迟缓,形态不规则,胞膜皱缩,细胞扁圆,部分细胞脱落悬浮于培养液中。
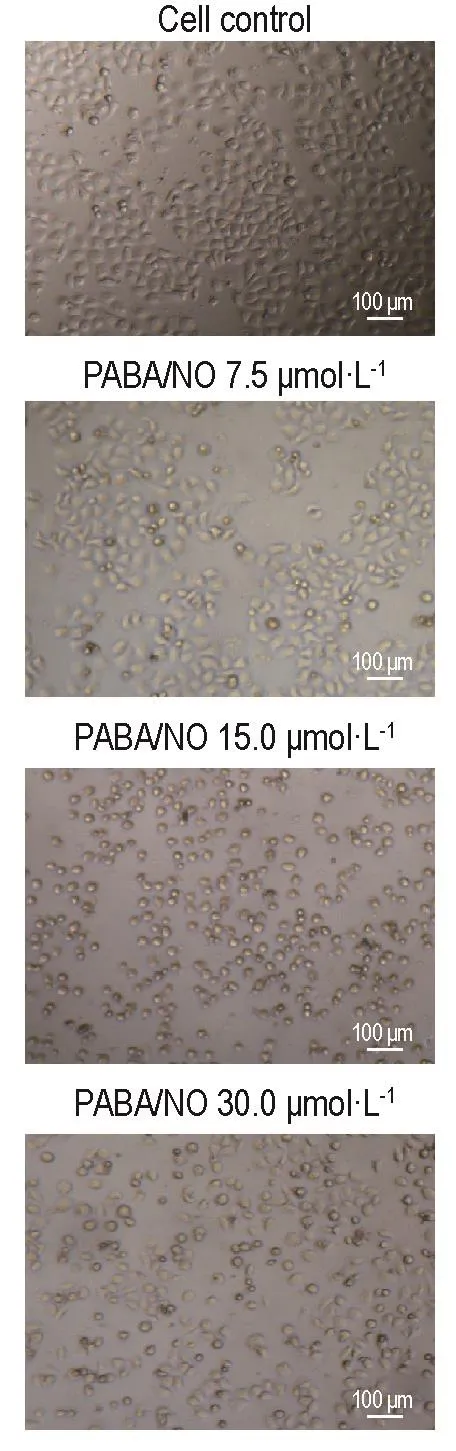
Fig.1 Effect of nitric oxide(NO)donor,O2-{2,4-dinitro-5-[4-(N-methylamino)benzoyloxy]phenyl}1-(N,N-di⁃methylamino)diazen-1-ium-1,2-diolate(PABA/NO)on morphology of HepG2 cells.HepG2 cells were cultured with PABA/NO for 24 h.
2.2 PABA/NO对人肝癌HepG2细胞内NO水平的影响
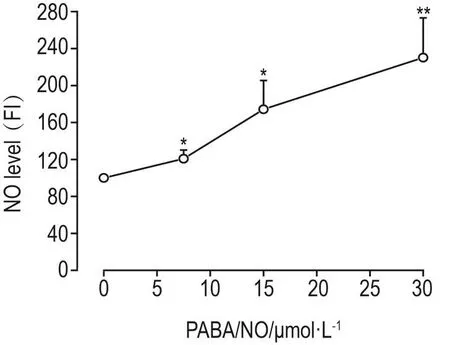
Fig.2 Effect of PABA/NO on level of nitric oxide(NO)in HepG2 cells.See Fig.1 for the cell treatment.FI:fluoresce intensity.x±s,n=3.*P<0.05,**P<0.01,compared with cell control(0)group.
图2 结果显示,与细胞对照组细胞内相对NO水平荧光强度100±3比较,PABA/NO 7.5,15.0和30.0 μmol·L-1作用细胞后,细胞内NO水平显著提高,荧光强度分别为121±9(P<0.05),174±31(P<0.05)和 230±43(P<0.01),提示 PABA/NO 作为NO供体可在细胞内释放NO。
2.3 PABA/NO对人肝癌HepG2细胞凋亡的影响
图3结果显示,与细胞对照组比较,PABA/NO 7.5,15.0和30.0 μmol·L-1作用细胞24 h后,HepG2细胞凋亡率明显增加(P<0.01),说明PABA/NO明显诱导HepG2细胞凋亡。
2.4 PABA/NO对人肝癌HepG2细胞线粒体膜电位的影响
图4 结果显示,与对照组细胞内Rh123的荧光强度668±69比较,PABA/NO7.5,15.0和30.0μmol·L-1作用细胞后,细胞内Rh123的荧光强度下降到605±73,420±65(P<0.05)和 242±47(P<0.01),提示PABA/NO可使HepG2细胞线粒体膜电位下降。
2.5 PABA/NO对人肝癌HepG2细胞凋亡相关蛋白的影响
与细胞对照组相比,PABA/NO作用HepG2后,随着浓度的增加,细胞中抗凋亡蛋白Bcl-2明显下调(P<0.05,P<0.01),促凋亡蛋白Bax上调(P<0.05,P<0.01),Bax/Bcl-2比值由对照组0.24±0.01升高到0.53±0.05,1.38±0.33和4.82±0.30,活化胱天蛋白酶3蛋白表达明显增加(P<0.01)(图5A1和图5A2)。胞浆中Cyt c的表达增加(P<0.01)(图5B1和图5B2);胞核中AIF的表达增加(P<0.01)(图5C1和图5C2),提示PABA/NO诱导细胞凋亡与激活线粒体通路有关。

Fig.4 Effect of PABA/NO on mitochondrial membrane potential in HepG2 cells.See Fig.1 for the cell treatment.
2.6 carboxy-PTIO对PABA/NO作用的影响
与单用PABA/NO比较,加入NO清除剂carboxy-PTIO后,抗凋亡蛋白Bcl-2表达增加(P<0.01),而促凋亡蛋白Bax表达下调(P<0.01),Bax/Bcl-2比值由3.90±0.45降低到1.32±0.06(P<0.01),活化胱天蛋白酶3的表达下调(P<0.01)(图6A1,图6A2和图6B2)。与单用PABA/NO比较,加入NO清除剂carboxy-PTIO后,胞浆中Cyt c的表达出现了明显下调(P<0.01)(图6B1和图6C2);细胞核内AIF蛋白的表达也明显下调(P<0.01)(图6C1和图6C2),提示PABA/NO可能通过释放NO激活线粒体通路诱导细胞凋亡。

Fig.5 Effect of PABA/NO on expressions of Bcl-2,Bax,cleaved caspase 3(A1 and A2),cytochrome c(Cyt c)(B1,B2)and apoptosis inducing factor(AIF)(C1 and C2)protein in HepG2 cells.See Fig.1 for the cell treatment.A2,B2 and C2 were the semi-quantitative results of A1,B1 and C1,respectively.x±s,n=3.*P<0.05,**P<0.01,compared with cell control(0)group.

Fig.6 Effect of carboxy-PTIO on expressions of Bcl-2,Bax,cleaved caspase3(A1 and A2),Cyt-c(B1 and B2)and AIF(C1 and C2)protein in PABA/NO treated HepG2 cells for 24 h.A2,B2 and C2 were the semi-quantitative results of A1,B1 and C1,respectively.Carboxy-PTIO 50 μmol·L-1was added 1 h before PABA/NO 30 μmol·L-1treatment.x±s,n=3.**P<0.01,compared with cell control group;##P<0.01,compared with PABA//NO group.
3 讨论
本研究结果显示,PABA/NO 7.5~30.0 μmol·L-1作用24 h后,对HepG2细胞存活具有明显的抑制作用,细胞形态出现扁圆、胞膜皱缩等明显的变化。NO荧光探针检测到PABA/NO可在细胞内释放较高水平的NO。另外,PABA/NO还可显著诱导人HepG2细胞凋亡,降低线粒体膜电位,改变凋亡相关蛋白的表达。研究显示,PABA/NO作为一种较为新型的偶氮鎓二醇盐衍生物,可在GSTπ作用下释放NO,产生较高浓度的NO,通过增加细胞内外源性NO水平抑制肿瘤细胞增殖[6-7]。
AnnexinⅤ-FITC/PI双染结果发现,PABA/NO作用HepG2细胞后凋亡率显著升高。Rh123荧光探针检测线粒体膜电位结果显示,PABA/NO可显著降低线粒体膜电位,提示PABA/NO可引起线粒体损伤,启动细胞内凋亡级联反应,诱导细胞凋亡。
本研究结果显示,PABA/NO可显著诱导细胞凋亡,引起抗凋亡蛋白Bcl-2表达下调,而促凋亡蛋白Bax上调,Bax与Bcl-2的比值升高,从而使线粒体膜的通透性发生改变。促凋亡蛋白Bax表达增加,可使线粒体结构与功能发生紊乱,引起细胞器肿胀和跨膜电位丢失等,最终受损的线粒体开放通透性转换孔。一旦线粒体外膜和内膜通透性发生改变,会从线粒体中释放并活化分解代谢的水解酶(包括胱天蛋白酶类)。这些水解酶可终止线粒体的生物能量和氧化功能,最后导致细胞死亡,这意味着线粒体可协调细胞死亡的最后阶段[8]。胱天蛋白酶是细胞凋亡通路上的关键酶之一。本研究结果显示,PABA/NO作用于HepG2细胞后,细胞中活化胱天蛋白酶3蛋白表达明显上调,说明PABA/NO诱导细胞凋亡与该通路激活有关。
一些释放到线粒体膜外的可溶性蛋白,如Cyt c和AIF可激活胱天蛋白酶的级联反应通路。本研究结果显示,PABA/NO能明显上调细胞核内AIF蛋白的表达,即AIF发生了核转运,胞浆中Cyt c表达增加,提示Cyt c从线粒体释放到了胞质中,提示PABA/NO可引起受损的线粒体开放通透性转换孔,从而释放Cyt c和AIF。Cyt c释放到胞质中与凋亡蛋白激活因子(apoptosis protease activating factor-1,Apaf-1)结合是凋亡进程中的一个关键步骤。Apaf-1与Cyt c结合后使其与dATP的亲和力增加,利于召集和形成凋亡复合体。凋亡复合体通过招募大量胱天蛋白酶9前体,并促进其剪切形成活化胱天蛋白酶9,随后胱天蛋白酶9可作为剪切因子活化胱天蛋白酶3,后者是执行凋亡的关键蛋白,进而激活下游的级联反应发生凋亡[9]。而AIF可转移到细胞核内参与不依赖胱天蛋白酶的染色质溶解。AIF是线粒体蛋白的一种,当一些细胞凋亡因子作用后,AIF被蛋白酶剪切成57 ku的AIF片段,从细胞膜上的锚定位点脱离。随着线粒体外膜通透性增加,这个片段可从线粒体膜间隙中释放到胞质中。由于AIF具有2个核定位信号,所以一旦它释放到胞质中,即可转运到细胞核中,从而激活可水解细胞核DNA的核酸内切酶,发生大范围的DNA片段化以及染色质凝集[10]。随后与AIF结合后形成凋亡复合体,后者促进胱天蛋白酶3前体形成活化胱天蛋白酶3,发挥促凋亡作用。另外,本研究结果显示,NO清除剂carboxy-PTIO可逆转PABA/NO对上述相关细胞凋亡相关蛋白表达的影响,如上调抗凋亡蛋白Bcl-2蛋白表达,下调促凋亡蛋白Bax蛋白表达,活化胱天蛋白酶3表达降低,同时释放到胞浆中的Cyt c表达降低,胞核中AIF表达也下降,提示PABA/NO诱导凋亡蛋白的改变与其释放NO有关。
综上所述,PABA/NO能抑制肝癌细胞增殖,通过降低线粒体膜电位,使Bax与Bcl-2的比值升高,促使Cyt c和AIF的释放,前者激活胱天蛋白酶途径,后者进入细胞核使DNA片段化,最终诱导HepG2细胞经线粒体途径诱导细胞凋亡。
[1] Rabender CS,Alam A,Sundaresan G,Cardnell RJ,Yakovlev VA,Mukhopadhyay ND,et al.The role of nitric oxide synthase uncoupling in tumor progression[J].Mol Cancer Res,2015,13(6):1034-1043.
[2] Ding QG,Zang J,Gao S,Gao Q,Duan W,Li X,et al.Nitric oxide donor hybrid compounds as promisinganticanceragents[J].DrugDiscov Ther,2017,10(6):276-284.
[3] Kogias E,Osterberg N,Baumer B,Psarras N,Koentges C,Papazoglou A,et al.Growth-inhibitory and chemosensitizing effects of the glutathione-S-transferase-π-activated nitric oxide donor PABA/NO in malignant gliomas[J].Int J Cancer,2012,130(5):1184-1194.
[4] Liu L,Fu J,Li T,Cui R,Ling J,Yu X,et al.NG,A novel PABA/NO-based oleanolic acid deriva⁃tive,induces human hepatoma cell apoptosis via a ROS/MAPK-dependent mitochondrial pathway[J].Eur J Pharmacol,2012,691(1-3):61-68.
[5] Saavedra JE,Srinivasan A,Buzard GS,Davies KM,Waterhouse DJ,Inami K,et al.PABA/NO As an anticancer lead:analogue synthesis,struc⁃ture revision,solution chemistry,reactivity toward glutathione,and in vitro activity[J].J Med Chem,2006,49(3):1157-1164.
[6] Fu J,Liu L,Huang Z,Lai Y,Ji H,Peng S,et al.Hybrid molecule from O2-(2,4-dinitrophenyl)diazeni⁃um diolate and oleanolic acid:a glutathione S-transferase π-activated nitric oxide prodrug with se⁃lective anti-human hepatocellular carcinoma activi⁃ty and improved stability[J].J Med Chem,2013,56(11):4641-4655.
[7] Kim Y,Maciag AE,Cao Z,Deschamps JR,Saavedra JE,Keefer LK,et al.PABA/NO lead optimization:improved targeting of cytotoxicity to glutathioneS-transferaseP1-overexpressingcancer cells[J].Bioorg Med Chem,2015,23(15):4980-4988.
[8] Zong WX,Rabinowitz JD,White E.Mitochondria and cancer[J].Mol Cell,2016,61(5):667-676.
[9] Siddiqui WA,Ahad A,Ahsan H.The mystery of BCL2 family:Bcl-2 proteins and apoptosis:an update[J].Arch Toxicol,2015,89(3):289-317.
[10] Wang F,Wei ZL,Sun XR,Zhang Q,Zhang CX,Jiang WX,et al.Apoptosis inducing factor is involved in stretch-induced apoptosis of myoblast via a caspase-9 independent pathway[J].J Cell Biochem,2017,118(4):829-838.
