丁苯酞注射液对原代培养神经元类缺血再灌注损伤的影响
2018-01-25高美琳
高美琳,杨 琨
(山西省中西医结合医院,山西太原030013)
脑卒中是目前严重威胁人民健康,影响人民生活质量的一种疾病,其存在着高发病率、高致死率、高致残率、高复发率等4大特点。这其中又以缺血性脑卒中(脑梗死)为主,临床中脑梗死的治疗以溶栓、抗血小板聚集、脑保护为主。研究证实,在神经细胞损伤的过程中,神经细胞凋亡起着主要作用,尤其处在缺血半暗带中的神经细胞,及时恢复灌注,早期进行抗细胞凋亡治疗是减少神经损伤的重要一环。但在治疗过程中,在改善微循环的同时,也会出现再灌注损伤,如何能够减轻再灌注损伤,减轻神经细胞凋亡,目前临床上有多种药物应用。而丁苯酞氯化钠注射液越来越受到重视。
丁苯酞氯化钠注射液(商品名:恩必普注射液)是近年来广泛应用于临床的脑保护剂。现有的多项研究均证实丁苯酞注射液对脑缺血后神经损伤有着良好的保护作用。既往研究认为丁苯酞注射液可保护细胞线粒体,但是否丁苯酞注射液可进一步减轻再灌注损伤后神经细胞凋亡,从而达到脑保护作用,目前还需进一步探讨。本实验中采用体外培养大鼠原代神经元细胞,并在此基础上诱导缺血再灌注损伤,以此为模型,观察丁苯酞注射液在神经元保护方面所起的作用。
1 材料与方法
1.1 实验材料
1.1.1 实验动物 新生1 d Wistar大鼠,清洁级,体质量5 g,购于北京,动物合格证编号:SCXK(京)2012-0001。
1.1.2 试剂与仪器 流式细胞仪(BD公司),胎牛血清(GIBCO),DMEM高(无)糖培养基(GIBCO),四噻唑蓝(MTT),Annexin V-FITC Apoptosis Detection KitⅠ(BD 401001),丁苯酞注射液,神经元特异性烯醇化酶(NSE)。
1.2 实验方法
取新生1 d的Wistar大鼠3只,在无菌情况下剪断大鼠双侧颈总动脉后放血,然后将大鼠放入75%酒精中消毒,去除脑后剥离脑膜和血管,剪碎成约1 mm3大小组织块,然后用胰酶3 mL终止消化,静置后弃上清液,将剩余组织吹打,过滤,离心。然后将处理过的细胞添加完全细胞培养基,并调整细胞数至合适数量,随后用台盼蓝染色法评估细胞活性,当所检细胞活性大于95%时,将处理好的细胞用含有10%胎牛血清的DMEM培养基种植于培养板上,每孔添加2 mL培养液,然后置于37℃、5%CO2的培养箱中培养,培养48 h后将半量培养液弃去并更换新培养液,同时在培养皿中加入阿糖胞苷以抑制胶质细胞生长。静置24 h后弃去含有阿糖胞苷的培养液,同时更换培养液,以后每3 d更换一半培养液。细胞培养7 d后应用显微镜观察培养神经元生长情况及细胞形态,并用神经元特异性烯醇化酶(NSE)鉴定培养的细胞为神经元[1]。
1.3 类缺血再灌注模型的建立
将培养7 d并鉴定为大鼠神经元的细胞,随机分为对照组、缺血组(类缺血后再灌注)、实验组(类缺血再灌注后加丁苯酞)。对照组正常细胞培养条件下培养,缺血组在神经元正常条件下培养7 d时,改变培养环境,用含90%氮气的气体替换正常空气,同时更换培养基为无添加胎牛血清的培养基,以上条件继续培养1 h,然后转入对照组相同条件下继续培养,并在1 h、12 h、24 h时分别取出细胞进行实验;实验组在更换为缺血组培养条件前24 h加入10 μmol/L的丁苯酞注射液作用24 h,然后同缺血组相同培养条件培养,建立实验模型。
1.4 检测指标
对各组神经细胞进行MTT比色分析以测定细胞存活率:分别在各组培养神经元的96孔培养板中加入MTT试剂,在37℃的CO2培养箱中作用4 h,取出后弃去上清液,将培养细胞放置于酶标仪上测490 nm波长处的吸光值(OD),用以检测培养神经元的存活率,并且设置空白对照组。神经元凋亡率检测:应用流式细胞仪检测神经元凋亡率,将培养板内用于实验的神经元细胞用胰酶消化法处理,处理时将贴壁培养细胞配置成细胞悬液,并调整细胞数目至上机数目,加入实验管内震荡混匀,混匀后加入磷脂酰结合蛋白V(Annexin V-FITC)及碘化丙啶(PI)10 μL,再次震荡混匀,后避光作用20 min,上流式细胞仪进行定量检测。并用细胞仪自带软件分析。
1.5 统计学方法
2 结 果
2.1 鉴定神经元细胞
取培养细胞应用免疫细胞化学方法,应用神经特异性烯醇化酶(NSE)多克隆抗体,按实验步骤进行免疫细胞化学染色,如细胞染为棕黄色染色则为阳性结果,通过以上方法检测培养细胞,结果证明本实验培养细胞为神经元细胞。
2.2 细胞活性测定
正常组的细胞活性在检测的3个时间点差异无统计学意义(P>0.05)。缺血组细胞活性随着时间的延长呈现下降趋势。随着再灌注时间的逐渐延长,可以观察到在再灌注12 h、24 h时,实验组的细胞活性显著高于缺血组,差异有统计学意义(P<0.01)。结果见表 1。
表1 各组细胞MTT比色分析结果 (±s)

表1 各组细胞MTT比色分析结果 (±s)
注:与缺血组再灌注1 h比较,1)P<0.01;与缺血组相应时间段比较,2)P<0.01
组别 例数 再灌注1 h 再灌注12 h 再灌注24 h正常组 12 3.470±0.121 3.631±0.168 3.251±0.129缺血组 12 2.265±0.273 1.556±0.0151) 1.428±0.0731)实验组 12 2.538±0.146 2.326±0.136 2.357±0.0672)
2.2 细胞凋亡率分析
用于检测细胞凋亡率的实验细胞经处理后,调整每管细胞,使细胞数在1×105/mL左右后,应用流式细胞仪定量分析,结果显示正常组培养细胞在不同时间点凋亡率差异无统计学意义(P>0.05);而缺血组培养细胞随着时间的延长凋亡率逐渐增加,后一时间点高于前一时间点,24 h检测值为最高;实验组细胞凋亡率仍为逐渐增加,在每个相同时间点实验组的细胞凋亡率明显低于缺血组(P<0.01)。结果见表 2。
3 讨论
表2 各组细胞细胞凋亡率检测结果 (±s)
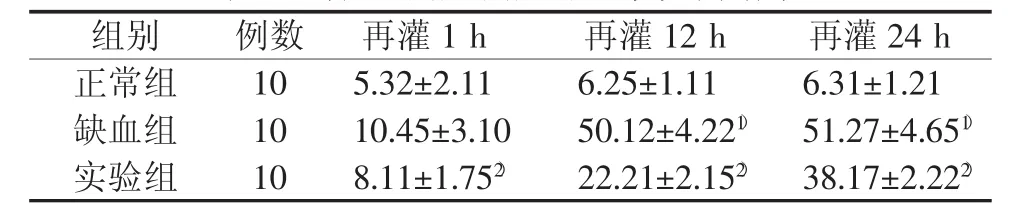
表2 各组细胞细胞凋亡率检测结果 (±s)
注:与缺血组再灌注1 h比较,1)P<0.01;与缺血组相同时间段比较,2)P<0.01
组别 例数 再灌1 h 再灌1 2 h 再灌2 4 h正常组 1 0 5.3 2±2.1 1 6.2 5±1.1 1 6.3 1±1.2 1缺血组 1 0 1 0.4 5±3.1 0 5 0.1 2±4.2 2 1) 5 1.2 7±4.6 5 1)实验组 1 0 8.1 1±1.7 5 2) 2 2.2 1±2.1 5 2) 3 8.1 7±2.2 2 2)
缺血性脑血管病(脑梗死),是供应脑部的血液发生阻断,从而引起脑组织包括神经细胞、胶质细胞等由于缺乏血液供应而发生的坏死。在脑梗死发生时,缺血脑组织如果能及时、充分地获得侧支循环,使得局部脑组织代谢需要营养物质得到恢复,就可以挽救脑组织,尤其是挽救那些濒于坏死的神经细胞。但在血液循环恢复的同时,缺血组织重新得到供血时,也会同时出现再灌注损伤,同样再灌注损伤也可以引起细胞的死亡和凋亡。这在目前脑梗死的治疗中是一个棘手的问题。
缺血再灌注损伤是近年来脑梗死后神经保护研究的热点,如何阻断缺血后细胞损伤的“瀑布效应”,就能减轻神经功能缺损,减少梗死面积。故治疗缺血半暗带内处于凋亡的细胞,阻断其进一步损伤,就能减轻梗死面积。改善脑梗死患者预后,减轻患者残障,改善患者生活质量。
近年来细胞凋亡是医学界研究较多的热点问题,细胞凋亡是指机体为维持内环境稳定,由基因控制的细胞自主而有序的死亡。细胞凋亡与细胞坏死有着本质区别,在细胞凋亡过程中细胞不是被动参与的,而是主动进行的,这其中关系众多相关基因的激活、表达以及主动调控等作用。细胞凋亡是一系列基因严格调控的过程,如Bcl-2家族、Caspase家族、癌基因如 C-myc、抑癌基因 P53 等[2]。在脑梗死后神经元损伤过程中,细胞凋亡是否起着重要作用,目前研究可知,脑缺血后神经细胞坏死与凋亡同时存在,同时引起神经功能缺损,且同样发挥着重要作用。
缺血性脑血管病时,缺血及缺血再灌注引起能量衰竭,细胞坏死,细胞缺血及由缺血后再灌注带来的细胞损伤均易诱发细胞凋亡。目前,体外细胞培养与大体动物实验均证实,凋亡这种损伤方式是神经元细胞缺血以及再灌注后的重要损伤方式。细胞凋亡的严重程度与细胞缺血时间、缺血后再灌注时间及程度等有一定的相关作用,也与神经系统损伤相关,故减少神经细胞凋亡数量,可达到减小梗死面积、减轻神经系统损伤的目的。
在动物模型中,我们培养出原代神经元细胞,并造出类似于脑缺血再灌注损伤模型,在这种模型基础上我们应用丁苯酞注射液预处理缺血的神经元细胞,来模拟脑梗死后神经元再灌注损伤的生理病理过程。本实验丁苯酞直接作用于原代培养神经元细胞,排除了药物在改善微循环方面带来的影响,单纯研究药物对神经元损伤的影响,可更直接地反应药物减轻凋亡的作用。
丁基苯酞(NBP)又名芹菜甲素,是从芹菜种籽中分离出的有效成分,经合成的消旋化合物为黄色油状液体,具芹菜香味。研究发现,NBP具有增加缺血区脑血流量和重构缺血区微循环、保护线粒体功能、改善全脑缺血后的能量代谢、减轻神经功能损伤的程度等功能,对缺血性卒中具有较强的治疗作用[3-4]。
本实验应用原代培养神经元细胞,然后制造缺血再灌注损伤模型,在此模型基础上检测细胞存活率、凋亡细胞等方法,证实丁苯酞注射液可显著增加类缺血再灌注神经元细胞再灌注后细胞的存活率,这种神经保护机制在一定程度上是通过其减少神经细胞凋亡而实现的。目前推测这种作用可能通过改善微循环,改善能量代谢,保护细胞内线粒体等实现。本实验更加证实了这种保护机制也是通过减轻细胞凋亡发挥作用的。这种作用是直接作用于细胞本身,而不需要循环支持,故不需要血液中成分参与。故丁苯酞注射液可减轻再灌注损伤,这种作用是通过抗凋亡实现的。
在今后的实验中,我们还将进一步探讨丁苯酞注射液这种抗凋亡的可能作用机制
[1]杨琨,刘瑞珍.GM-1对原代培养神经元类缺血再灌注损伤的影响[J].中西医结合心脑血管病杂,2009,7(10):1 184-1 186.
[2]陈津,张如松.细胞凋亡机制概述[J].中华中医药学刊,2011,29(4):886-889
[3]Xu H L,Feng Y P.Effects of 3-n-buty lphthalide on pial arterioles in focal cerebral ischemia rats[J].Acta Pharm Sin,1999,34(3):172-175.
[4]张镛,刘振芳,付庆喜,等.脑缺血和 NBP预处理对脑缺血沙鼠NGB和mit-Na-K~-ATP酶活性的影响[J].山东医药,2007,47(1):1-3.
