H2 O2 诱导ARPE-19细胞损伤模型的建立及蓝莓花青素的保护作用
2018-01-24HUTABARATRuthPaulina黄午阳
吴 寒, HUTABARAT Ruth Paulina, 黄午阳
(江苏省农业科学院农产品加工研究所,江苏 南京 210014)
年龄相关性黄斑病变 (age-related macular degeneration, AMD) 是一种随年龄增长出现的视网膜黄斑部退行性病变,是发达国家最常见的不可逆性致盲眼病。在我国,50岁以上人群中,AMD是最重要的致盲性疾病之一[1]。一般认为,AMD的发病机制涉及老化、氧化损伤、炎症、自身免疫等多种途径,视网膜色素上皮 (retinal pigment epithelial, RPE) 细胞是其病理改变各阶段的中心环节,长期氧化应激导致的RPE结构与功能异常被认为是引发AMD的重要原因[2]。作为眼部组织细胞代谢最活跃的细胞,RPE可以吞噬视网膜光感受器细胞的外界盘膜,产生大量的脂质过氧化物及H2O2[3]。因此,对RPE氧化应激损伤和保护进行研究,将有利于深入探索AMD的发病机制和治疗手段。
近年来,花青素保护视力研究受到了广泛关注,研究者认为花青素能够促进视网膜紫质合成、减轻氧化应激诱导的视网膜细胞损害[4]。前期研究时,本课题组从兔眼蓝莓 (Vacciniumashei) 中提取花青素,经高效液相色谱 (high performance liquid chromatography, HPLC) 和HPLC-DAD-MS联用技术分析,含有9种花色苷组分[5],依次为锦葵色素-3-半乳糖苷 (malvidin-3-galactoside, Mv-3-gal)、锦葵色素-3-葡萄糖苷 (malvidin-3-glucoside, Mv-3-glc)、牵牛花色素-3-半乳糖苷 (petunidin-3-galactoside, Pt-3-gal)、牵牛花色素-3-葡萄糖苷 (petunidin-3-glucoside, Pt-3-glc)、矢车菊素-3-半乳糖苷 (cyanidin-3-galactoside, Cy-3-gal)、飞燕草素-3-半乳糖苷 (delphindin-3-galactoside, Dp-3-gal)、飞燕草素-3-葡萄糖苷 (delphindin-3-glucoside, Dp-3-glc)、芍药素-3-半乳糖苷 (peonidin-3-galactoside, Pn-3-gal) 和锦葵色素-3-阿拉伯糖苷 (malvidin-3-arabinose, Mv-3-ara),其中Mv-3-gal和Mv-3-glc两者之和约占花青素总含量的46%。可见蓝莓中的花青素、锦葵色素含量丰富,为主导成分。目前,关于蓝莓花青素锦葵色素对于视网膜内皮细胞氧化损伤的保护作用的报道十分罕见,鉴于研究必要性,本文选择自由基引起老化理论的主要因素——H2O2作为诱导剂,建立ARPE-19细胞损伤模型,用于探究蓝莓花青素锦葵色素的保护作用。
1 材料与方法
1.1细胞株、药物与试剂人视网膜色素上皮细胞系 (ARPE-19),购自广州吉妮欧生物科技有限公司。兔眼蓝莓, 2016年6月摘于南京市溧水蓝莓种植基地,-18℃冻存;锦葵色素 (Mv)、锦葵色素-3-葡萄糖苷 (Mv-3-glc)、锦葵色素-3-半乳糖苷 (Mv-3-gal)、胰蛋白酶,购自美国Sigma Aldrich公司;胎牛血清、DMEM培养基 (含5.5 mmol·L-1葡萄糖),购自美国Gibco公司;青霉素、链霉素,购自上海Life Technologies公司;活性氧 (reactive oxygen species, ROS) 检测试剂盒、MTT细胞增殖检测试剂盒,购自上海碧云天生物技术有限公司;其他试剂均为市售分析纯。
1.2仪器Airtech超净工作台,苏州安泰空气技术有限公司;CO2细胞培养箱,美国Thermo公司; TDZ5-WS水平离心机,上海沪湘仪器有限公司;3K15离心机,德国Sigma公司;电子分析天平,上海精密科学仪器有限公司;Eyela FDU-1200冻干机,日本Tokyo Rikakikai公司;Synergy H4微孔板式多功能分析仪 (配有Hyper Terminal Applet ELISA软件),美国Bio Tek公司;DS-Ri2/ECLIPSE Ti-S倒置成像显微镜,日本Nikon公司。
1.3方法
1.3.1蓝莓花青素提取[5]称取250 g冻存蓝莓,室温下解冻并打浆,加入1 L含有1% HCl的甲醇溶液,浸提花青素24 h,每隔2 h混匀1次。浸提液在4℃、5 000×g条件下离心15 min,去除沉淀,40℃旋转蒸发,按1 ∶1 (V∶V) 比例加入乙酸乙酯,萃取3次。用AB-8型大孔树脂纯化花青素粗提物,之后冻干,得到蓝莓花青素提取物 (blueberry anthocyanin extract, BAE) 粉末。
1.3.2ARPE-19细胞培养[6]从液氮中取出ARPE-19冻存管,放于37℃水浴,尽快摇晃解冻,转移冻存液至离心管,25℃、1 000×g离心5 min,弃上清,除去DMSO。用含有10% (V/V) 胎牛血清、1% (V/V) 青链霉素的DMEM培养基在37℃、5% CO2培养箱中复苏细胞,再用0.25%胰酶进行消化,细胞计数、传代。选择生长良好的3~4代细胞,待细胞长至80%~90%融合时,用于实验。
1.3.3ARPE-19处理
1.3.3.1H2O2诱导ARPE-19细胞损伤的条件 选择浓度为0、10、40、80、100、200、400、800、1 600、3 200 μmol·L-1H2O2,分别诱导ARPE-19细胞2、6、24 h,筛选出H2O2刺激的最佳浓度和时间。
1.3.3.2BAE对ARPE-19细胞的毒性实验 根据上述结果,选择浓度为0、1、5、10 mg·L-1BAE,分别处理ARPE-19细胞6、24 h,确定在该浓度范围内、处理时间下BAE对细胞的毒性。
1.3.3.3BAE对H2O2诱导ARPE-19细胞损伤模型的保护 设立分组:未加入任何药物的细胞为空白组;只加入H2O2的细胞为诱导组;BAE预处理后,再加入H2O2的细胞为保护组。以上分组中,BAE浓度为1、5、10 mg·L-1,保护时间为6、24 h;H2O2浓度为800 μmol·L-1,刺激时间为2、24 h。确定H2O2和BAE的处理时间,以及BAE用量。
1.3.3.4比较锦葵色素对H2O2诱导ARPE-19细胞损伤的保护作用 按“1.3.3.3”设立分组,比较BAE、Mv、Mv-3-glc和Mv-3-gal的保护作用。锦葵色素浓度为5 mg·L-1,保护时间为6 h;H2O2浓度为800 μmol·L-1,刺激时间为2 h。
1.3.4细胞活力测定[7]采用MTT法测定细胞活力。收集细胞,制备浓度为1×109·L-1细胞悬浮液,每孔接种100 μL于96孔板,37℃、5% CO2培养,待细胞长满孔底时,弃去培养液,换无血清培养基培养4 h,使细胞处于同步生长状态。按照“1.3.3”处理细胞。每孔加入5 g·L-1MTT溶液10 μL,继续培养4 h,之后弃去孔内溶液。各加入100 μL DMSO,置于摇床上低速振荡10 min,使紫色结晶物充分溶解,测定490 nm处的吸光度 (Abs) 值。以“1.3.3”中未加入任何药物的细胞为空白对照,按下式计算ARPE-19细胞活力。
细胞活力=实验组Abs值/对照组Abs值×100%
1.3.5细胞中ROS水平测定[8]采用免疫荧光法测定细胞ROS水平。收集细胞,制备浓度为1×109·L-1细胞悬浮液,每孔接种2 mL于6孔板中,37℃、5% CO2培养,待细胞长满孔底时,弃去培养液,换无血清培养基培养4 h,使细胞处于同步生长状态。按照“1.3.3.4”处理细胞。弃去上清液,在无菌条件下装载DCFH-DA探针,浓度为10 μmol·L-1,于37℃细胞培养箱孵育20 min。用磷酸盐缓冲液 (PBS) 洗涤细胞3次,充分去除未进入细胞内的DCFH-DA。用1 mL PBS收集消化后的细胞,放入酶标仪中,在激发波长485 nm、发射波长535 nm条件下检测荧光强度。ROS水平以荧光强度值 (arbitrary unit, A.U.) 表示,“1.3.3.4”中未加入任何药物的细胞为空白对照,按下式计算ARPE-19细胞中ROS相对含量。
ROS相对含量=实验组A.U.值/对照组A.U.值×100%

2 结果
2.1H2O2诱导ARPE-19细胞损伤模型Tab 1为不同浓度、不同处理时间下,H2O2对ARPE-19细胞存活率的影响。结果表明,随着H2O2浓度的增大,活细胞数量明显下降,并呈现剂量依赖效应,H2O2浓度越大,细胞损伤越严重,测得的存活率依次降低。通常选择存活率为50%~60%时的损伤剂浓度为最佳诱导浓度,当H2O2浓度为800 μmol·L-1,刺激时间为2 h或24 h时,ARPE-19细胞存活率为62.51%和59.99%,接近该范围,因此选择该条件进行诱导。
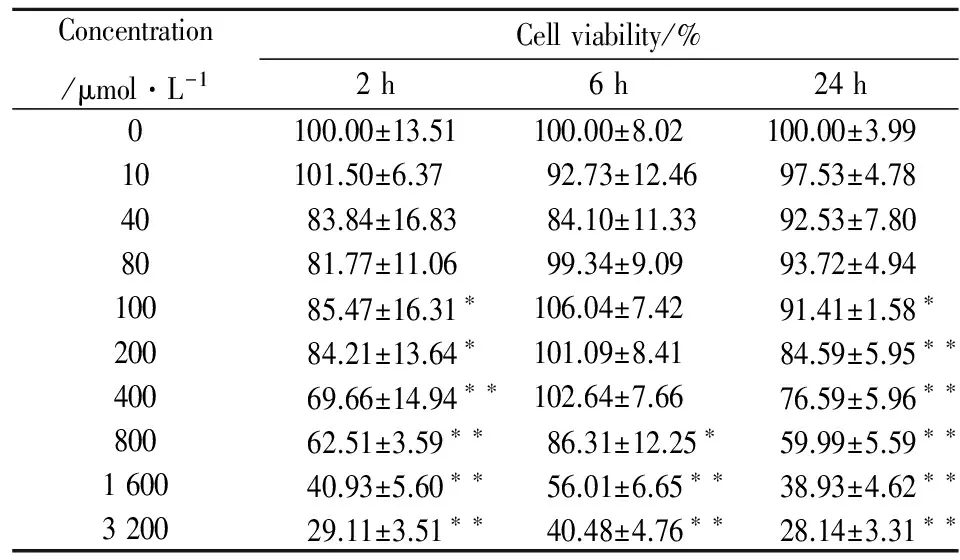
Tab 1 Effects of different concentrations and stimulatedtime of H2O2 on cell viability
*P<0.05,**P<0.01vsgroup without H2O2in each stimulated time
2.2BAE对ARPE-19细胞的毒性检测MTT法测定不同浓度BAE作用细胞6、24 h后,细胞存活率的变化情况。由Tab 2可以看出,0~10 mg·L-1的BAE作用ARPE-19细胞后,细胞存活率与未加样品的空白对照组相比无明显减少,在不同处理时间下,细胞的存活率差异也无显著性,甚至5 mg·L-1BAE预处理6 h可以改善细胞生长,提高存活率 (P<0.01)。结果表明,在所选浓度范围内,花青素对ARPE-19细胞生长无毒性,是其发挥对细胞损伤保护作用的前提。

Tab 2 Effects of different concentrations and mediatedtime of BAE on cell viability
**P<0.01vsgroup without BAE in each mediated time
2.3BAE对H2O2诱导ARPE-19细胞损伤模型的保护作用如Fig 1所示,1、5、10 mg·L-1BAE预处理ARPE-19细胞6 h (模型A)和24 h (模型B),分别以800 μmol·L-1H2O2再刺激2 h (模型A) 和24 h (模型B),处理后的细胞较未加入BAE保护的细胞在存活率上有明显区别。模型A中,H2O2诱导使细胞存活率降低38.50% (P<0.01),经5、10 mg·L-1BAE保护后,细胞存活率明显提高,分别达到86.57% (P<0.01) 和76.59% (P<0.05);模型B中,H2O2诱导使细胞存活率降低23.10% (P<0.01),但1~10 mg·L-1BAE对ARPE-19细胞的保护作用不明显,可能是由于长时间的损伤难以修复。因此,以蓝莓花青素浓度5 mg·L-1,预处理时间6 h;H2O2刺激浓度800 μmol·L-1,刺激时间2 h作为条件,进一步探究蓝莓花青素主成分锦葵色素及其糖苷对H2O2诱导ARPE-19细胞损伤的保护作用。

Fig 1 Effects of different treatments on growth of ARPE-19
Model A:Cells were incubated in BAE for 6 h, and then 800 μmol·L-1H2O2for 2 h; Model B: cells were incubated in BAE for 24 h, and then 800 μmol·L-1H2O2for 24 h.*P<0.05,**P<0.01vscontrol group without BAE and H2O2;#P<0.05,##P<0.01vsmodel group without BAE.
2.4锦葵色素对H2O2诱导ARPE-19细胞损伤模型的保护作用根据上述结果建立H2O2诱导ARPE-19细胞氧化损伤模型,比较BAE、Mv、Mv-3-glc和Mv-3-gal对细胞的保护作用,采用MTT法和免疫荧光法分别测定ARPE-19细胞的存活率及ROS水平。如Fig 2A所示,800 μmol·L-1H2O2刺激2 h后,细胞存活率明显下降36.31% (P<0.01),蓝莓花青素提取物和锦葵色素可以明显抑制细胞氧化损伤,提高ARPE-19细胞存活率。5 mg·L-1BAE、Mv、Mv-3-gal和Mv-3-glc预处理6 h后,细胞存活率分别达到86.57%、115.72%、98.15%和127.97%,其中锦葵色素糖苷 (Mv-3-glc、Mv-3-gal) 的保护作用比BAE和Mv更为明显。由于高浓度H2O2可以诱导产生氧化应激,ARPE-19细胞在800 μmol·L-1H2O2刺激下的ROS水平明显高于对照组 (P<0.01),见Fig 2B。经过5 mg·L-1蓝莓花青素预处理,BAE、Mv、Mv-3-gal和Mv-3-glc对H2O2诱导产生的ROS分别抑制26.66%、48.56%、39.47%和 58.04%。花青素锦葵色素及其糖苷对氧化应激下产生ROS的抑制作用 (P<0.01) 比蓝莓花青素提取物更为明显 (P<0.05),Mv-3-gal使细胞中ROS水平甚至低于空白对照组 (P<0.05),其抗氧化能力最强,说明锦葵色素及其糖苷是蓝莓花青素提取物中发挥抗氧化损伤的主要物质。
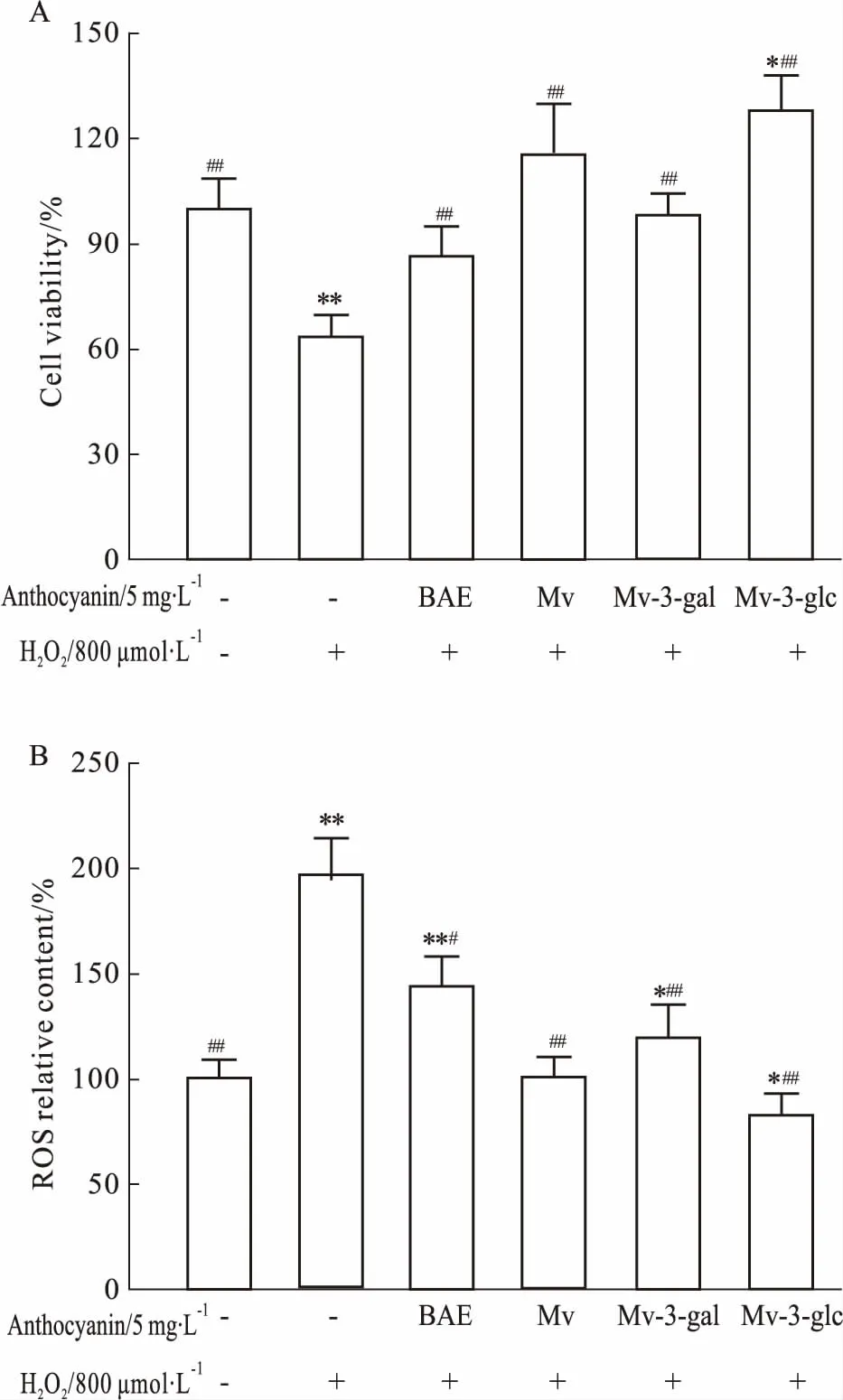
Fig 2 Effects of different treatments on growthand ROS level of ARPE-19
A:Cell viability; B: ROS relative content.*P<0.05,**P<0.01vscontrol group without BAE and H2O2;#P<0.05,##P<0.01vsmodel group without BAE.
3 讨论
花青素是迄今为止发现的最有效的天然水溶性自由基清除剂,其淬灭超氧阴离子自由基的能力是维生素C的20倍、维生素E的50倍。通过动物实验发现,花青素可以穿过血-脑水屏障和血-视网膜屏障被眼组织吸收,并以完整的形式存在[9]。之前研究表明,蓝莓中的花青素含量在各类水果蔬菜中排名第1,兔眼蓝莓中锦葵色素含量占花青素总量最多,主要以葡萄糖苷和半乳糖苷形式存在[5]。根据相关报道,在H2O2诱导RPE细胞氧化损伤过程中,从细胞膜出泡到细胞凋亡,以及RPE细胞连接遭到破坏,诱发了一系列病理反应,这一氧化应激过程参与了许多严重眼底疾病 (如老年性黄斑变性、视网膜静脉阻塞等) 的发病[2-3]。因此,作为活性氧中间产物之一,H2O2常被用于诱导RPE细胞的氧化损伤。本文研究了不同浓度H2O2、不同刺激时间对ARPE-19细胞活力的影响,确定最佳H2O2用量和时效,构建了RPE细胞损伤模型,并初步探讨了蓝莓花青素粗提物以及其主要成分锦葵色素、锦葵色素-3-葡萄糖苷、锦葵色素-3-半乳糖苷对RPE细胞的保护及减缓氧化损伤的作用。
结果表明,蓝莓花青素可以抑制H2O2诱导的ARPE-19细胞损伤,减少细胞内氧自由基,提高细胞存活率。这与花青素以下几方面的作用十分相关[10-11]:① 有效清除诱发脂质过氧化反应的羟自由基及反应中间产物脂质过氧化自由基、烷自由基,阻断自由基链式反应;② 激活视网膜酶,活化和促进视红素的再合成;③ 调节视网膜血液微循环、加速物质代谢交换,加强对毛细血管的保护作用。此外,Milbury等[12]从越橘中提取花青素及其他酚类物质,对RPE细胞进行预处理,之后进行氧化损伤实验,发现越橘花青素提取物可以上调抗氧化酶HO-1和GST-pi的表达,使细胞损伤程度明显小于对照组。张震等[13]采用1 mmol·L-1H2O2诱导BGC-823细胞,比较蓝莓花青素预处理对细胞氧化损伤的影响,表明6.25~100 mg·L-1蓝莓花青素提取物能够明显提高BGC-823细胞的存活率,抑制细胞中ROS生成,对H2O2诱导的细胞损伤起到保护作用。
ROS是生物体内重要的生物信号传导介质,广泛参与各种正常生理和病理过程。本研究中,H2O2诱导产生过多或无法迅速消除的ROS,使RPE细胞处于氧化应激状态,导致了机体中蛋白质破碎、DNA损伤和脂质过氧化。研究表明,花青素可以通过提高超氧化物歧化酶 (superoxide dismutase, SOD)、过氧化氢酶 (catalase, CAT)、谷胱甘肽过氧化物酶 (glutathione peroxidase, GSH-Px)等体内抗氧化酶活力,降低细胞中的ROS水平[14]。Teng等[15]还证明,飞燕草素、矢车菊素和天竺葵素的花色苷能够阻断MAPKs相关通路,如ERK1/2和p38MAPK信号通路,以及使Akt磷酸化,促进Akt信号通路中p-Akt/Akt增加,使细胞内抗氧化酶的表达上调,从而减少ROS水平。本文发现的蓝莓花青素对视网膜细胞的保护作用,证实了蓝莓护眼和预防眼科疾病的功能,为研究蓝莓花青素预防氧化应激引起的AMD作用机制提供了基础,明确了视网膜病变治疗的新方向。下一步我们还将继续探究蓝莓花青素锦葵色素对不同内源性抗氧化酶活力的影响,以及是如何通过调控MAPKs和Akt信号通路发挥保护作用的,进一步阐明蓝莓花青素对RPE细胞抗氧化损伤的保护机制。
(致谢:本文实验在江苏省农产品工程技术研究中心平台及实验室同学协助下完成,在此表示感谢。)
[1] Ding X, Patel M, Chan C C. Molecular pathology of age-related macular degeneration[J].ProgRetinEyeRes, 2009,28(1):1-18.
[2] Cano M, Wang L, Wan J, et al. Oxidative stress induces mitochondrial dysfunction and a protective unfolded protein response in RPE cells[J].FreeRadicBiolMed, 2014,69:1-14.
[3] Boulton M, Dayhaw-Barker P. The role of the retinal pigment epithelium: topographical variation and ageing changes[J].Eye(Lond), 2001,15(3):384-9.
[4] Paik S S, Jeong E, Jung S W, et al. Anthocyanins from the seed coat of black soybean reduce retinal degeneration induced by N-methyl-N-nitrosourea[J].ExpEyeRes, 2012,97(1):55-62.
[5] Li C Y, Feng J, Huang W Y, et al. Composition of polyphenols and antioxidant activity of rabbiteye blueberry (Vacciniumashei) in Nanjing[J].JAgrFoodChem, 2013,61(3):523-31.
[6] 周云丰, 李 琳, 葛争艳, 等. 黄芪甲苷对甲基乙二醛诱导的人视网膜色素上皮细胞损伤的保护作用研究[J]. 中国药理学通报, 2017,33(7):915-21.
[6] Zhou Y F, Li L, Ge Z Y, et al. Protective effect of astragalosides IV on retinal pigment epithelium injury induced by methylglyoxal[J].ChinPharmacolBull,2017,33(7):915-21.
[7] Lee H H, Kim S O, Kim G Y, et al. Involvement of autophagy in cordycepin-induced apoptosis in human prostate carcinoma LNCaP cells[J].EnvironToxicolPharmacol,2014,38(1):239-50.
[8] 孙 杰, 孙文佳, 陈北冬, 等. 白藜芦醇降低ox-LDL诱导血小板ROS产生和PECAM-1表达的分子机制研究[J]. 中国药理学通报, 2015,31(11):1608-13.
[8] Sun J, Sun W J, Chen B D, et al. Effect of resveratrol on ROS production and PECAM-1 expression in ox-LDL-stimulated platelets[J].ChinPharmacolBull, 2015,31(11):1608-13.
[9] Matsumoto H, Nakamura Y, Iido H, et al. Comparative assessment of distribution of blackcurrant anthocyanins in rabbit and rat ocular tissues[J].ExpEyeRes, 2006,83(2):348-56.
[10] Matsumoto H, Nakamura Y, Tachibanaki S, et al. Stimulatory effect of cyaniding 3-glycosides on the regeneration of rhodopsin[J].JAgricFoodChem, 2003,51(2):3560-3.
[11] Nakaish H, Matsumoto H, Tominaga S, et al. Effects of black current anthocyanoside imake on dark adaptation and VDT work induced transient refractive alteration in healthy humans[J].AitemMedRev, 2000,5(6):553-62.
[12] Milbury P E, Graf B, Curran-Celentano J M, et al. Bilberry (Vacciniummyrtillus) anthocyanins modulate heme oxygenase-1 and gltathione S-transferase-pi expression in ARPE-19 cells[J].InvestOphthVisSci, 2007,48(5):2343-9.
[13] 张 震, 周婷婷, 张 华, 等. 蓝莓花青素提取物对H2O2诱导人胃癌BGC-823细胞氧化损伤的保护作用[J]. 大连医科大学学报, 2016,38(1):16-9.
[13] Zhang Z, Zhou T T, Zhang H, et al. Protective effect of anthocyanins extract from blueberry on human gastric cancer BGC-823 cell oxidative injury induced by H2O2[J].JDalianMedUniv, 2016,38(1):16-9.
[14] Wang L, Azad N, Kongkaneramit L, et al. The Fas death signaling pathway connecting reactive oxygen species generation and FLICE inhibitory protein down-regulation[J].JImmunol, 2008,180(5):3072-80.
[15] Teng H, Fang T, Lin Q Y, et al. Red raspberry and its anthocyanins: bioactivity beyond antioxidant capacity[J].TrendsFoodSciTech, 2017,66:153-65.
