响应面法优化超声波辅助北苍术多酚提取工艺及其DPPH自由基清除能力研究
2018-01-23陈克克
陈克克,强 毅
(1.西安文理学院 生物与环境工程学院/基因工程实验室,陕西 西安 710065;2.陕西师范大学 生命科学学院/西北濒危药材资源开发国家工程实验室,陕西 西安 710119)
北苍术(Atractylodeschinensis(DC.) Koidz.)为菊科苍术属植物,主产于陕西、内蒙古、河北、山西、河南、甘肃、吉林、辽宁、黑龙江等地[1-2],其干燥根茎入药为苍术(ATRACTYLODIS RHIZOMA)。苍术为我国常用中药材,具有降血压、抗心律失常、抗肿瘤、抗溃疡、抗菌、抗炎、利尿、保肝等作用[3-7],主要用于湿阻中焦、脘腹胀满、泄泻、水肿、脚气痿蹙、风湿痹痛、风寒感冒、眼目昏涩等症。国内、外关于苍术化学成分的研究表明,苍术含有挥发油、多糖、倍半萜类化合物、三萜类化合物、聚乙炔类化合物、类固醇、香豆素等活性成分[8-14],其中科研工作人员对苍术挥发油开展了深入透彻的研究,分别从苍术挥发油的分类鉴定、化学结构和药理作用等方面进行了分析评价。目前,尚未见对苍术多酚的研究报道。多酚是广泛分布于植物体内的一类重要的次生代谢物质,化学性质独特,药理活性多样,已经成为评价药材质量的指标成分之一,在食品、医药保健、化学及化妆品等领域均有应用,因此对苍术多酚展开研究十分必要。本实验采用响应面法研究了北苍术多酚的提取工艺,并探讨了北苍术多酚的体外DPPH自由基清除能力,以期为苍术资源的综合开发利用奠定研究基础。
1 材料与方法
1.1 材料与仪器
北苍术采自陕西省太白县,经西安文理学院杜喜春副教授鉴定为菊科苍术属植物北苍术,取其根部干燥后粉碎过孔径为0.425mm筛,保存备用。
1,1-二苯基-2-三硝基苯肼(DPPH)购于美国Sigma公司,纯度>98.0%(质量分数);没食子酸购于陕西标普医药科技有限公司,纯度>98.0%(质量分数);抗坏血酸(纯度>98.0%(质量分数))和甲醇、无水碳酸钠(分析纯)均购于天津市天力化学试剂有限公司;Folin-Ciocalteu试剂购于上海荔达生物科技公司。
WN-200多功能粉碎机,广州旭朗机械设备有限公司;TE412-L型电子天平,德国Sartorius仪器有限公司;SHB-Ⅲ循环水式多用真空泵,上海科恒实业发展有限公司;KH-400KDB型高功率数控超声波清洗器,昆山禾创超声仪器有限公司;三用恒温水箱,天津泰斯特仪器有限公司;TDL-5-A型离心机,上海安亭科学仪器厂;UV-2550紫外可见分光光度计,日本岛津。
1.2 实验方法
1.2.1 北苍术多酚的提取工艺 准确称量5.0 g北苍术粉末于玻璃瓶中,按液料比加入不同浓度的乙醇提取溶剂,混合均匀后放入功率为240 W的超声波中超声一定时间,超声结束后真空抽滤得浅棕色滤液。
1.2.2 没食子酸标准曲线的绘制 精密称量标准品没食子酸13 mg,用甲醇溶解并稀释至50 mL棕色容量瓶中,摇匀,即得浓度为0.26 mg/mL没食子酸溶液。
精密移取该溶液0,0.1,0.4,0.5,0.6,0.8 mL于25 mL棕色容量瓶中,分别加入蒸馏水10.0 mL,Folin-Ciocalteu试剂2.0 mL,充分振荡摇匀后静置8 min,再依次加入15%(质量分数)Na2CO3溶液2.0 mL,摇匀后定容,室温下避光静置反应2 h。以第1瓶空白溶液作参比,测定765 nm波长处的吸光度。
1.2.3 北苍术多酚的测定 采用Folin-Ciocalteu分光光度法测定北苍术多酚含量[15]。取北苍术滤液50 μL,于765 nm处测定吸光度值,将该值代入没食子酸标准曲线回归方程,计算北苍术多酚的浓度。按公式(1)计算北苍术多酚的提取量,以没食子酸当量表示。
M=(X*V1*V0)/(M1*V2)
(1)
式中:M为北苍术多酚提取量,mg/g;X为标准曲线求出的北苍术多酚浓度,mg/mL;V0为提取北苍术多酚时定容后的体积,mL;V1为测定北苍术多酚时定容后的体积,mL;V2为测定多酚时移取的北苍术滤液的体积,mL;M1为提取北苍术多酚时北苍术粉末质量,g。
1.2.4 单因素实验 以乙醇浓度70%(质量分数)、液料比25mL/g、超声时间40 min为固定水平,考察各单因素水平对北苍术多酚提取量的影响,以确定后续实验的最佳提取工艺参数范围。各因素分别设置6个水平,具体为乙醇浓度40%,50%,60%,70%,80%,90%(质量分数),液料比5,10,15,20,25,30mL/g,超声时间10,20,30,40,50,60min。每组实验重复3次。
1.2.5 响应面法优化提取工艺实验设计 在单因素实验基础上利用响应面法设计优化超声波辅助提取北苍术多酚的实验方法,选取乙醇浓度(A),液料比(B)和超声时间(C)作为影响多酚提取优化的因素,以多酚提取量为响应值。根据Box-Behnken设计进行3因素3水平的实验,响应面设计实验因素及水平见表1。
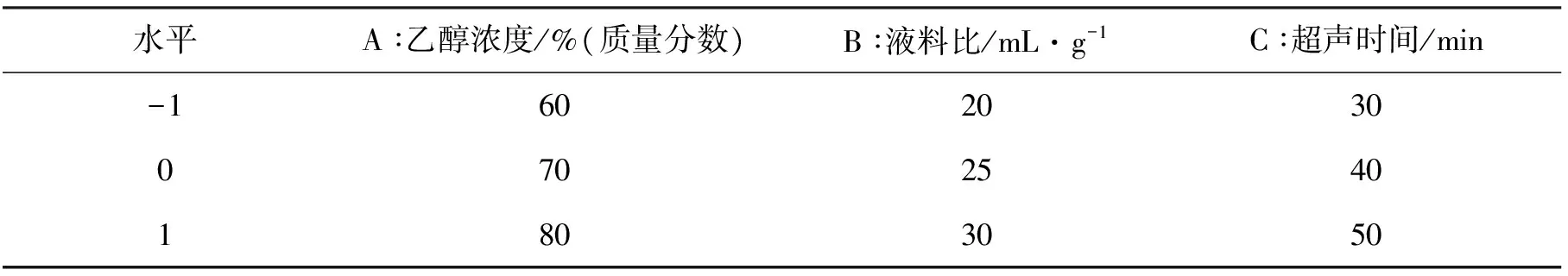
表1 Box-Behnken设计因素水平及编码表Tab.1 Levels and factors of response surface design
1.2.6 DPPH自由基清除能力 将提取得到的北苍术多酚和抗坏血酸配成系列浓度为40,80,160,320,640,1 280,2 560和4 000 μg/mL的样品溶液,取各浓度样品溶液2 mL分别放置于刻度试管中,加入0.2 mmol/L无水乙醇配制的DPPH自由基溶液2 mL,混匀后室温暗处反应30 min,517 nm波长下测吸光度值。以2 mL样品液加入2 mL无水乙醇作为空白组,以2 mL蒸馏水加入2 mL DPPH自由基溶液作为对照组,根据公式(2)计算DPPH自由基清除率。
DPPH自由基清除率(%)=[1-(A样品-A空白)/A对照]×100%
(2)
1.2.7 数据分析 所有实验均重复3次,实验数据以平均值±标准差表示。运用Design Expert 8.0.6.1软件进行响应面设计和分析,应用SPSS 17.0软件进行数据的统计分析。
2 结果与分析
2.1 没食子酸标准曲线的绘制结果
采用没食子酸溶液质量浓度(mg/mL)作为横坐标,对应吸光度值作为纵坐标,绘制标准曲线,得线性回归方程为Y=68.287X+0.003(R2=0.995 3)。
2.2 单因素实验

图1 乙醇浓度对北苍术多酚提取量的影响Fig.1 Effect of ethanol concentration on the yield of polyphenols
2.2.1 乙醇浓度对北苍术多酚提取量的影响 不同浓度的乙醇对北苍术多酚提取量的影响结果见图1。北苍术多酚的提取量随着乙醇浓度的增大而增大,当乙醇浓度为70%(质量分数)时,北苍术多酚提取量达到最大,随着乙醇浓度的继续增大,北苍术多酚提取量下降。可见,70%(质量分数)的乙醇浓度可以使北苍术多酚有较好的提取量。乙醇溶剂提取法是提取多酚类物质的常用方法,已被广泛应用于石榴[15]、猕猴桃[16]、西藏野生卷叶黄精[17]、黔产接骨草[18]、窄叶鲜卑花[19]、米糠[20]等植物多酚类物质的提取中。不同植物含有的多酚类物质成分有差异,导致其极性不同,而不同浓度的乙醇溶剂亦有不同的极性[21],因此,提取不同植物多酚类物质应根据相似相溶的原理选用不同浓度的乙醇溶液。本实验发现,70%的乙醇浓度可以使北苍术多酚有较好的提取量,可能是70%(质量分数)的乙醇溶液的极性和北苍术多酚的极性相似,故具有较大的溶解度。
2.2.2 液料比对北苍术多酚提取量的影响 不同液料比对北苍术多酚提取量的影响结果见图2。北苍术多酚的提取量随着液料比的增加而增大,当液料比为25mL/g时,北苍术多酚提取量达到最大,随着液料比的继续增加,北苍术多酚提取量下降。可见,25mL/g的液料比可以使北苍术多酚有较好的提取量。低浓度的液料比使北苍术多酚提取不充分,高浓度的液料比会导致一些其他物质如多糖溶出,从而抑制多酚提取量[22],因此,合适的液料比对多酚类物质的有效提取至关重要。经查阅文献发现,米糠[20]和石榴渣[15]多酚提取时的液料比为20mL/g,猕猴桃果皮[16]和西藏野生卷叶黄精[17]多酚提取时的液料比为25mL/g,窄叶鲜卑花[19]和黔产接骨草[18]多酚提取时的液料比分别为60mL/g和75mL/g,由此可知,不同植物多酚类物质提取所用的液料比均不同,实验时应根据具体的实验材料选择合适的液料比。

图2 液料比对北苍术多酚提取量的影响Fig.2 Effect of liquid-solid ratio on the yield of polyphenols
2.2.3 超声时间对北苍术多酚提取量的影响 不同超声时间对北苍术多酚提取量的影响结果见图3。北苍术多酚的提取量随着超声时间的增加而增大,在超声时间为40 min时,北苍术多酚的提取量达到最大,之后超声时间增加,北苍术多酚提取量下降。可见,40 min的超声时间可以使北苍术多酚有较好的提取量。研究证明,合适的超声时间可以让多酚提取的过程反应完全,过长的超声时间会因为机械力和热能破坏多酚结构,导致多酚提取量降低[23]。以往实验报道,超声辅助提取猕猴桃果皮[16]和黔产接骨草[18]多酚时的超声时间分别为25 min和50 min,本实验发现,40 min的超声时间可以使北苍术多酚有较好的提取量,而采用传统提取法提取米糠[20]、西藏野生卷叶黄精[17]和石榴渣[15]多酚时,其提取时间分别为2 h,2.5 h和3.5 h。可见,超声提取法提取时间明显缩短。
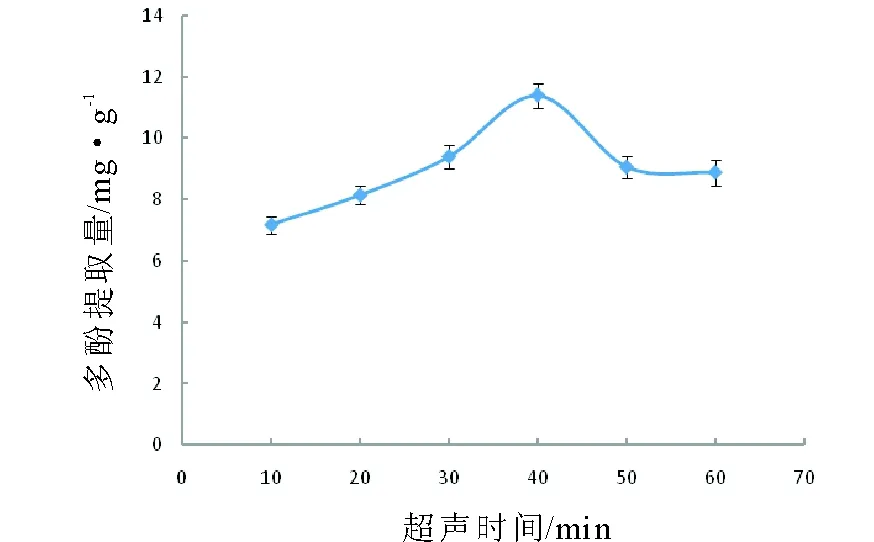
图3 超声时间对北苍术多酚提取量的影响Fig.3 Effect of ultrasonic time on the yield of polyphenols
2.3 响应面法优化提取工艺
2.3.1 响应模型的建立与方差分析 利用Design Expert 8.0.6.1软件进行Box-Behnken实验设计,结果见表2。
对表2数据进行二次多项式回归模型方程拟合,得到以乙醇浓度(A)、液料比(B)、超声时间(C)为影响因素的北苍术多酚提取量(mg/g)的回归方程:北苍术多酚提取量(mg/g)=11.79+0.33A+0.094B-0.075C+0.035AB-0.26AC+0.39BC-0.69A2-0.95B2-0.70C2。
根据p值可知,一次项A,交互项AC,BC和二次项A2,B2和C2对多酚提取量的影响极显著,一次项B对多酚提取率影响显著,影响大小顺序为:乙醇浓度>液料比>超声时间。
2.3.2 响应面优化 影响北苍术多酚提取量各因素间的交互作用的响应曲面如图4~6所示,可以得到乙醇浓度、液料比、超声时间之间交互关系的直观表现。响应曲面图的抛物面越明显,因素之间的交互作用越强;响应曲面图的抛物面越不明显,因素之间的交互作用越弱[24]。结合P值分析可知,因素间交互作用的影响为:液料比-超声时间的交互影响>乙醇浓度-超声时间的交互作用,而乙醇浓度-液料比间的交互作用影响不显著。
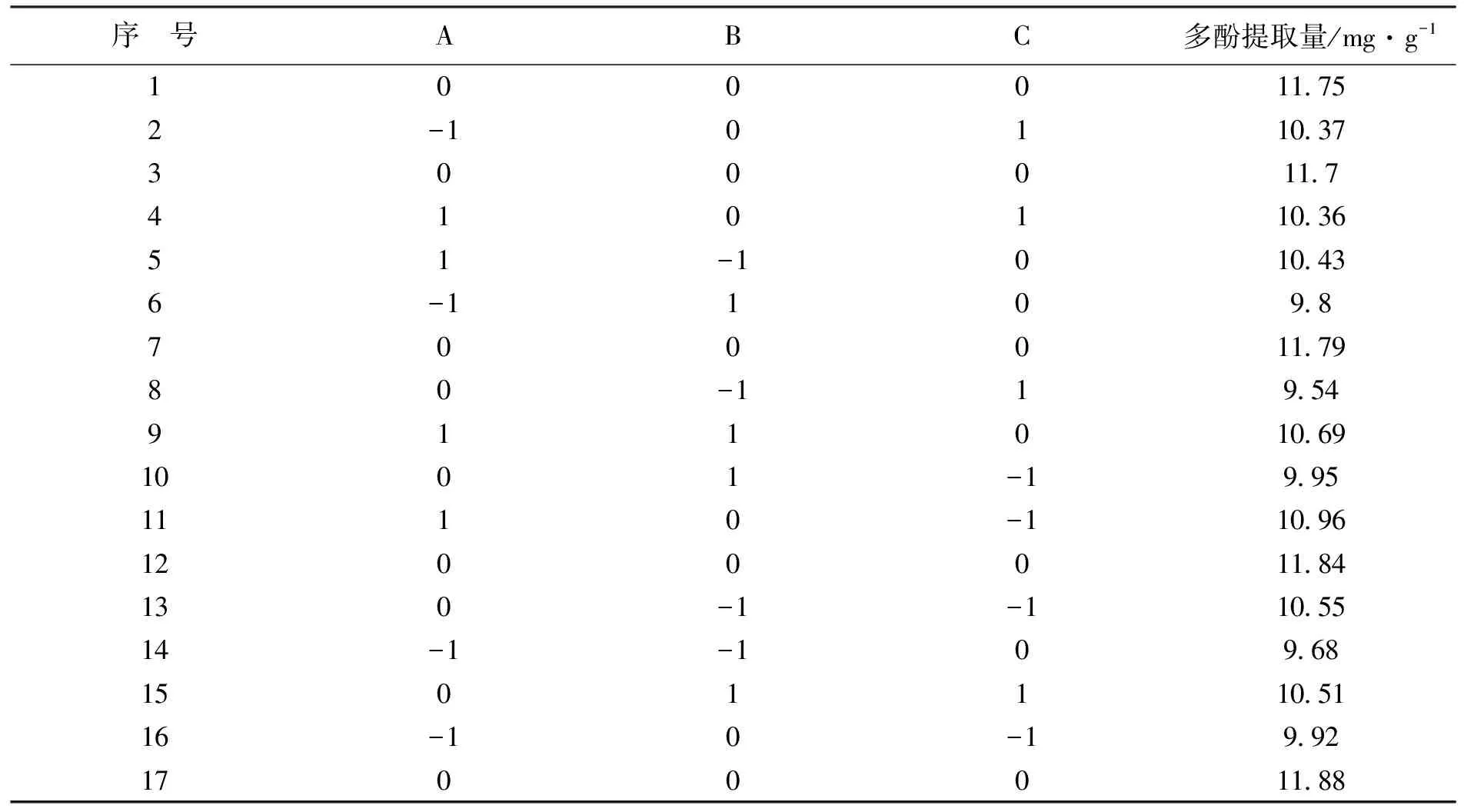
表2 北苍术多酚提取响应面设计及结果Tab.2 Experiment design and results for response surface analysis
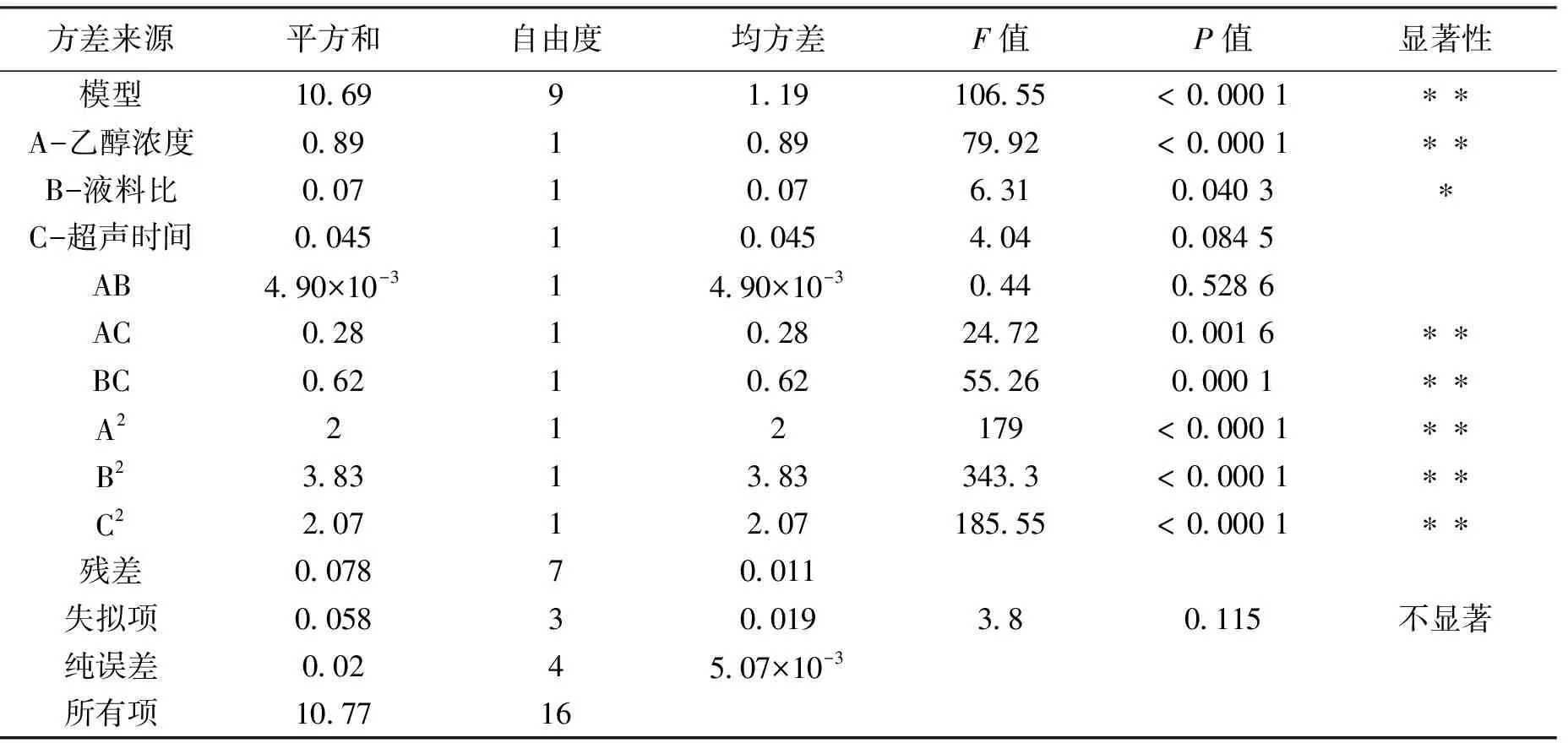
表3 回归模型方差分析表Tab.3 Analysis of variance of the regression model
注:* 表示差异显著(P<0.05),** 表示差异极显著(P<0.01)
2.3.3 最优提取工艺验证 由响应面法分析数据可得出北苍术中多酚的最佳提取工艺为:乙醇浓度为73.98%(质量分数),液料比24.86 mL/g,超声时间36.8 min,多酚的理论最佳提取量为11.90 mg/g。
根据模型预测结果进行验证实验,优化实验条件为乙醇浓度74%,液料比25mL/g,超声时间37 min,通过3次平行试验,求得多酚的提取量为11.67±0.15 mg/g,与理论值的误差为1.97%,说明该回归方程能够真实地反映各因素对北苍术多酚提取量的影响,可在实际生产中应用。
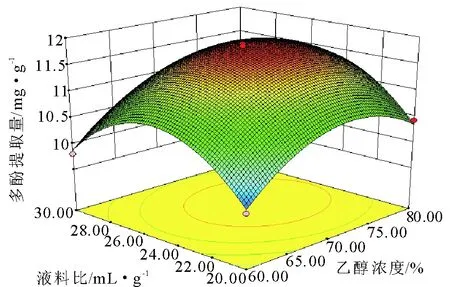
图4 乙醇浓度和液料比对多酚提取量的影响Fig.4 Effect of ethanol concentration and liquid-solid ratio on the yield of polyphenols

图5 乙醇浓度和超声时间对多酚提取量的影响Fig.5 Effect of ethanol concentration and ultrasonic time on the yield of polyphenols
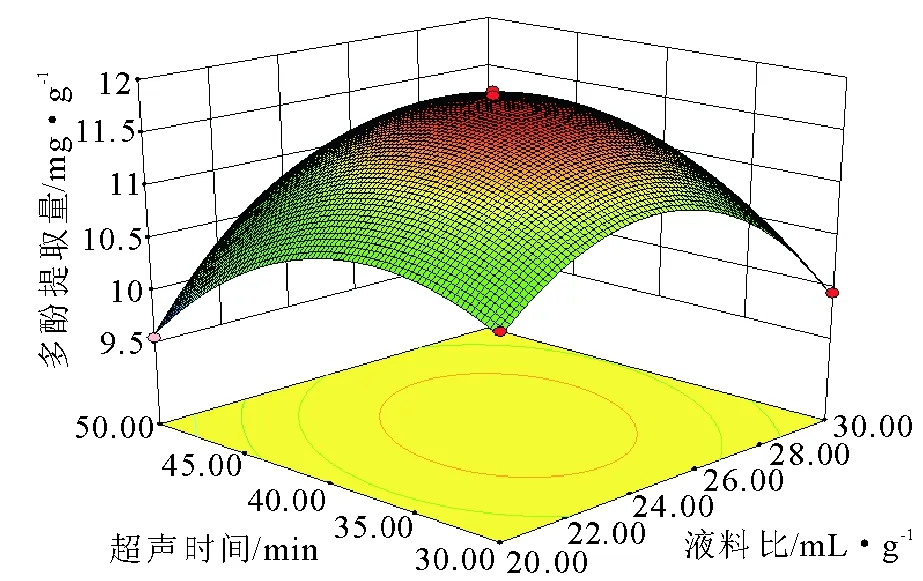
图6超声时间和液料比对多酚提取量的影响Fig.6 Effect of ultrasonic time and liquid-solid ratio on the yield of polyphenols
2.4 DPPH自由基清除能力测定结果
北苍术多酚提取液对DPPH自由基清除率的结果见图7。由图7可知,北苍术多酚提取液和抗坏血酸对DPPH自由基均有一定的清除作用,且随着其质量浓度的增加,清除率也增加,清除率最高分别可达到63.98%和96.02%。北苍术多酚提取液对DPPH自由基的清除能力可以用DPPH自由基清除率为50%时所对应的样品浓度(IC50)来衡量。经分析计算得出,北苍术多酚提取液和抗坏血酸的IC50值分别为2.10 mg/mL和0.05 mg/mL,与抗坏血酸相比,北苍术多酚提取液对DPPH自由基清除能力较弱。根据计算出的IC50值可知,北苍术多酚提取液具有清除DPPH自由基的能力,后续可通过分离纯化实验获得清除能力更强的多酚物质。

图7 北苍术多酚提取液对DPPH自由基的清除率Fig.7 DPPH radical scavenging activity of the extract of polyphenols
3 结 论
本实验首先通过单因素试验分析不同因素对北苍术多酚提取量的影响,确定合适的提取条件;再采用响应面法优化超声波辅助北苍术多酚的提取工艺,并利用Design-Expert软件分析了影响北苍术多酚提取量的因素。其中,乙醇浓度和液料比对多酚提取量影响显著,液料比和超声时间的交互作用以及乙醇浓度和超声时间的交互作用显著。最终,得出其最佳提取工艺为:乙醇浓度74%(质量分数),液料比25mL/g,超声时间37 min,在此条件下北苍术多酚提取量达到(11.67±0.15) mg/g,且得到的北苍术多酚具有较好的清除自由基的能力,可以作为天然抗氧化剂进行开发。超声波辅助提取植物多酚是一种有效的途径,利用超声波辅助提取北苍术多酚可为苍术资源的综合开发利用提供科学依据,并有利于产业化推广,具有良好的应用前景。
[1] 李云霞, 李沈明, 商春丽. 承德发展苍术种植的可行性分析[J]. 中草药, 2013, 44 (9): 1215-1218.
[2] 李万娟, 郭艳玲, 商春丽, 等. 北苍术化学成分的GC-MS分析[J]. 中国实验方剂学杂志, 2016, 22 (6): 66-70.
[3] PING J, JULIE T C, CORNELIUSEN B, et al. Lipase inhibition and antiobesity effect of Atractylodes lancea [J]. Planta Med, 2014, 80 (7): 577-582.
[4] KOONRUNGSESOMBOON N, NA BANGCHANG K, KARBWANG J. Terapeutic potential and pharmacological activities of Atractylodes lancea (Tunb.) DC [J]. Asian Pac J Trop Med, 2014, 7 (6): 421-428.
[5] RESCH M, STEIGEL A, CHEN Z L, et al. 5-Lipoxygenase and cyclooxygenase-1 inhibitory active compounds from Atractylodes lancea [J]. J Nat Prod, 1998, 61 (3): 347-350.
[6] XU K, YANG Y N, FENG Z M, et al. Six new compounds from Atractylodes lancea and their hepatoprotective activities [J]. Bioorganic & Medicinal Chemistry Letters, 2016, 26 (21): 5187-5192.
[7] CHEN F, REN C G, ZHOU T, et al. A novel exopolysaccharide elicitor from endophytic fungus Gilmaniella sp. AL12 on volatile oils accumulation in Atractylodes lancea [J].Scientific Reports,2016,6:34735.
[8] ZHEN Ouyang, LEI Zhang, MING Zhao, et al. Identification and quantification of sesquiterpenes and polyacetylenes in Atractylodes lancea from various geographical origins using GC-MS analysis [J]. Rev Bras Farmacogn, 2012, 22 (5): 957-963.
[9] KUO Xu, FENG Ziming, YANG Yanan, et al. Eight new eudesmane-and eremophilane-type sesquiterpenoids from Atractylodes lancea [J]. Fitoterapia, 2016, 114: 115-121.
[10] NAKAI Y, SAKAKIBARA I, HIRAKURA K, et al. A new acetylenic compound from the rhizomes of Atractylodes chinensis and its absolute configuration [J]. Chem Pharm Bull, 2005, 53 (12): 1580-1581.
[11] WANG K T, CHEN LG, YANG L L, et al. Analysis of the sesquiterpenoids in processed Atractylodis Rhizoma [J]. Chem Pharm Bull, 2007, 55 (1): 50-56.
[12] LIU Qiutao, ZHANG Shanshan, YANG Xihui, et al. Differentiation of essential oils in Atractylodes lancea and Atractylodes koreana by gas chromatography with mass spectrometry [J]. J Sep Sci, 2016, 39 (24): 4773-4780.
[13] CHU Shasha, JIANG Guohua, LIU Zhilong. Insecticidal compounds from the essential oil of Chinese medicinal herb Atractylodes chinensis [J]. Pest Manag Sci, 2011, 67 (10): 1253-1257.
[14] TAKAEDA O, MIKI E, TERABAYASHI S, et al. A comparative study on essential oil components of wild and cultivated Atractylodes lancea and A. chinensis [J]. Planta Med, 1996, 62 (5): 444-449.
[15] 赵光远, 许艳华, 陈美丽, 等. 石榴渣多酚提取及抗氧化活性研究[J]. 食品工业科技, 2017, 38 (5): 228-232.
[16] 郭彩霞, 任晓婷, 张生万, 等. 响应面法优化超声波辅助提取猕猴桃果皮多酚工艺研究[J]. 食品工业科技, 2017, 38 (11): 244-250.
[17] 张国强, 郭晓东, 薛文华, 等. 西藏野生卷叶黄精多酚的提取及其抗氧化活性分析[J]. 食品科学, 2017, 38 (6): 236-241.
[18] 黄雅, 陈华国, 周欣, 等. 黔产接骨草中总多酚的含量测定及抗氧化活性研究[J]. 天然产物研究与开发, 2017, 29 (2): 255-263.
[19] 卫阳飞, 刘东花, 张宏曦, 等. 窄叶鲜卑花叶中黄酮和多酚的超声提取工艺及抗氧化性研究[J]. 中药材, 2017, 40 (1): 158-163.
[20] 徐彩红, 马丽鑫, 李桂杰, 等. 响应面法优化米糠多酚的醇提工艺[J]. 食品工业科技, 2017, 38 (16): 194-198.
[21] CHEW K, KHOO M, NG S, et al. Effect of ethanol concentration, extraction time and extraction temperature on the recovery of phenolic compounds and antioxidant capacity of Orthosiphon stamineus extracts [J]. International Food Research Journal, 2011, 18 (4): 571-578.
[22] YUE T, SHAO D, YUAN Y, et al. Ultrasound assisted extraction, HPLC analysis, and antioxidant activity of polyphenols from unripe apple[J]. Journal of Separation Science, 2012, 35 (16): 2138-2145.
[23] 胡明明, 张国文, 何力, 等. 响应面法优化超声提取花生壳多酚[J]. 南昌大学学报(理科版), 2011, 35 (3): 241-246.
[24] 樊燕鸽, 张娟梅, 黄做华. 响应面法优化怀菊水溶性总多酚的超声提取工艺[J]. 食品工业科技, 2016, 37 (5): 268-272.
