阿勒泰锦鸡儿花及叶中总黄酮的超声提取工艺、抗氧化活性及化学成分研究
2018-01-19古丽斯坦阿不来提迪里木拉提毛里明
古丽斯坦·阿不来提,迪里木拉提·毛里明,姚 军
(新疆医科大学药学院, 乌鲁木齐 830011)
锦鸡儿,又名金雀花,属豆科蝶形花亚科锦鸡儿属(CaraganachinensisiTurcz.exMaxim)植物[1-2],全世界约有100余种,主要分布欧洲和亚洲的干旱和半干旱地区,我国产有62种,9个变种,12个变型[3],其中阿勒泰锦鸡儿产于我国新疆阿勒泰山青河地区[4]。研究表明锦鸡儿中主要含有黄酮类、甾体类、萜类、生物碱类等化学成分[5-9];黄酮类化合物是其主要成分[10]。黄酮类化合物具有降血压、抗肝毒性、抗炎、抗菌、抗病毒、抗痉挛等药理作用,其作用机理与总黄酮的抗氧化活性密切相关[11-14]。本研究采用超声提取法提取阿勒泰锦鸡儿叶和花中的总黄酮,通过响应面试验优化提取工艺,采用DPPH自由基、·OH自由基清除作用和铜离子还原能力试验评价阿勒泰锦鸡儿叶和花中总黄酮的抗氧化能力,采用LC-MS对阿勒泰锦鸡儿叶和花中主要黄酮类成分进行化学成分分析,现报道如下。
1 材料与方法
1.1仪器AB135-S型电子分析天平(瑞士梅特勒公司),KQ-500DE型数控超声波清洗器(昆山市超声仪器有限公司),T6型新世纪型紫外-可见分光光度计(北京慧龙环科环境仪器有限公司),HH-S4型恒温水浴锅(金坛市医疗仪器厂),LCQ DECA XP MAX型液相质谱联用仪(美国Thermo Fisher 公司),X-calibur工作站。
1.2试药芦丁对照品(上海源叶生物科技有限公司,批号20150721),无水乙醇(天津市富宇精细化工有限公司,批号20160325),二苯基苦基苯肼 (DPPH,上海梯希爱化成工业发展有限公司,批号20161024),新亚铜(上海梯希爱化成工业发展有限公司,批号20161012),醋酸铵(天津市盛奥化学试剂有限公司,批号20130412),硫酸铜(天津市盛奥化学试剂有限公司,批号20141103),抗坏血酸(天津欧博凯化工有限公司,批号20120812),水杨酸(天津市天新精细化工有限公司,批号20120911),氢氧化钠(天津永晟精细化工有限公司,批号20150916),硝酸铝(天津市致远化学试剂有限公司,批号2011-34),亚硝酸钠(天津市致远化学试剂有限公司,批号20120106),过氧化氢(天津市盛奥化学试剂有限公司,批号20111221),试剂均为分析纯。
1.3药材阿勒泰锦鸡儿全草2016年4月购于新疆阿勒泰地区哈萨克医院药房,经新疆医科大学药学院帕丽达·阿不力孜教授鉴定为豆科锦鸡儿属植物阿勒泰锦鸡儿(CaraganaaltaicaKom.Pojark)的全草。
1.4方法
1.4.1 对照品溶液的配制 称取芦丁对照品10 mg,用70%乙醇定容至50 mL容量瓶中,制得0.20 mg/mL的芦丁对照品溶液,冷藏,备用。
1.4.2 标准曲线的绘制 量取芦丁对照品溶液0、1.0、1.5、2.0、2.5、3.0 mL分别置于10 mL容量瓶中,加入0.40 mL 5% NaNO2溶液,静置6 min,加入10% Al(NO3)3溶液0.4 mL,摇匀,静置6 min,加入5.00 mL 4% NaOH溶液,用70%乙醇溶液定容至10 mL,摇匀,静置10 min,在510 nm处测定吸光度。以芦丁对照溶液的浓度为横坐标(C),吸光度为纵坐标(A)绘制标准曲线,得回归方程A=0.017 1C-0.003 3(R2=0.999 9)。
1.4.3 锦鸡儿总黄酮的超声提取方法 将阿勒泰锦鸡儿花干燥后粉粹过40目筛,称取1.00 g,加入70%乙醇溶液30 mL,浸泡15 min,在70℃下超声40 min,抽滤,冷却至室温,取1 mL置于10 mL容量瓶中,按“1.4.2”项下方法测定吸光度,计算总黄酮含量。
1.4.4 单因素考察试验 以阿勒泰锦鸡儿花粉末为原料,设定超声功率为300 W,乙醇体积分数为70%,料液比为1∶30,水浴温度为60 ℃,超声时间为40 min。固定其他条件,依次改变料液比(1∶10、1∶20、1∶30、1∶40、1∶50 g/mL)、乙醇体积分数(50%、60%、70%、80%、90%)、超声时间(20、30、40、50、60 min),以总黄酮提取含量为指标,采用单因素试验筛选各因素水平,每组试验重复3次。
1.4.5 Box-Behnken 响应面试验优化各因素水平 在单因素考察基础上,确定Box-Behnken 响应面以总黄酮的提取含量为响应值,设计3因素3水平试验方案,对提取工艺进行优化,见表1。

表1 响应面试验因素水平
1.4.6 阿勒泰锦鸡儿叶和花中总黄酮抗氧化活性研究
1.4.6.1 DPPH自由基清除能力测定 称取20 mg DPPH试剂,用无水乙醇溶解并定容于250 mL容量瓶,配制成浓度为2×10-4mol/L的溶液。取5支具塞试管依次加入(浓度为0.006、0.012、0.018、0.024、0.03 mg/mL)样品溶液各2 mL及DPPH溶液2 mL,无水乙醇1 mL使反应总体积为5 mL,摇匀。遮光静置30 min,于517 nm处测定吸光度(Ai),计算清除率,以VC为阳性对照,每组试验重复3次。式中:A0为无水乙醇2 mL+DPPH 2 mL+无水乙醇1 mL时的吸光度值;Aj为无水乙醇2 mL+待测样品2 mL+无水乙醇1 mL时的吸光度值;Ai为待测样品2 mL+DPPH 2 mL+无水乙醇1 mL时的吸光度值。
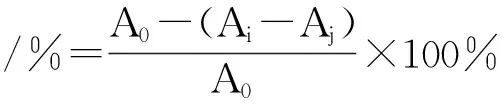
1.4.6.2 羟自由基清除能力测定 取5支具塞试管依次向其中加入2.0 mmol/L 的FeSO4溶液2.0 mL,1.0 mmol/L的 H2O22.0 mL,振荡,摇匀,再加入6.0 mmol/L水杨酸3.0 mL,摇匀,于37℃水浴加热15 min,在510 nm处测定吸光度(A0),然后分别向5支试管中加入待测样品0.2、0.4、0.6、0.8、1.0 mL,再分别加入超纯水0.8、0.6、0.4、0.2、0.0 mL,摇匀,37℃下水浴加热15 min,在510 nm处测定吸光度(Ax),计算清除率。以VC为阳性对照,每组试验重复3次。
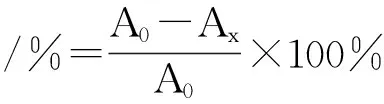
1.4.6.3 铜离子还原能力的测定 分别取0.5 mL(浓度为0.8、1.6、2.4、3.2、4.0 、4.8 mg/L)的样品液,加入0.01 mol/L CuSO4和7.5 mmol/L新亚铜试剂各0.125 mL混合,再加入0.2 mol/L pH值为7.0的NH4Ac缓冲液至总体积为1.0 mL,摇匀,静置30 min,于450 nm波长处测定吸光度,计算还原百分率。以VC为阳性对照,每组试验重复3次。式中:A0为不加样品时的吸光度值;Amax为在系列样品溶液中溶液浓度最高时的吸光度值;A为样品在450 nm处的吸光度值。
相对总还原百分率/%=(A-A0)/(Amax-A0)
1.4.7 花和叶中黄酮类成分质谱鉴定 色谱条件:Waters C18色谱柱(250 mm×3.0 mm,5 μm );柱温25℃;体积流速0.3 mL/min;进样量5 μL;流动相为乙腈(A)-0.2%甲酸溶液(B),梯度洗脱程序:0~25 min A:15%~50%。质谱条件:电喷雾离子源ESI,扫描范围:100~1 100(m/z),采用负离子检出模式,干燥气为N2,干燥气温度300℃,流速30 L/min,毛细管电压30 V,雾化器压力345 kPa,碰撞诱导解离电压45 eV。
2 结果
2.1单因素试验结果在超声温度为60~65℃条件下(1)控制反应条件:时间为40 min,乙醇体积分数为70%,料液比分别为1∶10、1∶20、1∶30、1∶40、1∶50时,超声提取总黄酮的含量为10.30、13.81、14.74、15.43、15.55 mg/g,当料液比为1∶50时,总黄酮含量最高。(2)控制反应条件:时间为40 min,料液比为1∶50,乙醇体积分数分别为20%、30%、40%、50%、60%、70%、80%、90%时,超声提取总黄酮的含量为16.63、17.42、17.81、19.36、19.41、18.84、16.0、11.72 mg/g,当乙醇浓度增加到60%时提取含量开始下降。(3)控制反应条件:料液比为1∶50,乙醇体积分数为60%,超声时间分别为20、30、40、50、60 min时,超声提取总黄酮的含量为21.12、21.63、22.72、22.85、20.31 mg/g,当超声时间为50 min时总黄酮的含量最高。
2.2Box-Behnken响应面试验分析以料液比(A)、提取时间(B)、乙醇体积分数(C)3个因素为自变量,总黄酮提取含量为响应值,通过三因素三水平响应面试验,实验结果见表2。通过软件Design-Expert8.0.6 对表2的数据进行分析,得到方差分析结果,见表3和图1-3。通过多元回归拟合分析得到金雀花中总黄酮提取含量(Y)与料液比(A)、超声时间(B)和乙醇体积分数(C)之间的二次多项回归方程:Y=-0.032 313+(1.193×10-3)A+(1.617 5×10-4)B+(6.98×10-4)C+(1.25×10-6)AB-(7.5×10-7)AC+(2.5×10-6)BC-(1.36×10-5)A2-(2.35×10-6)B2-(6.35×10-6)C2。根据方差分析结果,回归方程的P=0.005 8<0.01,表明试验所用的模型极为显著,可进行响应值预测,失拟项检验的P=0.169 5,R2=0.912 5,模型对实际情况拟合良好。二次模型统计学分析表明,各因素对总黄酮提取含量的影响大小顺序为B>C>A。通过软件Design-Expert8.0.6 得出最佳提取工艺条件:乙醇体积分数(C)为60%、料液比(A)1∶47.40、超声时间(B)50 min;为操作可行,将料液比调整为1∶50。根据所得的条件进行3组验证实验,总黄酮平均提取含量为22.3 mg/g,测定结果稳定,偏差不大,证明该结果合理可靠。
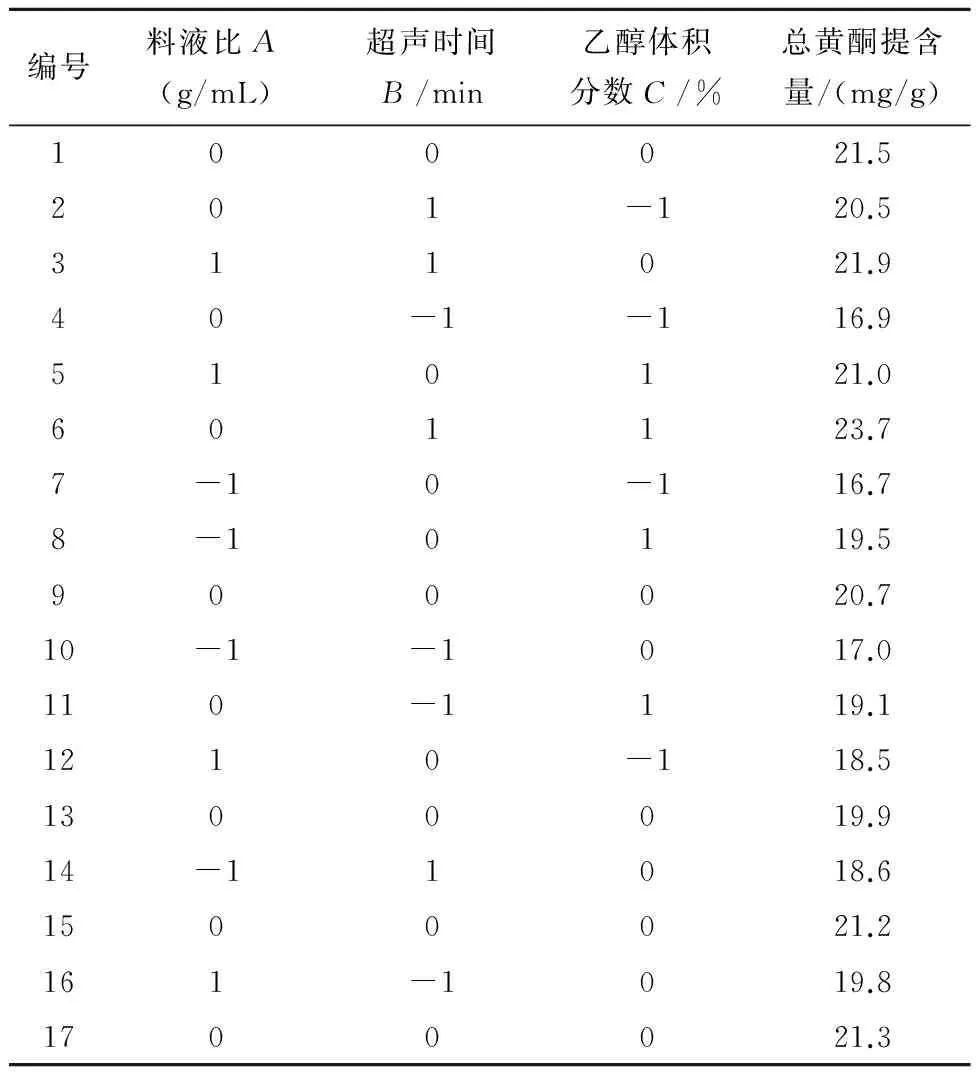
表2 box-behnken试验设计及结果
2.3阿勒泰锦鸡儿花、叶、根、茎中总黄酮提取含量的测定在最佳提取工艺条件下测得阿勒泰锦鸡儿不同部位中总黄酮的含量分别为:花22.3 mg/g,叶27.3 mg/g,根8.71 mg/g ,茎6.55 mg/g。
2.4抗氧化试验锦鸡儿叶和花中总黄酮对DPPH自由基、·OH自由基的清除能力和铜离子还原能力随着黄酮浓度的增大而增加。当总黄酮浓度为0.04 mg/mL时叶和花对DPPH自由基清除率分别为79.7%、84.4%,相同浓度的阳性对照VC的清除率为90.3%;当总黄酮浓度为3.2 μg/mL时叶和花对铜离子总还原百分率分别为85.4%、91.8%,相同浓度的阳性对照VC的清除率为96.3%;表明,随着溶液浓度的升高,叶和花中总黄酮的DPPH自由基清除率和铜离子还原百分率逐渐缓慢接近于VC的清除率;当总黄酮浓度为4.0 mg/L时叶和花对·OH自由基清除率分别为27.1%、30.5%,相同浓度的阳性对照VC清除率为71.2%、由此可知花和叶的·OH自由基的清除能力远小于VC的清除率,见图4-6。
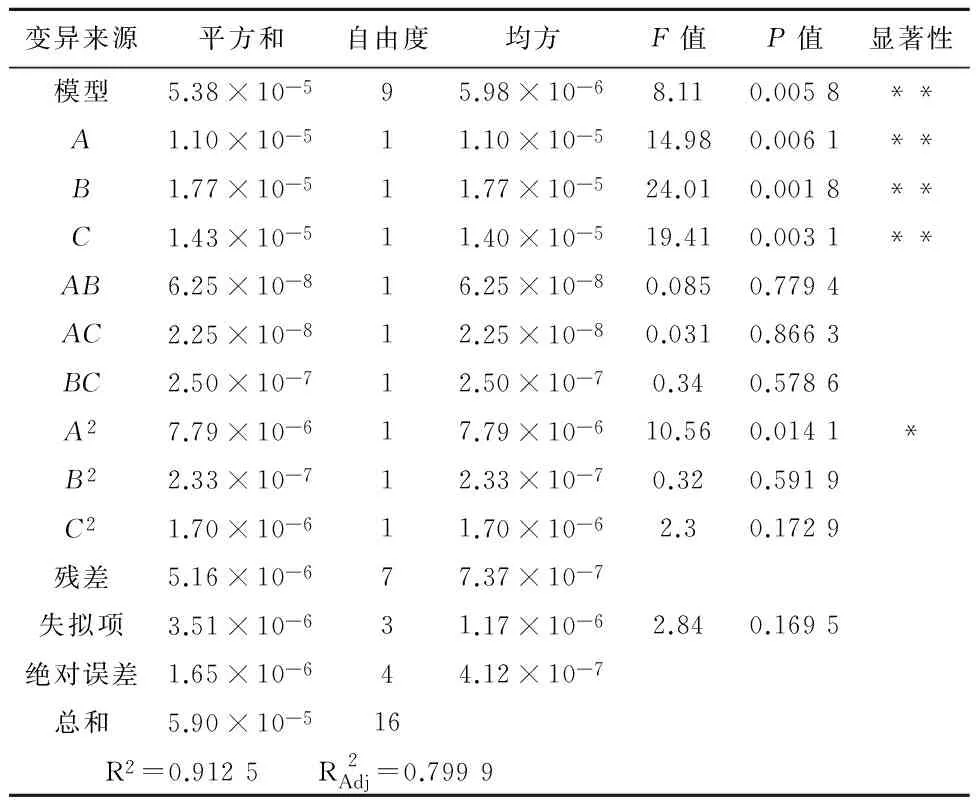
表3 多项式模型方差分析
注:显著性,**P<0.01显著,*P<0.05较显著。
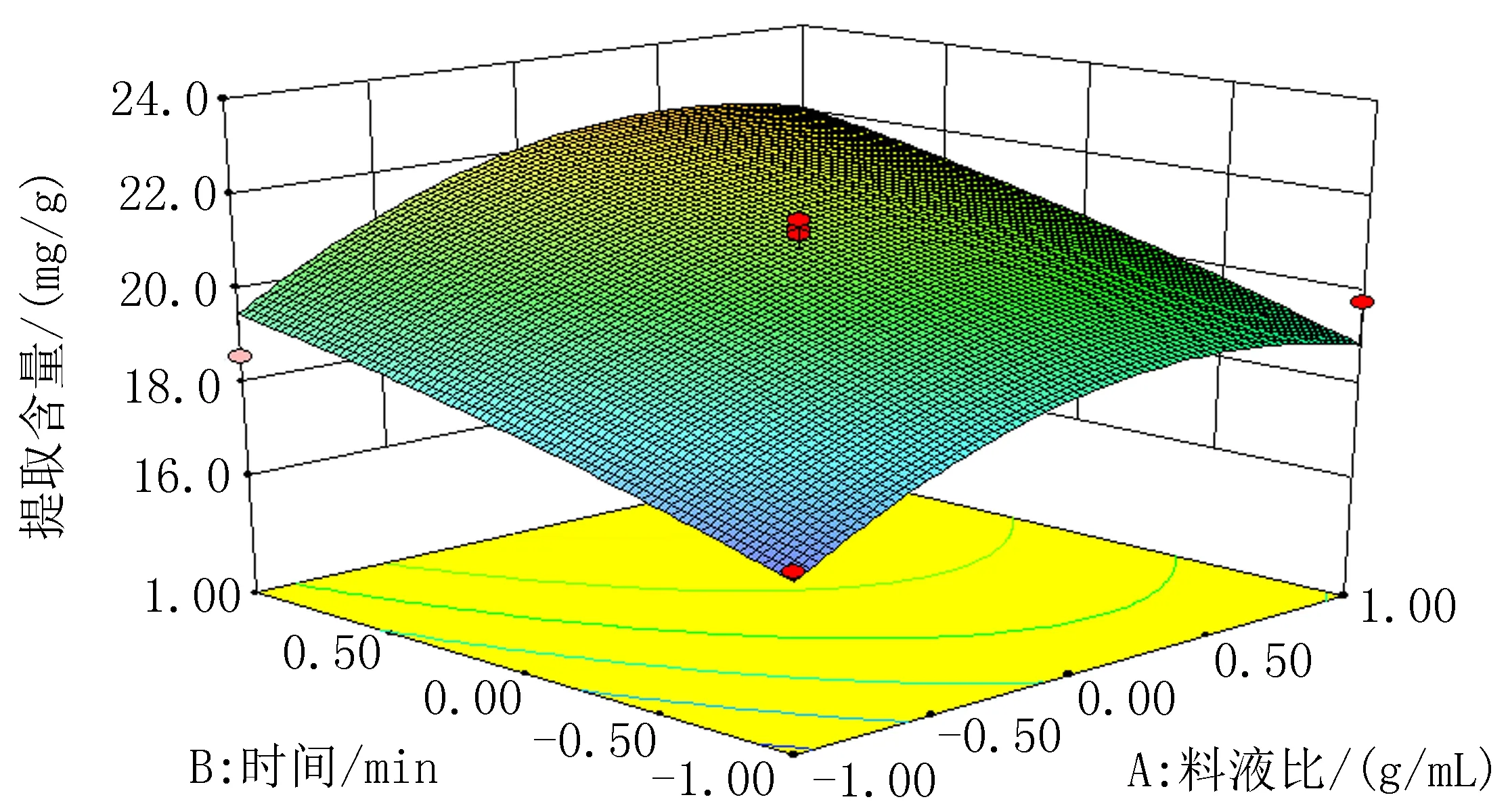
图1 料液比与提取时间响应面图
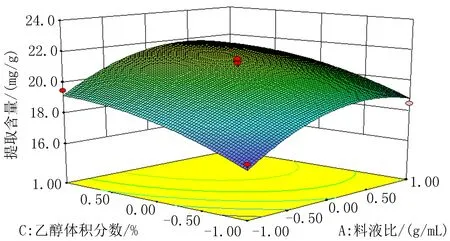
图2 料液比与乙醇体积分数响应面图
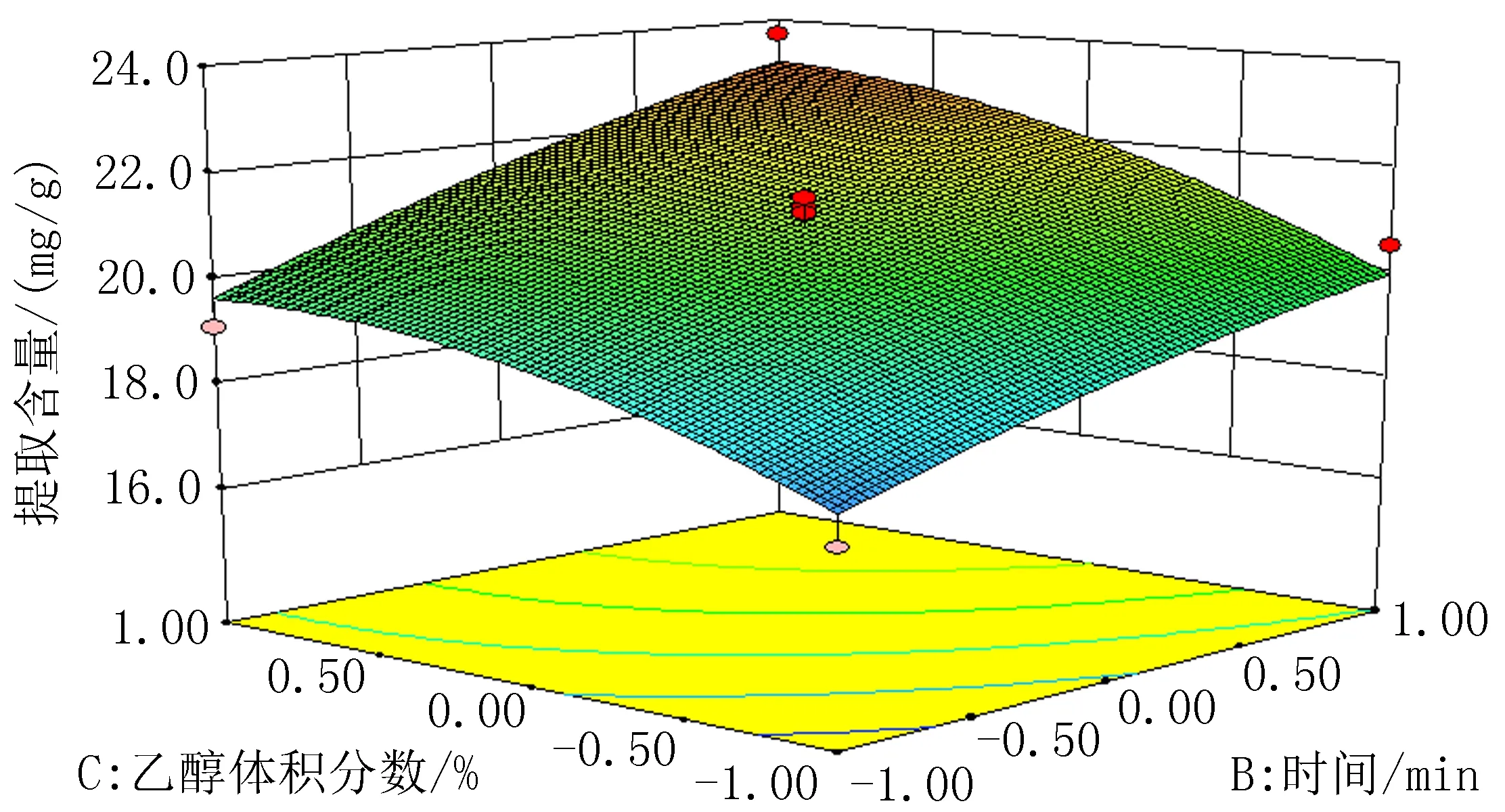
图3 提取时间与乙醇体积分数响应面图
2.5花和叶中黄酮类成分质谱鉴定通过最佳提取工艺提取叶和花中总黄酮,利用质谱鉴定得到花和叶的总离子流图,见图7-8。通过LC-MS鉴定花和叶样品中黄酮类成分,锦鸡儿花中有9种黄酮苷,叶中有8种黄酮苷,其花和叶中共有的为:槲皮素-3-O-(二鼠李糖)-芸香糖-7-O-鼠李糖苷、山奈酚-3-O-(二鼠李糖)-芸香糖-7-O-鼠李糖苷、槲皮素-3-O-(二鼠李糖)-芸香糖苷、山奈酚-3-O-(二鼠李糖)-芸香糖苷、芦丁、异鼠李素-3-O-芸香糖苷、山奈酚-3-O-芸香糖苷。异鼠李素-3-O-葡萄糖苷只存在于叶中,而杨梅素-3-O-芸香糖苷和异鼠李素-3-O-鼠李糖(1→2)鼠李糖(1→6)葡萄糖苷存在于花中。花中山奈酚-3-O-(二鼠李糖)-芸香糖-7-O-鼠李糖苷和芦丁的含量较高,叶中山奈酚-3-O-(二鼠李糖)-芸香糖苷和芦丁的含量较高,见表4。
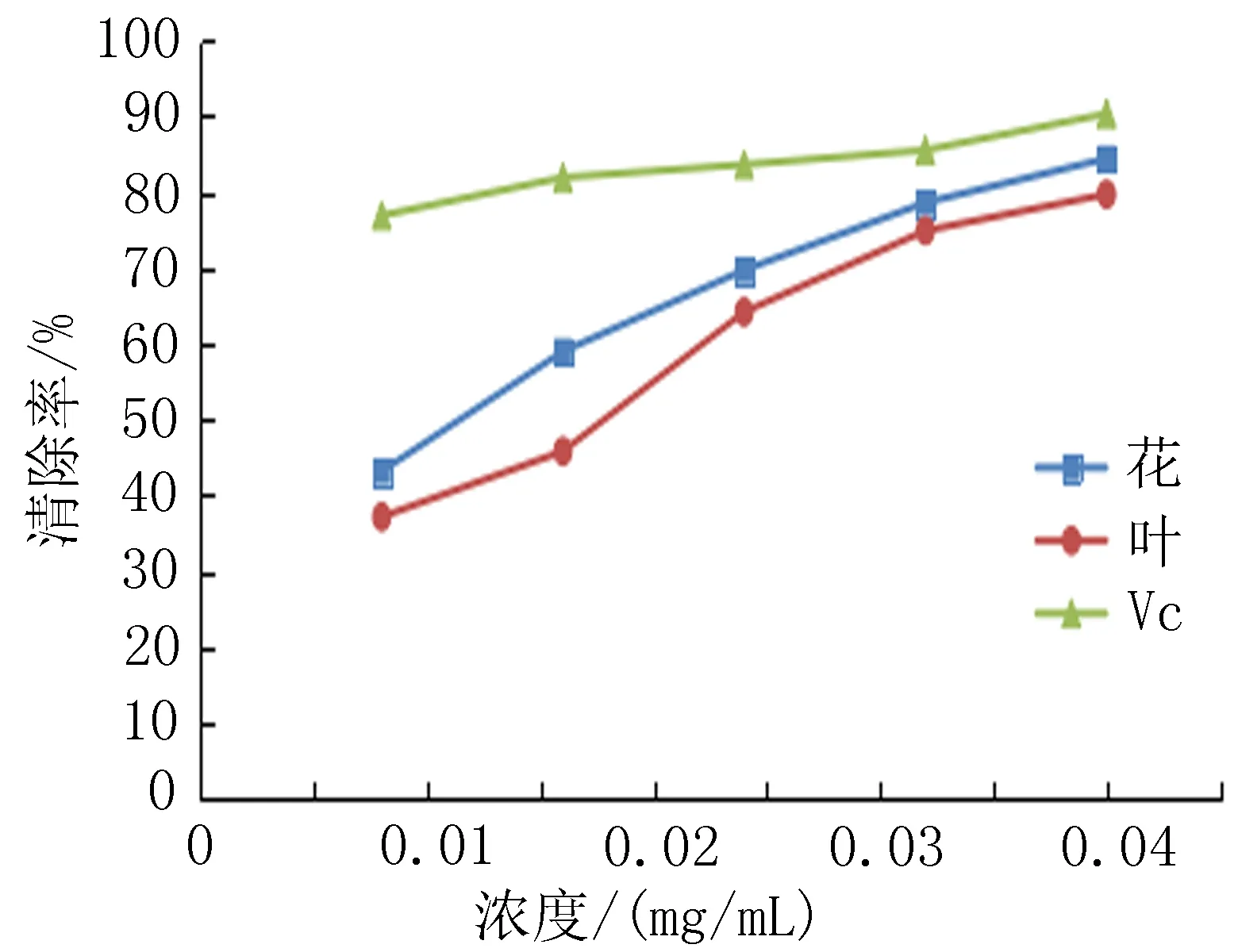
图4VC与叶、花中总黄酮的DPPH自由基清除能力

图5VC与叶、花中总黄酮的铜离子还原能力

图6VC与叶、花中总黄酮的·OH自由基清除能力
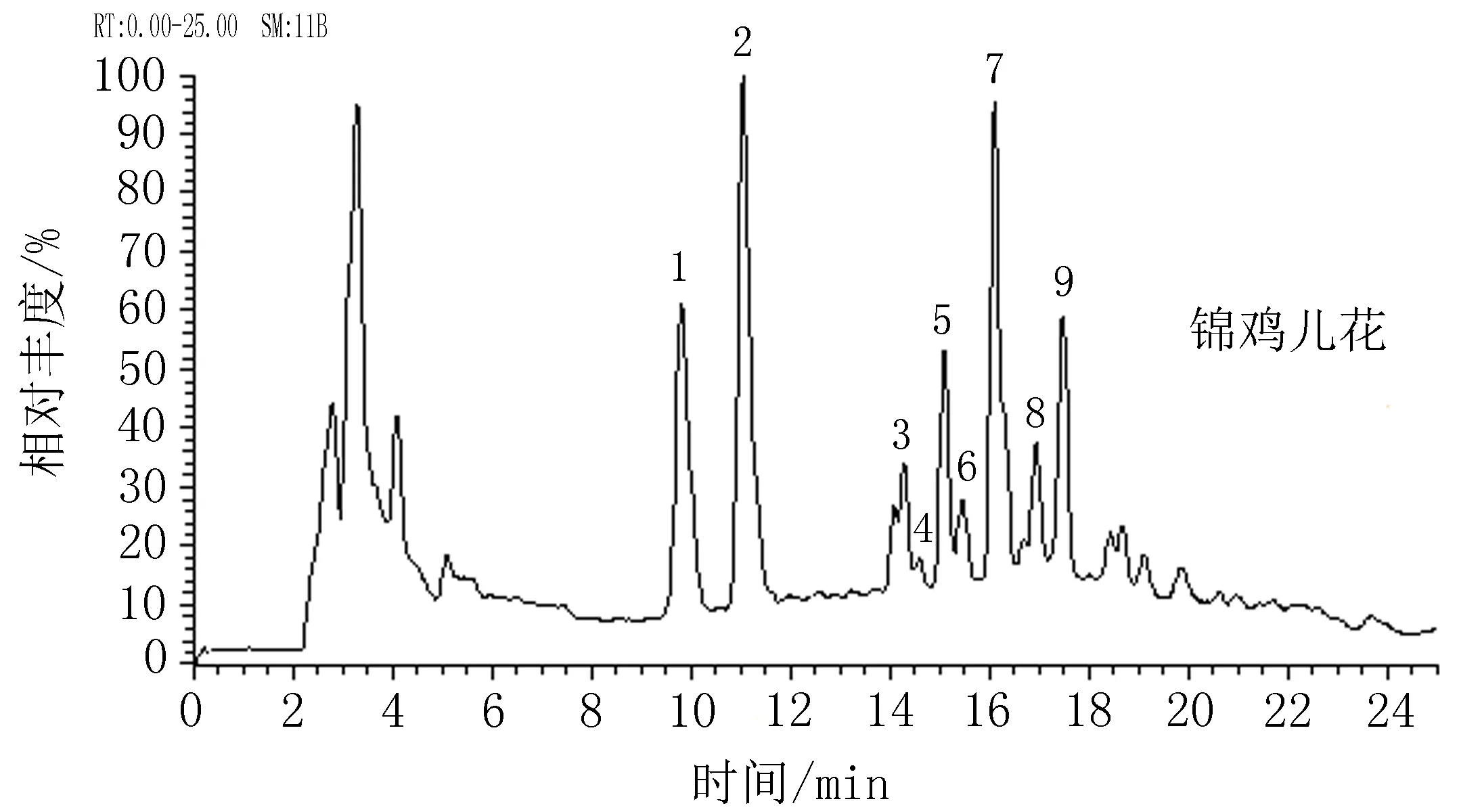
图7锦鸡儿花的总离子流图
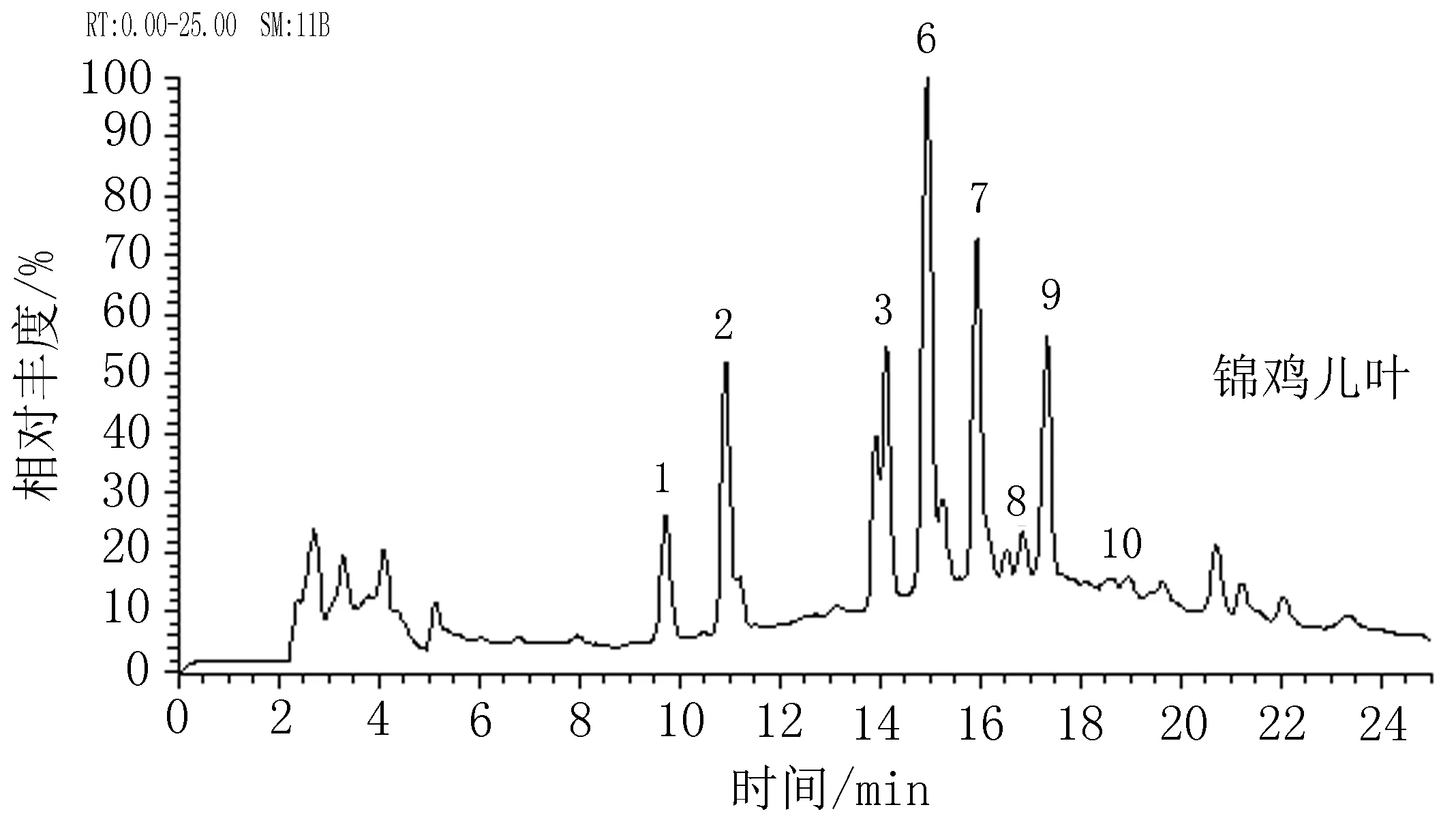
图8锦鸡儿叶的总离子流图
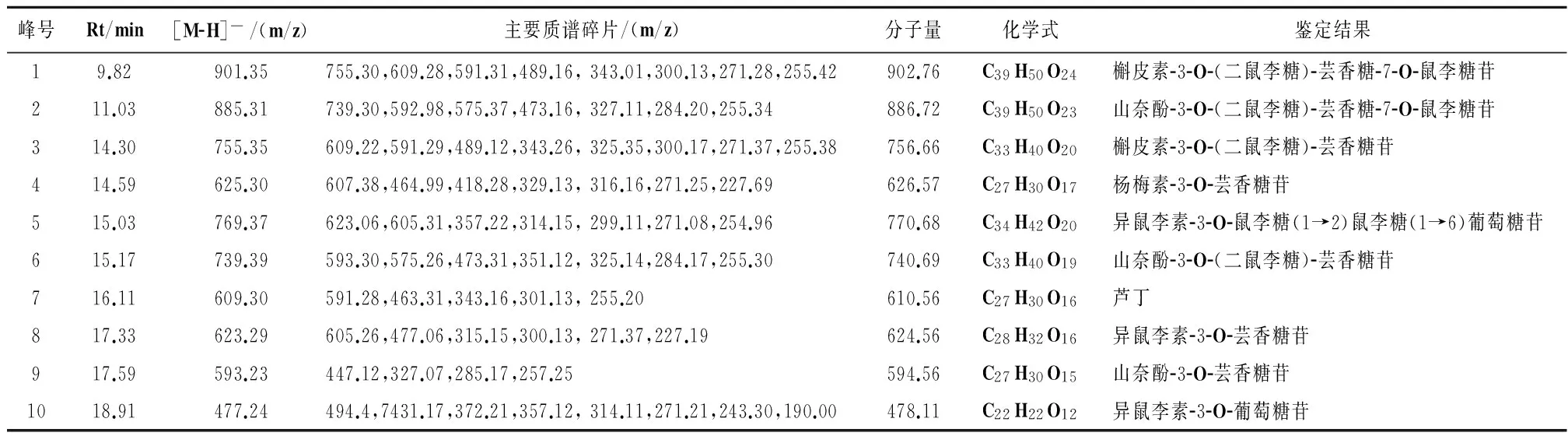
表4 阿勒泰锦鸡儿花与叶主要黄酮苷的质谱数据和鉴定结果
3 讨论
杨申明等[15]采用回流提取法提取锦鸡儿花,结果花中总黄酮含量为1.543mg/g,而本研究采用超声提取法提取锦鸡儿花和叶,结果花中总黄酮含量为22.3mg/g,叶中总黄酮含量为27.3mg/g。由于
加热回流等传统提取方法费时、操作繁琐,药材长期处于高温状态易发生氧化,超声提取所需时间短,避免了药材长时间处于高温下的氧化,从而使得产率和产品质量都得以提高[16]。本研究采用3种抗氧化试验评价阿勒泰锦鸡儿叶和花中总黄酮的抗氧化能力,发现阿勒泰锦鸡儿花中总黄酮含量低于叶中的总黄酮含量,但其抗氧化能力强于叶。采用LC-MS对阿勒泰锦鸡儿叶和花进行化学成分分析,发现阿勒泰锦鸡儿叶和花中所含黄酮苷的种类相似,但花和叶中各种黄酮苷含量不同,由于不同种黄酮的抗氧化能力不同,因此尽管花中总黄酮含量低于叶,但其抗氧化能力强于叶。
[1] 全国中草药汇编.全国中草药汇编(上)[M].北京:人民卫生出版社,1981:396-397.
[2] 云南省药物研究所.云南天然药物图鉴[M].昆明:云南科技出版社,2012:475.
[3] 潘兰,贾新岳,石明辉,等.新疆产四种锦鸡儿的民族植物学调查[J].中国现代中药,2013,15(7):578-579.
[4] 江纪武.药用植物大辞典[M].天津:天津科学技术出版社,2005:135-141.
[5] 王曙光.锦鸡儿化学成分及质量标准研究[D].上海:复旦大学,2004.
[6] 舒娜.锦鸡儿化学成分、含量及其变化研究[D].上海:复旦大学,2006.
[7] LUO H F,ZHANG L P,HU C Q.Five novel oligostilbenes from the roots of Caragana sinica [J].Tetrahedron,2001,57:4849-4854.
[8] CHENG K J, MA D Y,YANG G X,et al. A new tetrastilbene from Caragana sinica [J].Chinese chem let,2008,19:711-715.
[9] 太志刚.四种花卉化学成分及其抗氧化活性研究[D].昆明:云南大学,2011.
[10] 潘兰,贾盛杰,贾新岳,等.金雀花及金雀根化学成分研究[J].医药前沿,2014(6):326-327.
[11] 吴立军.天然药物化学[M].6版.北京:人民卫生出版社,2011:7.
[12] 王蓓蓓,牛付阁,段玉峰.高良姜与大高良姜总黄酮抗氧化活性比较研究[J].食品科学,2011,32(7):117-120.
[13] 吴碧华,龙存国,王晓明,等.甘草总黄酮清除羟自由基作用的体外实验探讨[J].川北医学院学报,2001,16(1):3-5.
[14] 周海玲,马麟,易智彪.基于三种体外抗氧化方法对白木香种子抗氧化能力的研究[J].中国医药导报,2016,13(22):326-327.
[15] 杨申明,王波,王振吉,等.金雀花中总黄酮提取工艺优化及抗氧化性研究[J].浙江农业学报,2015,27(2):278-284.
[16] 张庆云.茶多酚提取方法的进展[J].中国茶叶,2003,25(1):15-16.
