不同浓度尿酸对脂肪变性肝细胞氧化损伤的影响
2018-01-19程实,杨艳,马玲,周勇,向薇,姚华
程 实, 杨 艳, 马 玲, 周 勇, 向 薇, 姚 华
(1新疆医科大学, 乌鲁木齐 830011; 2乌鲁木齐市人民医院北院(儿童医院), 乌鲁木齐 830011;3新疆医科大学第一附属医院, 乌鲁木齐 830054)
非酒精性脂肪肝病(non-alcoholic fatty liver disease, NAFLD)近年来患病率快速增长,使其已经成为发展中国家最为普遍的慢性肝病之一[1-2]。NAFLD发生及发展的病理机制至今还不完全明确,但氧化应激被认为可能是NAFLD发生和发展的重要因素[3]。氧化应激是体内抗氧化能力无法平衡体内逐渐增高的氧化能力所导致的一种应激现象[4]。随着甘油三酯(triglyceride, TG)在肝细胞内堆积,过氧化氢(H2O2)作为其氧化代谢的副产物也不断增多,随着时间的推移就会使动物或者人类肝细胞产生氧化应激[5]。动物实验和人类研究都揭示了氧化应激与NAFLD之间呈正相关关系[6-7]。尿酸(uric acid, UA)是血液中强有力的自由基清除剂,大约有60%的自由基由UA负责从血液中清除[8]。在人类进化进程中,尿酸酶的失活、血液中尿酸水平的升高可能是为了适应血液中过量的自由基和氧化应激从而进化出的一种保护机制[8]。虽然UA的抗氧化能力预示着其可能对于肝细胞的氧化应激有治疗作用,但是最近的研究都显示尿酸水平与NAFLD呈正相关关系[9-10],并且,根据现有的研究结果,UA可能在NAFLD的发生和发展中都有促进作用,并且其可以通过损伤细胞内NADPH氧化酶来促进细胞产生氧化应激[11]。但是,UA与包括NAFLD在内的多种疾病之间在机制上是怎样的关系,具体起着什么样的作用至今还不完全明了。本研究采用不同浓度UA干预细胞,检测细胞中活性氧(reactive oxygen, ROS)水平,总超氧化物岐化酶(superoxide dismutase, SOD)活性,还原性谷胱甘肽(glutathione, GSH),丙二醛(malondialdehyde, MDA)的含量。细胞凋亡水平、天门冬氨酸氨基转移酶(aspartate transaminase, AST)和丙氨酸氨基转移酶(alanine aminotransferase,ALT)的活性,反应肝细胞的损伤,旨在研究UA对脂肪变性肝细胞的氧化应激作用。
1 材料与方法
1.1细胞系L-02细胞系购自南京凯基生物有限公司,用含10%血清的DMEM高糖培养基于37℃,5%CO2的培养箱中进行连续培养。
1.2主要仪器及试剂油酸(Sigma-Aldrich公司),MTT粉剂(Invitrogen公司),PEAnnexin V 凋亡试剂盒(BD公司),BCA蛋白浓度测定试剂盒、ROS测定试剂盒、还原性GSH含量测定试剂盒、甘油三酯含量测定试剂盒、总SOD活性测定试剂盒和MDA含量测定试剂盒、AST活性测定试剂盒、ALT活性检测试剂盒均购自南京建成生物技术研究所。酶标仪(BIO-RAD,Benchmark Plus),水浴锅(北京永光明,DZKW-D2),超净工作台(AIRTECH,SW-CJ-2F),高速离心机(Thermo,BR4),流式细胞仪(Beekmen Coulter),荧光倒置显微镜(Olympus,IX71),超声破碎仪(SCIENTZ,950E)。
1.3各试剂的配制
1.3.1 OA培养基的配制 称取40 mg NaOH粉剂溶解于5 mL超纯水中,称取282 mg OA粉剂于NaOH溶液中70℃水浴中反应1 h,待溶液透明无沉淀后用超纯水定容至10 mL,即配成100 mmol/L OA工作液,按照每10毫升完全培养基中加30 μL OA工作液的比例配成OA培养基,现用现配。未用完的OA工作液于4℃保存。
1.3.2 UA培养基的配制 称取UA粉剂13.5 mg于10 mL完全培养基中,于电磁混匀器上常温下混匀3 h,混匀后将其用完全培养基定容至45 mL并用0.22 μm滤器过滤,即配制成了30 mg/dL的UA母液,并按照一定比例用完全培养基分别稀释成5、10和20 mg/dL浓度的UA培养基各20 mL,待用。
1.4方法
1.4.1 脂肪变性模型的建造 将L-02细胞系接种在25 cm2培养瓶中进行传代培养。待细胞融合度达到80%,对细胞进行计数并按照5×103个/mL密度接种于96孔板,待贴壁生长1 d后用不同浓度的油酸培养基干预24 h后,进行MTT细胞活力检测。同样将正常培养的L-02细胞按照3×105个/mL铺至六孔板,待细胞贴壁生长1 d后用配制好的不同浓度的油酸培养基干预24 h后破碎细胞,测胞浆TG。
1.4.2 UA的干预 将正常培养的L-02细胞按照1×105个/mL密度接种至6孔板,待细胞贴壁生长1 d后用筛选出的最佳油酸浓度进行造模,造模24 h后分别用0、5、10、20、30 mg/dL的UA对模型细胞分别干预24、48和72 h,并设置不干预细胞为正常对照组,油酸干预细胞为模型组,其中,5 mg/dL是正常人体血尿酸水平组,其余3个尿酸干预组均为高尿酸水平组[9]。
1.4.3 胞内ROS水平的检测 将DCFH-DA试剂与PBS按照1∶10 000进行配制,将UA干预过的细胞去培养基后直接在六孔板中用稀释后的DCFH-DA溶液于37℃培养箱中避光孵育30 min,放置于荧光倒置显微镜下用蓝色激发光进行荧光激发,于200倍视野下观察,曝光时间50 ms,进行拍照。
1.4.4 胞浆SOD、MDA、GSH、ALT及AST的检测 将细胞进行尿酸干预后,对细胞进行超声破碎,检测细胞总蛋白质含量后按照SOD、MDA、GSH、ALT及AST检测试剂盒的说明进行相应检测。
1.4.5 流式细胞检测细胞凋亡 将UA干预后的细胞用胰酶消化,将收集的的细胞离心后按照试剂盒说明进行PE Annexin V和7-AAD2种荧光染料的孵育。孵育后取1×105个细胞进行流式分析。
1.5统计学处理采用SPSS 23.0统计软件对数据进行处理。对实验所得计量数据进行正态性检验,方差齐者多组间直接用单因素ANOVA分析组间整体差异,如有差异则用Tukey法进行两两比较;方差不齐者,用Brown-Forsythe对单因素ANOVA结果进行校正,如果有差异则用Games-Howell法进行两两比较。如果数据不符合正态性,则用非参数的秩和检验进行统计分析。试验中得到的百分率数据用χ2检验进行统计,总体检验水准取α=0.05,在两两比较时,因为同一时间各组间进行了9次比较,所以需对检验水准α进行分割,最终两两比较的检验水准为α=0.006。
2 结果
2.1L-02细胞脂肪变性模型的建造在所选的4个OA浓度中,与其他3个浓度相比,0.4 mmol/L的浓度的OA明显降低了细胞的活性,且差异有统计学意义(P<0.05),所以本研究中将0.4 mmol/L浓度去除(图1a)。用0.3 mmo/L的OA干预细胞后,胞内TG含量明显高于0.1和0.2 mmol/LOA干预组(图1b),因此本研究选择0.3 mmol/LOA作为造模最佳浓度条件。

a: 不同浓度OA干预L-02细胞后MTT的结果
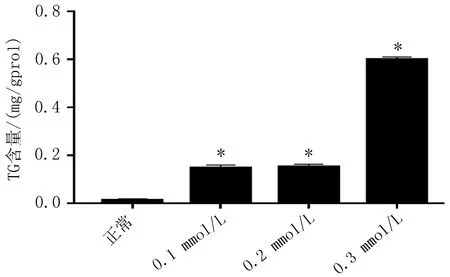
b:不同浓度OA干预L-02细胞后胞内TG含量
图1不同浓度油酸干预L-02细胞MTT和TG结果
2.2胞浆ROS、MDA、SOD及GSH的检测正常细胞随着培养时间的增加,ROS荧光强度在72 h内增加。模型组每个时间点的荧光强度都明显强于正常对照组。在UA的干预下,5 mg/dL和10 mg/dL组每个时间点的荧光强度均低于模型组。当UA浓度升高至20 mg/dL时,干预24 h相对于模型组可以看出明显的荧光强度的差异。30 mg/dL UA干预时,已看不出其与模型组的差异,72 h干预时其荧光强度略强于模型组(图2)。
模型组细胞内MDA含量在各干预时间都明显高于正常对照组细胞,差异有统计学意义(P<0.05),在进行不同尿酸干预后,除10 mg/dL UA组48和72 h与24 h没有明显差异外,其余浓度组随着干预时间的延长MDA含量明显上升,差异有统计学意义(P<0.05)。且10 mg/dL组各干预时间MDA含量均与正常细胞比较差异无统计学意义(表1)。
模型组细胞内SOD活力相比于正常对照组细胞明显升高,差异有统计学意义(P<0.05),5 mg/dL组在各干预时间的总SOD活性与模型组比较差异无统计学意义。10 mg/dL组48 和72 h与24 h的总SOD活力相比均没有明显差异,但其在48 h与同时间的模型组总SOD活力差异有统计学意义(P<0.05)。各组间72 h干预时间均没有明显差异(表1)。
OA干预后,模型组细胞GSH含量在各干预时间内均明显低于正常对照组细胞,差异有统计学意义(P<0.05)。24 h时,所有UA干预组的GSH含量比模型组均明显增加,其中5和20 mg/dL组GSH含量明显高于正常对照组细胞(P<0.05)。48 h时,20和30 mg/dL组细胞内GSH含量明显低于模型组细胞,差异有统计学意义(P<0.05)。72 h时,各组细胞相较正常组GSH均明显降低,差异有统计学意义(P<0.05)(表1)。
24 h 48 h 72 h
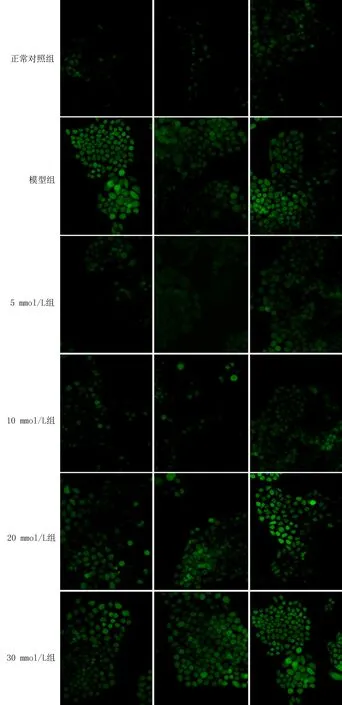
图2 胞内ROS荧光强度检测(×200)

正常对照组模型组5mg/dL组10mg/dL组20mg/dL组30mg/dL组PMDA/(nmol/gprot) 24h0.491±0.1000.699±0.123#0.559±0.0730.521±0.0830.468±0.0530.549±0.135 0.001 48h0.504±0.0240.847±0.086*#0.677±0.047*#0.541±0.0680.631±0.055*#0.587±0.114<0.001 72h0.593±0.040*0.834±0.094*#0.708±0.057*#0.570±0.0310.731±0.079*0.870±0.209*#<0.001 P0.0180.015<0.0010.334<0.0010.001SOD/(U/gprot) 24h10.936±0.84014.855±1.544#13.560±1.52712.201±2.68910.356±1.33311.415±1.3190.009 48h9.377±0.193*12.098±1.10513.558±1.279#10.217±1.44911.679±0.096#9.452±0.7030.003 72h10.101±0.34810.421±0.191*10.682±0.40010.383±0.2379.948±0.99410.219±0.4270.461 P0.0120.0050.0190.2640.1020.063GSH/(μmol/gprot) 24h40.555±0.12027.276±0.250*#46.645±0.099#31.009±0.144#52.145±0.292#39.295±0.071#<0.001 48h32.920±0.192*22.225±0.346*#31.833±0.081*#30.256±0.131*#22.016±0.045*#18.358±0.125*#<0.001 72h32.562±0.793*18.477±0.019*#26.714±0.070*#28.905±0.077*20.710±0.099*#15.916±0.094*#<0.001 P0.002<0.001<0.001<0.001<0.001<0.001
注:与同浓度24 h比较,*P<0.05; 与正常对照组比较,#P<0.05。
2.3不同浓度UA干预对于L-02脂肪变性细胞损伤的影响各组细胞AST活性并没有随着UA干预时间的增加而呈现出明显的规律,但在24和48 h的干预下模型组的AST活性明显高于正常对照组,差异有统计学意义(P<0.05),而20 mg/dL和30 mg/dL组24和48 h时与模型组活性没有差异。10 mg/dL UA组和对照组在各时间点差异均无统计学意义。72 h时,对照组、模型组、10 mg/dL及30 mg/dL组AST活性之间差异无统计学意义(图3a)。
ALT活性随着干预时间的增长,呈现出了上升趋势,但是,模型组ALT活性只在72 h时明显高于正常对照组,UA干预组除5 mg/dL组外,各组从48 h开始都明显高于正常对照组,30 mg/dL组在各干预时间点均明显高于模型组,差异有统计学意义(P<0.05)(图3b)。
模型组各时间点细胞凋亡率与对照组比较差异有统计学意义(P<0.05)。各UA干预组在前24和48 h时都降低了脂肪变性引起的细胞凋亡,差异有统计学意义(P<0.05)。而30 mg/dL组在72 h细胞凋亡率高于模型组,差异有统计学意义(P<0.05),见表2。
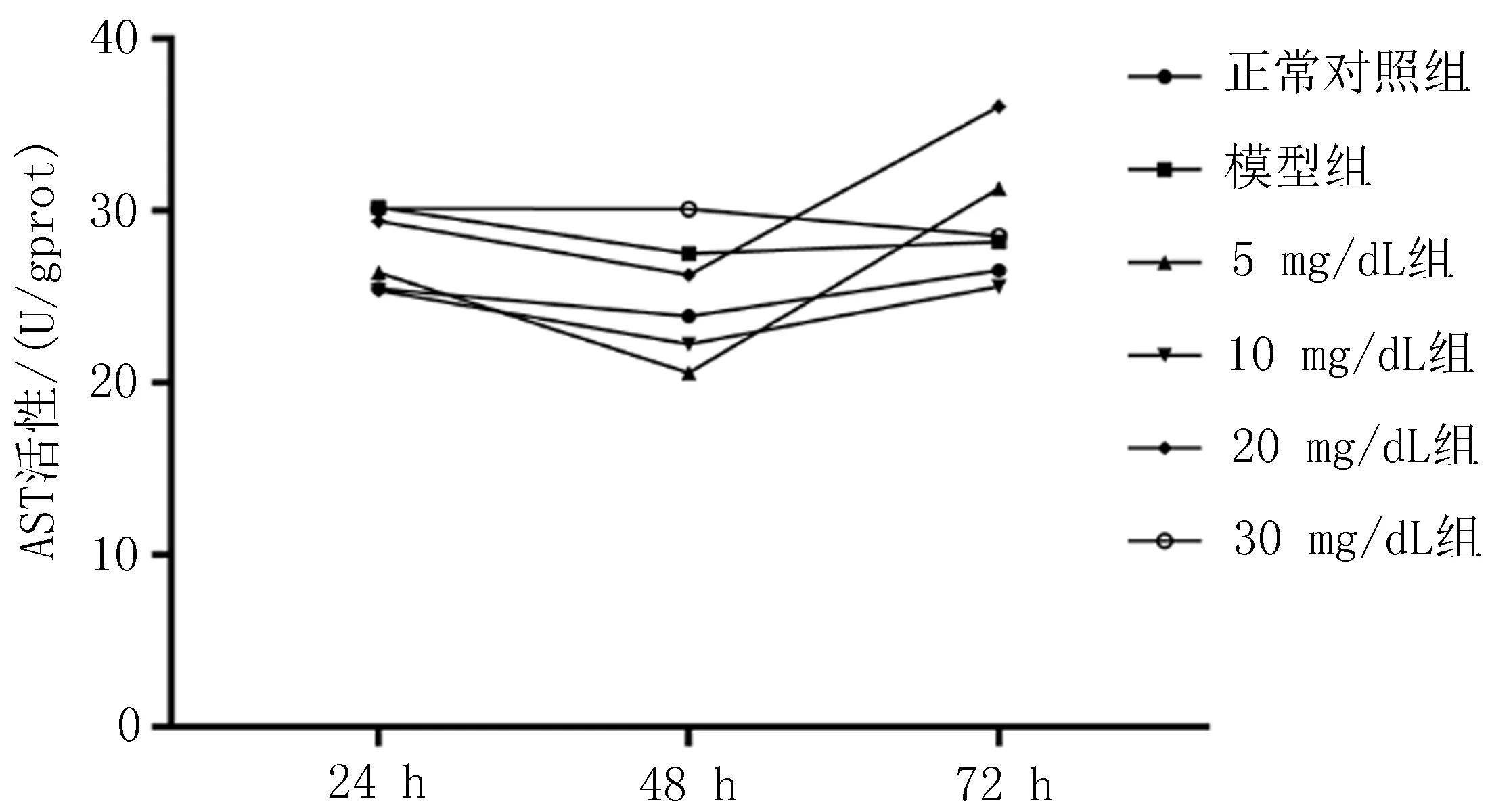
a: AST活性
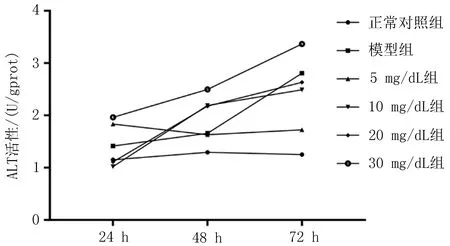
b: ALT活性

图3 不同浓度UA干预后各组胞内转氨酶活性的检测
注: 与正常组比较,*P<0.006; 与模型组比较,△P<0.006。
3 讨论
脂肪的累积是NAFLD发病的基础条件[12],过多的脂质在肝细胞内代谢引起的氧化应激会造成肝脏的损伤,这将加快NAFLD向更严重阶段发展的速度。氧化应激是细胞内ROS或者活性氮的产生超过了细胞清除他们的能力而造成的一种氧化抗氧化失衡[13],其特征一般是抗氧化物的减少,氧化物的增加。生命体能通过多种酶或非酶抗氧化分子来保护自身免受氧化物的损伤,这就包括GSH和SOD。
GSH是氧化还原反应中的还原剂,其通过谷胱甘肽过氧化物酶的催化,在机体内被氧化成氧化型谷胱甘肽。谷氨酰半胱氨酸连接酶(GCL)是还原性谷胱甘肽合成过程中的限速酶,而GCL由亚基GCLC和GCLM构成的二聚体,其中GCLC掌控着全酶的催化活性,而GCLM可以增强GCLC的催化效率[14]。机体产生的初级活性氧一般为超氧化物,超氧化物经歧化后生成反应活性较低的过氧化氢,而催化此过程的关键酶就是SOD。
在本研究中,通过ROS的检测,首先发现了0.3 mmol/L的油酸造成了细胞活性氧产物的增加,但是随着不同浓度不同时间尿酸的干预,发现5和10 mg/dL浓度有助于细胞内活性氧产物的减少。类似的结果也出现在SOD活性和GSH含量的检测中。SOD在氧化应激过程中活性增高和降低的两种情况在其他研究中都有出现过[15-16],对于SOD随着氧化应激发生而活性降低的情况,其原因可能是在氧化应激环境下,SOD在表达或表达后修饰的某阶段被氧化损伤,使其整体活力下降,而类似于本研究随着活性氧产物的增加其活力上升的情况,其原因可能是0.3 mmol/L油酸浓度下24 h的干预还不能使L-02细胞发生强烈的氧化应激,当前SOD活性还可以满足当前细胞的需求所致,同时从ROS的结果中还可以看出,高浓度的UA水平,尤其是30 mg/dL的UA不但没有减少ROS的产生,还有促进其产生的效果,从SOD的活性中也得到相同观点,30 mg/dL组的活性随着干预时间持续下降,可能是氧化应激增强所造成。其次,模型组GSH含量相对于正常对照组减少,是氧化应激比较典型的现象,随着UA的干预,在5 mg/dL和10 mg/dL组中的GSH逐渐恢复,这与SOD活性以及ROS含量的结果保持一致。因此可以推测GSH可能是比SOD在脂肪变性造成的氧化应激中更灵敏的抗氧化指标。
本研究在细胞损伤相关的研究中,检测了ALT、AST活性及细胞的凋亡率。转氨酶是机体糖酵解和氨基酸代谢的关键酶。在人类中,ALT和AST活性较高的一般在肝脏组织中,与此同时,其他器官例如肾脏、心脏、骨骼肌和胰腺也有较高的ALT和AST活性[17]。而这两者,尤其是ALT早已经用于临床来作为肝脏损伤的标志物之一。一般认为转氨酶的升高预示着细胞损伤的加深,但也有研究显示单纯转氨酶的升高并不能较准确的用来判断肝脏损伤情况[18],所以本研究结合细胞凋亡的检测一同判定细胞的损伤。从细胞的凋亡率来看,虽然模型组与正常对照组有明显差异,但油酸引起细胞凋亡的程度并不严重,凋亡率最高只有不到4%,且各组之间差异最多也只有不到1%。在5和10 mg/dL UA干预组中起到了降低脂肪变性细胞凋亡的作用,但是干预到72 h时,这两个浓度的尿酸已经不再有降低细胞凋亡的效果,30 mg/dL UA还加重了凋亡的发生,结合之前关于氧化应激的研究结果,30 mg/dL UA很有可能通过加重氧化应激来促使细胞凋亡增加。同时,在ALT的结果中也存在和凋亡相似的趋势,不过AST的结果并没有发现相应的规律。在其他学者对于尿酸的研究中,早在1988年就有学者提出5 mg/dL的尿酸,即正常范围内的血尿酸浓度在机体内扮演着抗氧化的角色[19],而高过正常水平的尿酸就有可能造成机体细胞的氧化应激。但是通过本次研究我们发现在已发生氧化应激的细胞内,高于正常血尿酸水平的10 mg/dL浓度依然可以起到抗氧化的作用,甚至20 mg/dL和30 mg/dL的UA在48 h内都能缓解由于脂肪变性所造成的凋亡,提示了机体自身产生的UA和作为干预剂加入细胞中的UA对细胞可能产生不同的效果,而UA本身对于细胞的作用可能也要依据细胞或者机体本身所处的条件而判定。UA在人类进化的历程中曾一度作为抵抗机体氧化应激的重要武器而存在,甚至近些年还有很多研究证明低于5 mg/dL的血UA水平范围内,其变化与许多疾病的死亡率呈负相关[20-22],暗示了UA极有可能是机体用来对抗多种疾病产生的氧化应激的武器,时至今日,还未能从机制的角度证明这一点,但如果被证明,那么同时可以加重氧化应激的尿酸则成为了大自然在人类进化过程中射向人类的无心之失。结合本研究结果,5 mg/dL和10 mg/dL的UA可能在脂肪变性造成的肝细胞氧化应激中起着抗氧化的作用,以此来保护细胞,减少细胞损伤凋亡,而30 mg/dL的UA可能随着干预时间的延长而加重细胞的氧化应激。
[1] 咸亚静,刘漪,赵艳杰.乌鲁木齐市维吾尔族与汉族社区居民非酒精性脂肪肝患病率相关危险因素调查[J]. 新疆医科大学学报,2017, 40(5):669-672.
[2] GORI M, SIMONELLI M C, GIANNITELLI S M, et al. Investigating nonalcoholic fatty liver disease in a liver-on-a-chip microfluidic device [J]. Plos One, 2016,11(7):e0159729.
[3] SATAPATI S, KUCEJOVA B, DUARTE J A, et al. Mitochondrial metabolism mediates oxidative stress and inflammation in fatty liver [J]. J Clin Invest, 2015,125(12):4447-4462.
[4] 张冲,于崇林.氧化应激在非酒精性脂肪性肝病中的作用机制及研究进展[J]. 大家健康,2014,8(24):4-5.
[5] 魏苏宁,苏雪莹,徐国恒.肝细胞甘油三酯代谢途径异常与脂肪肝[J].中国生物化学与分子生物学报,2016,32(2):123-132.
[6] 魏巍,张云静.健肝降脂丸对非酒精性脂肪肝大鼠疗效及氧化应激的影响[J].世界华人消化杂志,2014,22(31):4790-4794.
[7] 方文军,陆帅,陈寒蓓,等.非酒精性脂肪性肝病患者的炎症细胞因子水平与氧化应激参数的变化[J].同济大学学报,2014,35(4):71-75.
[8] AMES B N, CATHCART R, SCHWIERS E, et al. Uric acid provides an antioxidant defense in humans against oxidant- and radical-caused aging and cancer: a hypothesis [J]. Proc Natl Acad Sci U S A,1981,78(11):6858-6862.
[9] ZHENG X, GONG L, LUO R, et al. Serum uric acid and non-alcoholic fatty liver disease in non-obesity Chinese adults [J]. Lipids Health Dis,2017,16(1):202.
[10] FU Y Q,YANG H, ZHENG J S, et al. Positive association between metabolic syndrome andserum uric acid in Wuhan [J]. Asia Pac J Clin Nutr, 2017,26(2):343-350.
[11] VERZOLA D, RATTO E, Villaggio B, et al. Uric acid promotes apoptosis in human proximal tubule cells by oxidative stress and the activation of NADPH oxidase NOX 4[J]. PLoS One, 2014,9(12):e115210.
[12] LANASPA M A, SANCHEZ-LOZADA L G, CHOI Y J, et al. Uric acid induces hepatic steatosis by generation of mitochondrial oxidative stress: potential role in fructose-dependent and -independent fatty liver[J]. J Biol Chem,2012,287(48):40732-40744.
[13] GAN L, XIANG W, XIE B, et al. Molecular mechanisms of fatty liver in obesity [J]. Front Med, 2015,9(3):275-287.
[14] TARIQ Z, GREEN C J, HODSON L. Are oxidative stress mechanisms the common denominator in the progression from hepatic steatosis towards non-alcoholic steatohepatitis (NASH)? [J].Liver Int, 2014,34(7):e180-e90.
[15] 吴志红,马燕芬,赵磊,等.Nrf2-ARE 信号通路在机体氧化应激损伤中的作用及与其他信号通路的关系[J].畜牧与饲料科学,2016,37(3):42-48.
[16] CAO Y, LI Y S, LI Z J, et al. Dietary zinc may attenuate heat-induced testicular oxidative stress in mice via up-regulation of Cu-Zn SOD [J]. Genet Mol Res,2015,14(4):16616-16626.
[18] 林涛.血清总胆汁酸与丙氨酸氨基转移酶联合测定对肝胆疾病患者的临床价值分析[J].检验医学与临床,2013,10(5):534-535.
[19] DE GIORGI A, FABBIAN F, PALA M, et al. Uric acid: friend or foe? Uric acid and cognitive function “Gout kills more wise men than simple” [J]. Eur Rev Med Pharmacol Sci,2015,19(4):9748-9752.
[20] SEGURO A C, KANDA E, MUNEYUKI T, et al. Uric acid level has a U-shaped association with loss of kidney function in healthy people: aprospective cohort study [J]. PLoS One, 2015,10(2):e0118031.
[21] Hsieh C H, Lin J D, Wu C Z, et al. Is lower uric acid level better? a combined cross-sectional and longitudinal study in the elderly[J]. Endocrine,2014,47(3):806-815.
[22] Wu S H, Shu X O, Milne G, et al. Uric acid correlates to oxidation and inflammation in opposite directions in women [J]. Biomarkers,2015,20(4):225-231.
