远程缺血预处理和远程缺血后处理在兔肺移植缺血-再灌注损伤保护作用中的比较
2018-01-19刘媛媛伊力亚尔夏合丁
姜 涛, 魏 琴, 刘媛媛, 马 嵋, 张 春, 伊力亚尔·夏合丁, 朱 辉
(1新疆医学动物模型研究重点实验室, 新疆医科大学第一附属医院2临床医学研究院, 3次消毒供应室,4教学科, 5胸外科, 乌鲁木齐 830054)
肺移植是治疗晚期恶性肺部疾病如慢阻肺、肺纤维化、支气管扩张症等的最终选择[1],而肺移植中最普遍的问题就是缺血-再灌注损伤(IRI),如时间过长,就会引起全身器官不同程度的损伤,甚至发生不可逆性的损害[2]。前期研究已经将缺血预处理和缺血后处理对缺血再灌注损伤的作用进行了比较研究,取得较好结果。但是缺血预处理或者后处理可能会对局部组织器官造成损伤,在一定程度上限制了该技术的应用。如果能在不影响局部组织器官血供的情况下同样起到保护作用,将对临床应用有更大意义。故本研究选择了远程缺血预处理(RIPC)和远程缺血后处理(RIPOST)比较研究对IRI的作用。RIPC是指通过对一个远端组织或器官行短暂的非致死性的缺血再灌注后可加强其远隔组织或脏器对较长时间缺血的耐受性。已有研究证实,远程缺血预处理对心、肝、脑、肺等脏器的缺血再灌注损伤有保护作用[3-6]。Kerendi等[7]提出了RIPOST的概念,即再灌注开始后,通过对远离靶器官的非重要组织或器官进行处理以保护某些对缺血敏感的靶器官,已有研究证实RIPOST能提高心肌、肺脏及肝脏等脏器对较长时间缺血的耐受性[8-10]。故本课题选择肺移植模型,检测干预前后的氧分压(PaO2)、超氧化物歧化酶(SOD)、丙二醛(MDA)、一氧化氮(NO)、肿瘤坏死因子(TNF-α)含量和肺湿/干重比(W/D),比较RIPC和RIPOST在缺血再灌注损伤中的保护作用,以探讨其在不影响局部组织器官血供的情况下是否可以同样起到保护作用。
1 材料与方法
1.1动物实验新西兰大白兔48只,2月龄,雄性,体质量3.0~3.5 kg,购自新疆医科大学实验动物中心。动物模型的建立在新疆医科大学医第一附属医院临床医学研究院动物部进行,该部门具有国际AAALAC资质认证,实验动物的管理与使用遵循“Guide for care and use of Laboratory animals”,动物实验经过新疆医科大学第一附属医院IACUC的审批,伦理审批号: IACUC-20160709013。
1.2实验设计与分组48只新西兰大白兔用随机数字表随机均分为3组,每组16只(n=16),每组按体质量相近原则配对,分为缺血再灌注组(IR组)、远程缺血预处理组(RIPC组)、远程缺血后处理组(RIPOST组)。
1.3肺移植动物模型制备参照文献[11]中的肺移植模型制备方案。
1.4不同干预组的实施方案
1.4.1 IR组 仅实施异体肺移植。
1.4.2 RIPC组 供体实施。动物麻醉后气管插管接呼吸机,左侧第五肋间开胸后解剖分离上、下腔静脉和左肺动脉、静脉及左主支气管。阻断上、下腔静脉回心血流,用4℃的乳酸林格氏液以20 cm水柱压力依次经右心室和左心房进行顺行灌注和逆行灌注(150 mL/kg)。半膨胀状态切取左肺保存备用。在供体肺灌注之前,以血管夹反复阻断右侧股动脉血流3次,每次阻断时间为5 min,间隔时间为5 min。
1.4.3 RIPOST组 受体实施。麻醉及开胸同上,解剖游离支气管及血管,阻断左肺动脉及支气管,钳夹肺静脉汇合处的左心房侧壁。切断支气管、血管及心房壁,切除左肺。供肺包裹后置入受体左胸腔。依次吻合支气管、左心房壁和肺动脉,开放肺静脉,开放肺动脉,吻合口无出血漏气,肺血流通畅,动物生命体征平稳。受体肺移植操作完成后,移植肺开始恢复血流灌注前,先反复开放和阻断受体由下肢股动脉血流5次,每次阻断与间隔时间为1 min。
1.5标本采集所有模型动物于受体肺切除前、再灌注后60、120 min3个时间点经左肺下静脉采血测PaO2。再灌注完后采血用于检测SOD、MDA、NO和TNF-α。取肺组织约0.5 g称湿重,真空干燥箱100℃烘干烤24 h,称干重,计算肺湿/干重比。取肺组织指甲盖大小置于10%甲醛液固定,用于病理学检测。
1.6病理检测肺组织固定于10%甲醛,石蜡包埋,脱水,切片机(Leica ,德国)切片厚3 μm,进行苏木素-伊红(HE)染色。
1.7SOD、MDA、NO和TNF-α检测SOD和MDA是反映自由基损伤的指标。通过测定SOD含量间接反应肺组织清除超氧自由基和抗氧化损伤的能力,按照说明书操作测试(ADL 公司,USA)。而MDA作为脂质过氧化的代谢产物,测定其含量可间接反应细胞损伤的程度,按照说明书操作测试(ADL 公司,USA)。NO能够参与体内信号转导、炎症反应及免疫调节等多个环节,可以通过调节血管张力、抑制血小板聚集、抑制白细胞的黏附而发挥对缺血再灌注的保护作用,按照说明书操作测试(ADL公司,USA)。TNF-α按照说明书操作测试(ADL公司,USA)。所有检测使用Thermo Multiskan Spectrum酶标仪测试。
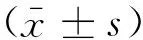
2 结果
2.1动物造模情况本研究选用新西兰兔48只,供受体均为24只,供体无死亡,受体手术死亡5只,模型成功19只。左肺移植受体成模情况见表1。
2.2肺组织病理改变为了观察不同保护措施在缺血再灌注损伤发生时的作用,采用HE染色观察肺组织的病理改变。IR组:低倍镜下可见肺组织结构紊乱,部分肺泡壁断裂,肺泡腔大小不等,肺泡内可见大量出血、水肿、部分不张(图1a);RIPC组:低倍镜下可见肺泡腔大小不等,结构紊乱,肺不张、肺气肿及水肿明显,可见大量炎症细胞浸润(图1b);RIPOST组: 低倍镜下满视野肺水肿及大量炎症细胞浸润,肺泡结构不完整,部分肺泡壁断裂(图1c)。
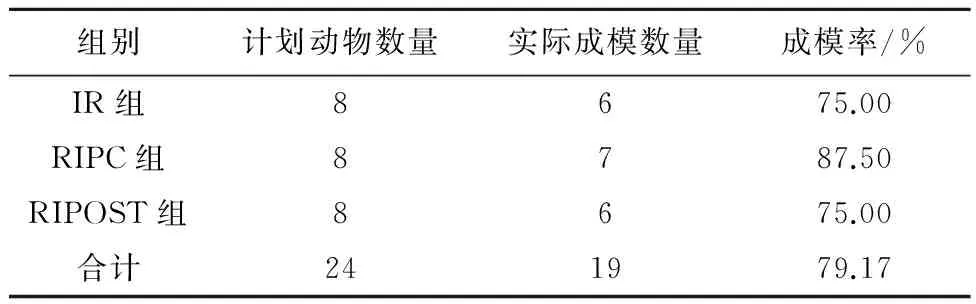
表1 左肺移植受体成模情况
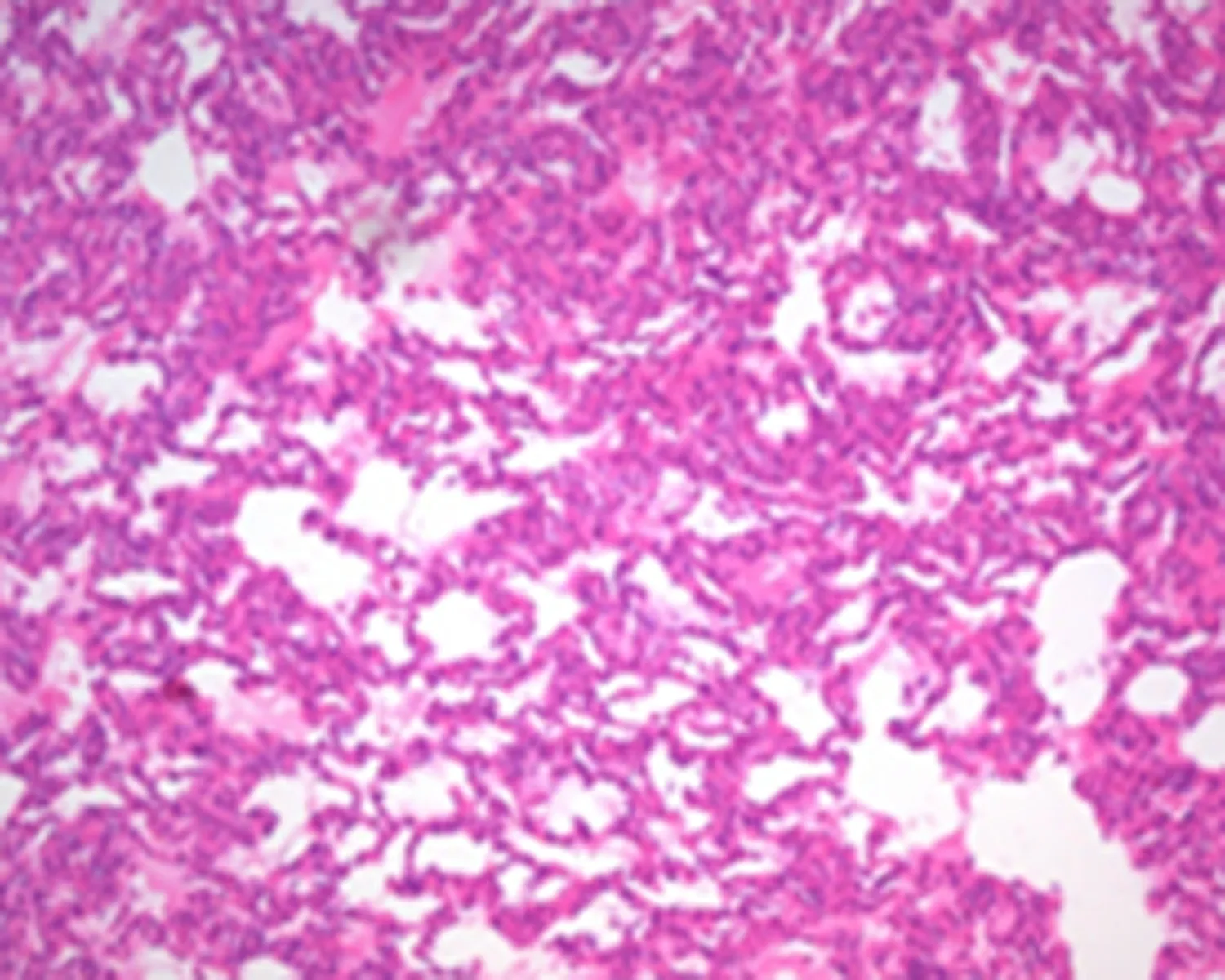
a: IR组
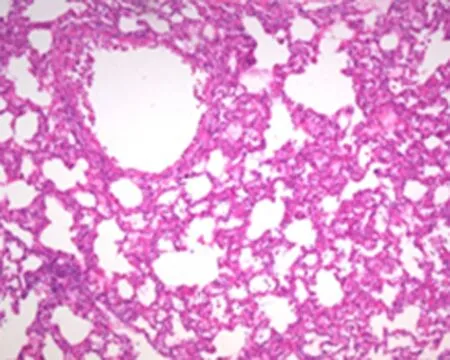
b: RIPC组

c: RIPOST组
图1肺组织病理改变(HE,×100)
2.3各组PaO2在不同时间的变化不同时间点各组PaO2含量差异有统计学意义(P<0.01)。在60、120 min时,RIPC组PaO2高于IR组、RIPOST组,差异有统计学意义(P<0.01),而IR组与RIPOST组之间差异无统计学意义(P>0.05)(表2)。
2.4不同干预组SOD、MDA、NO、TNF-α及肺湿/干重比的变化3组MDA、SOD、NO、TNF-α差异有统计学意义(P<0.05)。与IR组比较,RIPC组SOD、NO高于IR组及RIPOST组,而MDA、TNF-α低于IR及RIPOST组,差异有统计学意义(P<0.05),而IR组与RIPOST组之间差异无统计学意义(P>0.05)(表3)。
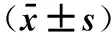
表2 各组在不同时间的PaO2比较
注:与IR组比较,*P<0.05;与RIPC组比较,△P<0.01。
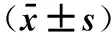
表3 远程缺血预处理、远程缺血后处理对缺血再灌注的保护作用比较
注:与IR组比较,*P<0.05;与RIPC组比较,△P<0.05。
3 讨论
肺移植是治疗晚期恶性肺部疾病如慢阻肺、肺纤维化、支气管扩张症等的最终选择,缺血再灌注损伤是肺移植失败的主要原因之一,而在缺血再灌注发生过程中产生的大量氧自由基和细胞内钙超载,是导致肺损伤的主要原因。本研究选用RIPC和RIPOST的干预方案探讨对IRI的保护作用的方法,通过监测移植再灌注后60、120 min PaO2的变化,观察肺组织病理改变,检测血清中SOD、MDA、NO、TNF-α和肺W/D来评价何种方式更有利于保护肺损伤。
本实验通过制作新西兰兔肺移植模型,在缺血再灌注损伤时给予远程缺血预处理和远程缺血后处理的不同干预方法。从我们的实验结果可以看出,IR组的病理呈现出明显的肺损伤;RIPC组可见肺泡腔大小不等,结构紊乱,肺不张、肺气肿及水肿明显,和IR组比较损伤明显减轻;RIPOST组肺泡组织塌陷严重,损伤也是较为严重。这符合Pankaj等[12]研究的RIPC对组织和脏器缺血再灌注损伤有保护作用。有研究表明,肺缺血再灌注损伤中肺气体交换功能可作为重要的评价指标[13],肺换气功能障碍时PaO2明显下降。在本实验中,IR组和RIPOST组在120 min PaO2明显下降,经比较RIPC组与前两组存在差异,可能提示RIPC组有助于提高氧分压。结合病理结果可以看出RIPC减轻了肺毛细血管和肺泡损伤,可能改善了肺的气体交换功能,从而对肺IRI起到了保护作用。
缺血再灌注时,活性氧产生过多引发链式脂质过氧化反应可生成MDA,因而测定MDA可代表脂质过氧化的程度。SOD能特异性清除超氧自由基,增强机体的抗氧化能力,可促进再灌注损伤脏器的恢复[14]。本实验中发现RIPC组的MDA活性明显低于IR组和RIPOST组,而SOD的含量明显高于IR组和RIPOST组。提示RIPC组肺部的脂质过氧化程度减弱,抗氧化能力增强,说明单侧下肢远程缺血预处理对肺缺血再灌注引起的肺损伤有良好的保护作用。NO具有舒张血管和局部抗炎的功能。有研究结果显示,吸入低浓度NO预处理对肺IRI具有保护作用[15]。本实验中RIPC组的NO活性明显高于IR组和RIPOST组,提示可能RIPC上调NO表达来对抗氧自由基的形成和中性粒细胞聚集,以达到保护肺损伤的效果。TNF-α是参与炎性损伤过程的重要促炎因子[16],可通过刺激粒细胞释放炎性介质和蛋白酶,并产生级联放大作用,从而直接损伤内皮细胞,使毛细血管通透性增加,加重缺血再灌注损伤[17]。本研究显示,RIPC组的TNF-α活性明显低于IR组和RIPOST组,提示RIPC可以抑制肺IRI的炎症反应。
总之,本研究探讨在新西兰大白兔肺移植的缺血再灌注损伤过程中,采用了远程缺血预处理和后处理的方式,经比较认为远程缺血预处理方案对再灌注损伤保护作用较好。本实验作为基础研究,对于临床问题缺血再灌注损伤提供了损伤小、保护效果好的实验方案——远程缺血预处理,对临床应用有一定意义。但是疾病的发生发展并不是独立存在的,全身的器官、组织、细胞乃至免疫系统都在发生级联发应,本研究只是做了部分基础研究,为临床应用提供理论依据,下一步将进行具体的机制研究。
[1] JATENE F B, PEGO-FEMANDS P M. Challenges in lung transplantation[J].Bras Pneumol, 2008,34(5):249-50.
[2] 汪涛,周业庭.急性肢体缺血再灌注损伤的研究进展[J].中华实验外科杂志,2012,29(12):2628-2632.
[3] 郑兰兰,景桂霞.远程缺血预处理对心肺转流心脏瓣膜置换术患者心肌损伤的保护作用[J].临床麻醉学杂志,2012,28(4):343-345.
[4] ABU-AMAR M, YANG S Y, QUAQLIA A, et al. Nitric oxide is an essential mediator of theprotective effects of remote ischaemic preconditioning in a mouse model of liver ischaemia/reperfusion injury[J]. Clin Sci,2011, 121(6):257-66.
[5] 仝淞铭,曹阳,于德水,等.远程缺血预处理对大鼠脊髓缺血再灌注损伤后脑源性神经营养因子表达的影响[J].中国全科医学,2015,18(21):2548-2554.
[6] 杨晓涵,于洪涛,张锐,等.远程缺血预处理对全胸腔镜体外循环手术的肺保护作用[J].中国当代医药,2016,23(21):19-22.
[7] KERENDI F, KIN H, HALKOS M E, et al. Remote postconditioning.Brief renal ischemia and reperfusion applied before coronary artery reperfusion reduced myocardialinfarct size via endogenous activation of adenosine receptors[J].Basic Res Cardiol,2005,100(5):404-412.
[8] GAO Y, SONG J, CHEN H, et al. TRPV1 activation is involved in the cardioprotection of remote limb Ischemic postconditioninginischemia-reperfusion injury rats[J]. Biochem Biophys Res Commun,2015, 463(4):1034-1039.
[9] CAO Q F, QU M J, YANG W Q, et al. Ischemia postconditioning preventing lung ischemia-reperfusion injury[J]. Gene. 2015,554(1):120-124.
[10] KHAN A R, BINABDULHAK A A, ALASTAL Y, et al. Cardio protective role of ischemic postconditioning in acute myocardial infarction:A systematic review and meta-analysis[J]. Am Heart,2014,168(4):512-521.
[11] 魏琴,刘媛媛,朱辉,等.缺血预处理和后处理对兔移植肺缺血再灌注损伤的保护作用的比较[J].新疆医科大学学报,2016, 39(10):1281-1285.
[12] SAXENA P, NEWMAN M A, SHEHATHA J S, et al.Remote Ischemic Conditioning:Evolution of the Concept Mechanisms,and Clinical Application[J].Card Surg, 2010, 25(1):127-134.
[13] NAIDU B V, FARIVAR A S, WOOLEY S M, et al.Novel broad-spectrum chemokine inhibitor protects against lung ischemia-reperfusion injury[J].Heart Lung Transplant,2004,23(1):128-134.
[14] JIANG H, CHEN R, XUE S, et al. Protective effects of three remote ischemic conditioning procedures against renal ischemic/reperfusion injury in rat kidneys:a comparative study[J].Ir J Med Sci, 2015, 184(3):647-653.
[15] 何文新,姜格宁,丁嘉安,等.一氧化氮减轻大鼠移植肺缺血再灌注损伤的作用及机制[J].中华器官移植杂志,2006,27:599-602.
[16] YANG W,XV M,YANG W C, et al. Exogenous α-calcitonin gene-related peptide attenuates Lipopolysaccharide-induced acute lung injury in rats[J].Mol Med Rep,2015,12(2):2181-2188.
[17] KIESSLING A H, GUO F W, GOKDEMIR Y, et al. The influence of selective pulmonary perfusion on the inflammatory response and clinical outcome of patients with chronic obstructive pulmonary disease undergoing cardiopulmonary bypass[J]. Interact Cardiovasc Thorac Surg,2014, 18(6):732-739.
