桃金娘烯醛基噻唑-腙类化合物的合成及抑菌活性*
2018-01-16陈智聪段文贵林桂汕罗梦香杨章旗
陈智聪 段文贵 林桂汕 张 瑞 罗梦香 杨章旗
(1.广西大学 南宁 530004; 2. 广西林业科学研究院 南宁 530002)
α-蒎烯是可再生性天然精油松节油的主要成分,利用α-蒎烯分子中的双键和四元环2个特征官能团以及烯丙位的反应,对其进行化学改性,合成得到多种功能性深加工产品(黄铎云等,2016)。桃金娘烯醛又名香桃木烯醛,天然存在于孜然芹(Cuminumcyminum)籽、桉(Eucalyptusspp.)叶、胡椒(Pipernigrum)和薄荷(Nepetacataria)等精油中,主要用作香料以及有机合成中间体,将α-蒎烯的烯丙位甲基氧化可得到桃金娘烯醛(白雪等,2015;彭莉等,2013)。研究表明,桃金娘烯醛本身具有广泛的生物活性,如扩张支气管、抗炎、抗溶血、抗凝聚、抗菌(Vegezzi, 1980)、杀灭疟原虫(Kamchonwongpaisanetal., 1995)、抗肝癌(Lingaiahetal., 2013;Hari-Babuetal., 2012)和驱蚊(Hardieetal., 1994)等。

结合本课题组近年来在松香、松节油、樟脑和樟脑酸等林产品基生物活性化合物方面所取得的研究成果(黄铎云等,2016; 白雪等,2015; 陈乃源等,2016; Duanetal., 2011;Linetal., 2014;吴光燧等,2014;马献力等,2015),本文通过对具有一定生物活性的桃金娘烯醛进行化学改性,合成得到系列含噻唑和腙活性基团的新型桃金娘烯醛基噻唑-腙类化合物,采用多种现代波谱手段对目标产物进行结构表征,并测试其抑菌活性,为我国天然优势林产资源α-蒎烯的化学改性和高值化利用提供新途径。
1 材料与方法
1.1 主要仪器与试剂
Nicolet iS 50 FT-IR红外光谱仪,美国Thermo Scientific有限公司;Avance ⅢHD 600 MHz超导核磁共振仪,瑞士Bruker有限公司;TSQ Quantum Access MAX液相色谱-质谱联用仪,美国Thermo Scientific有限公司;Agilent 6890 气相色谱仪,美国Agilent Technologies有限公司;Waters 1525高效液相色谱仪,美国Waters有限公司;MP-420全自动熔点仪,济南海能仪器股份有限公司。
α-蒎烯(GC测定质量分数为98.0%,广西梧州松脂股份有限公司);系列α-溴代苯乙酮(AR),硫代氨基脲(AR,广西西纯科技有限公司);其余所用试剂均为市售分析纯。
1.2 合成路线
新型桃金娘烯醛基噻唑-腙类化合物4a-4p的合成路线如下所示:
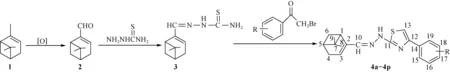
4a:R=H;4b:R=2-F;4c:R=3-F;4d:R=4-F;R=3-Cl;4f:R=4-Cl;4g:R=4-Br;4h:R=3,4-Cl;4i:R=2,4-Cl;4j:R=2,4-F;4k:R=p-CH3;4l:R=p-OCH3;4m:R=p-CN;4n:R=p-NO3;4o:R=m-NO2;4p:R=p-ph.
1.3 中间产物的合成
1.3.1 桃金娘烯醛(2)的制备 参照林桂汕等(2017)的方法制备桃金娘烯醛(2),81.0~81.5 ℃/670 Pa,GC测定含量为90.06%。
1.3.2 桃金娘烯醛基缩氨基硫脲(3)的合成 在250 mL三口烧瓶中加入60 mL水和3.62 g(0.02 mol)氨基硫脲,升温至60 ℃,搅拌至氨基硫脲溶解,再缓慢滴加6.60 g (0.02 mol)桃金娘烯醛(2)的乙醇溶液(60 mL)。滴加完毕后再继续反应1 h,冷却至室温,抽滤,用去离子水∶乙醇=1∶1的洗提液洗涤滤饼3~4次。烘干后用乙醇进行重结晶,干燥,得到白色晶体,即桃金娘烯醛基缩氨基硫脲(3),收率91%,纯度98.79%,熔点197~198 ℃。
1.4 目标产物新型桃金娘烯醛基噻唑-腙类化合物(4a-4p)的合成
以4a为例。在50 mL两口烧瓶中加入2.5 mmol桃金娘烯醛基缩氨基硫脲(3),无水乙醇10 mL,充分搅拌使其溶解。然后将2 mmol α-溴代苯乙酮溶于10 mL乙醇,在磁力搅拌和室温下缓慢滴加至烧瓶中,20 min滴加完毕,采用硅胶波层色谱(TLC)跟踪反应至终点。其后除去溶剂乙醇,残余物用适量乙酸乙酯溶解,分别用15.0 mL氢氧化钠溶液洗涤(3次)和蒸馏水洗涤(1次),用无水硫酸镁干燥,旋蒸除去乙酸乙酯,得到淡黄色固体粗产物。干燥后,用硅胶柱层析色谱进行纯化[洗脱剂为V(石油醚)∶V(乙酸乙酯)=15∶1],得到白色固体4a。化合物4b-4p用同样过程合成而得。
1.5 目标化合物的结构表征
采用KBr压片法测定目标化合物的IR;以CDCl3为溶剂,在600 MHz核磁共振仪上进行1H-NMR和13C-NMR分析;将产物配制成质量浓度为1 mg·L-1的溶液,采用电喷雾电离源(ESI)在液相色谱-质谱联用仪(LC-MS)上进行质谱分析。
1.6 抑菌活性测试
参照Su等(2013),采用琼脂稀释法,测试目标化合物对水稻纹枯病菌(Rhizoctorziasolani)、黄瓜枯萎病菌(Fusariumoxysporumf. sp.cucumerinum)、花生褐斑病菌(Cercosporaarachidicola)、玉米小斑病菌(Helminthosporiummaydis)、苹果轮纹病菌(Physalosporapiricola)、西瓜炭疽病菌(Colletotrichumlagenarium)、小麦赤霉病菌(Gibberellazeae)和番茄早疫病菌(Altemariasolani)8种植物病原菌的抑菌活性:将病原菌在含待测化合物质量浓度为50 mg·L-1的药板中置于(24±1)℃的培养箱内培养48 h后,计量各处理菌丝扩展直径,并与不加药剂平板的菌丝扩展直径进行比较,计算相对抑制百分率。活性分级指标:A级:≥90%;B级:70%~90%;C级:50%~70%;D级:≤50%。
2 结果与讨论
2.1 波谱分析


















2.2 抑菌活性测试结果
目标产物4对8种测试病原菌的抑菌率见表1。在50 mg·L-1下,目标化合物4对8种供试植物病原菌均有不同程度的抑制作用。结果显示,目标化合物4对8种植物病原菌的抑菌活性好于骨架化合物桃金娘烯醛。总体上,目标化合物对苹果轮纹病菌的抑制效果最好,平均抑菌率为64.2%,有12个目标化合物的抑菌率达60%以上,其中化合物4n (R=4-NO2)的抑菌率高达90.6%(活性级别为A级),化合物4f (R=4-Cl)、化合物4k (R=4-CH3)和化合物4m (R=4-CN)的抑菌率分别为74.6%、71.1%和79.4%(活性级别为B级)。总体上,取代基的引入使目标化合物对8种植物病原菌的抑菌活性均有所提高,其中对位引入硝基(化合物4n) 时活性最大,平均抑菌率达55.6%。还有,除卤素外,在4位引入吸电子基团(如4-NO2、4-CN)比引入给电子基团(如4-CH3、4-OCH3)时的生物活性要好。
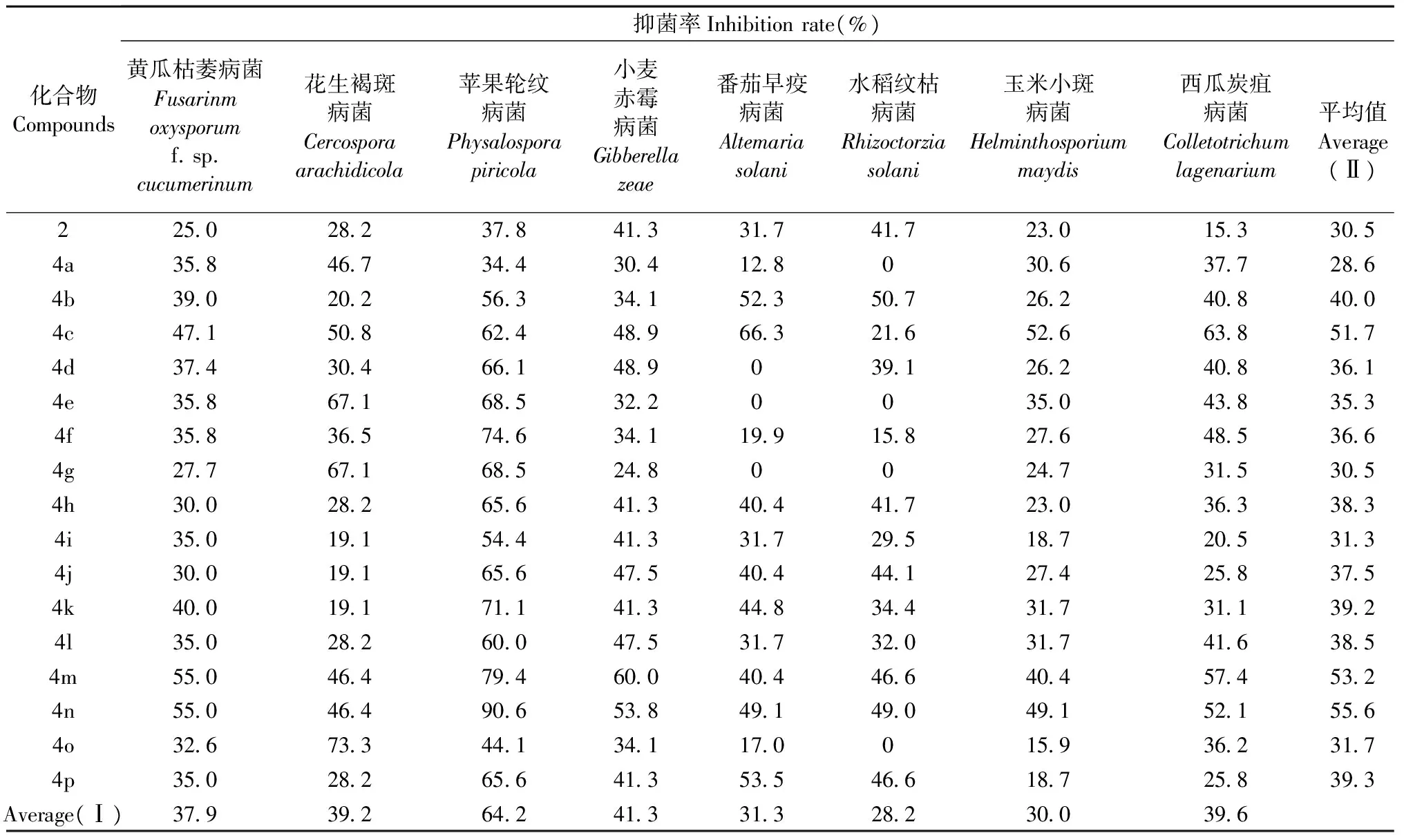
表1 化合物4的抑菌活性Tab.1 The antifungal activities of compound 4
3 结论
将α-蒎烯经烯丙位甲基氧化得到桃金娘烯醛,再通过对其醛基的化学改性,合成得到16个新型桃金娘烯醛基噻唑-腙类化合物4a-4p。利用FT-IR、1H-NMR、13C-NMR和ESI-MS等多种手段确认了目标化合物的结构。目标产物的抑菌活性测试结果表明:在50 mg·L-1质量浓度下,合成得到的16个桃金娘烯醛基噻唑-腙类化合物4a-4p对所测的8种植物病原菌均显示出一定的抑制活性,且对苹果轮纹病菌的抑制效果最好,抑菌率在60%的化合物有12个,化合物4n(R=4-NO2)的抑菌率高达90.6%(活性级别为A级),是值得进一步研究的先导化合物。
白 雪,段文贵,林桂汕,等.2015.新型桃金娘烯醛基双酰胺-噻二唑化合物的合成及其抗真菌活性. 合成化学, 23(11): 1000-1004, 1012.
(Bai X, Duan W G, Lin G S,etal. 2015. Synthesis and antifungal activities of novel myrtenal-based bisamide-thiadiazole compounds. Chinese Journal of Synthetic Chemistry, 23(11): 1000-1004, 1012. [in Chinese])
陈才俊,宋宝安. 2005. 噻唑类杀虫剂的研究进展. 农药,44(2): 53-55,65.
(Chen C J, Song B A. 2005. Research advances with thiazole insecticides. Chinese Journal of Pesticides, 44(2):53-55,65. [in Chinese])
陈乃源,段文贵,林桂汕,等. 2016. 去氢枞酸基B环并噻唑-酰胺化合物的合成及抑菌活性. 精细化工,33(7): 811-819.
(Chen N Y, Duan W G, Lin G S,etal. 2016. Synthesis and antifungal activity of dehydroabietic acid-based B ring-fused-thiazole-amide compounds. Fine Chemicals,33(7): 811-819.[in Chinese])
黄铎云,段文贵,林桂汕,等. 2016. 2-取代酰氨基-5-(α-龙脑烯醛基)-1,3,4-噻二唑化合物的合成及抑菌活性. 林产化学与工业,36(1): 61-69.
(Huang D Y, Duan W G, Lin G S,etal. 2016. Synthesis and antifungal activities of 2-sustituted acylamino-5-α-campholenic aldehyde-based-1,3,4-thiadiazole compounds. Chemistry and Industry of Forest Products, 36(1): 61-69. [in Chinese])
康圣鸿,胡德禹,吴 剑,等.2012.含腙类结构化合物生物活性研究进展. 农药,51(4): 238-242,245.
(Kang S H, Hu D Y, Wu J,etal. 2012. Research progress for biological activity of compounds containing hydrazone group. Agrochemicals, 51(4): 238-242,245. [in Chinese])
李英俊,李春燕,靳 焜,等. 2012.新型含噁二唑环的苯并噁/噻唑啉酮衍生物的合成、表征及生物活性. 化学学报,70(2): 151-160.
(Li Y J, Li C Y, Jin K,etal. 2012. Synthesis and biological activities of novel benzoxazolinone/benzothiazolone derivatives containing oxadiazole moiety. Acta Chimica Sinica, 70(2): 151-160. [in Chinese])
林桂汕,段文贵,利镇升,等. 2017.桃金娘烯醛基噻二唑-酰胺化合物的合成及性能. 精细化工, 34(5): 588-595.
(Lin G S, Duan W G, Li Z S,etal. 2017. Synthesis and properties of myrtenal-based thiadiazole-amide compounds. Fine Chemicals, 34(5): 588-595. [in Chinese])
马献力,闵方倩,段文贵,等. 2015. 樟脑酸基苯磺酰胺类化合物的合成及抑菌活性研究. 林产化学与工业, 35(1): 30-38.
(Ma X L, Min F Q, Duan W G,etal. 2015. Synthesis and fungicidal activity of camphoric acid-based benzenesulfonamide compounds. Chemistry and Industry of Forest Products, 35(1): 30-38. [in Chinese])
彭 莉,殷彩霞,张凤梅,等. 2013. 桃金娘烯醛合成及其生物活性测试. 化学与生物工程,30(2): 50-52, 66.
(Peng L, Yin C X, Zhang F M,etal. 2013. Synthesis and bioactivity determination of myrtenal. Chemistry & Bioengineering, 30(2): 50-52, 66. [in Chinese])
汪 飞,曹 瑾,袁莉萍,等.2006. 新型腙类衍生物的合成及其生物活性. 农药学学报,8(2): 176-179.
(Wang F, Cao J, Yuan L P,etal. 2006. Synthesis and bioactivity of a series of novel hydra zone derivatives. Chinese Journal of Pesticide Science, 8(2): 176-179.[in Chinese])
吴光燧,段文贵,林桂汕,等. 2014.N-(4-取代氨基磺酰基)苯基-酮基蒎酸酰胺的合成及生物活性. 农药学学报, 16(1): 8-13.
(Wu G S, Duan W G, Lin G S,etal. 2014. Synthesis and biological activity ofN-(4-substituted amino-sulfonyl)-phenyl-ketopinamides. Chinese Journal of Pesticide Science, 16(1): 8-13.[in Chinese])
Duan W G, Li X R, Mo Q J,etal. 2011.Synthesis and herbicidal activity of 5-dehydroabietyl-1,3,4-oxadiazole derivatives. Holzforschung, 65(2):191-197.
Galayko N V, Tolmacheva 1 A, Grishko V V,etal. 2010.Antiviral activity of 2,3-secotriterpenic hydrazones of lupine and 19beta,28-epoxy-18alpha-oleanane type. Bioorganicheskaia Khimiia, 36(4):516-521.
Hardie J, Isaacs R, Pickett J A,etal. 1994. Methyl salicylate and (-)-(1R,5S)-myrtenal are plant-derived repellents for black bean Aphid,AphisfabaeSCOP. (Homoptera: Aphididae). Journal of Chemical Ecology, 20(11): 2847-2855.
Hari-Babu L, Perumal S, Balasubramanian M P. 2012. Myrtenal, a natural monoterpene, down-regulates TNF-α expression and suppresses carcinogen-induced hepatocellular carcinoma in rats. Molecular and Cellular Biochemistry, 369(1/2): 183-193.
Helal M H M, Salem M A, El-Gaby M S A,etal. 2013. Synthesis and biological evaluation of some novel thiazole compounds as potential anti-inflammatory agents. European Journal of Medicinal Chemistry, 65: 517-526.
Kalkhambkar R G, Kulkarni G M, Shivkumar H,etal. 2007. Synthesis of novel triheterocyclic thiazoles as anti-inflammatory and analgesic agents. European Journal of Medicinal Chemistry, 42(10): 1272-1276.
Kamchonwongpaisan S, Nilanonta C, Tamchompoo B,etal. 1995. An antimalarial peroxide from amomum krervanh pierre. Tetrahedron Letters, 36(11): 1821-1824.
Kaplancikli Z A, Altintop M D, Ozdemir A,etal. 2012.Synthesis and biological evaluation of some hydrazone derivatives as anti-inflammatory agents. Letters in Drug Design & Discovery, 9(3), 310-315.
Lin G S, Ma C H, Duan W G,etal. 2014. Synthesis and biological activities of α-pinene-based dithiadiazoles. Holzforschung, 68(1):75-82.
Lingaiah H B, Natarajan N, Thamaraiselvan R,etal. 2013. Myrtenal ameliorates diethylnitrosamine-induced hepatocarcinogenesis through the activation of tumor suppressor protein p53 and regulation of lysosomal and mitochondrial enzymes. Fundamental & Clinical Pharmacology, 27(4): 443-454.
Osorio T M, Monache F D, Chiaradia L Detal. 2012. Antibacterial activity of chalcones, hydrazones and oxadiazoles against methicillin-resistantStaphylococcusaureus. Bioorganic & Medicinal Chemistry Letters, 22(1): 225-230.
Rai N P, Venu T D, Manuprasad B K,etal. 2010. Synthesis of some novel 2-[2-(aroyl-aroxy)-methyl]-4-phenyl-1,3-thiazoles as potent anti-inflammatory agents. Chemical Biology & Drug Design, 75(4): 400-406.
Su N N, Li Y, Yu S J,etal. 2013. Microwave-assisted synthesis of some novel 1,2,3-triazoles by click chemistry and their biological activity. Research on Chemical Intermediates, 39(2):759-766.
Terzioglu N, Gürsoy A. 2003. Synthesis and anticancer evaluation of some new hydrazone derivatives of 2,6-dimethylimidazo[2,1-b][1,3,4]thiadiazole-5-carbohydrazide. European Journal of Medicinal Chemistry, 38(7/8): 781-786.
Vegezzi D. 1980. Method for the preparation of verbenone, myrtenal and pinocarveol and their therapeutical use. United States Patent, 4190675.
Wu J, Song B A, Hu D Y,etal. 2012. Design, synthesis and insecticidal activities of novel pyrazole amides containing hydrazone substructures. Pest Management Science, 68(5): 801-810.
Zaharia V, Ignat A, Palibroda N,etal. 2010. Synthesis of some p-toluenesulfonyl-hydrazinothiazoles and hydrazino-bis-thiazoles and their anticancer activity. European Journal of Medicinal Chemistry, 45(11): 5080-5085.
