沉默CD98hc表达对乳腺癌细胞MDA-MB-231增殖、侵袭的影响
2018-01-15吴正升
牟 浪,吴正升,吴 强
乳腺癌是女性最常见的恶性肿瘤,其发病率呈逐年上升趋势,占中国女性癌症的15%,同时也是全球女性癌症死亡的首要原因[1]。肿瘤的转移和复发是乳腺癌患者致死的主要原因[2],因此探索肿瘤转移的机制,改善乳腺癌患者的预后至关重要。CD98hc(也称为4F2hc/SLC3A2)是溶质载体家族的一员,相对分子质量为8.5×104的单跨膜糖蛋白[3]。CD98hc可通过激活Integrin信号通路,促进肿瘤细胞与细胞外基质之间的黏附能力减弱,从而使肿瘤细胞易发生迁徙、转移,导致恶性程度增高,预后不良[4]。本实验通过RNA干扰技术沉默乳腺癌细胞MDA-MB-231中CD98hc分子的表达,分析其对MDA-MB-231细胞增殖侵袭力的影响,为进一步阐明乳腺癌侵袭迁移机制提供实验依据。
1 材料与方法
1.1材料与试剂兔抗人CD98单克隆抗体购自Abcam公司;小鼠抗人β-actin单克隆抗体购自Calbiochem公司;TRIzol购自Invitrogen公司;RNA反转录试剂、实时荧光定量PCR试剂购自TaKaRa公司;MTT试剂盒购自Promega公司;Transwell小室购自Corning公司;Lipofectamine 2000购自Invitrogen公司;MDA-MB-231细胞购自美国ATCC细胞库。
1.2方法
1.2.1CD98hc-shRNA真核表达载体构建 根据shRNA设计原则,靶向设计CD98hc的shRNA,上游:5′-CCGGTGCTGAGGTTACAGTAGAAACGGATCC GTTTCTACTGTAACCTCAGCATTTTTG-3′,下游:5′-A ATTCAAAAATGCTGAGGTTACAGTAGAAACGGATCC GTTTCTACTGTAACCTCAGCA-3′。退火处理:95 ℃ 5 min,85 ℃ 5 min,75 ℃ 5 min,70 ℃ 5 min,4 ℃保存。用SolutionⅠ连接酶将准备好的插入片段连接到载体Plko.1,转化到感受态细胞。挑取菌落,抽取质粒,酶切并鉴定。
1.2.2细胞培养 MDA-MB-231细胞培养于含10%FBS、2%L-谷氨酰胺的DMEM高糖培养基中,置于37 ℃、5%CO2培养箱,适时更换培养基和传代。实验时选取处于对数生长期的细胞。
1.2.3MDA-MB-231稳转细胞系构建 取对数生长期的MDA-MB-231细胞2×105个接种于6孔板中,继续培养,待融合度达60%按质粒 ∶脂质体=1 ∶2的比例转染实验组CD98hc表达质粒(CD98hc-shRNA)、对照组空载质粒(Vector),具体操作步骤按Lipofectamine 2000试剂盒说明书进行,培养48 h后按4 μL/mL添加Puromycin, 适时更换培养基。分别获得下调CD98hc的MDA-MB-231细胞株和对照MDA-MB-231细胞株。收集细胞进行Western blot和qRT-PCR技术鉴定,鉴定成功后用于后续的实验。
1.2.4Western blot检测 收集待检测细胞,细胞裂解液提取蛋白后进行10%SDS-PAGE凝胶电泳,湿转至NC膜后,应用5%脱脂牛奶封闭1 h,一抗4 ℃孵育过夜,PBST洗膜3次加入二抗,室温孵育1 h,洗膜3次,化学发光,采集图像。
1.2.5qRT-PCR检测 采用qRT-PCR法检测CD98hc的mRNA表达。收集待检测细胞,利用TRIzol提取细胞总RNA,按TaKaRa反转录试剂盒操作说明进行反转录。CD98hc定量PCR引物上游:5′-TCCGACTCTACCAGCTGATGC-3′,下游:5′-AAGCTG GACTCATCCCACAGC-3′。GAPDH引物序列上游:5′-TGCACCACCAACTGCTTAGC-3′,下游:5′-GGCA TGGACTGTGGTCATGAG-3′。引物序列合成由上海生工公司完成。反应条件:预变性94 ℃ 30 s,94 ℃ 15 s,60 ℃ 30 s,退火温度后采集荧光信号,合计40个循环,实验重复3次。将所得数据导出,绘制柱状图。
1.2.6MTT实验检测MDA-MB-231细胞活力 常规洗涤并用胰酶消化待检测的细胞,制成单细胞悬液,每孔1×103个细胞接种于96孔板中,每个处理组重复6孔,合计培养5个96孔板。于24 h后检测细胞活力,弃培养液,每孔加入100 μL MTT液,置培养箱孵育2 h。弃上清,每孔加入DMSO 100 μL。震荡10 min,在570 nm处测定各孔吸光度OD值,结果取平均值。
1.2.7Transwell实验检测MDA-MB-231细胞侵袭迁移能力 用胰酶消化各组细胞,PBS洗1~2次,用含10 g/L的BSA无血清培养基重悬,每组取1×105个细胞加入预先用Matrigel包被基膜的Transwell小室的上室中,下室加入含血清的完全培养基600 μL,培养48 h。培养结束后,取出小室,PBS清洗,用棉签小心擦去微孔膜内层的细胞,90%乙醇固定30 min,0.1%结晶紫染色15 min,倒置显微镜下观察,每个样本随机计数5个视野,取平均值,绘制柱状图。检测细胞迁移时,小室上室中不需要Matrigel包被基膜,其他步骤与之相同。
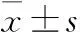
2 结果
2.1细胞中CD98hc的表达应用qRT-PCR检测CD98hc的mRNA水平表达,发现与空白组(1.040±0.056)、对照组(1.293±0.006)相比,实验组(0.527±0.045)在mRNA水平表达明显下调(P<0.05),空白组与对照组差异无统计学意义(P>0.05,图1A)。Western blot检测结果显示:CD98hc-shRNA组CD98hc蛋白表达明显下调,蛋白表达的抑制作用明显(图1B)。

图1 A.qRT-PCR检测MDA-MB-231细胞CD98hc干涉情况;B.Western blot检测MDA-MB-231细胞CD98干涉情况
2.2下调表达CD98hc分子抑制MDA-MB-231细胞增殖应用MTT实验检测CD98hc分子对MDA-MB-231细胞增殖的影响,结果发现48 h后CD98hc-shRNA组(0.580±0.035)细胞的增殖与空白组(0.706±0.013)、对照组(0.724±0.018)相比受抑制,差异有统计学意义(P<0.05);空白组与对照组差异无统计学意义(P>0.05,图2)。
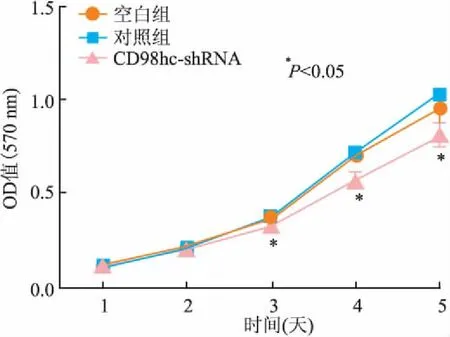
图2 MTT检测CD98hc分子对MDA-MB-231细胞的增殖抑制作用

③A③B③C④A④B④C
图3下调CD98hc显著抑制MDA-MB-231细胞侵袭能力:A. 空白组;B. 对照组; C. CD98hc-shRNA组图4下调CD98hc显著抑制MDA-MB-231细胞迁移能力:A. 空白组;B. 对照组; C. CD98hc-shRNA组
2.3下调表达CD98hc分子抑制MDA-MB-231细胞侵袭及迁移应用Transwell实验检测细胞侵袭及迁移的能力,结果发现CD98hc-shRNA组(108±4.5)穿过Matrigel包被的细胞数与空白组(377±20.9)、对照组(394.6±9.8)相比明显减少(P<0.05)。穿过未包被的微孔膜的细胞数CD98hc-shRNA组(118.4±13.1)也明显少于空白组(385.2±27.3)和对照组(405.2±13.8),差异有统计学意义(P<0.05);空白组与对照组相比,差异无统计学意义(P>0.05,图3、4)。
3 讨论
CD98hc首次被发现是作为T淋巴细胞的表面抗原[5],随后发现CD98hc在多种细胞中广泛表达。大量研究发现,CD98hc具有双重功能,其中胞膜外区可通过二硫键与6种L型氨基酸转运体(LAT1、LAT2、xCT、y+LAT1、y+LAT2和asc1)共价结合,构成的氨基酸转运体是其运输氨基酸的必需组分[6-7],保证肿瘤细胞对氨基酸的大量需求,维持肿瘤细胞的快速增殖能力[8]。CD98hc的胞质区可通过调节Integrin样信号通路来改变细胞的存活、迁徙甚至是转移[9]。
CD98hc在多种肿瘤细胞表面高表达,与肿瘤的发展密切相关[10]。Fei等[11]报道,CD98hc在非小细胞肺癌组织中高表达,且与CD98hc阴性的肺癌患者相比,CD98hc阳性患者总体生存率减低、复发率增高。Shin等[12]发现SLC3A2基因能与神经调节素1(neuregulin 1, NRG1)融合,该基因融合能够促进肺癌细胞的增殖、侵袭迁移。CD98hc可通过增强Rho激酶(ROCK)的活性以及YAP/TPZ 的转录,介导肿瘤微环境中细胞外基质重塑,促进胃肠道的转移[13]。CD98hc还可与左旋氨基酸转移蛋白1(L-type amino acid transporter 1, LAT1)结合,参与调节肿瘤细胞的生长、迁移和侵袭[14]。Poettler等[15]实验得出在肾透明细胞癌中沉默CD98hc的表达能够一定程度抑制细胞的增殖、转移等肿瘤特性。该现象在胶质瘤中也有发生[16],但在乳腺癌中还未见相关报道。本组实验结果显示:沉默CD98hc在乳腺癌细胞MDA-MB-231中的表达可以明显抑制细胞增殖及侵袭迁移能力,与其他肿瘤的研究结果一致。提示CD98hc可能参与乳腺癌细胞生物学行为的调控,但关于其调节肿瘤生物学行为的作用机制还有待于进一步分析。
[1] Chen W Q, Zheng R S, Baade P D,etal. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016,66(2):115-132.
[2] Lim B, Hortobagyi G N. Current challenges of metastatic breast cancer[J]. Cancer Metastasic Rev, 2016,35(4):495-514.
[3] Merlin D, Sitaraman S, Liu X,etal. CD98-mediated links between amino acid transport and beta 1 integrin distribution in polaried columnar epithelia[J]. J Biol Chem, 2001,276(42):39282-39289.
[4] Lemaitre G, Stella A, Feteira J,etal. CD98hc (SLC3A2) is a key regulator of keratinocyte adhesion[J]. J Dermatol Sci, 2011,61(3):169-179.
[5] Haynes B F. Human T lymphocyte antigens as defined by monoclonal antibodies[J]. Immunol Rev, 1981,57(1):127-161.
[6] Fort J, de la Ballina L R, Burghardt H E,etal. The structure of human 4F2hc ectodomain provides a model for homodimerization and electrostatic interaction with plasma membrane[J]. J Biol Chem, 2007,282(43):31444-31452.
[7] Verrey F, Closs E I, Wagner C A,etal. CATs and HATs: the SLC7 family of amino acid transporters[J]. Pflugers Arch, 2004,447(5):532-542.
[8] de la Ballina L R, Cano-Crespo S, Gonzalez-Munoz E,etal. Amino acid transport associated to cluster of differentiation 98 heavy chain (CD98hc) is at the cross-road of oxidative stress and amino acid availability[J]. J Biol Chem, 2016,291(18):9700-9711.
[9] Feral C C, Nishiya N, Fenczik C A,etal. CD98hc (SLC3A2) mediates integrin signaling[J]. Proc Natl Acad Sci USA, 2005,102(2):355-360.
[10] 石圆圆,潘宇飞,谈冶熊,等. 氨基酸转运体组分SLC3A2在肿瘤发生发展中的作用[J]. 肿瘤防治研究, 2017,44(3):236-240.
[11] Fei F, Li X, Xu L,etal. CD147-CD98hc complex contributes to poor prognosis of non-small cell lung cancer patients through promoting cell proliferation via the PI3K/AKt signaling pathway[J]. Ann Surg Oncol, 2014,21(13):4359-4368.
[12] Shin D H, Lee D, Hong D W,etal. Oncogenic function and clinical implications of SLC3A2-NRG1 fusion in invasive mucinous adenocarcinoma of the lung[J]. Oncotarget, 2016,7(43):69450-69465.
[13] Nguyen H T, Dalmasso G, Yan Y,etal. Intestinal epithelial cell-specific CD98 expression regulates tumorigenesis in Apc(Min/+) mice[J]. Lab Invest, 2012,92(8):1203-1212.
[14] Shi L, Luo W, Huang W,etal. Downregulation of L-type amino acid transporter 1 expression inhibits the growth, migration and invasion of gastric cancer cells[J]. Oncol Lett, 2013,6(1):106-112.
[15] Poettler M, Unseld M, Braemswig K,etal. CD98hc (SLC3A2) drives integrin- dependent renal cancer cell behavior[J]. Molecular Cancer, 2013,12:169.
[16] 苗 锐,赵 耀,杨荣军,等. RNA干扰下调CD98hc表达对胶质瘤细胞U251增殖、转移的影响[J]. 中国医学学报, 2016,13(17):16-19.
