miR-3619-5p对乳腺癌细胞MCF-7和T47D增殖、凋亡的影响及分子机制
2018-01-15任志敏古雅丽李新敏
任志敏,古雅丽,李新敏,张 瑶
目前,乳腺癌发病率居于女性肿瘤的第一位,美国癌症协会的调查数据显示,2016年乳腺癌预计新发病例249 260例,死亡40 890例[1-2]。因此,寻找新的乳腺癌靶基因对乳腺癌的预防和治疗具有重要意义。随着靶向治疗的发展,miRNA在乳腺癌中的应用已成为研究的热点[3-4]。miR-3619-5p是近年发现的具有明显抑癌效应的miRNA[5-6],在乳腺癌细胞中作用尚未见报道。本文以体外培养的人乳腺癌细胞MCF-7和T47D为实验对象,观察miR-3619-5p对乳腺癌细胞增殖能力的影响及探讨可能的分子机制。
1 材料与方法
1.1材料has-miR-3619-5p mimic、对照组(转染dsControl)和5-乙炔基-2′脱氧尿嘧啶核苷(EdU)细胞增殖检测试剂盒购自广州锐博公司;Annexin V-FITC/PI双染细胞凋亡检测试剂盒购自江苏凯基公司;流式细胞仪购自美国BD公司。人乳腺癌细胞系MCF-7和T47D购自中国科学院上海生命科学研究院细胞资源中心;胎牛血清和DMEM培养基购自美国Gibco公司; Lipofectamine 3000、Opti-MEM购自美国Invitrogen公司;qPCR试剂盒购自日本TaKaRa公司;PCR引物合成购自上海生工公司;BCA protein assay kit购自美国Pierce公司;一抗鼠单抗GAPDH、兔多抗p21、CDK6和Cyclin D1,均购自美国Cell Signaling Technology公司;辣根过氧化物酶(HRP)标记的二抗羊抗兔/鼠购自美国Affinity公司;ECL显影液购自美国Millipore公司;其余试剂购自上海碧云天公司。根据文献设计miR-3619-5p和dsControl序列,miR-3619-5p与p21基因启动子结合区域详见图1;dsControl是与人类基因组无序列同源性的dsRNA[6-7];根据Primerbank数据库设计GAPDH、p21、CDK6和Cyclin D1的引物(表1)。

表1 miR-3619-5p、dsControl序列及qRT-PCR引物序列
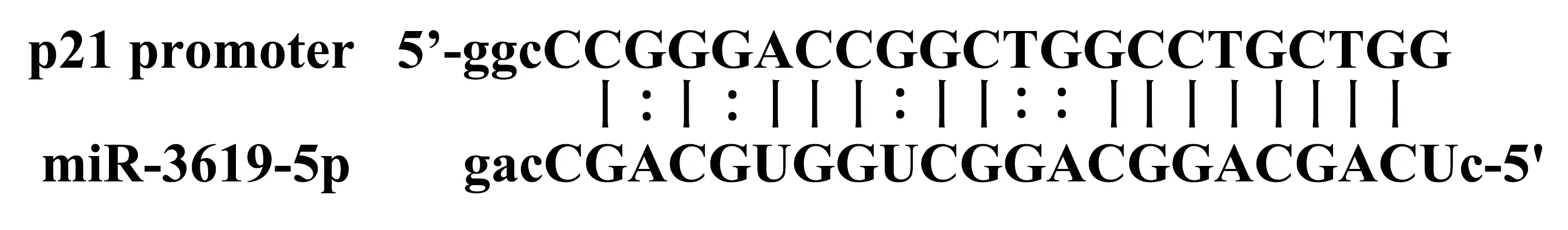
图1 miR-3619-5p与p21基因启动子结合区域
1.2方法
1.2.1细胞培养和转染 在37 ℃、CO2体积分数为5%饱和湿度培养箱中使用含10%胎牛血清的RPMI 1640培养基培养人乳腺癌细胞系MCF-7和T47D。根据Lipofectamine 3000说明书进行转染实验。
1.2.2EdU细胞增殖实验检测乳腺癌细胞增殖能力 转染实验后24 h,将乳腺癌细胞以每孔6 000个接种于96孔板中,继续培养24 h,使细胞融合度达60%。每孔加入100 μL稀释EdU溶液,继续孵育2 h。根据EdU细胞增殖检测试剂盒说明书进行细胞固定、Apollo染色、DNA染色,荧光显微镜下进行观察拍照,随机选取4个视野计数细胞,计算增殖率。
1.2.3集落形成实验检测细胞增殖能力 转染后24 h,按1×103个/孔接种于6孔细胞培养板,连续培养10天;PBS溶液洗3次;1 mL甲醇固定15 min;0.1%结晶紫溶液固定30 min;流水缓慢洗去结晶紫染液,空气干燥,倒置显微镜下计算集落形成率。
1.2.4流式细胞术(flow cytometry, FCM)检测细胞周期分布 转染实验后72 h,进行胰酶消化,预冷的PBS溶液洗3次;70%乙醇溶液重悬后,置于4 ℃冰箱内固定过夜;离心1 000 r/min,取细胞沉淀,1 mL PBS溶液洗3次;加入100 μL RNAse,37 ℃水浴箱孵育30 min;加入100 μL PI混匀,4 ℃避光孵育30 min;流式细胞仪进行单色荧光细胞流式计数,使用Multicycle软件(美国Beckman公司)进行细胞周期分析。
1.2.5细胞凋亡检测 转染实验后72 h,使用胰酶消化收集细胞,按照Annexin V-FITC/PI双染细胞凋亡检测试剂盒说明书进行操作,流式细胞仪检测。
1.2.6RNA提取及定量检测 转染后72 h收集乳腺癌细胞,分别用Trizol提取各组细胞RNA,使用逆转录酶和olige(dT)逆转录RNA为cDNA。以甘油醛-3-磷酸脱氢酶(GAPDH)为内参,合成的cDNA使用荧光定量PCR试剂盒及特异性引物通过PCR仪进行扩增检测,最终结果采用2-ΔΔCt方法分析。
1.2.7Western blot检测细胞中相关蛋白表达变化 转染72 h后收集乳腺癌细胞,用预冷的PBS洗3次,加入RIPA细胞裂解液,4 ℃裂解30 min,提取总蛋白。使用BCA protein assay kit测定蛋白浓度。每个样品提取30 μg蛋白上样,采用10%的SDS-PAGE胶进行电泳分离,使用PVDF转膜后用含5%牛血清白蛋白的TBST溶液室温封闭后,分别与特异性一抗GAPDH(1 ∶3 000)、p21(1 ∶2 000)、CDK6(1 ∶1 000)、Cyclin D1(1 ∶2 000)在4 ℃下孵育过夜。二抗(1 ∶1 000)室温下摇床孵育;条带滴加ECL试剂曝光显影。
2 结果
2.1EdU细胞增殖实验检测细胞增殖变化与dsControl组相比,转染miR-3619-5p后细胞EdU阳性细胞数显著降低(P<0.05),提示miR-3619-5p可抑制乳腺癌细胞的增殖能力(表2)。
表2 miR-3619-5p对乳腺癌细胞增殖能力、凋亡率的影响
miR-3619-5p组与dsControl组比较,P<0.05
2.2集落形成实验检测细胞增殖能力与dsControl组相比,miR-3619-5p组细胞形成的集落大小和集落数均明显减少(P<0.01),表明miR-3619-5p可导致乳腺癌细胞增殖能力显著降低(表2)。
2.3FCM法检测细胞周期分布转染miR-3619-5p后与dsControl组相比,MCF-7和T47D细胞在S期和G2/M期细胞比例明显减少,G0/G1期细胞比例显著增加(P<0.05,表3),表明miR-3619-5p可抑制乳腺癌细胞周期的进展;MCF-7和T47D细胞凋亡率明显上升(P<0.01,表2),提示miR-3619-5p可诱导乳腺癌细胞的凋亡。
表3 miR-3619-5p对乳腺癌细胞周期的影响
miR-3619-5p组与dsControl组比较,P<0.05
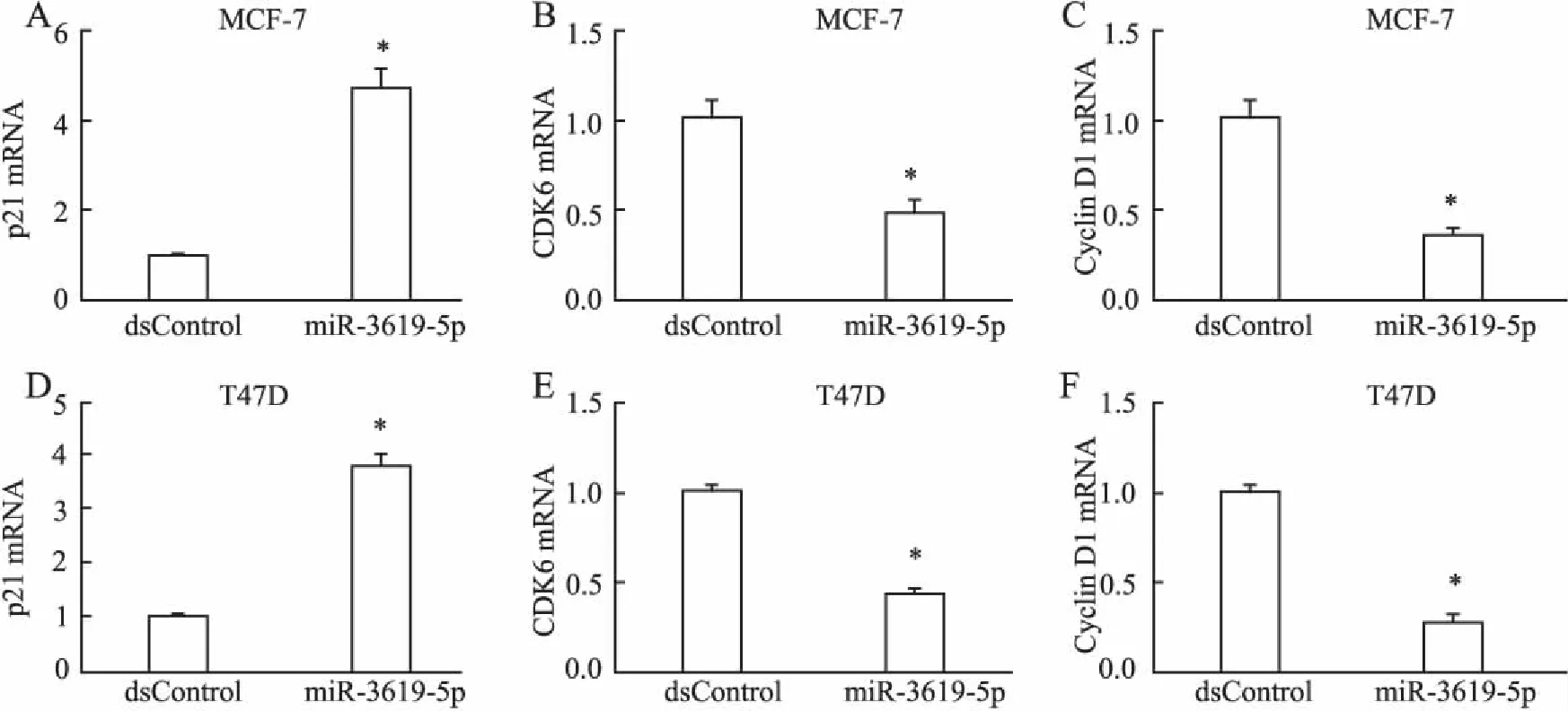
图2 miR-3619-5p过表达对乳腺癌不同细胞表达的影响
A.MCF-7中p21表达;B.MCF-7中CDK6表达;C.MCF-7中Cyclin D1 mRNA表达;D.T47D中p21表达;E.T47D中CDK6表达;F.T47D中Cyclin D1表达;*P<0.01
2.4qRT-PCR法检测p21mRNA表达转染miR-3619-5p后与dsControl组相比,MCF-7和T47D细胞中p21 mRNA的表达分别上调4.70倍(P<0.01)和3.76倍(P<0.01);CDK6 mRNA的表达分别下调至48%(P<0.01)和42%(P<0.01);Cyclin D1 mRNA的表达分别下调至34%(P<0.01)和28%(P<0.01,图2)。
2.5Westenblot法检测蛋白表达与dsControl组相比,miR-3619-5p组可见p21蛋白表达明显升高,CDK6和Cyclin D1蛋白表达明显降低(图3),提示miR-3619-5p可显著激活乳腺癌细胞中p21蛋白的表达。
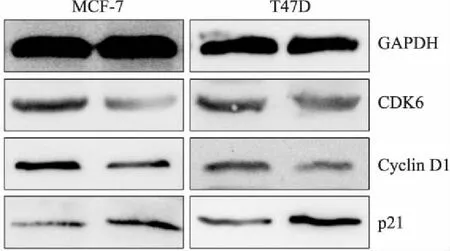
图3 miR-3619-5p过表达对乳腺癌细胞中p21、CDK6和Cyclin D1蛋白表达的影响
3 讨论
RNA激活作用(RNAa)是新近发现的小分子RNA可上调低表达基因如抑癌基因的现象,这一特征使RNAa具有肿瘤靶向治疗研究的潜在价值[8]。与传统的RNA干扰作用(RNAi)不同,RNAa的确切机制尚不明确[9]。目前最为广泛接受的机制是具有激活作用的小分子RNA转染细胞后,首先被装载于Ago蛋白家族,形成有活性的Ago-RNA复合物,该复合物穿过核膜,特异性结合于靶基因启动子区域,招募多种组蛋白修饰酶,染色质结构打开,转录激活[10]。近年的研究表明,越来越多的miRNA可通过作用于基因启动子区域,激活特定基因表达[11]。miRNAs激活作用出现在转染后的24~48 h,在72 h达高峰,作用约可持续2周[12]。
miR-3619-5p是近年新发现的可抑制肿瘤生长的miRNA,目前在肿瘤中的研究较少。Niu等[5]研究发现,非小细胞肺癌中miR-3619-5p表达水平显著降低,β-链蛋白表达升高,两者表达水平呈明显的负相关。生物信息学分析显示,miR-3619-5p可结合非小细胞肺癌细胞中β-链蛋白mRNA的3′-UTR以抑制其翻译,显著抑制癌细胞的生长和侵袭作用,有望成为非小细胞肺癌新型的抑癌因子。miR-3619-5p不仅具有干扰基因的表达,而且具有激活基因表达的作用。Li等[6]研究发现,miR-3619-5p可通过激活前列腺癌细胞中p21基因的表达,抑制前列腺癌细胞的生长和迁移。然而,miR-3619-5p在乳腺癌细胞中的作用未见报道。本组发现,转染miR-3619-5p后乳腺癌细胞的增殖能力明显下降,细胞周期明显受到抑制,细胞凋亡率明显升高。CDK6和Cyclin D1是细胞周期相关蛋白,两者可特异性结合形成CyClin D1-CDK6复合物,促进细胞周期的进展,提高细胞的增殖能力,参与多种肿瘤的发生、发展[13-14]。通过qRT-PCR和Western blot检测发现,CDK6和Cyclin D1的表达水平均明显下降。p21基因在多种肿瘤中呈显著的低表达,具有广泛的细胞周期依赖性激酶抑制活性,可特异性的抑制Cyclin D1-CDK6复合物的形成,抑制肿瘤的生长,具有明显的抑癌效应[15-16]。我们通过qRT-PCR和Western blot实验发现miR-3619-5p可明显激活乳腺癌细胞中p21蛋白的表达。乳腺癌中p21蛋白表达升高导致CDK6和Cyclin D1的表达明显下调,使Cyclin D1-CDK6复合物形成减少,导致MCF-7和T47D细胞G1期到S期进程受阻,乳腺癌细胞周期的进展受到抑制,增殖能力下降。miR-3619-5p是否直接通过作用于p21基因启动子区域激活表达是本实验分析不足,我们下一步将采用染色质免疫共沉淀实验验证miR-3619-5p的靶点。同时我们也将通过动物实验观察miR-3619-5p在体内对乳腺癌细胞增殖能力的抑制作用,并通过RNAi观察下调p21基因的表达,miR-3619-5p对乳腺癌细胞生长的影响。
综上所述,miR-3619-5p可显著抑制乳腺癌细胞的增殖能力,促进细胞的凋亡,其分子机制可能为通过激活乳腺癌细胞中抑癌基因p21的表达。miR-3619-5p有望成为具有乳腺癌治疗应用价值的基因工具。
[1] Siegel R L, Miller K D, Jemal A. Cancer statistics, 2016[J]. CA Cancer J Clin, 2016,66(1):7-30.
[2] 郑 丽,赵 敏,昂 琳,等. 乳腺癌中BCL-6和ZEB2的表达及其意义[J]. 临床与实验病理学杂志, 2017,33(1):50-54.
[3] Liang A L, Zhang T T, Zhou N,etal. MiRNA-10b sponge: an anti-breast cancer studyinvitro[J]. Oncol Rep, 2016,35(4):1950-1958.
[4] 丁克硕,吴正升. miR-330抑制乳腺癌细胞增殖及其临床病理学意义[J]. 临床与实验病理学杂志, 2016,32(9):967-970.
[5] Niu X, Liu S, Jia L,etal. Role of MiR-3619-5p in beta-catenin-mediated non-small cell lung cancer growth and invasion[J]. Cell Physiol Biochem, 2015,37(4):1527-1536.
[6] Li S, Wang C, Yu X,etal. miR-3619-5p inhibits prostate cancer cell growth by activating CDKN1A expression[J]. Oncol Rep, 2017,37(1):241-248.
[7] Wang C, Chen Z, Ge Q,etal. Up-regulation of p21(WAF1/CIP1) by miRNAs and its implications in bladder cancer cells[J]. FEBS Lett, 2014,588(24):4654-4664.
[8] Zou Q, Liang Y, Luo H,etal. miRNA-mediated RNAa by targeting enhancers[J]. Adv Exp Med Biol, 2017,983:113-125.
[9] Wu H L, Li S M, Hu J,etal. Demystifying the mechanistic and functional aspects of p21 gene activation with double-stranded RNAs in human cancer cells[J]. J Exp Clin Cancer Res, 2016,35(1):145.
[10] Huang V, Place R F, Portnoy V,etal. Upregulation of Cyclin B1 by miRNA and its implications in cancer[J]. Nucleic Acids Res, 2012,40(4):1695-1707.
[11] Wang C, Tang K, Li Z,etal. Targeted p21(WAF1/CIP1) activation by miR-1236 inhibits cell proliferation and correlates with favorable survival in renal cell carcinoma[J]. Urol Oncol, 2016,34(2):23-59.
[12] Guo D, Barry L, Lin S S,etal. RNAa in action: from the exception to the norm[J]. RNA Biol, 2014,11(10):1221-1225.
[13] Xia B, Yang S, Liu T,etal. miR-211 suppresses epithelial ovarian cancer proliferation and cell-cycle progression by targeting Cyclin D1 and CDK6[J]. Mol Cancer, 2015,14:57.
[14] Li X, Gong X, Chen J,etal. miR-340 inhibits glioblastoma cell proliferation by suppressing CDK6, cyclin-D1 and cyclin-D2[J]. Biochem Biophys Res Commun, 2015,460(3):670-677.
[15] Ye D, Luo H, Lai Z,etal. ClC-3 Chloride channel proteins regulate the cell cycle by up-regulating cyclin D1-CDK4/6 through suppressing p21/p27 expression in nasopharyngeal carcinoma cells[J]. Sci Rep, 2016,6:30276.
[16] 张 军,汪瑞雪,樊晓妹,等. 卵巢浆液性腺癌中SP1、KLF4和p21表达及其预后意义[J]. 临床与实验病理学杂志, 2017,33(1):22-26.
