加碱对猪场废水厌氧消化液好氧处理过程酸化改进作用及其对菌群结构的影响
2018-01-11邓良伟姜奕圻
王 伸, 邓良伟, 姜奕圻, 王 霜, 徐 则 , 郑 丹
( 1.农业部沼气科学研究所, 成都 610041; 2.农业部农村可再生能源开发利用重点实验室, 成都 610041)
加碱对猪场废水厌氧消化液好氧处理过程酸化改进作用及其对菌群结构的影响
王 伸1,2, 邓良伟1,2, 姜奕圻1,2, 王 霜1,2, 徐 则1,2, 郑 丹1,2
( 1.农业部沼气科学研究所, 成都 610041; 2.农业部农村可再生能源开发利用重点实验室, 成都 610041)

猪场废水厌氧消化液; SBR; 短程硝化; pH值; 加碱
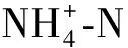
笔者对加碱改进猪场废水厌氧消化好氧处理效果进行了长期、比较系统的研究,并对加碱处理后的微生物群落进行分析。希望能为厌氧消化液好氧后处理工程应用提供参考。
1 试验材料和方法
1.1 污泥和污水
试验所用接种污泥来源于实验室培养的好氧污泥(具有硝化、反硝化活性)。试验进水为四川邛崃某猪场废水处理沼气工程厌氧反应器出水(厌氧消化液)。
1.2 试验装置
试验采用SBR工艺,实验装置为内径为12 cm,外径为18 cm,高度100 cm的有机玻璃圆柱体,总容积11.3 L,反应容积为9.5 L。反应器外设夹套以及加热循环水进出口各一个,通过循环电子恒温水浴锅(型号HH-W21,北京中兴伟业仪器有限公司)内热水以实现对温度的控制。在反应器底部布置定制的直径为9cm的曝气盘,曝气盘连接空气压缩机(型号ACO-002,天津森森集团股份有限公司)进行曝气。底部曝气盘上设微型潜水泵(型号At-104,香港创星制品有限公司)作为搅拌装置。采用蠕动泵(型号WT600-2J,保定兰格集团)进行进出料。
1.3 试验方法
处理系统酸化预实验:在1个50 L桶里面加入生活污水处理厂曝气池污泥,进水为猪场废水厌氧消化液,只进水不出水,充分曝气培养,5 d后桶里面混合pH值降至6.0以下,视为酸化。
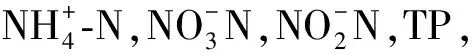
1.4 检测项目及分析方法
1.5 微生物高通量测序分析
从反应开始时的接种污泥、稳定运行203 d时反应器混合液取样。对所取样品采用CTAB方法进行基因组DNA提取,随后利用琼脂糖凝胶电泳检测其DNA的浓度和纯度。使用聚合酶链式反应(PCR)技术扩增细菌的16SrRNA基因。以16S rRNA V3~V4 区内338F (5′-ACTCCT ACGGGAGGCAGCA-3′)和806R (5′-GGACTAC HVGGGTWTCTAA T-3′)为特征引物。PCR 反应体系和程序(30μL)为: Phusion Master Mix(2×) 15 μL ;Primer(2μM) 3 μL(6μM) gDNA(1 ng·μL-1) 10 μL(5~10 ng) H2O 2 μL ;98℃预变性1 min;30 个循环包括(98 ℃,10 sec;50 ℃,30 sec;72 ℃,30 sec);72℃,超纯水灭菌5 min;用2%浓度的琼脂糖凝胶进行电泳检测PCR的产物;使用Thermo Scientific公司的GeneJET胶作为回收试剂盒对PCR扩增产物进行回收。委托北京诺禾致源生物信息科技有限公司基于Illumina Hiseq 2500平台对PCR 扩增产物的高通量测序,在多样性评估的基础上,采用Qiime 软件进行微生物分类学分析。
2 结果与讨论
2.1 反应器中混合液pH值变化
从图1中可以看出,反应开始时,两个反应器的混合液都处于酸化状态,pH值为5.7左右。其后, AA组加入碱以后pH值就在6.5以上,反应装置不再酸化,其pH值随加碱的变化而变化;而未加入碱的CG组,在前期出现波动,出现pH值上升现象,从第84天以后开始到试验结束第203天,pH值逐渐下降,直至稳定在5.7左右。AA组出水pH值平均值为7.9,说明改进策略能明显抑制酸化。AA组改进原因是因为外加的碱能中和硝化过程中产生的酸,使其pH值能维持在6.5以上。
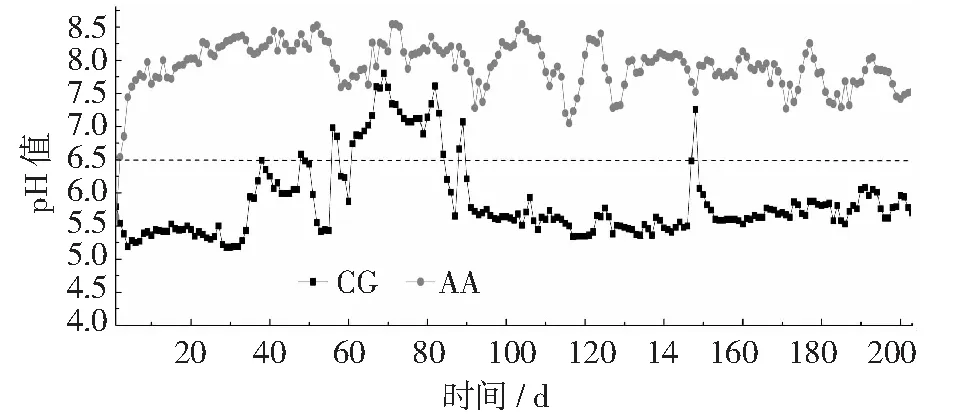
图1 不同反应器曝气结束时混合液pH值
2.2 SBR对COD的去除
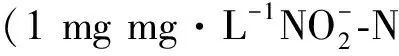
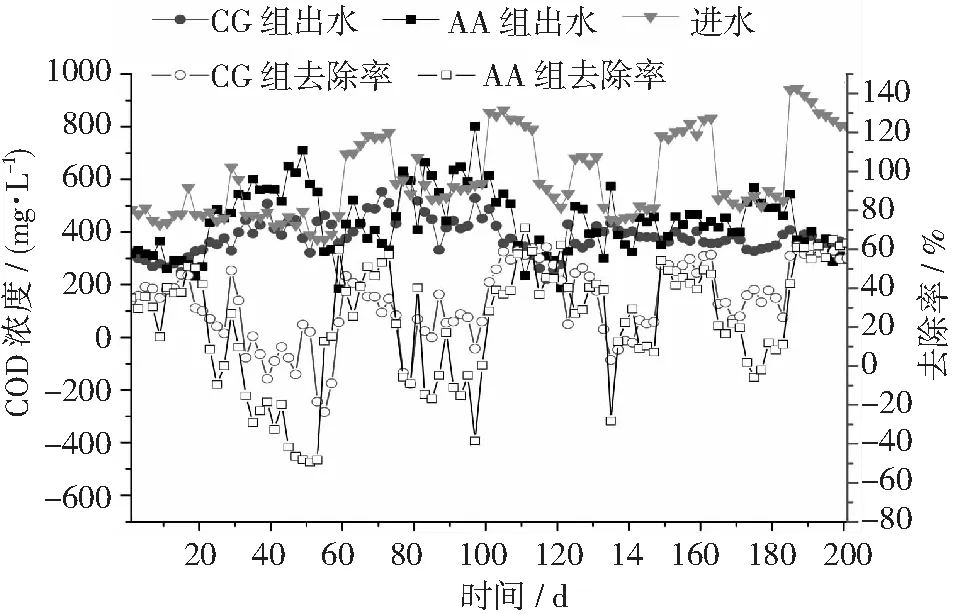
图2 不同反应器对猪场废水厌氧消化液COD的去除
2.3 氮去除
2.3.1 氨氮去除

图3 不同反应器对猪场废水厌氧消化液的去除
2.3.2 氨氮转化物
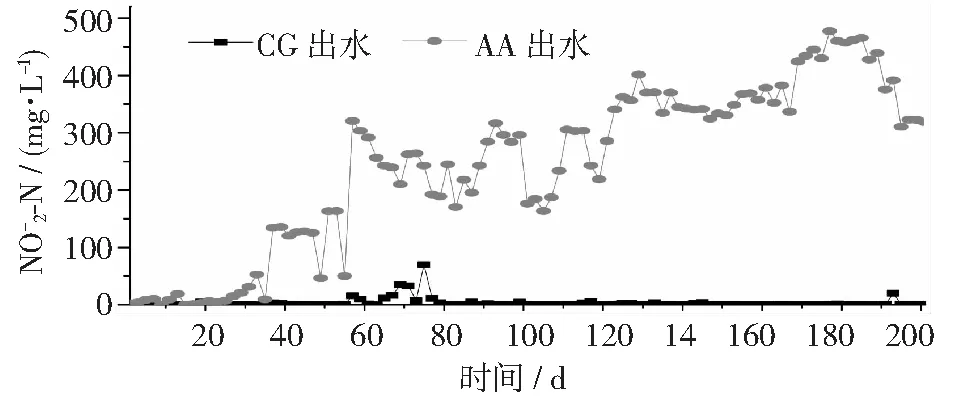
图4 不同反应器中浓度变化情况
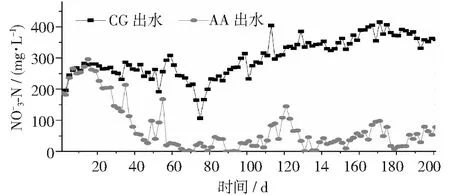
图5 不同反应器中浓度变化情况
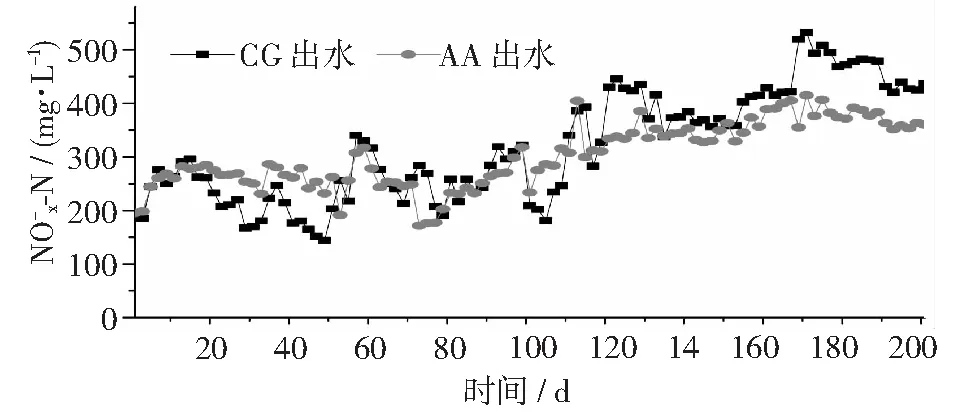
图6 不同反应器中浓度变化情况
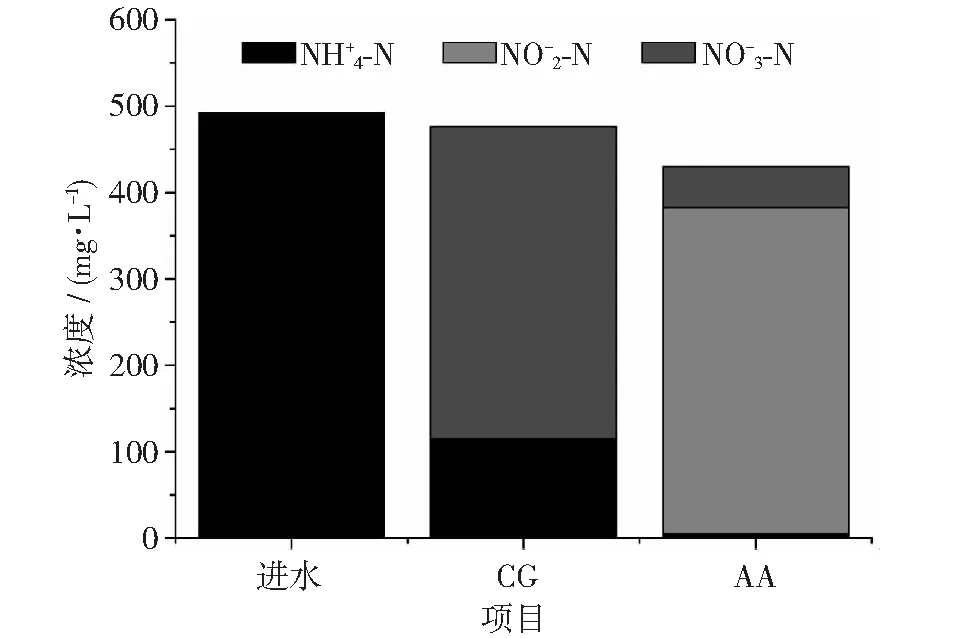
图7 进水和129~201天期间CG和AA组出水中和浓度变化
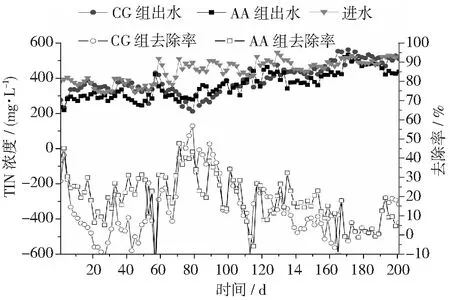
图8 不同反应器对猪场废水厌氧消化液的去除
2.4 总磷去除
图9显示了SBR对猪场废水厌氧消化液TP去除效果。从图6可知,在试验前期(第19周前),进水(厌氧消化液)TP浓度为45.2 mg·L-1,CG和AA组出水TP浓度分别为58.2 mg·L-1,48.9 mg·L-1和23.8 mg·L-1,对应去除率分别为-36.1%和-19.6%。在稳定期(第19~28周),进水(厌氧消化液)TP浓度为37.9 mg·L-1,CG和AA组出水TP浓度分别为43.6 mg·L-1和38.3 mg·L-1,对应去除率分别为-19.4%和-7.48%。通过对比发现,稳定期间酸化改进AA组,可以提高11.9%的TP去除率。出现AA组对TP去除率为负数的原因是在反应器中前期积累的大量的TP而没有排除,造成后期出水浓度比进水浓度高。传统的生物除磷理论[26~27]认为,生物除磷主要通过聚磷菌(Poly-P Accumulating Organisms, PAOs)在好氧条件下过量的吸磷,在厌氧条件下,水解细胞原生质中聚合磷酸盐(poly-P)从而释放磷;通过排除富含磷的污泥,以此达到除磷的目的。因为去除TP是通过排除富含微生物的剩余污泥[28],而运行203 d期间没有排富含磷的污泥,导致污泥老化,也是磷去除效果差的又一原因。因此,在试验运行期间没有进行排泥和污泥老化解体是笔者试验除磷效果差的根本原因。
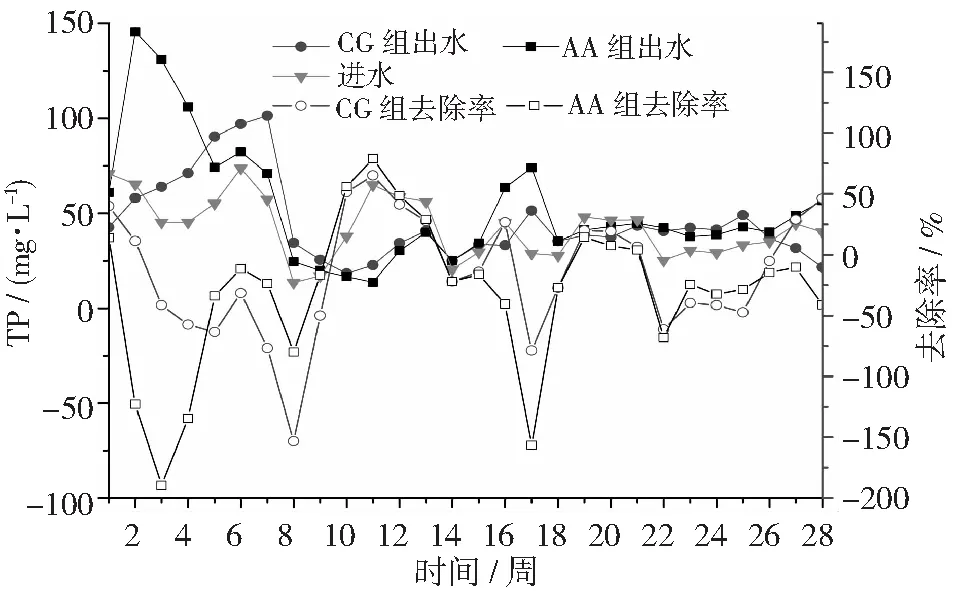
图9 不同反应器对猪场废水厌氧消化液TP的去除
2.5 微生物菌群结构的变化
利用Hiseq高通量测序平台对对照组和改进组污泥中微生物多样性进行了分析。高达99.9%以上的覆盖率表明,测序结果能真实反映样品中的菌群分布情况。CG组和AA组得到相同的56676和57563条有效序列,平均长度为分别为420和420 bp,在99%的相似水平上可聚类产生1262和1286个OTU。不同污泥样品的具体细菌群落多样性指数如表2所示。由ACE, Chao, Simpson和Shannon指数分析可知,加碱的AA组中污泥细菌群落的丰富度和多样性高于未加碱的CG组,同时也增加了细菌群落的均一性。对测序样品得到的序列进行比对分析,两组样品在生物分类学门的水平上进行分类。由表1可知变形菌门 (Proteobacteria)和拟杆菌门(Bacteroidetes)是两个反应器共有的优势菌门,CG组相对丰度为27.4%和26.2%,AA组相对丰度为35.2%和31.2%。与未加碱CG组相比,加碱的AA组使变形菌门 (Proteobacteria)和拟杆菌门(Bacteroidetes)的相对丰度有所增加,而Acidobacteria(酸杆菌门)的相对丰度急剧减小,从相对丰度28.9%减少到4.78%。
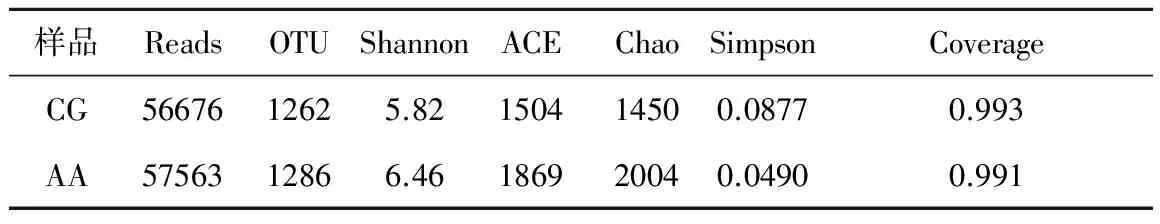
表1 样本微生物多样性指数
注:表中Chao和ACE指数常用来表征菌群的丰富度,数值越大,表示样品中群落结构越丰富。Shannon和Simpson指数常用来估算样本中微生物的多样性,Shannon值越大,其说明群落多样性越高;而Simpson指数值越大,说明群落多样性越低,均一性相对越差。
表2是CG和AA组污泥中由相对丰度所有大于1%的属组成,共有22个属。在CG组中,主要是好氧异养微生物,如Blastocatella[29],Saprospiraceae和Chitinophagacea[30-31]。其中也包含一些自养细菌如硝化细菌 (Nitrospira; NOB) 和Nitrosomonas(ammonium-oxidizing bacteria, AOB)[31], 也包括一些异养脱氮菌如Thermomona[30]和自养脱氮菌 (Limnobacter)[32]。 在AA组污泥中,主要不同于CG组的微生物为具有聚磷作用PHOS-HE51(17.34%)和PHOS-HE36(1.78%)[33]和好氧异养型的OPB35_soil_group_norank[34]和OM1clades[35]。 与CG组微生物相对丰度相比, AA组中的主要功能Nitrosomonas(AOB)的相对丰度从 0.65% 增加到5.75%, 而Nitrospira(NOB) 从 1.27% 下降到 0.01%。氨氧化细菌的富集和亚硝酸盐细菌的下降能很好解释在AA组出现亚硝酸盐的积累。

表2 对照组和IS组污泥中相对丰度>1%的属 (%)
注:每组加粗为反应器前三主要菌属
3 结论
(2)不同于对照(CG)组,加碱(AA)组形成了亚硝酸积累,亚硝酸盐积累率(NAR)为88.8%。
(3)加碱(AA)组的氨氧化细菌(Nitrosomonas)丰度(AOB)上升,亚硝酸氧化菌(NOB)丰度下降,有利于实现短程硝化。
[1] L Deng, P Zheng, Z Chen, Q Mahmood.organic material, nitrogen and phosphorus[J].Bioresource Technology, 2008 (99):3136-3145.
[2] D Yang, L Deng, D Zheng, L Wang, Y Liu.Separation of swine wastewater into different concentration fractions and its contribution to combined anaerobic-aerobic process[J].Journal of Environmental Management, 2016 (168):87-93.
[3] T Jin, T Zhang, Q Yan.Characterization and quantification of ammonia-oxidizing archaea (AOA) and bacteria (AOB) in a nitrogen-removing reactor using T-RFLP and qPCR[J].Appl Microbiol Biot, 2010 (87):1167-1176.
[4] B Wett, W Rauch.The role of inorganic carbon limitation in biological nitrogen removal of extremely ammonia concentrated wastewater[J].Water Research, 2003 (37):1100-1110.
[5] B Sinha, A P Annachhatre.Partial nitrification—operational parameters and microorganisms involved[J].Reviews in Environmental Science and Bio/Technology, 2007 (6):285-313.
[6] M Muβmann, I Brito, A Pitcher, J S Sinninghe Damsté, R Hatzenpichler, A Richter, J L Nielsen, P H Nielsen, A Müller, H Daims, M Wagner, I M Head.Thaumarchaeotes abundant in refinery nitrifying sludges express amoA but are not obligate autotrophic ammonia oxidizers[J].Proc Natl Acad Sci, 2011 (108): 16771-16776.
[7] S Park, W Bae, J Chung, S C Baek.Empirical model of the pH dependence of the maximum specific nitrification rate[J].Process Biochemistry, 2007 (42):1671-1676.
[8] Metcalf I,Eddy G,Tchobanoglous F,Burton H D Stensel.Wastewater Engineering: Treatment and Reuse, 4 ed[M].McGraw-Hill Education, 2002.
[9] R A Morris.Investigation of the Optimal Dissolved CO2Concentration and pH Combination for the Growth of Nitrifying Bacteria[J].University of South Florida, 2011.
[10] A Gieseke, S Tarre, M Green, D de Beer.Nitrification in a biofilm at low pH values: role of in situ microenvironments and acid tolerance[J].Applied and Environmental Microbiology, 2006 (72):4283-4292.
[11] S Tarre, M Green.High-rate nitrification at low pH in suspended-and attached-biomass reactors[J].Applied and Environmental Microbiology, 2004(70): 6481-6487.
[12] C Grunditz, G Dalhammar.Development of nitrification inhibition assays using pure cultures of nitrosomonas and nitrobacter[J].Water Research, 2001 (35): 433-440.
[13] S A Burton, J I Prosser.Autotrophic ammonia oxidation at low pH through urea hydrolysis[J].Applied and environmental microbiology, 2001(67):2952-2957.
[14] 王 伸, 邓良伟, 徐 则, 郑 丹, 王 兰, 王 霜.pH值对好氧处理及污泥性能的影响[J].中国沼气, 2016 (34):22-26.
[15] 杨 虹, 李道棠.集约化养猪场冲栏水的达标处理[J].上海交通大学学报, 2000 (34):558-560.
[16] 胡启智, 朱凰榕, 王 军, 欧阳春飞.猪场废水的石灰处理研究[J].安徽农业科学, 2012 (40): 8551-8552.
[17] 方炳南, 顾欣欣, 朱 亮.常规SBR工艺对猪场沼液的处理性能研究[J].中国沼气, 2012 (30):27-30.
[18] 王 新, 倪晋仁, 翟风敏.猪场稳定塘废水的IBAF脱氮影响因素研究[J].应用基础与工程科学学报, 2006 (5):10-15.
[19] T Yamamoto, K Takaki, T Koyama, K Furukawa.Long-term stability of partial nitritation of swine wastewater digester liquor and its subsequent treatment by Anammox[J].Bioresource Technology, 2008 (99):6419-6425.
[20] G Bortone, S Gemelli, A Rambaldi, A Tilche.Nitrification, denitrification and biological phosphate removal in sequencing batch reactors treating piggery wastewater[J].Water Science Technology, 1992 (26):977-985.
[21] B Boiran, Y Couton, J Germon.Nitrification and denitrification of liquid lagoon piggery waste in a biofilm infiltration-percolation aerated system (BIPAS) reactor[J].Bioresource technology, 1996(55):63-77.
[22] W Bae, S Baek, J Chung, Y Lee.Optimal operational factors for nitrite accumulation in batch reactors[J].Biodegradation, 2001 (12):359-366.
[23] G BITTON.Wastewater Microbiology, 3ra.edic [M].New Jersey,2005.
[24] M H Gerardi.Nitrification and denitrification in the activated sludge process [M].New York:Wiley Interscience,2003.
[25] S E Jorgensen, B Fath.Encyclopedia of Ecology [M].Elsevier, 2008.
[26] G L Leung.N Tam.Operation strategy of a sequencing batch reactor for simultaneous removal of wastewater organic matter and nutrients[J].Resources, Conservation and Recycling, 1994 (11):209-223.
[27] D T Sponza, H Atalay.Influence of nitrate and COD on phosphorus, nitrogen and dinitrotoluene (DNT) removals under batch anaerobic and anoxic conditions[J].Anaerobe, 2004 (10):287-293.
[28] S Won, C Ra.Biological nitrogen removal with a real-time control strategy using moving slope changes of pH (mV)-and ORP-time profiles[J].Water Research, 2011 (45):171-178.
[29] M Tank, D A Bryant.Chloracidobacterium thermophilum gen nov sp nov an anoxygenic microaerophilic chlorophotoheterotrophic acidobacterium[J].International Journal of Systematic Evolutionary Microbiology, 2015 (65):1426-1433.
[30] Y Yue, J Liu, B Ma, L Ye, W Bo, Y Peng.Improving municipal wastewater nitrogen and phosphorous removal by feeding sludge fermentation products to sequencing batch reactor (SBR) [J].Bioresource Technology, 2016 (222):326-334.
[31] J Meng, J Li, J Li, K Sun, P Antwi, K Deng, C Wang, G Buelna.Efficiency and bacterial populations related to pollutant removal in an upflow microaerobic sludge reactor treating manure-free piggery wastewater with low COD/TN ratio[J].Bioresource Technology, 2016 (201):166-173.
[32] S Deng, D Li, X Yang, W Xing, J Li, Q Zhang.Biological denitrification process based on the Fe(0)-carbon micro-electrolysis for simultaneous ammonia and nitrate removal from low organic carbon water under a microaerobic condition[J].Bioresource Technology, 2016(219):677-686.
[33] S A Baldwin, M Khoshnoodi, M Rezadehbashi, M Taupp, S Hallam, A Mattes, H Sanei.The microbial community of a passive biochemical reactor treating arsenic, zinc, and sulfate-rich seepage[J].Frontiers in Bioengineering Biotechnology, 2015(3).
[34] P F Dunfield, A Yuryev, P Senin, A V Smirnova, M B Stott, S Hou, B Ly, J H Saw, Z Zhou, Y Ren.Methane oxidation by an extremely acidophilic bacterium of the phylum Verrucomicrobia[J].Nature, 2007 (450):879-882.
[35] R O, S J, J MSM, L C.Metagenomic potential for and diversity of N-cycle driving microorganisms in the Bothnian Sea sediment[J].Microbiology Open, 2017.
AlleviatingAcidificationofAerobicPost-treatmentofDigestedPiggeryWastewaterbyAddingAlkaliandItsInfluenceonMicrobialCommunity
WANGShen1,2,DENGLiang-wei1,2,JIANGYi-qi1,2,WANGShuang1,2,XUZe1,2,ZHENGDan1,2
( 1.BiogasInstituteofMinistryofAgriculture,Chengdu610041,China; 2.LaboratoryofDevelopmentandApplicationofRuralRenewableEnergy,MinistryofAgriculture,Chengdu610041,China)
Digested effluent; SBR; shortcut nitrification; pH; Adding alkali
2017-10-09
项目来源: 国家生猪技术产业体系(CARS-36-10B); 国家自然科学基金(31572450)
王 伸(1990-),男,安徽亳州人,在读硕士,主要研究方向为农村废弃物处理技术,E-mail:ws55185366@163.com
邓良伟,E-mail:dengliangwei@caas.cn
S216.4; X703
A
1000-1166(2017)06-0003-07
