水生药用植物黑三棱对多环芳烃的吸收、分布和代谢研究
2018-01-10*
*
1.南京中医药大学药学院,江苏省中药资源产业化过程协同创新中心,江苏 南京 210046;2.河南科技大学化工与制药学院,河南 洛阳 471023
水生药用植物黑三棱对多环芳烃的吸收、分布和代谢研究
戴仕林1王新胜2吴啟南1*
1.南京中医药大学药学院,江苏省中药资源产业化过程协同创新中心,江苏 南京 210046;2.河南科技大学化工与制药学院,河南 洛阳 471023
目的分析黑三棱对菲和芘的吸收、分布、代谢,为进一步研究多环芳烃对三棱药材品质的影响提供依据。方法采用GC-MS对黑三棱植物的根、茎、叶以及沉积物中的菲、芘进行含量测定。结果200 mg/kg条件下,菲和芘在黑三棱植物根、茎、叶以及沉积物中的含量高于50 mg/kg生长条件下各部分的含量;200 mg/kg生长条件下,菲和芘在块茎中的含量高于叶,50 mg/kg生长条件下则相反;沉积物中含有菲和芘的降解中间产物邻苯二酚。结论黑三棱对多环芳烃有较强的吸收、富集能力;菲和芘的浓度对黑三棱的生长及在植物体内的分布有着重要影响,其降解途径与植物及其根际微生物的联合作用有关。
黑三棱;多环芳烃;GC-MS;代谢
多环芳烃(Polycyclic Aromatic Hydrocarbons,简称PAHs)是指分子中含有两个或两个以上苯环以线状、角状或簇状排列的稠环型化合物,包括菲(Phe)、芘(Pyr)、萘(Nap)等150余种化合物[1]。研究表明,多种PAHs具有致癌、致畸、致突变作用[2],引起世界各国的重视。由于PAHs具有疏水性,沉积物中可检测到多种PAHs[3-7]。植物生态修复具有不破坏生态环境的特点,受到越来越多研究者的关注[8-9],吸收、富集或转化有毒、有害物质,从而达到修复的目的。另一方面,由于PAHs的生物富集性,通过食物链会影响到人类身体健康,研究表明,有机物污染物进入植物体主要途径是通过根部吸收和植物叶片吸收[10],根系吸收主要通过共质体传输和质外体传输两种主要途径[11];与陆生植物相比,多环芳烃在水生植物的吸收、富集、分布和代谢研究较少[12]。黑三棱科植物黑三棱(SparganiumstoloniferumBuch.-Ham)是典型的水生药用植物,主要分布在中国、日本、韩国[13],欧洲和非洲等地也有分布,其块茎为常用中药,具有破血行气,消积止痛的功效[14]。水生药用植物是一类特殊环境下的中药资源,水环境的改变对药材品质有很大影响[15]。笔者以黑三棱植物为研究对象,采用GC-MS分析其对菲和芘的吸收、分布和代谢状况,为进一步研究水环境改变对三棱药材品质影响提供基础。
1 仪器与材料
1.1 仪器 GC-MS(Agilent GC6980/5973MSD);12孔固相萃取装置(美国Sigma公司);BT125型电子天平(赛多利斯科学仪器有限公司);KH300SP型超声仪(300 W;昆山禾创超声仪器有限公司);EPED超纯水系统(南京易普易达科技发展有限公司);TGL-16C型离心机(上海安亭科学仪器厂);DCY-12S型氮吹仪(青岛海科仪器有限公司);R-3旋转蒸发仪(瑞士Buchi公司)。
1.2 试药 菲(98%,批号:101081681)、芘(98%,批号:101024057)购于美国Sigma公司;StrataPAH固相萃取小柱(美国Phenomenex公司);甲醇(色谱纯,批号:1799107539,德国Merck公司);乙腈(色谱纯,批号:JA040830,德国Merck公司);超纯水由实验室自制;其它化学试剂均为分析纯,购自国药集团化学试剂有限公司。
1.3 样品来源及处理
1.3.1 污染沉积物的配制 将采自南京中医药大学药苑,未被PAHs污染的粘土(有机质0.3%,pH:6.09,速效N、P、K分别是10.63、1.00、56.00 mg/kg),自然晾干,过2 mm筛,加入菲和芘的丙酮溶液,其中,高污染组(菲+芘,200 mg/kg),低污染组(菲+芘,50 mg/kg),以加入等体积丙酮的沉积物为对照[16]。
1.3.2 样品采集和处理 黑三棱幼苗采自南京市浦口区石桥镇,经南京中医药大学吴啟南教授鉴为黑三棱科植物黑三棱(SpargniumstoloniferumBuch-Ham),选择长势均匀的黑三棱植物幼苗,洗净泥土,种植于不同污染程度的沉积物中。室外培养,及时加水,维持水深,实验过程中加入肥料以保证三棱生长需求,连续培养5个月后,分别采集两组的根、块茎、叶以及沉积物,自然晾干,备用。
2 方法与结果
2.1 对照品溶液的制备 精密称取适量菲和芘,置于2 mL容量瓶中,乙腈定容,稀释成不同浓度的对照品溶液,13000 rpm/min离心15 min后,备用。
2.2 供试品溶液的制备 分别精密称取两组的根、块茎、叶以及沉积物样品各5 g,分别置于具塞三角瓶中,分别加入正己烷-丙酮(1∶1)50 mL,超声提取3次,提取液合并,3 ℃减压回收溶剂至干,分别用乙腈-水(25∶75)50 mL洗涤残渣,固相小柱萃取,分别用5 mL甲醇-水(1∶1)冲洗,抽干溶剂,再分别以6 mL二氯甲烷洗脱,氮气吹干,以0.5 mL乙腈溶解,高速离心,备用。
2.3 色谱条件
2.3.1 菲和芘的色谱条件 GC条件:HP-5MS 30 m×0.250 mm毛细管色谱柱(Agilent公司),载气为高纯He,进样口温度240 ℃不分流进样,进样量为1μL,初始温度80 ℃以25 ℃/min升到140 ℃,然后以15 ℃/min,升到250 ℃,保留14 min。MSD条件:EI电离源70 eV,质量范围35~400 amu,离子源温度230 ℃,选择离子检测(SIM)模式,菲和芘的定量离子分别为178和202。
2.3.2 菲和芘降解产物分析的色谱条件 GC条件:HP-5MS 30 m×0.250 mm毛细管色谱柱(Agilent公司),载气为高纯He,进样口温度240 ℃,顶空进样。初始温度40 ℃,以5 ℃/min升到250 ℃,保持5 min,保留14 min。MSD条件:EI电离源70 eV,质量范围45~650 amu。
2.4 标准曲线制定 取不同浓度的对照品溶液,按照“2.3.1”项下的色谱条件进行分析,以峰面积为纵坐标y,对照品溶液浓度为横坐标x,进行线性回归,绘制标准曲线和计算相关系数r。菲的标准曲线分别为:y=1.35×108x-197190,r=0.9999,线性范围为0.215~215 μg/mL;芘的标准曲线为:y=1.75×108x-192435,r=0.9999,线性范围为0.146~146 μg/mL。菲和芘线性关系良好。
2.5 结果
2.5.1 含量测定 按照“2.3.1”项下的色谱条件进行分析,菲和芘的选择离子扫描图见图1。采用标准曲线法测定菲和芘在黑三棱根、块茎、叶以及沉积物中的含量,测定结果见表1。在高污染组,菲和芘在黑三棱根、块茎、叶以及沉积物中的含量明显高于低污染组。菲和芘在沉积物中的含量最高,其次是根;两者在叶和块茎中的含量,受污染程度高低影响而不同,高污染组中,块茎中含量较高,低污染组中叶子中含量较高。
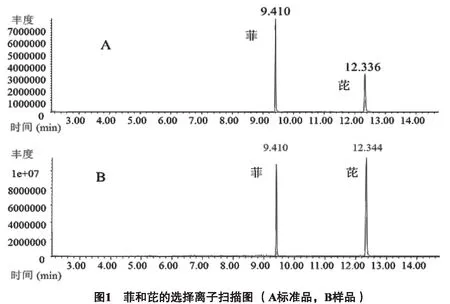
表1 不同样品中菲和芘含量
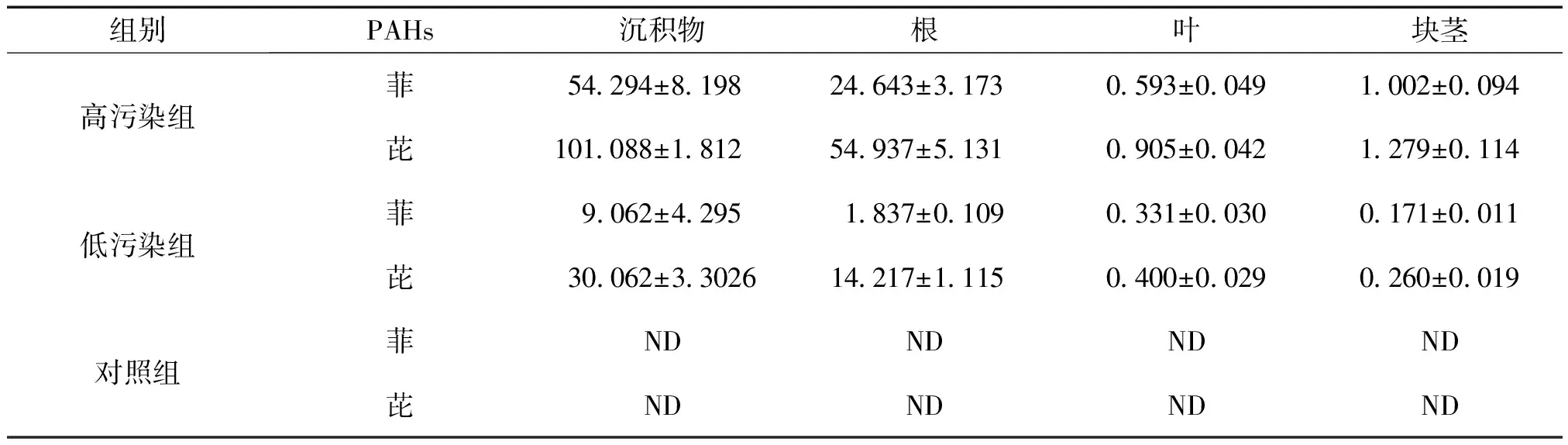
组别PAHs沉积物根叶块茎高污染组菲54294±8198 24643±3173 0593±00491002±0094芘101088±1812 54937±51310905±00421279±0114低污染组菲9062±42951837±01090331±00300171±0011芘30062±3302614217±11150400±00290260±0019对照组菲NDNDNDND芘NDNDNDND
2.5.2 沉积物的GC-MS分析 按照2.3.2项下菲和芘降解产物的色谱分析条件,对沉积物进行GC-MS分析,总离子流图谱如图2所示,降解产物用面积归一化法计算各个化学成分峰面积的相对百分含量,通过质谱数据库检索与标准图谱对照。结果见表2。
表2 菲和芘的降解产物
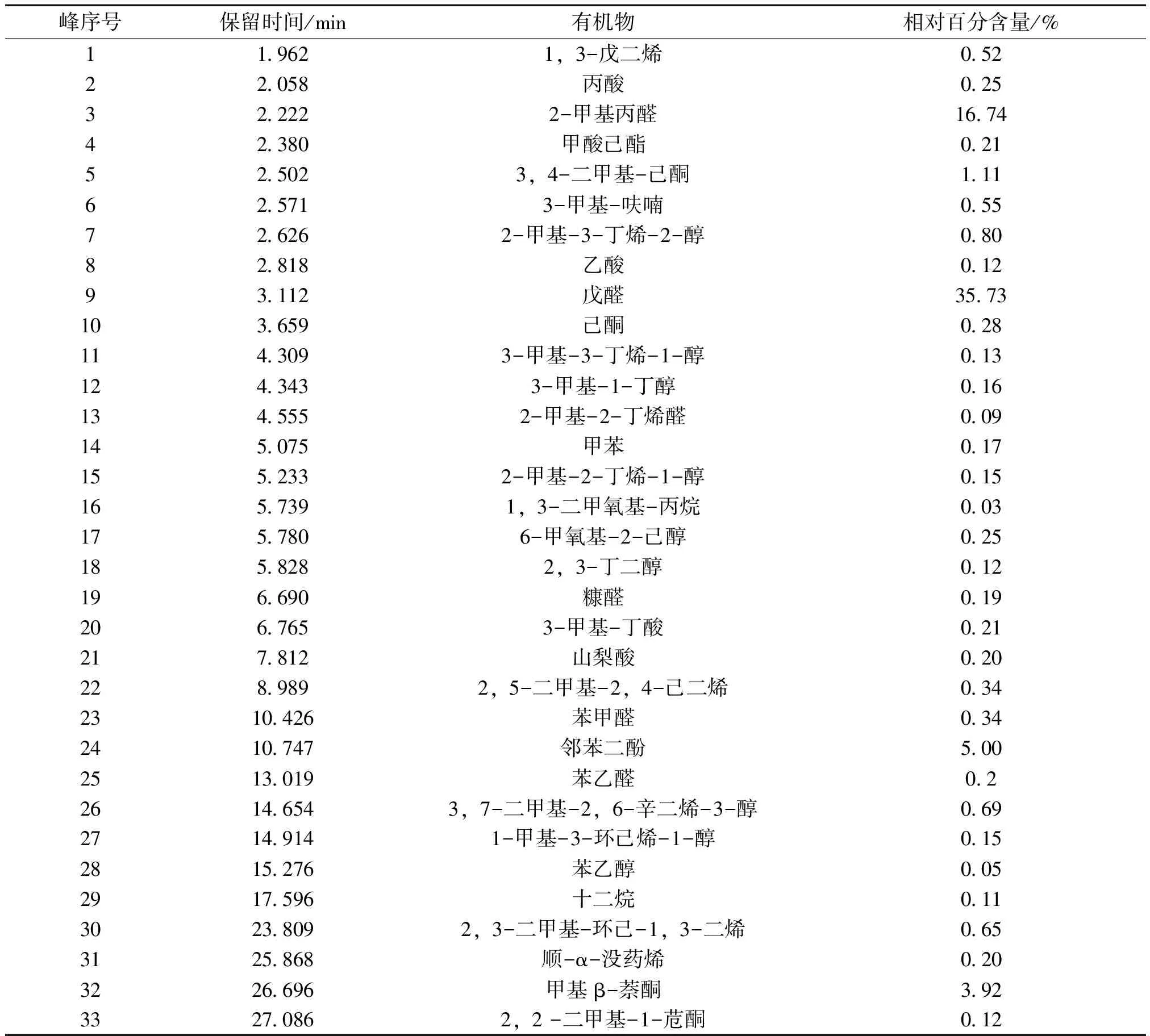
峰序号保留时间/min有机物相对百分含量/%119621,3-戊二烯05222058丙酸025322222-甲基丙醛167442380甲酸己酯021525023,4-二甲基-己酮111625713-甲基-呋喃055726262-甲基-3-丁烯-2-醇08082818乙酸01293112戊醛3573103659己酮0281143093-甲基-3-丁烯-1-醇0131243433-甲基-1-丁醇0161345552-甲基-2-丁烯醛009145075甲苯0171552332-甲基-2-丁烯-1-醇0151657391,3-二甲氧基-丙烷0031757806-甲氧基-2-己醇0251858282,3-丁二醇012196690糠醛0192067653-甲基-丁酸021217812山梨酸0202289892,5-二甲基-2,4-己二烯0342310426苯甲醛0342410747邻苯二酚5002513019苯乙醛0226146543,7-二甲基-2,6-辛二烯-3-醇06927149141-甲基-3-环己烯-1-醇0152815276苯乙醇0052917596十二烷01130238092,3-二甲基-环己-1,3-二烯0653125868顺-α-没药烯0203226696甲基β-萘酮39233270862,2-二甲基-1-苊酮012
2.6 结论 黑三棱对多环芳烃有较强的吸收、富集能力;菲和芘的浓度对黑三棱的生长及在植物体内的分布有着重要影响,其降解途径与植物及其根际微生物的联合作用有关。
3 讨论
由菲和芘在黑三棱植物的根、块茎、叶及沉积物中含量可知,黑三棱对菲和芘有较强的吸收、富集能力,且与沉积物受污染的程度呈正相关,污染程度越高,对菲和芘富集越多。
多环芳烃是通过植物根系的吸收、富集而转运到其它组织[17-19],沉积物中菲和芘被黑三棱的根系吸收、富集后,转运到块茎、叶子等组织,高浓度(200 mg/kg)菲和芘可能抑制了转运,使得块茎中的含量高于叶;研究表明菲和芘在低浓度(50 mg/kg)时,可促进植物生长[20],转运加快,因此叶中的菲和芘含量高于块茎。菲和芘分别为三环和四环类多环芳烃,由表1可知黑三棱对四环芘吸收、富集能力高于三环菲,但四环芘比三环菲在沉积物中残留更持久,这与Sun等[21]和Chiapusio等[22]报道一致。
沉积物中多环芳烃的降解机制主要有植物直接吸收、植物释放生物酶促进降解以及植物与根际微生物的联合作用降解[23],其中微生物联合降解多环芳烃的过程中会产生邻苯二酚或取代邻苯二酚的中间代谢产物[24],然后进一步裂解、开环进入三羧酸循环。从降解产物分析结果中含有邻苯二酚可知,实验中菲和芘的降解可能与植物及其根际微生物的联合作用有关。
通过对菲和芘在黑三棱不同部位和沉积物中含量分布及降解产物分析,为进一步研究和探讨多环芳烃进入黑三棱植物体内的生物学过程及外源污染物对三棱药材品质的影响提供实验基础。
[1]Sims RC, Overcash MR. Fate of polynuclear aromatic compounds (PNAs) in soil-plant systems [J]. Residue reviews, 1983(8): 1-68.
[2]Charles A. Menzie, Bonnie B. Potocki, et al. Exposure to carcinogenic PAHs in the encironment [J]. Envion. Sci. Technol, 1992, 26(7):1278-1284.
[3] 胡小萌,潘玉良,张庆红,等.泛杭州湾海域沉积物中多环芳烃分布及源解析[J]. 海洋环境科学, 2017, 36(1):107-112.
[4]吴义国,方冰芯,李玉成,等.杭埠-丰乐河表层沉积物中多环芳烃的污染特征、来源分析及生态风险评价[J].环境化学,2017,36(2):420-429.
[5] 康杰,胡健,朱兆洲,等.太湖及周边河流表层沉积物中PAHs的分布、来源与风险评价[J].中国环境科学,2017,37(3):1162-1170.
[6] Chen JL, Au KC, Wong YS, et al. Using orthogonal design to determine optimal conditions for biodegradation of phenanthrene in mangrove sediment slurry [J]. J Hazard Mater, 2010(176): 666-671.
[7] Linsak Z, Linsak DT, Glad M, et al. Ecotoxicological characterization of marine sediment in Kostrena coastal area [J]. Coll Antropol, 2012, 36(4): 1401-1405.
[8] Haritash AK, Kaushik CP. Biodegradation aspects of polycyclic aromatic hydrocarbons (PAHs): a review [J]. J Hazard Mater, 2009(169): 1-15.
[9] Dordio A, Carvalho AJP, Teixeira DM, et al. Removal of pharmaceuticals in microcosm constructed wetlands using Typha spp. and LECA [J]. Bioresour Technol, 2010(101): 886-892.
[10] Collins C, Fryer M, Grosso A. Plant uptake of Non-lonic organic chemicals [J]. Environ Sci Technol, 2006(40): 45-52.
[11]Wild E, Dent J, Thomas GO, et al. Direct observation of organic contaminant uptake, storage, and metabolism within plant roots [J]. Environ Sci Technol, 2005(39): 3695-3702.
[12] Toyama T, Furukawa T, Maeda N, et al. Accelerated biodegradation of pyrene and benzo[α]pyrene in the Phragmites australis rhizosphere by bacteria-root exudates interactions [J]. Water Res, 2011(45): 1629-1638.
[13] Wang XS, Wu QN, Wu YF, et al. Determination of Seven Phenolic Compounds in Rhizoma Sparganii by RP-HPLC [J]. J Chromat Sci, 2013(51): 371-375.
[14]国家药典委员会.中华人民共和国药典(一部)[M]. 北京:中国医药科技出版社,2015:13.
[15]陈蓉,吴启南,段金廒,等.水环境改变对药材品质形成的影响研究进展[J].中药材,2010,33(11):1811-1816.
[16] Brinch UC, Ekelund F, Jacobsen CS. Method for spiking soil samples with organic compounds [J]. Appl Environ Microbiol, 2002(68): 1808-1816.
[17] Gao YZ, Zhu LZ. Plant uptake, accumulation and translocation of phenantheren and pyrene in soils [J]. Chemosphere, 2004(55): 1160-1178.
[18] Wild E, Dent J, Thomas GO, et al. Direct observation of organic contaminant uptake, storage, and metabolism within plant roots [J]. Environ Sci Technol, 2005(39): 3695-3702.
[19] Wu FY, Yu XZ, Wu SC, et al. Phenanthrene and pyrene uptake by arbuscular mycorrhizal maize and their dissipation in soil [J]. J Hazard Mater, 2011(187): 341-347.
[20] Zhang ZH, Rengel Z, Meney K. Polynuclear aromatic hydrocarbons (PAHs) differentially influence growth of various emergent wetland species [J]. J Hazard Mater, 2010(182):689-695.
[21] Sun TR, Cang L, Wang QY, et al. Roles of abiotic losses, microbes, plant roots, and root exudates on phytoremediation of PAHs in a barren soil [J]. J Hazard Mater, 2010(176): 919-925.
[22] Chiapusio G, Pujol S, Toussaint M, et al. Phenanthrene toxicity and dissipation in rhizosphere of grassland plants (Lolium perenne L. and Trifolium pratense L.) in three spiked soils [J]. Plant Soil, 2007(294): 103-112.
[23] 王新胜,吴启南.多环芳烃污染对水生药用植物品质的影响[J].中国现代中药,2012,14(11):42-45.
[24] Obayori OS, Salam LB. Degradation of polycyclic aromatic hydrocarbons: role of plasmids [J]. Sci Rew Eaasys, 2010, 5(25): 4093-4106.
Absorption,DistributionandMetabolismofPAHsinAquaticMedicinalPlants-SparganiumstoloniferumBuch.-Ham.
DAI Shilin1WANG Xinsheng2WU Qinan1*
1.School of pharmacy, Nanjing University of Chinese Medicine, Jiangsu Collaborative Innovation Centre of Chinese Medicinal Resources Industrialization, Nanjing 210046, China;
2.School of Chemical Engineering and Pharmacy of Henan University of Science and Technology, Luoyang 471023, China
ObjectiveAnalysis the absorption, distribution and metabolism of PAHs inSparganiumstoloniferumBuch.-Ham. and provide a basis for the effect of PAHs on the quality of Sparganii Rhizoma.MethodsThe contents of Phe and Pyr in roots, stems, leaves ofSparganiumstoloniferumBuch.-Ham and sediments were determined by GC-MS.ResultsUnder the condition of 200 mg/kg, the contents of Phe and Pyr in roots, stems, leaves and sediments were higher than those under the condition of 50 mg/kg. The contents of Phe and Pyr in tuber were higher than that in leaves and the result was reversedunder the condition of 50 mg/kg.Thecatechol was found in degradation intermediates.ConclusionThe ability of absorption and enrichment ofPAHs ofSparganiumstoloniferumBuch.-Hamwas powerful. The growth ofSparganiumstoloniferumBuch.-Ham was affected by the concentration of Phe and Pyr. The degradation pathway was related to the combined effect of plant and rhizosphere microorganisms.
Sparganiumstoloniferum; PAHs; GC-MS; Metabolism
药物研究
国家自然基金项目(81073002);江苏省高校优势学科建设项目。
戴仕林(1985-),男,汉族,硕士研究生,实验师,研究方向为中药品质评价。E-mail:leonard2511@126.com
吴啟南(1963-),男,汉族,教授,研究方向为中药资源及品质评价。E-mail:qnwyjs@163.com
R284.1
A
1007-8517(2017)23-0021-05
2017-10-25 编辑:邓佳丽)
