莫西沙星在肺炎大鼠血液及肺组织的药代动力学研究
2018-01-10曹玉书徐世林童皖宁官振标卓安山解放军第4医院呼吸科上海0008解放军
李 奕,成 熙,曹玉书,徐世林,童皖宁,官振标,卓安山(.解放军第4医院呼吸科,上海 0008;.解放军
第411医院药剂科,上海 200081)
社区获得性肺炎(community-acquired pneumonia,CAP)是最常见的感染性疾病,有很高的发病率和死亡率。而肺炎链球菌(Streptococcus pneumoniae,S.p)是引起CAP最常见的致病菌[1]。2016年中国成人CAP诊治指南推荐可选择莫西沙星等呼吸喹诺酮类药物作为初始经验性抗感染药物[2]。以往莫西沙星药代动力学研究的数据通常来源于血浆或浆膜腔积液[3]中,而对于感染者局部组织的药代动力学特点却罕有报道。本课题组建立肺炎大鼠模型,莫西沙星灌胃给药,应用微透析法同步采样,观察肺炎大鼠血浆及肺组织中的游离药物浓度差异。
1 材料
1.1 实验动物
周龄为4 ~ 6周的Wistar健康雄性大鼠12只,SPF级,体质量200 ~ 220 g[上海斯莱克实验动物有限公司,实验动物使用许可证编号:(沪)2007-0005,合格证号:2007000514232]。饲养环境:室温19 ~ 26 ℃,相对湿度40% ~ 70%,光照周期为12 L : 12 D。实验前禁食12 h过夜。
1.2 实验菌株
肺炎链球菌由第二军医大学附属长海医院微生物实验室提供,于接种前1 d接种于血琼脂平板,置于37 ℃ CO2培养箱中培养24 h,用无菌生理盐水稀释成含细菌浓度为0.6×108cfu.mL-1的混悬液,备用。质控菌株为肺炎链球菌标准株(ATCC49619,上海宝米科生物科技有限公司提供)。
1.3 仪器与试药
莫西沙星标准品(中国食品药品检定研究院,纯度> 99%,批号1448606),莫西沙星片(拜耳医药保健有限公司,批号BJ13520),HPLC级甲醇(美国Burdick & Jackson公司),HPLC级乙腈(德国Merck公司)。CMA402型微量泵、CMA820型微量收集器、血管探针、肺探针(瑞典CMA公司)。ALC-V8S小动物呼吸机(上海奥尔科特生物科技有限公司)。安捷伦1100高效液相色谱仪配有Chemstation工作站(美国安捷伦公司)。
2 方法
2.1 莫西沙星含量测定
2.1.1 色谱条件 色谱柱:Agilent SB-C18柱(250 mm× 4.6 mm,5.0 µm);流动相:乙腈-水(含0.1%甲酸,25 : 75);流速:1.0 mL.min-1;分析时间:10 min;柱温:30 ℃;进样量:5 μL;检测波长:295 nm。
2.1.2 标准品溶液的制备 精密称取莫西沙星标准品粉末10.0 mg置10 mL量瓶中,加甲醇溶解,定容至刻度,得浓度为1.0 mg.mL-1的莫西沙星标准储备液;取适当体积莫西沙星标准储备溶液置于10 mL量瓶中,以甲醇逐级稀释得浓度为25.00、10.00、5.00、2.50、1.00、0.50、0.25 µg.mL-1的莫西沙星标准溶液。
2.1.3 血浆样品的处理 精密量取100 µL血浆样品,置1.5 mL塑料离心管中,加入200 µL甲醇,漩涡混合30 s后,12 000 r.min-1离心10 min,取200 µL上清液于进样瓶中,进样量5 µL,进行HPLC-UV分析。
2.1.4 标准曲线与线性范围 取空白血浆100 µL,精密加入莫西沙星标准对照品溶液20 µL,配成浓度分别为5.00、2.00、1.00、0.50、0.20、0.10、0.05 µg.mL-1标准含药血浆,除不加200 µL甲醇外,其余按“2.1.3”项下方法操作,计算面积。以莫西沙星浓度为横坐标,峰面积为纵坐标。求得回归方程为:Y= 13.801X+0.010 78(r= 0.999 9)。结果表明莫西沙星在0.05 ~5.00 µg.mL-1浓度范围内线性关系良好。
2.1.5 定量限与检测限 配制莫西沙星浓度为0.05µg.mL-1的标准含药血浆5份,进行分析,依照当日标准曲线方程求得实测浓度为(0.050 1 ± 0.004 1)µg.mL-1,准确度90.8% ~ 112.7%。结果表明莫西沙星在血浆中的定量下限为0.05 µg.mL-1,S/N> 10,线性关系良好。经逐级稀释,按S/N> 3测得莫西沙星在血浆中的检测限为0.025 µg.mL-1。
2.1.6 精密度实验 制备含莫西沙星浓度分别为0.05、0.50和5.00 µg.mL-1的标准含药血浆(每个浓度做5 份),按“2.1.3”项下方法操作,连续测定3 d,计算日内和日间精密度。测得日内精密度RSD%分别为4.14%、2.56%、3.41%;日间精密度分别为4.00%、2.31%、4.36%,均小于10%,符合精密度要求。2.1.7 准确度实验 以相对回收率表示,制备含有莫西沙星浓度分别为0.05、0.50、5.00 µg.mL-1的标准含药血浆,按“2.1.3”项下方法操作,计算实测浓度与实际浓度的比值即为相对回收率。结果分别为106.10%、104.15%、107.39%,均在80% ~ 120%范围内,且RSD% < 10 %,符合要求。
2.1.8 稳定性考察 配制莫西沙星低、中、高3个浓度(0.05、0.50、5.00 μg.mL-1)各3份分别进行如下考察:①室温放置3 h、24 h,4 ℃放置24 h;②– 40 ℃保存,反复冻融3次;③– 40 ℃保存30 d。测定样品浓度,计算测得值与实际值的相对偏差(RE%)在– 9.32% ~ 4.80%,RSD均< 10%。结果表明样品在上述条件下保持稳定。
2.2 肺炎大鼠模型
采用气管穿刺法注入菌液建立肺炎大鼠模型。腹腔麻醉后,切开颈部皮肤暴露气管,经气管软骨环间穿刺,注入肺炎链球菌混悬液0.2 mL(约0.12×108cfu/只),将大鼠直立位20 s,再使大鼠保持右侧卧位10 min,促使菌液充分流入右肺。于接种后第5 ~ 7天建立大鼠右侧肺炎模型。所有大鼠实验结束后行病理解剖及肺组织匀浆培养证实建模成功。
2.3 探针植入
取造模成功的肺炎大鼠麻醉后,固定于保温垫,在气管上段做一T型切口,插入气管导管,接小动物呼吸机辅助通气,频率75 ~ 80 次.min-1,潮气量2.5 mL。于大鼠右侧胸壁做斜行切口,止血钳离断第5肋骨前肋,充分暴露右肺。用注射器针尖稍刺破右肺中叶脏层胸膜,将肺探针向肺门方向钝性植入肺组织,复位肺叶,固定探针并关闭胸腔。切开左侧股静脉,植入血管探针推送至下腔静脉固定。
2.4 药动学分析
莫西沙星模拟成人常用剂量400 mg.d-1,大鼠按体表面积折算给药剂量为42 mg.kg-1[4]稀释至1 mL溶液灌胃给药,5 s内注入完毕,立即开始同步收集血浆及肺组织透析样品。每10 min收集一次,60 min后每1 h收集一次,至第5小时结束。所有样品通过HPLC分析。采用反向透析法测定探针回收率(Rdial),体内实际药物浓度(Cu)由所得透析液浓度(Cm)按公式计算,Cu=Cm/Rdial转化获得。
采用DSA 3.0软件(上海博佳医药科技有限公司)以非房室模型计算以下药动学数据:曲线下面积(AUC)、平均驻留时间(MRT)、药物消除半衰期(t1/2)、药物在肺部的穿透率(PR =C肺/C血液)、药物的分布系数(AUC肺/AUC血液)。
2.5 统计学方法
采用SPSS13.0统计软件进行统计学处理,所有资料以表示。药动学参数先经方差齐性分析,符合正态分布,采用两样本t检验,P< 0.05为差异有统计学意义。
3 结果
3.1 药-时曲线
灌胃给药莫西沙星后,肺炎大鼠血浆及肺组织药物浓度迅速上升,至1 h时达峰,随后两者同步下降。上升阶段肺组织中莫西沙星的药物浓度均高于血浆浓度。肺炎大鼠体内的血药浓度-时间曲线见图1。
3.2 肺组织穿透率(PR)
肺炎大鼠灌胃给药后,莫西沙星在肺部的PR值最高1.87,最低0.89,平均为1.256±0.321。肺部穿透率-时间曲线见图2。

图1 莫西沙星在肺炎大鼠血浆及肺组织中的药-时曲线Fig 1 Mean concentration-time curves of moxifloxacin in plasma and lung of pneumonia rats
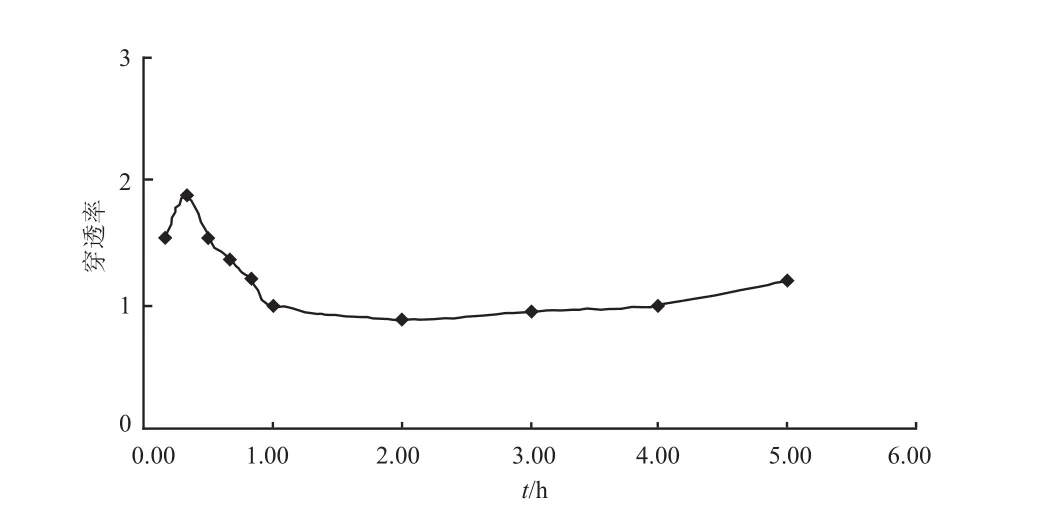
图2 莫西沙星在肺炎大鼠肺部穿透率-时间曲线Fig 2 Penetration rate-time curve of moxifloxacin in lung of pneumonia rats
3.3 主要药动学参数
灌胃莫西沙星后,肺炎大鼠血浆及肺组织的Tmax、Cmax相近,但肺组织中t1/2及AUC0-∞明显增高。药物分布AUC肺/AUC血液为1.216 ± 0.041。MRT差异无统计学意义,P值为0.077,但从数值上看亦有延长趋势。PK参数详见表1。
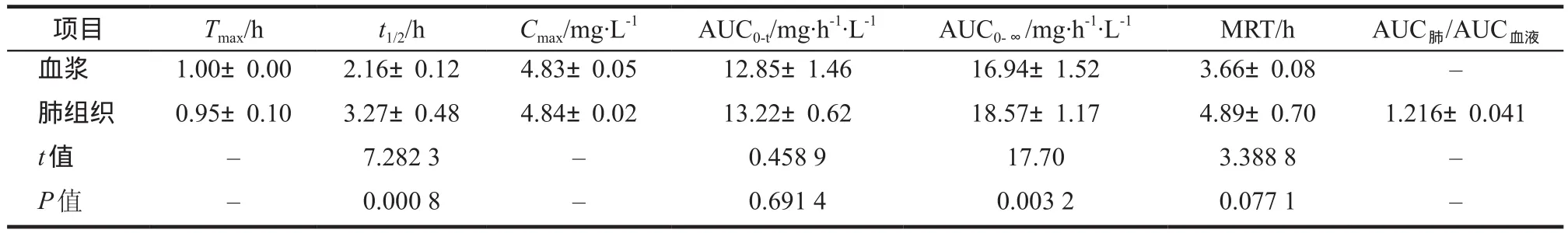
表1 灌胃给药莫西沙星在肺炎大鼠血浆及肺组织中的药代动力学参数Tab 1 PK parameters in plasma and lung of pneumonia rats after gavage moxifloxacin
3.4 莫西沙星对肺炎链球菌的PK/PD参数
结合相关报道的MIC及MPC值,将本实验结果Cmax和AUC0-∞与之相比,莫西沙星对肺炎链球菌的PK/PD参数见表2[a:赵春江等[5]报道莫西沙星对S.p的MIC90为0.125 mg.L-1;b:郭蓓宁等[6]报道莫西沙星对S.p的防突变浓度(mutant prevention concentration,MPC)为2 mg.L-1]。
4 讨论
在引起CAP的细菌性病原体中,肺炎链球菌是最为常见的致病菌之一[7]。但是,其日益增长的耐药性却已经成了世界各国所关心的问题。革兰阳性球菌的耐药监测项目显示,肺炎链球菌对口服青霉素的耐药率从2005年的30%上升到了2010年的60%[8]。而全国细菌耐药监测网发布2015年监测报告,肺炎链球菌对红霉素耐药率平均高达91.5%[9]。

表2 莫西沙星对肺炎链球菌的PK/PD参数Tab 2 PK/PD parameters of moxifloxacin for Streptococcus pneumoniae
氟喹诺酮类药物具有抗菌力强、口服吸收好、与其他抗菌药物无交叉耐药及不良反应/事件较少等特点[10]。莫西沙星是新一代的8-甲氧基氟喹诺酮类药物,抑菌机制为干扰拓扑异构酶Ⅱ和拓扑异构酶Ⅳ的活性,促使病原体的DNA双链破坏,阻止DNA的复制和转录从而产生杀菌作用[11]。我国的多中心研究结果显示,莫西沙星对肺炎链球菌的敏感度达99%,MIC90为 0.125 mg.L-1[5]。
莫西沙星说明书中介绍其在肺(肺泡液、肺泡巨噬细胞、支气管组织)等组织中的浓度可超过血药浓度。但这些数据都来源于正常受试者的结果,而感染者肺组织间液中的游离药物浓度更为重要。我们采用微透析方法获取肺炎大鼠肺组织间液中的游离药物浓度,模拟反映莫西沙星在感染患者靶器官中的药代动力学变化。
本研究结果表明,莫西沙星在肺炎大鼠肺组织中的药-时曲线与血浆中趋势基本一致,其在肺组织穿透率的范围在0.89 ~ 1.87,平均为1.256±0.321,显示出良好的组织穿透性。
从药动学参数来看,虽然莫西沙星在肺炎大鼠血浆及肺组织中的Cmax相近,但在肺组织中的t1/2明显延长,导致AUC0-∞有显著性差异,AUC肺组织明显高于AUC血浆,P值为0.003 2,肺内的分布系数达到了1.216±0.041。由于莫西沙星具备在肺组织分布浓度较高的特性,也使其成为了呼吸道感染的优选用药。
随着氟喹诺酮类药物的广泛使用,其耐药率的上升趋势已受到许多学者的关注。为此,将该药的药代动力学和药效学结合才能更好的指导抗菌药物的合理应用。为防止肺炎链球菌产生耐药突变,Bowker等[12]建议氟喹诺酮类药物应保持AUC/MIC(AUIC)比值大于100。通过实验,我们发现在该剂量条件下,莫西沙星在肺炎大鼠血浆及肺组织AUIC均大于100,尤其是肺组织中达到了148.56,证明其在清除细菌的同时可以有效防止耐药突变菌株的产生。这可能也是莫西沙星上市应用以来对肺炎链球菌始终保持高度敏感性的原因之一。
近年来提出的防耐药突变浓度(MPC)和突变选择窗(mutant selection window,MSW)概念,对控制感染的同时降低耐药突变菌株的选择性扩增具有重要的意义。有学者在研究莫西沙星对肺炎链球菌的体外药效学模型后认为,AUC0-24/MPC及Cmax/MPC是与肺炎链球菌耐药突变相关性更重要的PK/PD参数,当AUC0-24/MPC > 13.41和Cmax/MPC > 1.20时,肺炎链球菌可以达到完全根除,该值越高,就越可以有效地防止细菌耐药性的出现[13]。郭蓓宁等[6]发现莫西沙星临床常用剂量400 mg时血浆Cmax为4.3 mg.L-1,AUC为39.3 mg.h-1.L-1,计算所得AUC/MPC90及Cmax/MPC90分别为19.7和2.2,在该剂量条件下不仅可以清除细菌,且可以预防耐药突变的产生。但其数据来源均为健康志愿者的全血药物浓度。根据产品说明书,莫西沙星的蛋白结合率约45%,故测算其实际游离药物的Cmax约为1.935 mg.L-1,AUC亦相应降低。而我们采用微透析法直接测定肺炎大鼠的的游离药物浓度,血浆Cmax为4.83 mg.L-1,肺组织Cmax为4.84 mg.L-1,Cmax/MPC90分别为2.41及2.42,均> 1.20。
因此,在该剂量条件下,莫西沙星在肺炎链球菌感染的大鼠中,能够有效清除细菌,获得良好的疗效,并且能防止耐药菌株的突变富集。
[1] Cillóniz C, Ceccato A, de la Calle C,et al.Time to blood culture positivity as a predictor of clinical outcomes and severity in adults with bacteremic pneumococcal pneumonia[J]. PLoS One, 2017,12(8): e0182436.
[2] 中华医学会呼吸病学分会.中国成人社区获得性肺炎诊断和治疗指南(2016年版)[J].中华结核和呼吸杂志,2016,39(4):1-27.
[3] 邓斐,金家桂,王蓝天,等.HPLC法测定结核性胸膜炎患者胸腔积液中莫西沙星的浓度[J].中国药物应用与监测,2016,13(3):140-143.
[4] Li Y, Wang Zh, Xiao HP,et al.A microdialysis study of pharmacokinetics of orally or intravenously administratered levofloxacin in lung tissues of theStreptococcus[J]. Int J Clin Exp Med, 2016, 9(4): 7247-7255.
[5] 赵春江,张菲菲,王占伟,等.2012年中国成人社区获得性呼吸道感染主要致病菌耐药性的多中心研究[J].中华结核和呼吸杂志,2015,38(1):18-22.
[6] 郭蓓宁,郁继诚,张菁,等.氟喹诺酮类药物对临床分离肺炎链球菌的防突变浓度[J].中国感染与化疗杂志,2010,(1):13-16.
[7] 孙宏莉,陈玲,陈绪林,等.2013 – 2014年中国二级医院社区 获得性呼吸道感染病原菌耐药性监测[J].中华结核和呼吸杂志,2016,39(1):30-37.
[8] Wang H, Zhao C, He W,et al.High prevalence of fluoroquinolone-resistant group B Streptococci among clinical isolates in China and predominance of sequence type 19 with serotype Ⅲ[J]. Antimicrob Agents Chemother, 2013, 57(3): 1538-1541.
[9] 国家卫生计生委合理用药专家委员会.2015年全国细菌耐药监测报告[J].中国执业药师,2016,13(3):3-8.
[10] 尹航,谢程.111例氟喹诺酮类药品不良反应/事件临床分析[J].中国药物应用与监测,2017,14(3):163-165.
[11] Chan PF, Srikannathasan V, Huang J,et al.Structural basis of DNA gyrase inhibition by antibacterial QPT-1, anticancer drug etoposide and moxifloxacin[J]. Nat Commun, 2015, 6: 10048.
[12] Bowker KE, Garvey MI, Noel AR,et al.Comparative antibacterial effects of moxifloxacin and levofloxacin onStreptococcus pneumoniaestrains with defined mechanisms of resistance: impact of bacterial inoculum[J]. J Antimicrob Chemother, 2013, 68(5): 1130-1138.
[13] Homma T, Hori T, Sugimori G,et al.Pharmacodynamic assessment based on mutant prevention concentrations of fluoroquinolones to prevent the emergence of resistant mutants of Streptococcus pneumoniae[J]. Antimicrob Agents Chemother,2007, 51(11): 3810-3815.
