一氧化氮合酶途径在精氨酸诱导番茄果实采后抗病性中的作用
2018-01-08季娜娜闵德栋李富军邵淑君张新华
季娜娜,闵德栋,李富军,邵淑君,张新华*
(山东理工大学农业工程与食品科学学院,山东 淄博 255049)
一氧化氮合酶途径在精氨酸诱导番茄果实采后抗病性中的作用
季娜娜,闵德栋,李富军,邵淑君,张新华*
(山东理工大学农业工程与食品科学学院,山东 淄博 255049)
以绿熟期‘中蔬4号’番茄果实为实验材料,研究了精氨酸(arginine,Arg)对番茄果实灰霉病发生的影响及一氧化氮合酶(nitric oxide synthase,NOS)途径在其中的作用及机制。结果表明:0.0~10.0 mmol/L范围内,5.0 mmol/L的Arg对番茄果实灰霉病的发生率及病斑面积的扩展控制效果最佳。同时5.0 mmol/L Arg处理明显提高了番茄果实NOS活力及NO含量,促进了酚类物质的积累,提高了番茄果实体内苯丙氨酸解氨酶、多酚氧化酶、β-1,3-葡聚糖酶和几丁质酶等抗病相关酶的活力,诱导了病程相关蛋白(pathogenesis-related proteins,PRs)PR2a、PR2b、PR3a和PR3b的表达。而NOS抑制剂N-硝基-L-精氨酸通过抑制NOS的活力和NO的水平,明显削弱了Arg对番茄果实的这种诱导作用,因此Arg可能是通过调控NOS途径诱导了番茄果实抵抗灰霉病的抗性。
番茄果实;一氧化氮合酶;精氨酸;抗病性
我国是果蔬生产大国,产量居世界第一位,但多数果蔬在采后贮运过程中易遭受病原体侵染,导致严重的经济损失。目前主要采用化学杀菌剂防治果蔬病害,药剂残留不仅对人体健康及环境造成危害,同时会导致果蔬致病菌产生抗药性。因此,在寻找化学杀菌剂替代品的同时,诱导果蔬自身产生抗病性成为减轻采后病害的一条有效途径[1]。
在人体及动物系统中的研究发现,精氨酸(arginine,Arg)不但广泛地参与了机体的组织代谢与蛋白质代谢,在人体内还具有重要的免疫调节和营养功能[2]。因为Arg是植物体内氮碳比最高的氨基酸,长期以来在植物系统中对Arg功能的研究主要集中于它的氮素贮藏功能[3]。近年来研究发现,Arg还具有其他氨基酸不具备的一些特殊生理功能,如外源Arg处理可以增强小麦植株对高温胁迫的抵抗能力[4];缓解重金属对天仙子以及水分胁迫对番茄植株造成的氧化损伤[5-6];提高盐胁迫下菜豆种子的发芽率及盐胁迫下幼苗中多胺(polyamine,PA)的含量[7];促进阿月浑子幼苗体内NO的产生,提高幼苗的抗冷能力[8]等。通过果实采后的相关研究发现,Arg处理可以抑制鲜切苹果和莴苣褐变的发生[9],前期实验结果也证明,Arg代谢途径的激活可以增强果实抗低温胁迫的能力[10-11]。由此可见,在植物中Arg除了贮存氮素营养外,还广泛参与植物的胁迫适应过程。PA是生物体中具有生物活性的一类低分子质量脂肪族含氮碱,广泛参与了植物的生长发育及抗逆过程[12]。NO是一种重要的信号分子,在植物的生长发育、抗病防御反应、细胞程序性死亡和非生物胁迫反应等过程中发挥了重要的调节作用[13]。而Arg是生成NO和PA的前体,目前,已有大量研究证明Arg可以通过向PA转化而参与植物的生理、病理等多种反应过程[14-15]。植物体内的NO可以通过酶催化和非酶催化途径合成,其中一氧化氮合酶(nitric oxide synthase,NOS)是依赖于Arg的NO合成酶[16],而目前关于Arg代谢的NOS途径在植物,特别是果蔬采后抗性中的作用还有待深入研究。本实验以番茄果实为材料,采用适宜浓度的外源Arg处理番茄果实,并结合NOS的特异性抑制剂N-硝基-L-Arg(Nω-nitro-L-arginine,L-NNA)阻断NOS途径,以探讨NOS在Arg诱导番茄果实采后抗病性中的作用及机制。
1 材料与方法
1.1 材料与试剂
绿熟期番茄果实‘中蔬4号’采自山东省淄博市张店区东孙村蔬菜大棚,选择大小一致、果型端正、无病虫害和机械伤的果实作为实验原料,采摘当天运回实验室。
荧光染料SYBR Green 日本东洋纺有限公司;NOS试剂盒、NO测试盒 南京建成生物工程研究所;寡聚核苷酸引物 生工生物工程(上海)股份有限公司;Trizol试剂、M-MLV反转录酶、Oligo(dT)18、核糖核酸酶抑制剂、琼脂糖 宝生物工程(大连)有限公司;脱盐蜗牛酶、昆布多糖、福林酚试剂 美国Sigma-Aldrich公司;磷酸、乙醇、碳酸钠、磷酸钠、氯仿、异戊醇、异丙醇、丙酮、盐酸、邻苯二酚、柠檬酸、L-苯丙氨酸等均为国产分析纯。
1.2 仪器与设备
H H-6型数显恒温水浴锅 金坛市荣华仪器制造有限公司;UV-2102PCS型紫外-可见分光光度计 尤尼柯(上海)仪器有限公司;TC/96/G/H(b)A型聚合酶链式反应(polymerase chain reaction,PCR)仪、FQD-96A型实时荧光定量PCR检测系统 杭州博日科技有限责任公司;3500型凝胶成像仪 上海天能科技有限公司;GL-20-H型离心机 上海安亭科学仪器厂;DYY-8C型电泳仪北京市六一仪器厂;LDZX-50FBS型蒸汽灭菌锅 上海申安医疗器械厂;DW-HL 538型超低温冰箱 中科美菱低温科技有限责任公司;SK-1型快速混匀器 上海市上登实验设备有限公司。
1.3 方法
1.3.1 样品处理
散去田间热的番茄果实先在体积分数3%的次氯酸钠溶液中浸泡2 min进行表面消毒,然后用清水冲洗自然晾干后进行处理。实验共分为以下两部分。
预实验:将番茄果实随机分为5 组,分别用浓度为0.0(对照)、0.5、1.0、5.0 mmol/L和10.0 mmol/L的Arg溶液进行真空渗透处理。真空渗透处理的方法为:将番茄果实放入盛有处理溶液(或蒸馏水)的容器中,再放入真空罐中,用真空泵抽真空,压强达到-0.035 MPa后保持30 s,恢复到常压后再浸泡2 min,取出番茄果实自然晾干。约24 h后对番茄果实进行病原菌损伤接种,接种后将番茄果实放入聚乙烯保鲜袋,于(25±1)℃、相对湿度90%~95%条件下贮藏,并于接菌后的第2、4、8天统计番茄果实病斑直径和发病率。根据番茄果实的发病率及病斑面积,选择最佳的Arg处理浓度,用于后续实验。每个处理重复3 次,每个重复选取12 个番茄果实。
实验处理:将番茄果实随机分为3 组,分别用预实验中最佳浓度的Arg溶液、0.2 mmol/L L-NNA溶液、0.2 mmol/L L-NNA+最佳浓度的Arg溶液及蒸馏水(对照)按上述方法对番茄果实进行真空渗透处理,处理结束后,番茄果实自然晾干,约24 h后每个处理取36个番茄果实(包含3 个重复)进行病原菌损伤接种,接种后将番茄果实放入保鲜袋,于(25±1)℃、相对湿度90%~95%条件下贮藏,并于接菌后的第2、4、8天统计果实病斑直径和发病率。其余未接种的番茄果实于(25±1)℃、相对湿度90%~95%条件下贮藏,每隔1 d在每个处理组中随机选取6个番茄果实,取番茄果实赤道部位的中果皮置于液氮中速冻,于-80 ℃低温冰箱中保存,用于基因表达及各项生理指标的测定,每个处理重复3 次。
1.3.2 菌种与果实损伤接种
参照周晓婉等[17]的方法,略作修改。番茄灰霉病病原菌(Botrytis cinerea Pers.)分离于腐烂的番茄果实,经鉴定后接种在马铃薯琼脂糖培养基上,室温条件下培养7 d,接种前用含有0.05% Tween-80的无菌水配制成孢子悬浮液,并借助血球计数板调整浓度为2×105CFU/mL。处理组与对照组均接种,接种前先用70%乙醇擦拭番茄果实表面进行消毒,自然晾干。再用灭菌铁钉在果实赤道区域刺2 个孔(深4 mm、直径2 mm)。待伤口处汁液晾干后,用微量移液器向每个孔注入10 μL孢子悬浮液。
1.3.3 病害发生率及病斑面积
番茄果实病害发生率的计算如式(1)。

病斑直径利用游标卡尺进行十字交叉法测定[18],每个病斑测量3 次,计算平均值作为其测量值,取各处理发病伤口病斑直径的平均值分别作为其病斑直径d(mm),病斑面积的计算如式(2)。

1.3.4 防御酶活力的测定
1.3.4.1 苯丙氨酸解氨酶活力的测定
参考Assis等[19]的方法测定番茄果实中苯丙氨酸解氨酶(phenylalanine amonialyase,PAL)的活力,并略有修改。称取1.0 g样品,用5 mL硼酸缓冲液(0.2 mol/L、pH 8.8,含10 g/L聚乙烯吡咯烷酮、2 mmol/L乙二胺四乙酸和5 mmol/L β-巯基乙醇)研磨,然后在4 ℃、12 000×g条件下离心15 min,取0.5 mL上清液,加入2 mL 0.1 mol/L pH 8.8硼酸缓冲液和1 mL L-苯丙氨酸溶液,37 ℃保温1 h。290 nm波长处测定反应前后的吸光度,以每小时吸光度变化1为1 个酶活力单位(U)。实验重复3 次。
1.3.4.2 几丁质酶和β-1,3-葡聚糖酶活力测定
称取1.0 g样品加5 mL醋酸缓冲液(0.1mol/L、pH 5.2,含1 mmol/L乙二胺四乙酸和5 mmol/L β-巯基乙醇)研磨,然后在4 ℃、12 000×g条件下离心10 min,上清液用于测定几丁质酶(chitinase,CHI)和β-1,3-葡聚糖酶(β-1,3-glucanase,GLU)的活力。
CHI活力的测定参考Abeles等[20]的方法并略有修改。取0.5 mL上清液,加0.5 mL胶状几丁质于37 ℃保温1 h,然后再加0.1 mL、质量分数3%蜗牛酶,37 ℃保温1 h。保温结束后,加0.3 mL四硼酸钾溶液,沸水浴5 min,迅速冷却。然后,再加2 mL对二甲氨基苯甲醛,37 ℃保温10 min显色,于585 nm波长处测定吸光度。实验重复3 次。
GLU活力的测定参考Cao Shifeng等[21]的测定方法,略有改动,以每分钟分解昆布多糖产生1 mg葡萄糖为一个酶活力单位(U)。实验重复3 次。
1.3.4.3 多酚氧化酶活力的测定
多酚氧化酶(polyohenoloxidase,PPO)活力的测定参考周晓婉等[17]的方法,并略有修改。取1.0 g样品加入5 mL、pH 6.8的磷酸盐缓冲液冰浴研磨,然后在4 ℃、12 000×g条件下离心10 min,上清液为酶提取液。取2 mL磷酸盐缓冲液和1 mL邻苯二酚,与0.5 mL酶提取液混合,测定420 nm波长处吸光度的变化,以每分钟吸光度变化0.01为一个酶活力单位(U),单位为U/g(以鲜质量计)。实验重复3 次。
1.3.4.4 总酚含量的测定
采用福林-酚法[22]进行测定。称取1.0 g果实样品,加入2.5 mL、95%乙醇匀浆,4 ℃避光提取24 h后于4 ℃、10 000×g条件下离心10 min。取1 mL上清液,加入1 mL 95%乙醇、5 mL蒸馏水、0.5 mL体积分数50%福林-酚试剂,混匀静置5 min后,加入1 mL、5 g/L碳酸钠,室温避光反应1 h,于685 nm波长处测吸光度,以没食子酸作标准曲线计算总酚含量。
1.3.5 NOS活力和NO含量的测定
番茄果实体内的NO含量及NOS活力分别采用NO和NOS试剂盒进行测定。NO含量单位为μmol/g(以鲜质量计),NOS活力单位为U/g(以鲜质量计),每毫升样品每分钟生成10-9mol NO为一个酶活力单位(U)。实验重复3 次。
1.3.6 病程相关蛋白基因的实时荧光定量PCR分析
1.3.6.1 番茄果实总RNA的提取及其反转录
采用Trizol法[23]提取番茄果实总RNA,利用微量紫外分光光度计及琼脂糖凝胶电泳对RNA的浓度及纯度进行检测,并参考宝生物工程(大连)有限公司的M-MLV反转录酶说明书合成cDNA,-80 ℃下保存备用。
1.3.6.2 引物设计与合成
根据基因库中公布的番茄病程相关蛋白(pathogenesis-related proteins,PRs)基因的序列,用Primer 5.0软件设计引物,并参考Wang Fengde等[24]利用的引物序列,选择最佳的引物序列,由生工生物工程(上海)公司合成。以Ubi3作为内参基因,引物序列见表1。

表1 实时定量PCR引物序列Table 1 Sequences of the primers used for quantitative real-time PCR
1.3.6.3 实时定量PCR
实时定量PCR以SYBR Green为荧光染料,采用25 μL体系:上、下游引物(10 μmol/L)各1 μL、cDNA模板2 μL、SYBR premix Ex TaqTM(2×)反应液12.5 μL,用双蒸水补至25 μL。PCR反应程序为:95 ℃预变性2 min;95 ℃变性15 s,60 ℃退火30 s,40个循环;72 ℃延伸7 min。每个样品重复3 次,目的基因相对表达量的分析以Ubi3基因作为内参基因,利用2−ΔΔCt法进行相对定量分析。
1.4 数据处理
采用Excel 2010软件计算平均值、标准差并作图,用SPSS 18.0软件进行单因素方差分析(One-way ANOVA),用邓肯多重比较方法进行差异显著性分析(P<0.05)。
2 结果与分析
2.1 不同浓度Arg处理对番茄果实采后发病率和病斑面积的影响
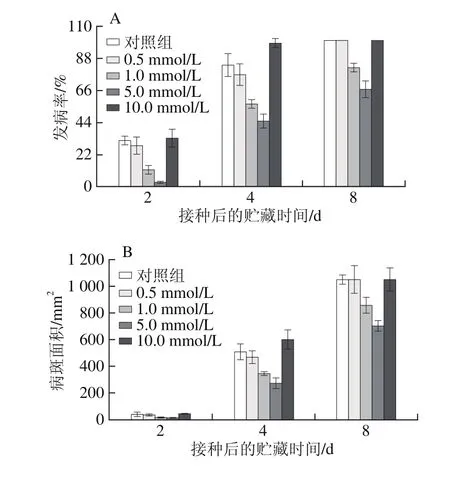
图1 不同浓度Arg处理对番茄果实发病率(A)和病斑面积(B)的影响Fig. 1 Effect of different concentrations of arginine on decay incidence (A)and lesion area (B) in tomato fruit
由图1可知,适宜浓度的Arg处理可以有效地降低番茄果实的灰霉病发病情况。如图1A所示,接种灰霉病原菌后第2天,经不同浓度的Arg处理过的番茄果实均出现感病现象,但与对照组相比,0.5、1.0 mmol/L和5.0 mmol/L的Arg均不同程度地降低了番茄果实的发病率,而10.0 mmol/L处理组的番茄果实发病率为33.3%,略高于对照组(31.7%);接种后第4天,各个处理组的番茄果实发病率急剧上升,对照组番茄果实的发病率达到83.3%,5 mmol/L处理组的发病率最低,与对照组相比降低了46.0%,而10.0 mmol/L Arg处理组的发病率高于对照组;接种后第8天,除了1.0 mmol/L和5.0 mmol/L Arg处理组,其他3 个处理组的番茄果实均全部发病,而1.0 mmol/L和5.0 mmol/L Arg处理组的发病率分别比对照组低18.3%和33.3%。
由图1B可知,接种后第2天,各个处理组番茄果实的病斑面积均低于50 mm2,其中经5.0 mmol/L Arg处理的番茄果实病斑面积只有7 mm2。随着贮藏时间的延长,果实的病斑面积逐渐扩大,在接种后第4天与第8天时,1.0 mmol/L和5.0 mmol/L处理组的番茄果实均低于对照组,其中5.0 mmol/L Arg处理的番茄果实病斑面积最小。由上述两个指标的结果可知,5.0 mmol/L Arg处理对番茄果实抗病性的诱导效果最好,因此,本研究用5.0 mmol/L Arg处理进行后续的实验。
2.2 不同处理对番茄果实NOS活力和NO含量的影响

图2 Arg与L-NNA处理对番茄果实中NO含量(A)和NOS活力(B)的影响Fig. 2 Effect of arginine and L-NNA treatments on NO content (A) and NOS activity (B) in tomato fruit
不同的处理对番茄果实中NO含量和NOS活力产生了不同的影响。由图2A可以看出,在贮藏的前8 d内,5 mmol/L Arg处理明显降低了NO含量的下降幅度,8 d后Arg处理组的NO的含量与对照组比无明显差异。L-NNA处理降低了番茄果实体内NO的含量,也明显抑制了Arg对番茄果实体内NO的诱导效应。在贮藏的前8 d,Arg与L-NNA复合处理组的番茄果实体内NO的含量明显低于Arg处理组的果实。
如图2B所示,与对照组相比,5 mmo/L Arg处理明显提高了番茄果实体内NOS的活力,处理后第2天NOS的活力达到最大,比同时间对照组高29.4%。而L-NNA处理不但抑制了番茄果实体内NOS的活力,也明显抑制了Arg对NOS活性的诱导作用,除了在贮藏的第12天外,Arg与L-NNA复合处理组的番茄果实体内NOS的活力均明显低于Arg处理组的果实。
2.3 不同处理对Arg诱导的番茄果实抗病性的影响

图3 L-NNA与Arg处理对番茄果实发病率(A)、病斑面积(B)的影响Fig. 3 Effect of L-NNA and Arg treatments on decay incidence (A) and lesion area (B) in tomato fruit
由图3可知,在贮藏期间,5 mmol/L Arg处理降低了番茄果实灰霉病的发病率,经0.2 mmol/L L-NNA单独处理的番茄果实发病率与病斑面积虽然与对照组番茄果实相比无明显变化,但L-NNA与Arg复合处理抑制了Arg对番茄果实抗病性的诱导效应。如图3A所示,Arg与L-NNA复合处理组番茄果实的发病率在接菌后的前4 d虽然低于对照组果实,但明显高于Arg处理组的番茄果实,在接菌后的第4天和第8天,发病率分别比Arg处理组番茄果实高59.3%和50.0%,番茄果实发生病害的病斑面积也高于Arg处理组的番茄果实(图3B)。
2.4 不同处理对番茄果实中总酚含量、PAL及PPO活力的影响


图4 Arg与L-NNA处理对番茄果实中总酚含量(A)、PAL(B)及PPO(C)活力的影响Fig. 4 Effect of Arg and L-NNA treatments on total phenol content (A)and PAL (B) and PPO (C) activities in tomato fruit
如图4A所示,对照组番茄果实的总酚含量总体呈现先上升后下降的变化趋势,在处理后第6天达到峰值,随后略有下降;Arg处理明显提高了番茄果实贮藏中后期总酚的含量,在贮藏的第12天时,Arg处理组番茄果实的总酚含量达到最高,比同期对照组番茄果实总酚含量高33.1%。L-NNA单独处理的番茄果实总酚含量变化趋势与对照组果实相似,但复合处理明显抑制了Arg对番茄果实体内总酚含量的诱导,在贮藏的大多数时间内,Arg与L-NNA复合处理组番茄果实的总酚含量均明显低于Arg处理组的果实。
如图4B所示,与对照组番茄果实相比,Arg处理明显提高了整个贮藏过程中番茄果实体内PAL的活力,在采后贮藏的第8天,对照组和Arg处理组番茄果实中PAL活力均达到最大,但对照组番茄果实的PAL活力比Arg处理组的低25.3%。而L-NNA单独处理明显降低了番茄果实体内PAL的活力,复合处理也明显抑制了Arg对番茄果实PAL的诱导效应,在贮藏第12 天时,L-NNA与Arg复合处理组番茄果实的PAL活力分别比同期对照组和Arg处理组低23.9%和34.9%。
如图4C所示,对照组番茄果实的PPO活力呈波动变化的趋势,且除了在贮藏末期外,整个贮藏过程中无明显升高。而Arg使番茄果实中PPO活力急剧升高,在处理后第8天达到峰值,比同时期对照组番茄果实高79.53%,之后缓慢下降。L-NNA单独处理组的番茄果实PPO活力与对照组相比无明显差异,但L-NNA明显抑制了贮藏中后期Arg对PPO活力的诱导效应,如L-NNA与Arg复合处理组果实的PPO活力在贮藏的第8天比Arg处理组的番茄果实低21.0%,在贮藏第10天时比Arg处理组的番茄果实低43.6%。
2.5 不同处理对番茄果实中病程相关蛋白基因表达、GLU及CHI活力的影响
对照组番茄果实中PR2a的相对表达量在贮藏过程中一直处于较低的水平(图5A),PR2b的相对表达量在贮藏前期增加明显,第4天时达到峰值,随后下降(图5B)。Arg处理明显提高了整个贮藏过程中番茄果实体内PR2a的相对表达量,在采后第2天,Arg处理番茄果实的PR2a的相对表达量急剧增加,比同期对照组番茄果实高1 764.1%。在贮藏的前4 d,Arg处理番茄果实PR2b的相对表达量低于对照组,但明显提高了贮藏中后期PR2b的相对表达量,在第6天时,Arg处理组番茄果实PR2b的相对表达量达到峰值,比同期对照组高200.3%。Arg处理组的番茄果实中GLU活力明显高于对照组,在贮藏的第12天时,Arg处理组番茄果实的GLU活力仍比对照组高18.8%(图5C)。与对照组相比,L-NNA单独处理对PR2a与PR2b的相对表达量及GLU活力均无明显影响,但显著抑制了Arg对三者的诱导作用。
Arg处理组番茄果实中PR3a和PR3b的相对表达量在贮藏过程中均明显高于对照组。Arg处理组番茄果实PR3a的相对表达量在采后第8天达到峰值,比同期对照组高127%(图5D);对照组和Arg处理组番茄果实中PR3b的表达在采后第2天均达到最大值,但对照组番茄果实PR3b的相对表达量只有Arg处理组果实的50.6%(图5E)。Arg处理组番茄果实的CHI活力在整个贮藏期间明显高于对照组,在采后第8天达到最大值,比同期对照组高44.0%(图5F)。L-NNA单独处理降低了处理后第8天PR3a的相对表达量、贮藏第12天时PR3b的相对表达量及贮藏后期CHI活力,并明显抑制了Arg对整个贮藏过程中番茄果实CHI活力、PR3a表达以及贮藏前期对PR3b表达的诱导效应。


图5 Arg与L-NNA处理对番茄果实PR2a(A)、PR2b(B)、PR3a(D)、PR3b(E)相对表达量以及GLU(C)和CHI(F)活力的影响Fig. 5 Effect of Arg and L-NNA treatments on the expression of PR2a(A), PR2b (B), PR3a (D) and PR3b (E) and the activities of GLU (C) and CHI (F) in tomato fruit
3 讨 论
在植物生长和发育过程中,Arg发挥着重要的作用。越来越多的研究表明,Arg不仅是植物中氮素转化和贮存的媒介[3],还是NO、PA等多种生物活性物质合成的前体[10]。因此,Arg在植物的抗逆性中可能也发挥了重要的作用。本实验发现,0.5~5.0 mmol/L的Arg可以有效地缓解绿熟期番茄果实采后病害的发生,其中5.0 mmol/L的Arg对番茄果实灰霉病的发生抑制效果最为显著;而0.1 mmol/L和10.0 mmol/L的Arg加剧了番茄果实病害的发生,这可能是因为Arg浓度过低不但没有对番茄果实起到诱抗作用,而且可能为霉菌的生长提供了必要的营养物质来源;而Arg作为一种碱性氨基酸,过高的浓度可能会对番茄果实自身产生伤害。
在植物中Arg不仅是蛋白质合成的重要原料,同时也是PA、NO、脯氨酸等重要物质的合成前体。而PA和NO都是植物中重要的信使分子,参与包括生长发育、抗逆性等在内的几乎所有的生理生化过程。目前,在植物的植株及果实组织中,已有大量研究证明Arg可以代谢为PA而参与植物的生理、病理等多种反应过程[12-13]。在动物系统中,已有大量的研究报道NOS催化产生NO需依赖Arg,Arg也因此广泛参与各种生理与病理过程[25-26];而植物中虽然检测到有依赖Arg的NO产生[10,15],但NOS在植物逆境胁迫中的作用亟待进一步研究。本研究发现,适宜浓度的外源Arg处理提高了番茄果实体内NOS的活力以及NO的含量,而L-NNA明显抑制了Arg代谢的NOS途径,同时也明显削弱了外源Arg对果实抗病性的诱导作用。L-NNA是NOS的抑制剂,在植物中广泛用于NOS功能的研究[27-28]。本实验结果表明,外源Arg可通过促进果实内源Arg代谢的NOS途径来增强果实抵抗灰霉病的能力。
酚类物质是植物中重要的次生代谢产物,有很强的清除自由基和抗氧化的能力[29]。PAL是植物次生物质生成合成途径——苯丙烷代谢的关键酶,与植物的抗逆境胁迫和抗病性密切相关。PPO能催化酚类物质氧化形成比病原菌毒性更强的醌类物质,因此在植物体防御机制中也发挥了重要的作用[30]。周晓婉等[17]发现,1-甲基环丙烯提高苹果果实的抗病性与果实体内PAL、PPO活力的提高及酚类物质含量的增加有关;β-氨基丁酸诱导PAL活力及总酚含量的增加有助于提高葡萄果实对灰霉病的抗性[31]。本研究中,Arg处理能够有效提高PAL和PPO的活力,同时提高了贮藏中后期果实中酚类物质的积累,并使总酚含量均保持在相对较高水平,从而增强了果实对灰霉病的抗性;但加入L-NNA后,Arg对果实的这种诱导效应被显著抑制。L-NNA可抑制NOS的活力,降低NO的含量。有研究表明,外源NO处理可明显提高油桃果实PAL与PPO活力,促进酚类物质的积累[32];提高番茄果实PAL活力[33];提高蘑菇总酚物质的积累及PAL等抗病酶的酶活力[34]。因此,推测Arg代谢的NOS途径在Arg对果实总酚含量、PAL与PPO活力的诱导中可能发挥了重要作用。
果实PRs是果实受生物或非生物胁迫诱导产生并积累的一类蛋白质总称,是果实防卫体系的重要组成部分[35]。大多数的PRs有抗真菌或者细菌的活性,许多PRs在抗病性中的作用也已经被证实[36]。PR2在病理相关条件可诱导细胞间隙或细胞内产生GLU[37],GLU能够水解存在于真菌和卵菌细胞壁的葡聚糖,具有抗真菌的作用。PR3编码的CHI(PR3a编码细胞外CHI;PR3b编码细胞内CHI)能够水解真菌细胞壁中的几丁质,也具有抗真菌的功能。Ding等[37]研究发现茉莉酸甲酯和水杨酸甲酯诱导的番茄果实PR2和PR3 mRNA的积累,有助于增强果实对低温及病原菌的抵抗能力。Wang Fengde等[24]也发现牛蒡低聚果糖能增加PR2a、PR2b、PR3a及PR3b表达水平,这有助于增强果实抵抗灰霉病原菌的能力,减轻果实的发病率。本研究表明,外源适宜浓度的Arg处理可以有效诱导番茄果实中PR2a、PR2b、PR3a以及PR3b的表达,并显著提高GLU和CHI的活力;而L-NNA处理明显降低了Arg对番茄果实PR基因的表达、GLU和CHI活力的诱导。PRs基因表达的增加是植物系统性获得抗性(systemic acquired resistance,SAR)的重要标志[24],而NO在诱导植物建立SAR的信号途径中发挥了重要作用[38],Song Fengming等[39]的研究也发现NOS抑制剂处理可使水杨酸诱导的烟草SAR消失。因此,推测外源Arg可通过NOS途径促进果实体内NO的产生,诱导番茄果实产生SAR,增强果实的抗病能力。
4 结 论
5.0 mmol/L Arg处理显著降低了接种灰霉菌番茄果实的发病率和病斑面积,提高了番茄果实体内PPO、PAL、GLU和CHI等抗病相关酶的活力,促进了酚类物质的积累;诱导了病程相关蛋白PR2a、PR2b、PR3a和PR3b基因的表达,从而提高番茄果实对灰霉病的抗性。而NOS抑制剂与Arg复合处理明显削弱了Arg对番茄果实的这种诱导作用,因此,NOS途径在Arg诱导番茄果实抵抗灰霉病的过程中发挥了重要作用。
[1] ZHANG X H, SHEN L, LI F J, et al. Hot air treatment-induced arginine catabolism is associated with elevated polyamines and proline levels and alleviates chilling injury in postharvest tomato fruit[J].Journal of the Science of Food and Agriculture, 2013, 93(13): 3245-3251. DOI:10.1002/jsfa.6166.
[2] TSIKAS D, WU G Y. Homoarginine, arginine, and relatives: analysis,metabolism, transport, physiology, and pathology[J]. Amino Acids,2015, 47(9): 1697-1702. DOI:10.1007/s00726-015-2055-5.
[3] MICALLEF B J, SHELP B J. Arginine metabolism in developing soybean cotyledons 1. Relationship to nitrogen nutrition[J]. Plant Physiol. 1989, 90(2): 624-630. DOI:10.1104/pp.90.2.624.
[4] KHALIL S I, EL-BASSIOUNY H M S, HASSANEIN R A, et al.Antioxidant defense system in heat shocked wheat plants previously treated with arginine or putrescine[J]. Australian Journal of Basic and Applied Sciences, 2009, 3(3): 1517-1526.
[5] NASIBI F, HEIDARI T, ASRAR Z, et al. Effect of arginine pretreatment on nickel accumulation and alleviation of the oxidative stress in Hyoscyamus niger[J]. Journal of Soil Science and Plant Nutrition,2013, 13(3): 680-689. DOI:10.4067/S0718-95162013005000054.
[6] NASIBI F, YAGHOOBI M M, KALANTARI K M. Effect of exogenous arginine on alleviation of oxidative damage in tomato plant underwater stress[J]. Journal of Plant Interactions, 2011, 6(4): 291-296. DOI:10.1080/17429145.2010.539708.
[7] ZEID I M. Effect of arginine and urea on polyamines content and growth of bean under salinity stress[J]. Acta Physiologiae Plantarum,2009, 31(1): 65-70. DOI:10.1007/s11738-008-0201-3.
[8] BARAND A, NASIBI F, MANOUCHEHRIKALANTARI K. The effect of arginine pretreatment in the increase of cold tolerance in Pistacia vera L. in vitro[J]. Russian Agricultural Sciences, 2015,41(5): 340-346. DOI:10.3103/S1068367415050043.
[9] WILLS R B H, LI Y X. Use of arginine to inhibit browning on fresh cut apple and lettuce[J]. Postharvest Biology and Technology, 2016,113: 66-68. DOI:10.1016/j.postharvbio.2015.11.006.
[10] ZHANG X H, SHEN L, LI F J, et al. Methyl salicylate-induced arginine catabolism is associated with up-regulation of polyamine and nitric oxide levels and improves chilling tolerance in cherry tomato fruit[J]. Journal of Agricultural and Food Chemistry, 2011, 59(17):9351-9357. DOI:10.1021/jf201812r.
[11] ZHANG X H, SHEN L, LI F J, et al. Amelioration of chilling stress by arginine in tomato fruit: changes in endogenous arginine catabolism[J]. Postharvest Biology and Technology, 2013, 76: 106-111. DOI:10.1016/j.postharvbio.2012.09.012.
[12] WALTERS D. Resistance to plant pathogens: possible roles for free polyamines and polyamine catabolism[J]. New Phytologist, 2003,159(1): 109-115. DOI:10.1046/j.1469-8137.2003.00802.x.
[13] SIDDIQUI M H, AL-WHAIBI M H, BASALAH M O. Role of nitric oxide in tolerance of plants to abiotic stress[J]. Protoplasma, 2010,248(3): 447-455. DOI:10.1007/s00709-010-0206-9.
[14] BECKMANN N, SCHAFFERER L, SCHRETTL M, et al.Characterization of the link between ornithine, arginine, polyamine and siderophore metabolism in Aspergillus fumigatus[J]. PLoS ONE,2013, 8(6): e67426. DOI:10.1093/jxb/erv138.
[15] MAJUMDAR R, BARCHI B, TURLAPATI S A, et al. Glutamate,ornithine, arginine, proline, and polyamine metabolic interactions: the pathway is regulated at the post-transcriptional level[J]. Frontiers in Plant Science, 2016, 7: 78-94. DOI:10.3389/fpls.2016.00078.
[16] 杨洪强, 高华君. 植物精氨酸及其代谢产物的生理功能[J]. 植物生理与分子生物学学报, 2007, 33(1): 1-8.
[17] 周晓婉, 唐永萍, 石亚莉, 等. 1-MCP对低温贮藏苹果灰霉病抗性的诱导作用[J]. 食品科学, 2016, 37(12): 254-260. DOI:10.7506/spkx1002-6630-201612046.
[18] 袁仲玉, 周会玲, 田蓉, 等. 芦荟粗提物对苹果采后灰霉病的防治效果与机理[J]. 农业工程学报, 2014, 30(4): 255-263. DOI:10.3969/j.issn.1002-6819.2014.04.031.
[19] ASSIS J S, MALDONADO R, MUÑOZ T, et al. Effect of high carbon dioxide concentration on PAL activity and phenolic contents in ripening cherimoya fruit[J]. Postharvest Biology and Technology,2001, 23(1): 33-39. DOI:10.1016/S0925-5214(01)00100-4.
[20] ABELES F B, BOSSHART R P, FORRENCE L E, et al. Preparation and purif i cation of glucanase and chitinase from bean leaves[J]. Plant Physiology, 1971, 47(1): 129-134. DOI:10.1104/pp.47.1.129.
[21] CAO Shifeng, ZHENG Yonghua. Effect of 1-methylcyclopropene on anthracnose rot caused by Colletotrichum acutatum and disease resistance in loquat fruit[J]. Journal of the Science of Food and Agriculture, 2010, 90(13): 2289-2294. DOI:10.1002/jsfa.4084.
[22] WANG K T, JIN P, CAO S F, et al. Methyl jasmonate reduces decay and enhances antioxidant capacity in Chinese bayberries[J]. Journal of Agricultural and Food Chemistry, 2009, 57(13): 5809-5815.DOI:10.1021/jf900914a.
[23] ZHANG X H, SHEN L, LI F J, et al. Up-regulating arginase contributes to amelioration of chilling stress and the antioxidant system in cherry tomato fruits[J]. Journal of the Science of Food and Agriculture, 2010, 90(13): 2195-2202. DOI:10.1002/jsfa.4070.
[24] WANG Fengde, FENG Guihua, CHEN Kaoshan. Defense responses of harvested tomato fruit to burdock fructooligosaccharide, a novel potential elicitor[J]. Postharvest Biology and Technology, 2009, 52(1):110-116. DOI:10.1016/j.postharvbio.2008.09.002.
[25] VANELLA L, DI GIACOMO C, ACQUAVIVA R, et al. The DDAH/NOS pathway in human prostatic cancer cell lines: antiangiogenic effect of L-NAME[J]. International Journal of Oncology, 2011, 39(5):1303-1310. DOI:10.3892/ijo.2011.1107.
[26] LIN K Y, ITO A, ASAGAMI T, et al. Impaired nitric oxide synthase pathway in diabetes mellitus role of asymmetric dimethylarginine and dimethylarginine dimethylaminohydrolase[J]. Circulation, 2002,106(8): 987-992. DOI:10.1161/01.CIR.0000027109.14149.67.
[27] HICHRI I, BOSCARI A, CASTELLA C, et al. Nitric oxide: a multifaceted regulator of the nitrogen-fixing symbiosis[J]. Journal of Experimental Botany, 2015, 66(10): 2877-2887. DOI:10.1093/jxb/erv051.
[28] CHANG K, GUO T T, LI P F, et al. Novel fluorescence arginine analogue as a sensor for direct identification and imaging of nitric oxide synthase-like enzymes in plants[J]. Scientif i c Reports, 2016, 6:32630-32636. DOI:10.1038/srep32630.
[29] HATANO T, MIYATAKE H, NATSUME M, et al. Proanthocyanidin glycosides and related polyphenols from cacao liquor and their antioxidant effects[J]. Phytochemistry, 2002, 59(7): 749-758.DOI:10.1016/S0031-9422(02)00051-1.
[30] CONSTABEL C P, YIP L, PATTON J J, et al. Polyphenol oxidase from hybrid poplar. cloning and expression in response to wounding and herbivory[J]. Plant Physiology, 2000, 124(1): 285-296.DOI:10.1104/pp.124.1.285.
[31] 龙清红, 高梵, 李晓安, 等. BABA处理对葡萄果实采后灰霉病的影响及机理[J]. 食品科学, 2016, 37(14): 213-218. DOI:10.7506/spkx1002-6630-201614039.
[32] 李永才, 陈松江, 毕阳, 等. 采后一氧化氮处理对油桃抗软腐病的诱导[J]. 食品工业科技, 2012, 33(10): 340-342; 357. DOI:10.13386/j.issn1002-0306.2012.10.019.
[33] 刘零怡, 于萌萌, 郑杨, 等. 采后一氧化氮处理调控番茄果实茉莉酸类物质合成并提高灰霉病抗性[J]. 食品科学, 2010, 31(22): 457-461.
[34] JIANG T J, ZHENG X L, LI J R, et al. Integrated application of nitric oxide and modif i ed atmosphere packaging to improve quality retention of button mushroom (Agaricus bisporus)[J]. Food Chemistry, 2011,126(4): 1693-1699. DOI:10.1016/j.foodchem.2010.12.060.
[35] THIBAUD M C, GINESTE S, NUSSAUME L, et al. Sucrose increases pathogenesis-related PR-2 gene expression in Arabidopsis thaliana through an SA-dependent but NPR1-independent signaling pathway[J]. Plant Physiology and Biochemistry, 2004, 42(1): 81-88.DOI:10.1016/j.plaphy.2003.10.012.
[36] VAN LOON L C, PIERPOINT W S, BOLLER T, et al. Recommandations for naming plant pathogenesis-related proteins[J]. Plant Molecular Biology Reporter, 1994(12): 245-264. DOI:10.1007/BF02668748.
[37] DING C K, WANG C Y, GROSS K C, et al. Jasmonate and salicylate induce the expression of pathogenesis-related-protein genes and increase resistance to chilling injury in tomato fruit[J]. Planta, 2002,214(6): 895-901. DOI:10.1007/s00425-001-0698-9.
[38] ROMERO-PUERTAS M C, PERAZZOLLI M, ZAGO E D, et al.Nitric oxide signalling functions in plant-pathogen interactions[J].Cellular Microbiology, 2004, 6(9): 795-803. DOI:10.1111/j.1462-5822.2004.00428.x.
[39] SONG Fengming, GOODMAN R M. Activity of nitric oxide is dependent on, but is partially required for function of, salicylic acid in the signaling pathway in tobacco systemic acquired resistance[J].Molecular Plant-Microbe Interactions, 2001, 14(12): 1458-1462.DOI:10.1094/MPMI.2001.14.12.1458.
Role of Nitric Oxide Synthase Pathway in Arginine-Induced Disease Resistance in Postharvest Tomato Fruit
JI Nana, MIN Dedong, LI Fujun, SHAO Shujun, ZHANG Xinhua*
(School of Agricultural Engineering and Food Science, Shandong University of Technology, Zibo 255049, China)
This study aimed to investigate the effect of arginine treatment on the occurrence of postharvest gray mold in‘Zhongshu No. 4’ tomato fruit and the role and mechanism of nitric oxide synthase (NOS) pathway in arginine-induced disease resistance during storage at (25 ± 1) ℃. The results indicated that 5.0 mmol/L arginine was the most effective treatment in reducing the incidence of gray mold and lesion area in tomato fruit in the concentration range of 0.0—10.0 mmol/L.Moreover, 5.0 mmol/L arginine treatment increased NOS activity and nitric oxide (NO) content. Total phenol content and the activities of phenylalanine ammonia-lyase, polyphenol oxidase, chitinase and β-1,3-glucanase were also enhanced remarkably. Besides, the expression of pathogenesis-related genes (PR2a, PR2b, PR3a and PR3b) were induced signif i cantly.However, these effects were partially counteracted by Nω-nitro-L-arginine, an inhibitor of NOS. Our results indicate that arginine-induced resistance to gray mold in postharvest tomato fruit may be due to promoting the NOS pathway.
tomato fruit; nitric oxide synthase; arginine; disease resistance
10.7506/spkx1002-6630-201801038
TS262.6
A
1002-6630(2018)01-0250-08
季娜娜, 闵德栋, 李富军, 等. 一氧化氮合酶途径在精氨酸诱导番茄果实采后抗病性中的作用[J]. 食品科学, 2018, 39(1):
250-257. DOI:10.7506/spkx1002-6630-201801038. http://www.spkx.net.cn
JI Nana, MIN Dedong, LI Fujun, et al. Role of nitric oxide synthase pathway in arginine-induced disease resistance in postharvest tomato fruit[J]. Food Science, 2018, 39(1): 250-257. (in Chinese with English abstract)
10.7506/spkx1002-6630-201801038. http://www.spkx.net.cn
2016-09-28
国家自然科学基金青年科学基金项目(31201432;31101587)
季娜娜(1992—),女,硕士研究生,研究方向为果蔬采后生理与贮藏保鲜。E-mail:jinana_sdut@126.com
*通信作者简介:张新华(1976—),女,副教授,博士,研究方向为果蔬采后生理与贮藏保鲜。E-mail:zxh@sdut.edu.cn
