次氯酸钠催化氧化法处理氨氮废水的研究*
2018-01-08章启帆
章启帆,李 勇,徐 婷,朱 伟
(苏州科技大学环境科学与工程学院,江苏苏州215009)
环境·健康·安全
次氯酸钠催化氧化法处理氨氮废水的研究*
章启帆,李 勇,徐 婷,朱 伟
(苏州科技大学环境科学与工程学院,江苏苏州215009)
次氯酸钠直接氧化氨氮的产物是氮气和硝酸根,在m(氯气)∶m(氨气)=7.7、pH=7、常温下完全处理100 mg/L的氨氮废水,硝酸根生成率为5%。通过比较,三氧化二镍有较好的催化效果,可大幅缩短反应时间并减少余氯,但总氮(TN)的去除率下降。催化氧化下三氧化二镍投加量越大,反应速度越快,硝酸根生成越多;处理高初始浓度氨氮废水的效率较低初始浓度低;投加三氧化二镍能加快反应速率但无法减少直接氧化下所需次氯酸钠的用量;本实验条件下最适宜pH为7;温度的升高导致次氯酸钠自分解不利于催化氧化的进行。
催化氧化;次氯酸钠;氨氮;金属氧化物
污水中过量的氨氮会使水体产生富营养化导致水质的恶化,严重危害环境和人体健康。次氯酸钠作为一种具有较强氧化能力的氧化剂,且具有廉价和杀菌有效等优点常被用在含氨氮废水的处理中。但由于次氯酸钠的不稳定性,会降低其在折点加氯法中的利用率[1],因此有研究者对如何提高次氯酸钠的利用率展开了研究[2]。已有的研究表明,在氨氮废水中加入氧化镍作为催化剂,使折点加氯法这一单一氧化过程转变为催化氧化的过程,可明显提高其氧化性能,尤其是对含有难降解有机物或高浓度有机废水的催化氧化处理有明显的提升效果[3];或在氧化镍中加入少量的氧化铁和其他载体改性,进一步提升次氯酸钠的活性[4-5]。本实验以次氯酸钠催化氧化的方法处理含氨氮废水,考察其催化氧化的实际效果。
1 材料与方法
1.1 试剂和材料
氨氮模拟废水:使用NH4Cl分析纯试剂人工配制,pH采用NaOH和HCl溶液调节。氧化剂:NaClO溶液,分析纯(经测定有效氯质量分数<5%)。催化剂:Ni2O3,分析纯试剂(粉末状);负载型催化剂:Ni2O3-MgO、Ni2O3-Fe2O3、Ni2O3-Fe2O3/MgO、Ni2O3-Fe2O3/SiO2,采用沉淀法和混捏法制备以上负载型催化
剂[4,6]。
1.2 实验原理
1.2.1 折点加氯法
次氯酸钠可与液相中的氨氮发生反应,次氯酸或次氯酸根离子能够与氨氮发生多种反应,并会产生几种中间产物如一氯胺、二氯胺、三氯胺等,最后氨氮转化成氮气释放到空气中,此过程称为折点加氯,其相关反应式如下[7]:
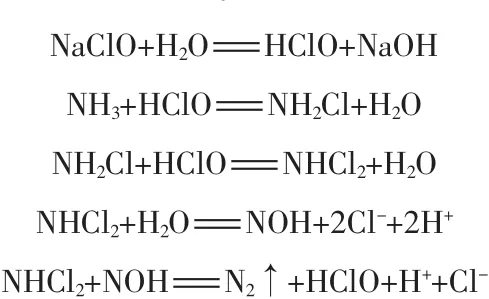
总反应式为:NH3+1.5NaClO=0.5N2↑+1.5H2O+1.5NaCl
参照此组反应式可知,水中每1分子的氨氮可通过投加至少1.5分子的次氯酸钠去除,但在实际情况下,由于次氯酸钠的不稳定性和实际废水中物质的复杂性,最终全部去除氨氮的次氯酸钠投加量往往大于理论投加量[8]。
1.2.2 次氯酸钠催化氧化
以NaClO为氧化剂,Ni2O3为催化剂,在中性和室温的条件下催化氧化处理废水中的有机物和其他能被氧化的物质,其反应机理如下[9]:
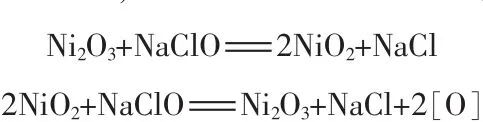
在反应过程中产生的四价镍(NiO2)和原子氧([O]),具有极强的氧化能力,其氧化点位相当高,在复杂废水的处理中较常规的氯氧化能更为迅速地分解废水中物质。且从理论反应式可以看出,Ni2O3作为催化剂可不断恢复再生,重复作用。
1.3 实验方法
配制一定浓度的氨氮废水,取50 mL置于玻璃烧杯中,采用HCl和NaOH溶液调节体系pH,称取一定质量的催化剂置于待反应废水中并恒温搅拌,使用仪器为集热式恒温加热磁力搅拌器(型号为DF-101S),加入一定量的NaClO进行反应,每间隔5 min取样分析,总共40 min。分为两部分实验,第一步观察在单独氧化和各催化剂作用下氨氮的实际转化效果;第二步实验,建立在上部分实验的基础上,选择取得较好效果的催化剂,分别考察在改变催化剂投加量、反应初始浓度、氧化剂投加量、pH和反应温度的情况下催化氧化的效果。
1.4 分析测定方法
氨氮浓度的测定采用纳氏试剂分光光度法,按照HJ 535—2009《水质氨氮的测定纳氏试剂分光光度法》进行测定;NO3-浓度由离子色谱仪(ICP-9000)测定;废水余氯含量的测定采用碘量法滴定[10]。
2 结果与讨论
2.1 次氯酸钠投加量的确定
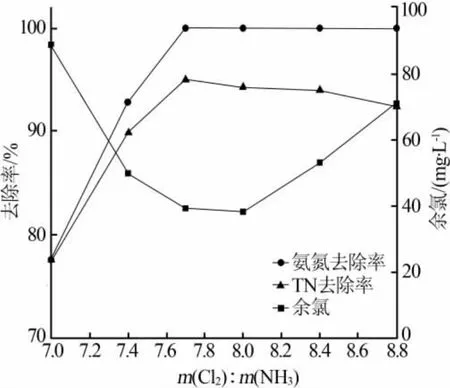
取质量浓度为100 mg/L的氨氮废水,调节pH=7,常温下先单独投加一定量的次氯酸钠溶液,观察反应效果,确定次氯酸钠的适合投加量,不同次氯酸钠投加量下氨氮氧化实际情况如图1所示。由图1可以看出,随着次氯酸钠投加量的增大,氨氮的去除率迅速提升,在 m(Cl2)∶m(NH3)=7.7 时,氨氮的去除率达最高,为 100%。 在 m(Cl2)∶m(NH3)≥7.7 时,由于NO3-浓度的升高,总氮(TN)的去除率缓慢下降,从95%下降至92.4%,这说明了折点加氯法处理含氨氮废水的过程中,并不是所有的氨氮都能按照理论反应式转化成N2释放出去,实际情况是有一定量的氨氮会被过度氧化为 NO3-,且在 m(Cl2)∶m(NH3)≥7.7的投加量下,转化为NO3-的比例逐渐增加。同时,反应完成后的余氯水平呈先下降后升高的趋势,在氨氮去除率达100%时降至较低水平,与理论变化规律基本一致。 综合来看,m(Cl2)∶m(NH3)=7.7 较合适,既能完全去除氨氮,同时保证了较高的TN脱除率,尽量降低余氯含量。
2.2 各催化剂效果比较
选择Ni2O3(A)作为催化剂,并采用沉淀法制备了 Ni2O3-MgO(B)、Ni2O3-Fe2O3/MgO(C),采用混捏法制备了 Ni2O3-Fe2O3(D)、Ni2O3-Fe2O3/SiO2(E)几种催化剂。取质量浓度为100mg/L的氨氮废水,在m(Cl2)∶m(NH3)=7.7、pH=7、常温下分别投加以上 5 种催化剂10 g/L,反应结果如图2所示。从图2可知,相同条件下,只有Ni2O3催化效果最佳,可以去除100%的氨氮,而另外4种负载型催化剂的效果较Ni2O3差,都没有将氨氮全部氧化且余氯水平较高,虽然理论上加入负载可以提高镍基催化剂的活性[4],但是对于氨氮的转化可能起不到作用,并且相同的投加量中负载型催化剂Ni2O3的比例较低,减少了Ni2O3与NaClO之间的有效反应,包括以活性氧化铝为载体的镍基催化剂[11],催化性能的提高是因为加入了活性氧化铝这一载体提高了催化剂的比表面积从而提供了较先前更大的反应表面。而对于本实验的情况,应保持氧化镍的质量不变,继而提供催化载体才可在原基础效果上加以提升。

2.3 催化剂投加量对催化氧化的影响
由于Ni2O3相较于其他催化剂有较好的效果,考察不同的Ni2O3投加量下,处理质量浓度为100 mg/L的氨氮废水的效果。 在 m(Cl2)∶m(NH3)=7.7、pH=7、常温的条件下,不同Ni2O3投加量对催化氧化的影响见图3和表1。由图3可见,在不投加Ni2O3的条件下,氨氮去除的速率较投加条件下缓慢,在35 min时完成了100%的氨氮去除。随着催化剂投加量的增加,反应速率明显加快,反应终点提前到达。当Ni2O3投加量达18 g/L时,可在20 min内完成100%的氨氮去除,这说明Ni2O3作为催化剂起到了明显的催化作用,加快了氨氮的氧化反应。同时可以从表1看出,随着Ni2O3投加量的加大,NO3-的产量也随之增大,导致TN的去除率从94.91%逐渐下降至76.24%,这是因为在氨氮转化速率加快的同时,由于催化体系的强氧化性,更多的氨氮被氧化为NO3-,从而表现出TN去除率的降低。也由于催化作用,次氯酸钠的分解率得到提升,余氯随Ni2O3投加量增大而明显降低,投加至6 g/L后体系中余氯质量浓度降至8.86 mg/L。因此,催化剂投加量的增加使反应速度加快,且增加NO3-的浓度,降低TN的去除率和余氯水平。
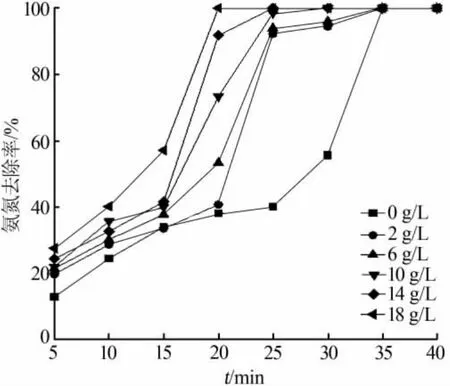
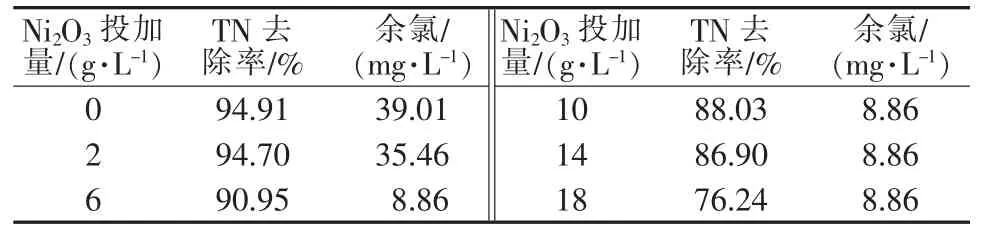
表1 不同Ni2O3投加量下TN去除率和余氯的量
2.4 初始浓度对催化氧化的影响
在 m(Cl2)∶m(NH3)=7.7、10 g/L 的 Ni2O3投加量、pH=7、常温的条件下,考察了不同氨氮初始浓度对催化氧化的影响,结果见图4和表2。
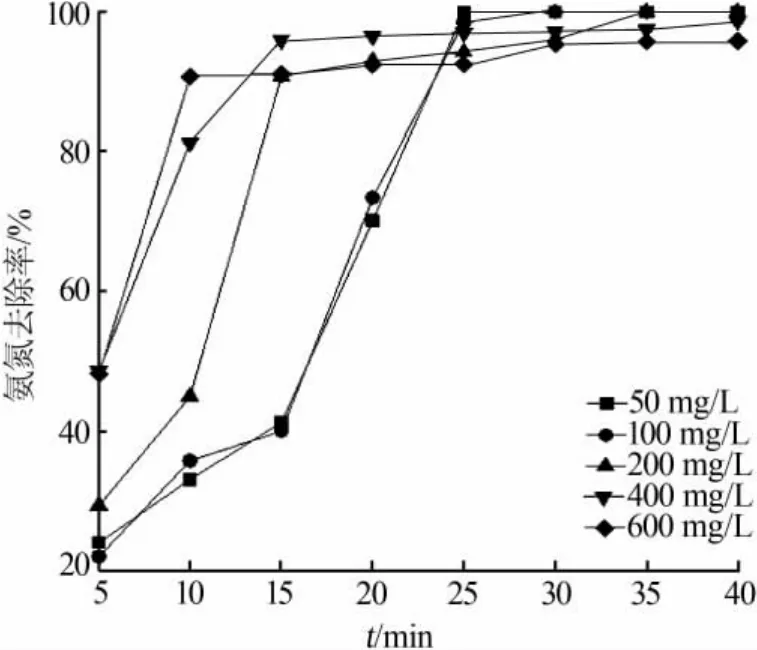
图4 不同初始浓度对催化氧化的影响

表2 不同初始浓度下TN去除率和余氯的量
由图4所示,随着初始浓度的增加,反应速度加快,50 mg/L初始质量浓度下基本到达反应终点的用时在25 min左右,而在600 mg/L初始质量浓度下10 min就可以基本达到。高浓度下反应接触程度大,较短时间内可完成前一段的反应。而在此之后还存在氨氮去除缓慢的过程,是由于体系内生成的中间产物NH2Cl和NHCl2构成了反应的不同阶段且NH2Cl的分解过程是一限速反应[12],至 35 min 后氨氮去除率基本无变化。TN的去除表现出先增加后平缓的趋势,原因是投加固定量的催化剂的条件下,低初始浓度时会有更多的NO3-产生导致较低的TN去除率。另外,高初始浓度下氨氮并不能按照低浓度下的投加比例100%去除,这与传统折点加氯法高氨氮浓度下的氯投加量的不经济性是相似的,也可从残留余氯水平中看出,初始浓度越高反应结束的余氯也越高,说明高初始浓度下要100%去除氨氮需要进一步增加氯的投加。
2.5 次氯酸钠投加量的削减
研究了在投加Ni2O3催化剂的条件下能否减少单独氧化氨氮所用的NaClO的量。以100 mg/L氨氮废水实验,在10 g/L的Ni2O3投加量、pH=7、常温条件下改变次氯酸钠的投加量,观察在存在催化的情况下能去除100%氨氮所需要的最少NaClO的量。不同 m(Cl2)∶m(NH3)对催化氧化的影响见图 5 和表 3。
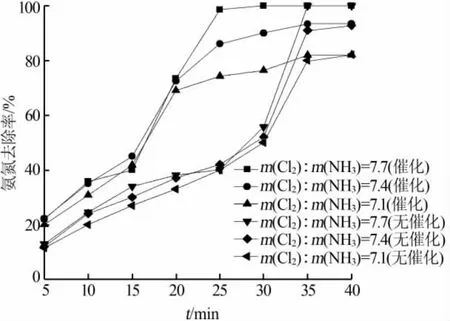
图 5 不同 m(Cl2)∶m(NH3)对催化氧化的影响
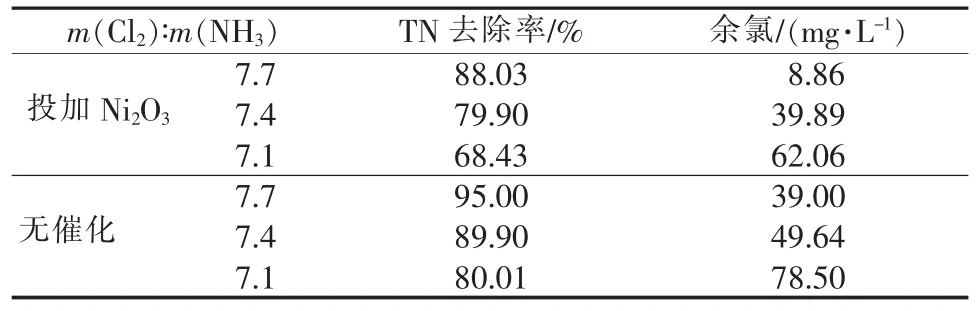
表3 不同 m(Cl2)∶m(NH3)下 TN 去除率和余氯的量
由图5可见,无论是在投加Ni2O3催化氧化还是在 NaClO 直接氧化下,随着 m(Cl2)∶m(NH3)的降低(即NaClO用量的减少),都表现出氨氮的最终去除率不断降低,且不论有无Ni2O3催化氨氮去除率的降低程度基本一致,不同之处在于投加Ni2O3的反应明显较快,在25 min时基本达到反应终点,而直接氧化则在35min达到反应终点。从表3可见,投加Ni2O3的TN去除率较无催化明显低,是因为更多的氨氮被催化氧化为NO3-,转化为N2的部分减少导致相同的氨氮去除率却存在TN去除高低的差异。同样,不论 m(Cl2)∶m(NH3)的多少,有 Ni2O3催化下的余氯水平较无催化低。所以在同样条件下,加入了催化剂Ni2O3的作用可以加快反应,改变产物的选择性,但无法降低氧化剂的使用量。
2.6 pH对催化氧化的影响
通常在传统的折点加氯法中,体系pH是重要的影响因素,高pH下氨氮大多以NH3的形式存在,比 NH4+更容易被氧化[13],而高 pH 下由于 OH-的增加,NaClO的氧化电位会降低,不利于氨的氧化,所以这一矛盾体系中存在较为适宜的pH。研究认为pH为8左右最佳[14]。但加入催化剂后的情况可能与此结论并不一致。在100mg/L的氨氮废水、m(Cl2)∶m(NH3)=7.7、10 g/L 的 Ni2O3投加量、常温的条件下,改变体系pH,催化氧化的效果如图6、表4所示。

图6 不同pH对催化氧化的影响
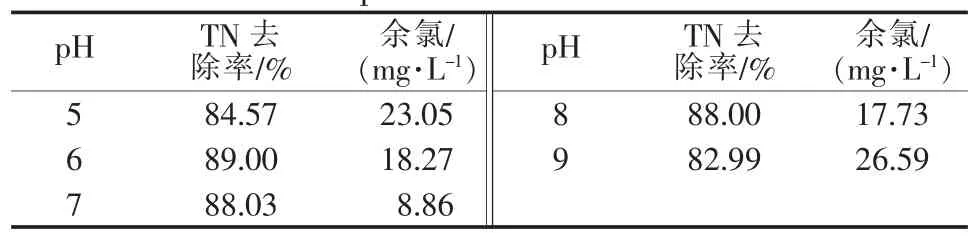
表4 不同pH下TN去除率和余氯的量
由图6和表4可见,随着pH从酸到碱的改变,氨氮的去除率呈先增加后减小的趋势,在pH=5时为94.75%,随着pH的改变,氨氮的去除率提升到100%后下降至94.30%。显然,pH<6的酸性条件和pH>8的碱性条件都不利于氨氮的氧化,因为酸性条件下氨氮呈NH4+形式较难被氧化且其反应速度明显较缓慢,pH的提升导致氨氮呈NH3形式比例增加,反应速率加快,在pH≥9时虽然其反应速率仍较快,但因NaClO氧化能力下降以致其氨氮去除率下降。而各pH条件下的NO3-生成质量浓度基本都在50 mg/L上下,表现出TN的去除趋势和氨氮去除趋势基本相同,这可能由于NaClO直接氧化氨氮受到pH的影响大于Ni2O3催化氧化氨氮作用受到pH的影响。从余氯水平可以看出,各pH条件下的余氯含量都要明显比无催化条件下低,而在pH=7时对NaClO的催化分解程度最高。因此,pH=7的条件下有利于催化氧化反应的进行。
2.7 温度对催化氧化的影响
虽然存在NaClO见光或受热易分解失效的理化性质[15],但温度的升高可同时使反应速率和催化速率加快。在100 mg/L的氨氮废水、m(Cl2)∶m(NH3)=7.7、10 g/L 的 Ni2O3投加量的条件下,观察温度的变化对催化氧化的影响,结果见图7和表5。
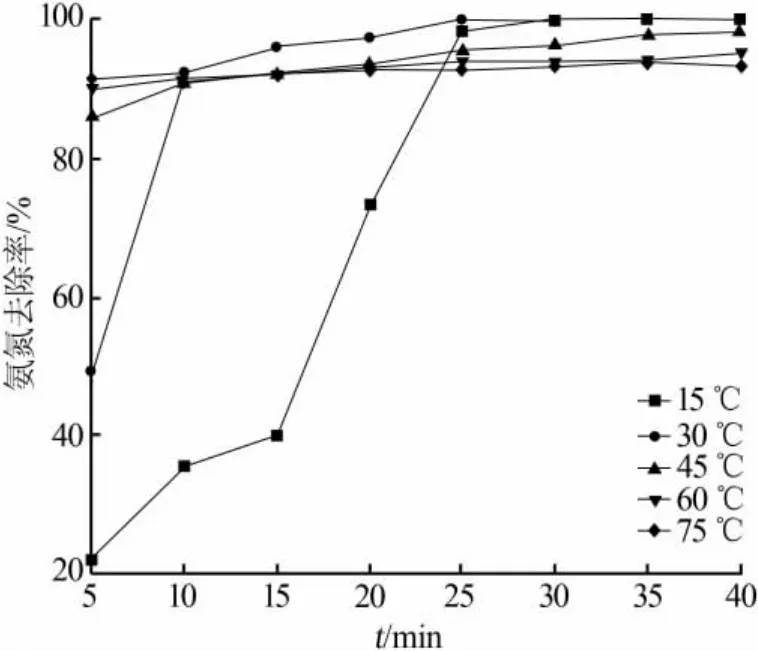
图7 不同温度对催化氧化的影响

表5 不同温度下TN去除率和余氯的量
由图7和表5可见,随着温度的升高,反应速率迅速加快,尤其在45℃后,5 min的反应时间就可基本达到反应终点,这是由于温度的升高引起的加速。但是,随着温度的升高虽然速率得到提升,氨氮的去除率却从100%下降至93.75%,这是由于高温下NaClO 受热自分解导致 m(Cl2)∶m(NH3)的降低,不足以将所有的氨氮全部氧化。而NO3-的产率随温度升高缓增,TN的去除率变化趋势与氨氮去除的趋势基本一致。余氯残留水平随温度升高而升高,但此时液相中的NaClO已被使用或自分解,故升高的余氯是生成的中间产物一氯胺或二氯胺所致,无法进一步继续反应。总体来说,温度的升高不利于催化氧化的进行,无论是氨氮和TN的去除还是余氯残留水平都比常温下效果差。
3 结论
1)投加Ni2O3可加快氨氮的氧化,且随着投加量的增大,反应速率的提升越快,但增加了氨氮向NO3-的转化,从而降低了TN的去除。2)处理高氨氮浓度的废水,催化氧化法与直接加氯氧化法都表现出NaClO投加量的不足,因此不适用于高浓度氨氮废水处理;Ni2O3的加入只能使反应终点大幅提前,但无法减少传统加氯法所需要的NaClO的量;由于pH的矛盾体系的存在,本实验中最适宜的pH约为7,更低或更高的pH环境不利于NaClO的氧化;温度的升高导致NaClO自分解,虽然反应速率提升明显,但降低了处理效率,因此高温下不利于催化氧化的进行。3)相较于直接加氯氧化,在投加了Ni2O3之后,都能够降低反应最终的余氯水平。
[1]苏秀霞,李仲谨,匡俊艳.氯化钠对次氯酸钠溶液稳定性影响的研究[J].陕西科技大学学报,2006,24(5):45-47.
[2]邵黎歌,陈卿.次氯酸钠的分解特性及提高其稳定性能的途径[J].氯碱工业,1997(4):21-24.
[3]程建忠,张英喆,何永亮,等.次氯酸钠催化氧化法处理十二碳硫醇恶臭污水[J].城市环境与城市生态,2001,14(2):32-33.
[4]石晓鹏,梅华,姚虎卿.改性镍基催化剂催化增强次氯酸钠氧化性的性能研究[J].工业催化,2009,17(8):72-76.
[5]King F,Hancock F E.Catalysis and pollution abatement:the removal of hypochlorite from waste chlorine/caustic effluent[J].Catalysis Today,1996,27:203-207.
[6]束长好,申晨,梅华,等.沉淀法制备镍催化剂及其提高次氯酸钠氧化性能的研究[J].无机盐工业,2010,42(9):14-17.
[7]郑涵,姜萍萍.微污染水源水中氨氮去除研究[J].城镇供水,2013(1):18-21.
[8]王昶,黄志金,左军,等.次氯酸钠氧化脱除河水低浓度氨氮研究[J].中国市政工程,2013,165(2):39-42.
[9]石晓鹏,梅华,沈健.Ni2O3催化剂的制备及其催化NaClO分解产生活性氧的性能[J].化工进展,2009,28(6):962-966.
[10]国家环境保护总局.水和废水监测分析方法[M].北京:中国环境科学出版社,2012.
[11]孙春晖,于海斌,陈永生,等.氧化铝载体对镍/氧化铝催化剂性能的影响[J].无机盐工业,2014,46(12):79-80.
[12]张胜利,刘丹,曹臣.次氯酸钠氧化脱除废水中氨氮的研究[J].工业用水与废水,2009,40(3):23-26.
[13]Hoigné J,Bader H,Haag W R.Rate constants of reactions of ozone with organic and inorganic compounds in water-Ⅲ:Inorganic compounds and radicals[J].Water Research,1985,19(8):993-1004.
[14]顾庆龙.次氯酸钠氧化法脱除二级生化出水中氨氮的中试研究[J].环境科学与管理,2007,32(12):97-100.
[15]王万林.次氯酸钠溶液稳定性研究进展[J].无机盐工业,2007,39(9):12-14.
Study on treating ammonia-nitrogen wastewater with catalytic oxidation of NaClO
Zhang Qifan,Li Yong,Xu Ting,Zhu Wei
(School of Environmental Science&Engineering,Suzhou University of Science&Technology,Suzhou 215009,China)
N2and NO3-are the products of oxidizing ammonia-nitrogen with NaClO.The productivity of NO3-was 5%when treating 100 mg/L ammonia-nitrogen wastewater completely in the conditions of m(Cl2)∶m(NH3)=7.7,pH=7 and normal temperature.Compared with other catalysts,Ni2O3provided the best effect of catalytic oxidation of cutting reaction time and decreasing residual chlorine,but the removal rate of total nitrogen (TN)decreased.The reaction rate and NO3-productivity increased with the increasing of Ni2O3dosage;The treating efficiency under high initial concentration was lower than that of low initial concentration;The reaction rate was accelerated when adding Ni2O3but the NaClO needed in was unfavorable for catalytic oxidation direct oxidation cannot be cut down;The suitable pH was 7 under these experimental conditions;The NaClO′s self decomposition due to the high temperature.
catalytic oxidation;NaClO;ammonia-nitrogen;metal oxides
TQ126.2
A
1006-4990(2018)01-0052-05
江苏省环境科学与工程重点专业(类)建设项目(201223276);江苏省特色优势学科二期立项项目;2015年度研究生科研/实践创新计划项目(SKCX15_023)。
2017-07-29
章启帆(1992— ),男,硕士研究生,研究方向为水污染控制与理论。
李勇
联系方式:279043319@qq.com
