氯化铝对碳酸钙结晶形貌的影响*
2018-01-08黄文艺马蓝宇王崇罡李利军
黄文艺 ,马蓝宇 ,程 昊 ,王崇罡 ,李利军
[1.广西科技大学生物与化学工程学院,广西柳州545006;2.广西糖资源绿色加工重点实验室(广西科技大学);3.广西蔗糖产业协同创新中心;4.广西高校糖资源加工重点实验室(广西科技大学)]
研究与开发
氯化铝对碳酸钙结晶形貌的影响*
黄文艺1,2,3,4,马蓝宇1,2,3,4,程 昊1,2,3,4,王崇罡1,2,3,4,李利军1,2,3,4
[1.广西科技大学生物与化学工程学院,广西柳州545006;2.广西糖资源绿色加工重点实验室(广西科技大学);3.广西蔗糖产业协同创新中心;4.广西高校糖资源加工重点实验室(广西科技大学)]
在溶液中采用复分解法,以氯化铝和氯化钙为混合钙源、碳酸钠作为碳源,在反应过程中,利用铝离子的双水解产生具有复杂结构的氢氧化铝凝胶体,提供一个特殊的反应环境来制备碳酸钙晶体并影响其形貌。采用场发射扫描电子显微镜、X射线衍射分析仪对产物进行表征。结果表明:氯化铝的加入对反应过程和产物形貌均产生很大影响,随体系浓度和钙、铝离子物质的量比的不同,晶体析出与生长环境发生了改变,出现了球形、花球形和纺锤形的碳酸钙微粒。
氯化铝;氢氧化铝;碳酸钙;结晶形貌
碳酸钙产品作为一种重要的无机化工原料,生产工艺简单,性能优良[1]。碳酸钙材料随形貌与晶型的不同其性质上也存在差异,在实际应用中对碳酸钙的形貌有着不同的要求,因此不同形态尺寸碳酸钙晶体的制备技术成为研究热点[2]。碳酸钙3种较为常见的晶型为球霰石、文石和方解石[3]。在碳酸钙制备过程中,球霰石、文石和方解石都可能生成,在溶液中让晶体自由生长,产物通常都会转变为热力学上最为稳定的方解石[4]。 张群等[5]利用吐温-80 和聚乙烯吡咯烷酮(PVP)作为控制剂,采用乳状液膜与共沉淀结合法制备出了颗粒大小约为5 μm的碳酸钙微球;丁杨等[6]利用水包油(O/W)型体系相界面反应模式,该模式使反应不再限制在水核中而是拓展到所有两相接触的接触面,制备了形貌可控的碳酸钙颗粒;M.Takiguchi等[7]通过配有特殊阳离子交换薄膜的反应器,在薄膜表面生长出碳酸钙微米管;G.Yuan 等[8]在乙醇/水体系中添加氨丙基三乙氧基硅烷制备出花状、花生状和中空形状的碳酸钙微粒。在溶液法中对碳酸钙微粒的形貌调控多以高分子有机控制剂为主,引入的有机物在后续处理过程中较难彻底洗脱,而单一的有机控制剂多数只能形成单一形貌的碳酸钙微粒,大部分常规有机控制剂单一使用效果不佳,需两种或更多种控制剂进行复配调整,达到预期效果。本文以氯化铝作为单一的无机控制剂直接混合氯化钙作为钙源,碳酸钠作为碳源,利用铝离子双水解过程产生氢氧化铝凝胶体提供一个特殊的反应环境,通过调控钙、铝离子物质的量比和反应体系浓度,改变氢氧化铝凝胶体,再进行复分解反应产生不同形貌碳酸钙微粒,分析过程中的影响因素,探讨反应机理,为研究者提供参考。
1 实验部分
1.1 原料与仪器
原料:无水氯化钙、无水碳酸钠、六水氯化铝、氢氧化钠、无水乙醇,均为AR;实验用水均为二次蒸馏水。所有化学试剂均未经过进一步提纯而直接使用。
仪器:SIGMA-04-55型场发射扫描电子显微镜(FESEM);Rigaku Smartlab 型 X 射线衍射仪(Cu/40 kV/30 mA);PH100-3A41L-EP型光学生物显微镜;DF-101S型集热式恒温加热磁力搅拌器;2FDA5040A型全自动新型鼓风干燥箱。
1.2 实验方法
在室温条件下,取适量混有AlCl3的CaCl2溶液于烧杯中,迅速倾入稍过量的Na2CO3溶液,即刻发生双水解产生大量气体并形成凝胶态物质,维持800 r/min搅拌速度,恒定室温反应10 min后待凝胶水化后投入过量NaOH反应约15 min将Al(OH)3胶体洗去(若洗涤困难可适当加热),然后使用二次蒸馏水和无水乙醇交替过滤、洗涤产物至中性,将其放置于100℃鼓风干燥箱内充分干燥4 h后得到干燥的碳酸钙样品。
1.3 样品表征
采用场发射扫描电子显微镜(FESEM)分析产物的形貌,样品经喷金处理后,在15 kV扫描电压下进行观察;X射线衍射(XRD)分析产物物相,测试条件为Cu靶,Kα辐射,电压为40 kV,电流为30 mA,λ=0.154 18 nm,2θ为 20~60°,扫描速度为 5 (°)/min。
2 结果与分析
2.1 不同钙、铝物质的量比对产物形貌的影响
图1为体系浓度不变时(0.25 mol/L),不同钙、铝离子物质的量比所得碳酸钙的形貌。由图1a可以看出,在 n(Ca2+)∶n(Al3+)=1∶2 时,碳酸钙形貌主要为均匀的球形微粒,粒径分布在3~5 μm,分散度较高;当 n(Ca2+)∶n(Al3+)=1∶1 时,碳酸钙形貌以纺锤形为主,零星分布少量类球状微粒,如图1b所示;当n(Ca2+)∶n(Al3+)=1∶0.5 时,产生了图 1c 中粒径约 8~10 μm的花球状碳酸钙微粒,局部放大显示其可能由初生纺锤形碳酸钙微晶凝并生长所形成;当钙、铝离子物质的量比进一步增大时,碳酸钙的形貌变得不可控,团聚现象较为严重,图1d中仍可发现少量球形碳酸钙微粒,而在图1e中碳酸钙多以不规则形微粒存在,尺寸较大且粒径分布不均。

图 1 不同 n(Ca2+)∶n(Al3+)下合成 CaCO3的 SEM 照片
图2是当体系浓度不变时(0.25 mol/L),不同钙、铝离子物质的量比时所得碳酸钙的XRD谱图。结果显示,随着钙、铝离子物质的量比不断增大,碳酸钙形貌产生变化,物相也由球霰石逐渐转变为方解石。图 2a、2b、2c 在衍射角 2θ位于 21.02、24.98、27.16、32.86、43.96、51.10、55.88°附近显示出球霰石特征衍射峰,分别对应球霰石的(004)、(110)、(112)、(114)、(300)、(118)和(224)晶面,在其他位置未发现方解石或其他碳酸钙晶型特征衍射峰,说明体系钙、铝离子物质的量比较低时所制备碳酸钙物相为球霰石。图2d则同时出现了方解石和球霰石的特征衍射峰,球霰石特征衍射峰强度衰减严重,在方解石最具特征的(104)晶面衍射峰位置(2θ=29.42°)出现尖锐的衍射,表明该碳酸钙为球霰石和方解石两种物相。

图 2 不同 n(Ca2+)∶n(Al3+)下合成 CaCO3的 XRD 谱图
当碳酸钙物相中只存在方解石和球霰石时,可依据如下公式[9-10]计算出球霰石质量分数为46%。
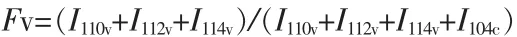
式中:Fv 代表球霰石质量分数;I110v、I112v、I114v和I104c分别代表球霰石(110)、(112)、(114)晶面和方解石(104)晶面衍射峰强度。
图 2e 中在衍射角 2θ为 23.02、29.34、35.88、39.36、43.10、47.46、48.46、57.28°附近出现方解石特征衍射峰,说明当 n(Ca2+)∶n(Al3+)=1∶0.01 时所制备的碳酸钙物相为单一方解石相。
2.2 不同体系浓度对产物形貌的影响
图 3 为 n(Ca2+)∶n(Al3+)=1∶0.5 时,不同体系浓度对碳酸钙结晶形貌的影响。从图3可以看出,在该条件下均有纺锤形碳酸钙微粒形成,随体系浓度降低,纺锤形碳酸钙晶体粒径增大,并出现了较规律的凝并团聚现象。图3c中出现少量类花球状碳酸钙微粒,仍存在较多纺锤形微粒;图3d中则存在较多成熟的花球状碳酸钙微粒,粒径约7~10 μm,周边零星分布尚未成熟的纺锤形微粒。

图3 在不同体系浓度下合成CaCO3的SEM照片
在不同体系浓度下合成CaCO3的XRD谱图见图4。分析其XRD结果显示,该条件下所得碳酸钙样品物相均为球霰石,体系浓度的改变对碳酸钙晶型没有影响。在整个碳酸钙晶体生成过程中,产物最初可能是以无定形碳酸钙的相出现,这些无定形碳酸钙具有比较疏松的内部结构,含有许多水分子聚集体,活性高不稳定,可通过重建结构迅速形成亚稳定的球霰石型碳酸钙并向热力学上最稳定的方解石型碳酸钙转变[11-12],而一定量的氢氧化铝凝胶体抑制了球霰石向方解石的转变过程。
2.3 反应机理讨论
溶液中复分解法制备碳酸钙是利用溶液中的Ca2+与 CO32-反应生成 CaCO3沉淀(式 1),在该反应体系中随着Al3+的引入,Al3+优先发生强烈的双水解反应(式2),生成氢氧化铝胶体,由于体系中存在着大量电解质,胶体迅速凝胶失去流动性,该凝胶体具有很强的吸附作用[13-14],但该凝胶态不稳定,在实验过程中,凝胶态很快又水化形成类似溶液的流动状态。Al3+比例越高水解过程越强烈,所形成凝胶结构可能越复杂。
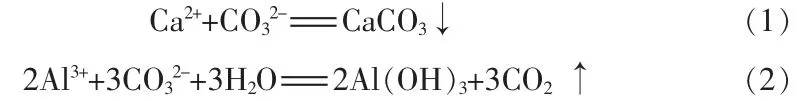
反应过程中显微照片如图5所示。图5a直接进行反应未添加氯化铝,显微镜下显示碳酸钙微粒自由生长;而相同体系浓度加入氯化铝后,反应过程形成的凝胶中,由图5b可见在显微镜同倍率视野中仅存在少量晶体,碳酸钙微粒被限制在相对独立的空间内生长熟化,周围被大量凝胶包覆,而凝胶本身以及凝胶内离子直接影响晶体生长熟化过程。

图5 反应过程中显微照片(放大倍数为450倍)
图6给出了推测的反应机理。随着剧烈双水解过程的发生,可能形成了具有空间网络结构的氢氧化铝凝胶将Ca2+与CO32-限制在局部微区内进行反应,同时在Al3+的双水解过程中消耗了大量的水并产生了CO2气体,部分CO2气体也被束缚在凝胶中,被束缚的CO2以及溶剂中的CO32-提供充足的碳源,溶剂中的离子浓度升高,Ca2+与CO32-在局部形成较高的过饱和度,晶核迅速析出并在凝胶中按照一定方向生长、熟化,后期加入过量的氢氧化钠将氢氧化铝洗脱,得到特定形貌的碳酸钙微粒。
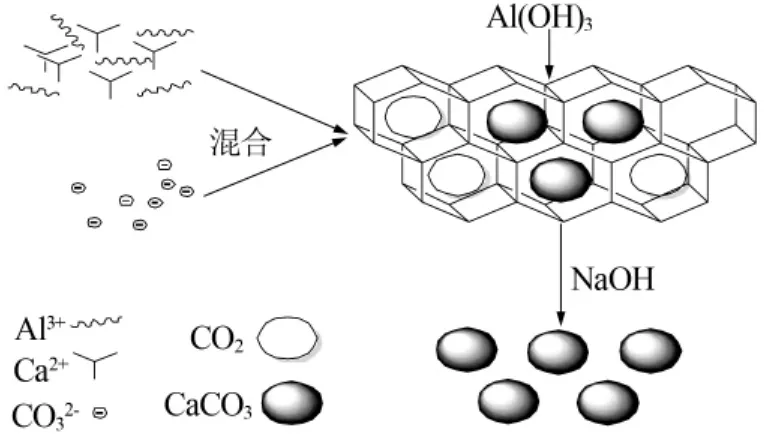
实验过程中,钙、铝混合钙源中氯化铝添加量较多时Al3+浓度较高,经剧烈双水解过程后形成氢氧化铝凝胶体,表面存在大量活性羟基(—OH)对Ca2+起到良好的吸附与络合作用,诱导其生成球霰石型碳酸钙微晶并在微晶间静电力作用下继续聚集生长[15],最终形成了均一的球形碳酸钙微粒;当氯化铝添加量减少时,形成的氢氧化铝凝胶结构空隙相对增大,空隙内初生晶核数目增多,在局部有限空间内,晶粒发生碰撞凝并生长的几率增大;氢氧化铝表面的活性羟基提供了较大的空间位阻,碳酸钙晶体生长取向受到影响,在晶棱或者晶体角顶发生质点堆积的机会较多,生长速度快,形成纺锤形或花球形碳酸钙晶体;混合钙源中氯化铝添加量少于一个定值[n(Ca2+)∶n(Al3+)=1∶0.5]时,反应过程中无法形成氢氧化铝凝胶态结构,弱化了对碳酸钙晶体取向性生长的影响,晶核会长大碰撞凝并成较大的微粒,易发生团聚现象,形貌不可控。
3 结论
在室温条件下保持其他变量恒定,氯化铝的加入对产物形貌产生很大影响,当氯化铝添加量逐渐增加,钙、铝离子物质的量比逐渐减小时,碳酸钙微粒形貌变成球形、纺锤形、花球形,物相均为球霰石;当氯化铝添加量逐渐减少,n (Ca2+)∶n (Al3+)>1∶0.5时,产物形貌无规则且不可控,物相由球霰石变为球霰石和方解石的混合相直至纯方解石相;当氯化铝添加量一定,保持 n(Ca2+)∶n(Al3+)=1∶0.5 时,体系浓度变化对产物的晶型基本无影响,仅粒径随浓度的降低而略增大。
[1]Zhao L,Zhang Y D,Miao Y,et al.Controlled synthesis,characterization and application of hydrophobic calcium carbonate nanoparticles in PVC[J].Powder Technology,2016,288:184-190.
[2]陈银霞,赵改青,王晓波.聚合物控制碳酸钙晶型、形貌的研究[J].化学进展,2009,21(7/8):1619-1625.
[3]黄文艺,马蓝宇,程昊,等.球霰石型碳酸钙微球的制备及在不同溶液中转变过程的研究[J].无机盐工业,2017,49(5):18-21.
[4]Tong H,Ma W T,Wang L L,et al.Control over the crystal phase,shape,size and aggregation of calcium carbonate via a L-aspartic acid inducing process[J].Biomaterials,2004,25:3923-3929.
[5]张群,朱万华,汪绪武,等.超细碳酸钙微球的制备[J].人工晶体学报,2014,43(2):438-442.
[6]丁杨,任洋洋,王丹,等.微乳液体系中形貌可控合成碳酸钙的研究[J].无机盐工业,2017,49(6):33-36.
[7]Takiguchi M,Igarashi K,Masayuki A,et al.Tubular structure agglomerates of calcium carbonate crystals formed on a cation-exchange membrane[J].Crystal Growth and Design,2006,6(7):1611-1614.
[8]Yuan G,Chen X F,Li X,et al.The synthesis of calcium carbonate microparticles with multiple morphologies through self-assembly method[J].Powder Technology,2015,284:253-256.
[9]Lei M,Tang W H,Cao L Z,et al.Effects of poly(sodium 4-styrenesulfonate) on morphology of calcium carbonate particles[J].Journal of Crystal Growth,2006,294(2):358-366.
[10]吴浩然,陈友明,郭源君.在乙二醇-水二元体系中控制合成凸透镜状碳酸钙[J].机械工程材料,2015,39(1):52-57.
[11]AlexandraNavrotsky.Energetic clues to pathways to biomineralization:Precursors,clusters,and nanoparticles[J].Proceedings of the National Academy of Sciences of the United States of America,2004,101(33):12096-12101.
[12]Radha A V,Forbes T Z,Killian C E,et al.Transformation and crystallizationenergeticsof synthetic and biogenic amorphous calcium carbonate[J].Proceedings of the National Academy of Sciences of the United States of America,2010,107(38):16438-16443.
[13]Kawasaki N,Ogata F,Tominaga H.Selective adsorption behavior of phosphate onto aluminum hydroxide gel[J].Journal of Hazardous Materials,2010,181:574-579.
[14]张琪,王清良,李乾,等.Al(OH)3胶体的制备及其对铀的吸附机理[J].化工学报,2014,65(4):1279-1286.
[15]张腾龙,庞艺川,冯杰.多孔碳酸钙微粒的简易制备及其形貌控制[J].高校化学工程学报,2015,29(2):377-381.
Effect of aluminum chloride on crystal morphology of calcium carbonate
Huang Wenyi1,2,3,4,Ma Lanyu1,2,3,4,Cheng Hao1,2,3,4,Wang Chonggang1,2,3,4,Li Lijun1,2,3,4
(1.College of Biological and Chemical Engineering,Guangxi University of Science and Technology,Liuzhou 545006,China;
2.Guangxi Key Laboratory of Green Processing of Sugar Resources,Guangxi University of Science and Technology;3.Collaborative Innovation Center of Guangxi Sugar Industry;4.Key Laboratory for Processing of Sugar Resources of Guangxi Higher Education Institutes,Guangxi University of Science and Technology)
With aluminum chloride and calcium chloride as mixed calcium ion sources and sodium carbonate as carbonate ion sources,calcium carbonate crystals were prepared by double decomposition method in the solution.In the process,a special reaction environment was got with the complex-shaped aluminum hydroxide gel produced by aluminum ions double hydrolysis.And the morphology was affected by the environment.The obtained samples were characterized by X-ray Diffraction(XRD)and field emission scanning electron microscope(FESEM).The results indicated that aluminum chloride had a significant effect on the reaction process and morphology.With different concentration and ratios of calcium ions to aluminum ions,calcium carbonate microparticles with different shapes,such as sphere,flower and spindle,were synthesized in the changing environment of crystallization and growth.
aluminum chloride;aluminum hydroxide;calcium carbonate;morphology
TQ132.32
A
1006-4990(2018)01-0020-04
国家自然基金(31560466);广西自然科学基金(2014GXNSFAA118402);广西科技攻关计划项目(1348018-3);广西高等学校高水平创新团队及卓越学者计划(桂教人[2014]7号);广西科技大学硕士研究生创新项目(GKYC201609)。
2017-07-15
黄文艺(1975— ),男,博士,高级实验师,主要从事纳米材料方面的研究。
李利军
联系方式:hwenyii@tom.com
