甲基睾酮对中华鳑鲏体色的影响
2018-01-06陈小江王建国王权
陈小江+王建国+王权

摘要: 为探索甲基睾酮对中华鳑鲏体色的影响,分别将50日龄和80日龄中华鳑鲏各分6组,每组重复,随机分别养在24个相同规格、容积为0.5 m3的循环水养殖缸内,每缸放养80尾。对照组(Control)投喂不添加甲基睾酮(17α-MT)的基础饲料,处理组(TG1、TG2、TG3、TG4、TG5)分别投喂17α-MT含量为10、20、30、40、50 mg/kg的试验饲料。试验时间56 d,期间对试验鱼的体色及肌肉中所沉积的类胡萝卜素进行比较研究。结果表明,17α-MT添加量40、50 mg/kg 的饲料组对50日龄中华鳑鲏色素沉积明显(P<0.05),80日龄的中华鳑鲏各处理组与对照组差异不显著(P<0.05)。17α-MT添加量在30 mg/kg以上,50日龄的中华鳑鲏体色明显开始起效,效应时间需28 d,80日龄中华鳑鲏各处理组与对照组差异不显著。
关键词: 17α-甲基睾酮;添加量;饲喂时间;中华鳑鲏;类胡萝卜素;体色
中图分类号: S965.819 文献标志码: A
文章编号:1002-1302(2017)22-0192-03
天然雄激素与合成雄激素类物质均属于内分泌干扰物[1]。天然雄激素包括睾酮、雄酮、雄烯二酮等,影响水产动物的内分泌系统,导致部分水产动物雄性比例提高,雌鱼显现雄性副特征、卵巢精巢并生、生殖力降低,还会引起哺乳动物呈现雄性化特点[2]。
合成雄激素如17α-甲基睾酮 ( 17α-MT ),为呈白色或乳白色的结晶性粉末,能促进雄性性器官发育成熟和第二性征的形成和维持。不同浓度的17α-MT对鱼类产生的生物效应因品种而异,低浓度有利于鱼类生长,高浓度易致鱼畸形或死亡,一定剂量的17α-MT还能改变部分鱼类的性别,导致雌鱼雄性化[3]。投饲或埋植雄激素给河鲈(Perca fluviatilis)、褐牙鲆(Paralichthys olivaceus)和石斑鱼(Epinephelus)、虹鳟(Oncorhynchus mykiss)、大西洋鳕(Gadus morhua)数月后,可得到有成熟精液的功能性雄鱼[4-8]。大量激素诱导试验成功并取得良好诱导效果,其中以17α-MT诱导转雄成效最佳[9]。投喂经17α-MT处理后的饲料给红剑尾鱼(Xiphophorous helleri)、珍珠玛丽鱼(Molliensia viliferia)以及红斑马鱼(Brachydanio rerio),發现其体色更鲜艳[10-12]。
中华鳑鲏 (Rhodeus sinensis)是中国著名的原生观赏鱼类之一。20世纪60年代,观赏鱼进入欧洲,被称为中国彩虹。有关中华鳑鲏鱼的研究报道主要集中在生物学习性及分子生物学方面[13-16]。通过在饲料中添加甲基睾酮诱导中华鳑鲏鱼体色改变方面研究还未见报道,本研究采用不同甲基睾酮含量的饲料投喂不同月龄的中华鳑鲏,通过测定鱼体类胡萝卜素总量及体色变化情况来判断其对鳑鲏体色的影响,为开发观赏性中华鳑鲏提供参考。
1 材料与方法
1.1 饲养条件和试验时间
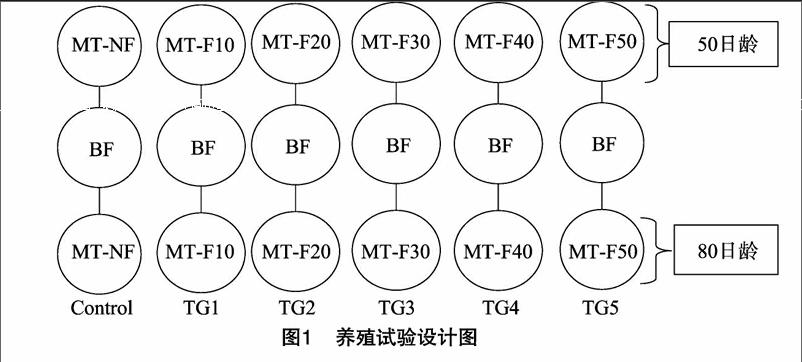
选用江苏农牧科技职业学院自繁中华鳑鲏鱼苗,在试验开始前2个星期挑选体色一致、规格均匀的健康个体,转移进室内循环水养殖系统(图1),选长江水源,水温控制在24~25 ℃,溶氧保持在6.0~8.0 mg/L,pH值7.5~8.0,投喂不含17α-MT的基础饵料。试验开始时50日龄和80日龄中华鳑鲏随机分养在24个相同规格、容积为0.5 m3的循环水养殖缸内,每缸放养80尾。试验共6组,每组重复,分别投喂 17α-MT含量为0 mg/kg(对照组,Control)、10 mg/kg(处理组1,TG1)、20 mg/kg(处理组2,TG2)、30 mg/kg(处理组3,TG3)、40 mg/kg(处理组4,TG4)、50 mg/kg(处理组5,TG5)的试验饲料。每日10:00和17:30定时投饲,投饲率占鱼体质量的3%~5%,试验时间56 d。
1.2 试验饲料的配制
本试验选用鱼粉20.00%,黄粉虫干17.00%,面粉1300%,南瓜粉5.00%,玉米粉20.00%,麦麸10.00%,海带粉2.00%,金盏菊0.45%,啤酒酵母0.50%,磷酸二氢钙100%,甜菜碱0.50%,螺旋藻粉0.50%,红辣椒粉0.50%,大蒜粉0.50%,红虫粉4.00%,鱼油2.00%,大豆油3.00%,防霉剂0.05%,配制成人工配合饲料。17α-MT溶于乙醇配制成1 mg/mL母液,通过再稀释混于配合饲料,按17α-MT含量为0、10、20、30、40、50 mg/kg配制试验饵料。
1.3 药品及仪器
17α-MT,纯度大于98%,购自Sigma公司;丙酮、石油醚、硫酸钠,均为AR级。仪器包括紫外可见分光光度计(UV1902型)、扫描型紫外分光光度计(UV756型)、TE3102S型电子天平、THZ-92B型水浴恒温振荡器。
1.4 样品收集方法
分别在饲喂0、14、28、42、56 d,每组随机取4尾鱼,处死、
除去内脏后置于4 ℃无霜冰箱中干燥24 h。24 h后测定鱼体类胡萝卜素含量并记录增色效果。类胡萝卜素提取方法参照黄永政的方法[12]。
1.5 总类胡萝卜素的计算与数据处理
式中:X为胡萝卜素含量;A为448 nm处最大吸光度;y为提取液使用体积;A%1 cm=2 500(胡萝卜素分子平均吸收系数);g为分析样品质量[17]。采用SPSS 14.0 统计分析,先单因素方差分析,若处理间差异显著,再用Ducans 多重比较进行分析,P<0.05表示差异显著。
2 结果与分析
2.1 17α-MT不同添加量对中华鳑鲏体色的影响endprint
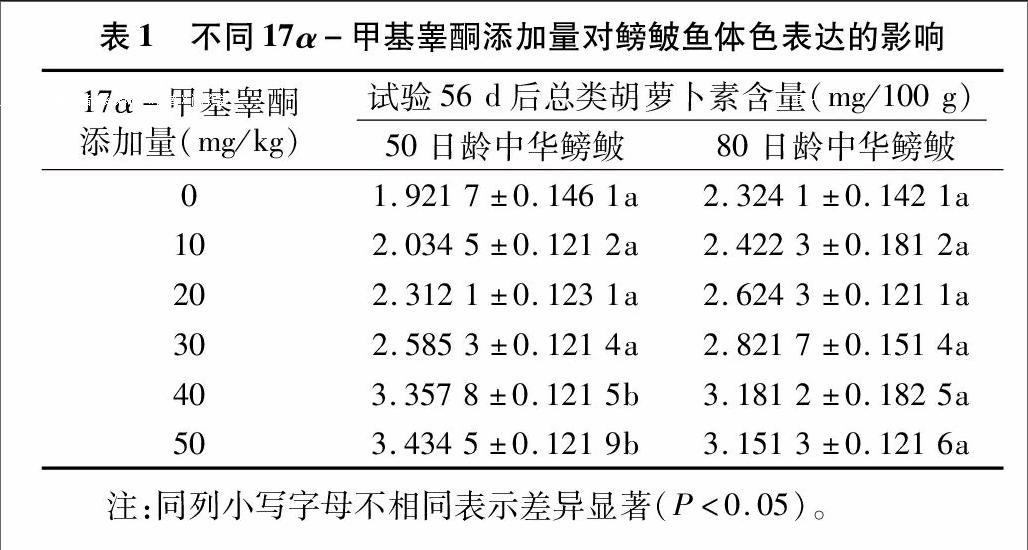
由表1可知,试验56 d,50日龄中华鳑鲏对照组鱼体总类胡萝卜素含量1.921 7±0.146 1,处理1组(10 mg/kg)、处理2组(20 mg/kg)、处理3组(30 mg/kg)类胡萝卜素含量与对照组差异不显著(P>005),而处理4组(40 mg/kg)和处理5组(50 mg/kg)含量较高,分别为(3.357 8±0.121 5)、(3434 5±0.121 9) mg/100 g,显著高于对照组(P<0.05)。80日龄中华鳑鲏鱼体对照组总类胡萝卜素含量最低,为 (2.324 1±0.142 1) mg/100 g,含量最高的是处理组4(40 mg/kg),总类胡萝卜素含量为 (3.181 2±0.182 5) mg/100 g,但各处理组间差异不显著(P>0.05)。
2.2 17α-MT饲喂时间的变化对中华鳑鲏鱼体色的影响
由图1可知,各处理组的总类胡萝卜素含量随饲喂时间的变化不同,处理组与对照组的变化趋势相似,随着养殖时间延长呈现上升趋势,到56 d时,总类胡萝卜素含量达到最高。各处理组在 56 d 时,总类胡萝卜素平均含量分别为2.034 5、2.312 1、2585 3、3.357 8、3.434 5 mg/100 g。处理组4、处理组5与对照组差异明显,其表现为在饲养28 d时,总类胡萝卜素含量快速上升,而后增长放缓。
由图2可知,各处理组总类胡萝卜素含量变化相似,均随着时间的延长逐渐上升,在42 d时总类胡萝卜素含量快速上升,在56 d时总类胡萝卜素平均含量最高,分别为2.422 3、2.6 24 3、2.821 7、3.181 2、3.151 3 mg/100 g,处理组与对照组差异不明显。
3 讨论
3.1 17α-甲基睾酮对中华鳑鲏体色影响的机制
鱼类体色基于皮肤中的色素细胞,神经和内分泌两大系统参与体色调节机制。类胡萝卜素是脂溶性色素,使鱼体表呈现黄、红等各种颜色,具有相当重要的作用。绝大多数鱼类由于无法自身合成,需要通过从食物中摄取,并将其转化成所需类胡萝卜素,进一步沉积于肌肉或体表,使呈现不同颜色[18]。一般雌鱼色素沉积主要集中在卵巢和卵黄,沉积于体表和肌肉的类胡萝卜素较少。雄鱼在性成熟后,色素的沉积主要集中在体表和肌肉,所以雄鱼在繁殖季节一般都较雌鱼艳丽,出现“婚姻色”。
鱼类性腺发育成何种性别,一定程度是受性激素控制,据研究发现,性腺分化未深的鱼类,投飼含17α-MT的饵料,可使其性腺髓质分化为精巢组织而抑制其皮质分化为卵巢组织[19]。在雌鱼转化为雄鱼的过程中,生殖腺的皮质部优先发育为具备功能的卵巢时,髓质部仍有精原囊存在,当给予 17α-MT时,促使精原囊逐渐增殖并分化为各级精细胞,从而出现雌雄嵌合体,随着卵细胞萎缩退化和精巢的发育,成为具有正常生理功能的雄鱼[20]。性腺分化程度越低,雄性化效果越高,更有利于类胡萝卜素的着色效果,这与该试验结果相符。
3.2 17α-甲基睾酮含量及饲喂时间对中华鳑鲏鱼体色的影响
本试验研究结果显示,试验56 d,17α-MT含量40、50 mg/kg 的饲料组对50日龄中华鳑鲏的色素量沉积明显,但对80日龄中华鳑鲏色素沉积量不明显。李云等在饲料中添加10 mg/kg 17α-MT对3月龄红剑尾鱼和5月龄珍珠玛丽鱼进行体色影响试验,结果显示3月龄增色效果均好于5月龄[10]。黄永政在饲料中添加10~50 mg/kg 17α-MT对1月龄红斑马鱼和3月龄红斑马鱼进行体色影响试验,结果显示1月龄增色效果好于3月龄,性腺分化程度越低,其增色效果越好[2],本试验结果与之相符。
不同浓度的17α-MT对各种鱼类有不同的生物学效应,12.5 mg/kg 17α-MT可诱导赤点石斑鱼完全性逆转[21];低浓度17α-MT (1~10 mg/kg)影响鲤鱼生长及性逆转[22]。本次试验17α-MT浓度40、50 mg/kg对50日龄的增色效果明显。17α-MT被鱼类摄入后,表现出效应时间,效应时间与17α-MT的添加量及鱼类性腺发育程度有关。本试验中,从总类胡萝卜素含量变化,可以看出17α-MT药效的变化,50日龄中华鳑鲏在28 d时,17α-MT添加量在30mg/kg以上明显开始起效,持续增色直至试验结束;80日龄中华鳑鲏各处理组差异不显著,效应时间无法考证。总的来说,17α-MT作用于50日龄中华鳑鲏相对80日龄中华鳑鲏增色效果好,投喂时间越早,性腺分化程度越低,甲基睾酮起作用时间越早,增色效果越好。
参考文献:
[1] Lee L S,Carmosini N,Sasman S A,et al. Agricultural contributions of antimicrobials and hormones on soils and water quanlity[J]. Advances in Agronomy,2007,93: 2-67.
[2]Zheng W,Yates S R,Bradford S A. Analysis of steroid hormones in a typical dairy waste disposal system[J]. Environmental Science and Technology,2008,42(2): 530-535.
[3]Zhang L H,Zhang W M,Lin H R. Effects of 4-androstene-3,17-dine and 17α-methyl-testosterone on testosterone and 17α-estradiol levels in the serum of Anguilla japonica[J]. Journal of Fisheries of China,2001,25(2): 107-111.endprint
[4]Rougeot C,Jacob B S,Kestemont P,et al. Sex control and sex determinism study in Eurasian perch,Perca fluviatilis,by use of hormonally sex-reverses male breeders[J]. Aquaculture,2002,211(1/2/3/4): 81-89.
[5]Kitano T,Takamune K,Nagahama Y,et al. Aromatase inhibitor and 17α-methyltestosterone cause sex-reversal from genetical females to phenotypic males and suppression of P450 aromatase gene expression in Japanese flounder (Paralichthys olivaceus)[J]. Molecular Reproduction and Development,2000,56(1): 1-5.
[6]Glamuzina B,Glavic N,Skaramuca B,et al. Induced sex reversal of dusky grouper,Epinephelus marginatus (Lowe)[J]. Aquaculture Research,1998,29(8): 563-567.
[7]Atar H H,Bekcan S,Dogankaya L. Effects of different hormones on sex reversal of rainbow trout (Oncorhynchus mykiss Walbaum) and production of all-female populations[J]. Biotechnology & Biotechnological Equipment,2009,23(4): 1509-1514.
[8]Haugen T,Andersson E,Norberg B,et al. The production of hermaphrodites of Atlantic cod (Gadus morhua) by masculinization with orally administered 17-alpha-methyltestosterone,and subsequent production of all-female cod populations[J]. Aquaculture,2011,311(1/2/3/4): 248-254.
[9]Pandian T J,Sheela S G. Hormonal induction of sex reversal in fish[J]. Aquaculture,1995,138(1/2/3/4): 1-22.
[10] Li Y,Li Y W,Xiang X,et al. The effects of carotenoid and 17α-MT on the colour of ornamental fishes[J]. Journal of Southwest Agricultural University,1999,21(3): 270-273.
[11]Zhou X H,Xiang X,Wang J W. A preliminary study on the effects of methyltestosterone on sexreversal and body colour in sailfin molly and red sword-tall[J]. Fisheriesence and Technology Information,2000,27(3):99-101. [HJ1.7mm]
[12]黃永政. 17α-甲基睾酮与类胡萝卜素对观赏鱼体色影响的研究[M]. 重庆:西南大学,2008.
[13]Pateman-jones C,Rasotto M B,Reichard M,et al. Variation in male reproductive traits among three bitterling fishes(Acheilognathinae:Cyprinidae)in relation to the mating system[J]. Biological Journal of the Linnean Society,2011,103(3): 622-632.
[14]沈建忠. 中华鳑鮍Rhodeus sinensis繁殖习性的初步观察[J]. 华中农业大学学报,2000,19(5):494-496.
[15]曾 燏,刘焕章,沈建忠. 鳑鲏鱼类产卵时对河蚌鳃不同位置的选择[J]. 动物学报,2006,52(2):272-278.
[16]Yang X,Ma Z,Xie L,et al. Complete mitochondrial genome of the Chinese bitterling Rhodeus sinensis (Cypriniformes: Cyprinidae)[J]. Mitochondrial DNA,2015,26(4): 647-648.
[17]高桂珍,伍晓明,陆光远,等. 油菜种子类胡萝卜素总量测定方法的研究[J]. 植物遗传资源学报,2005,6(4):414-417.
[18]崔 培,姜志强,崔宽宽. 类胡萝卜素对鱼类功能的作用及影响鱼类着色效果的因素[J]. 天津水产,2012(1):4-9.
[19]曹丽琴. 红罗非鱼单性化试验研究[J]. 水产学报,1994,18(1):75-79.
[20]郑曙明,陈章宝. 甲基睾酮对孔雀鱼玛丽鱼性逆转的研究[J]. 四川动物,1997,16(4):183-185.
[21]方永强,林秋明,齐 襄. 17α-甲基睾丸酮对赤点石斑鱼性逆转的影响[J]. 水产学报,1992,16(2):171-174.
[22]Hulak M,Paroulek M,Simek P,et al. Water polluted by 17 alpha-methyltestosterone provides successful male sex inversion of common carp (Cyprinus carpio L.) from gynogenetic offspring[J]. Journal of Applied Ichthyology,2008,24(6): 707-710.endprint
