某院2016年ICU与普通病房铜绿假单胞菌耐药性对比分析
2018-01-04邹明祥王海晨黄紫嫣胡咏梅刘文恩
税 剑, 邹明祥,李 军, 王海晨, 黄紫嫣, 胡咏梅, 刘文恩
(中南大学湘雅医院,湖南 长沙 410008)
·论著·
某院2016年ICU与普通病房铜绿假单胞菌耐药性对比分析
税 剑, 邹明祥,李 军, 王海晨, 黄紫嫣, 胡咏梅, 刘文恩
(中南大学湘雅医院,湖南 长沙 410008)
目的了解某院2016年重症监护病房(ICU)与普通病房铜绿假单胞菌分布状况及其耐药性,为临床合理使用抗菌药物提供科学依据。方法采用VITEK 2 Compact 全自动微生物分析系统对该院2016年临床分离菌株进行鉴定及药敏试验, 比较ICU与普通病房铜绿假单胞菌耐药性的差异。结果ICU与普通病房送检标本均以痰为主,分别占78.7%、66.5%。ICU铜绿假单胞菌的检出率(11.7%)与普通病房(11.0%)比较,差异无统计学意义(P>0.05)。ICU检出的铜绿假单胞菌对氨曲南耐药率最高,达73.8% ,对哌拉西林/他唑巴坦、头孢哌酮/舒巴坦、头孢他啶、亚胺培南、美罗培南的耐药率也高达50%以上;普通病房检出的铜绿假单胞菌对氨曲南耐药率最高,达59.6%,其次是哌拉西林/他唑巴坦、亚胺培南,分别为48.0%、44.3%;ICU铜绿假单胞菌对被检测的12种抗菌药物耐药率均高于普通病房(P<0.05)。结论ICU铜绿假单胞菌的耐药率高于普通病房,应引起临床高度重视;临床上治疗其感染时,应根据药敏试验结果合理选用抗菌药物。
ICU; 普通病房; 感染; 铜绿假单胞菌; 抗药性,微生物; 耐药性
铜绿假单胞菌是医院感染常见的条件致病菌,属于革兰阴性非发酵杆菌,广泛分布于空气、水,以及正常人的皮肤、呼吸道、肠道等处[1-3]。该菌生长条件要求低,繁殖能力强,且容易形成生物膜,对多种常用抗菌药物天然耐药,加上近年来广谱抗菌药物的使用,使其感染和耐药性日趋严重,尤其多重耐药铜绿假单胞菌的增多使临床抗感染变得更加棘手。重症监护病房(intensive care unit, ICU)患者病情严重,通常需要使用呼吸机、留置导尿管、静脉插管等有创性操作维持生命体征。有创操作破坏了机体的保护屏障,使患者更容易感染铜绿假单胞菌。欧美以及我国感染病原学调查发现,铜绿假单胞菌感染率在ICU已居前列[4-5]。了解ICU与普通病房铜绿假单胞菌感染分布以及耐药性差异,对指导临床合理用药,有效控制铜绿假单胞菌感染具有重要意义。本研究回顾性分析2016年中南大学湘雅医院ICU与普通病房铜绿假单胞菌感染分布状况,以及其耐药性差异,现将结果报告如下。
1 材料与方法
1.1 菌株来源 铜绿假单胞菌分离自中南大学湘雅医院2016年ICU和普通病房送检的各类标本,包括痰、支气管分泌物、支气管肺泡灌洗液、血、脑脊液、引流液、尿等。ICU包括神内ICU、神外ICU、心胸外ICU、呼吸内科ICU、综合ICU、急诊ICU;普通病房包括消化内科、呼吸内科、肾内科、内分泌科、普通外科、神经外科等临床非ICU病房。
1.2 仪器与试剂 VITEK 2 Compact 全自动微生物分析系统由法国梅里埃公司生产,AST-GN13药敏卡由法国梅里埃公司提供。头孢哌酮/舒巴坦(CSL)、美罗培南(MEM)药敏纸片为英国Oxoid公司产品,M-H平板购自江门市凯林贸易有限公司。
1.3 菌株鉴定及药敏试验 所有菌株培养、分离参照《全国临床检验操作规程》第四版进行,采用法国梅里埃公司生产的VITEK 2 Compact全自动微生物分析仪进行菌株鉴定及药敏试验,检测抗菌药物包括:哌拉西林/他唑巴坦(TZP)、CSL、头孢他啶(CAZ)、头孢比肟(FEP)、氨曲南(ATM)、亚胺培南(IPM)、MEM、阿米卡星(AMK)、妥布霉素(TOB)、庆大霉素(GEN)、环丙沙星(CIP)、左氧氟沙星(LVX),其中CSL、MEM药敏试验采用K-B法。药敏结果判定参照美国临床实验室标准化协会(CLSI)2015年标准[6]进行,其中CSL药敏折点参照头孢哌酮的标准。质控菌株为ATCC 27853,购自国家卫生计生委临床检验中心。
1.4 痰标本纳入标准 痰标本培养前先涂片染色镜检,白细胞与上皮细胞比值大于2.5时为合格痰,否则为不合格痰,需要重新留取痰标本送检。
1.5 统计分析 ICU与普通病房铜绿假单胞菌耐药率比较应用SPSS 21.0软件进行χ2检验,P≤0.05为差异具有统计学意义。
2 结果
2.1 ICU与普通病房铜绿假单胞菌感染分布 各种标本中共分离1 832株铜绿假单胞菌,其中ICU 581株,普通病房1 251株,各标本构成比见表1。其中ICU呼吸道标本占比最高,痰与支气管分泌物分别达78.7%、7.7% ;普通病房痰、支气管分泌物、创面分泌物占比居前三位,分别达66.5%、8.0%、6.2%。
表1ICU与普通病房铜绿假单胞菌的标本分布
Table1Specimen distribution ofP.aeruginosain ICUs and general wards
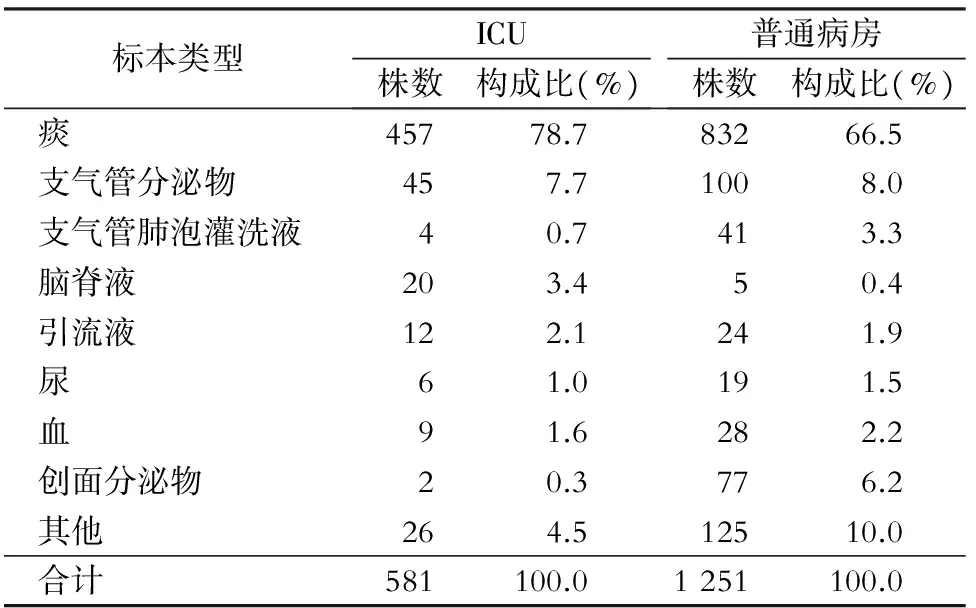
标本类型ICU株数构成比(%)普通病房株数构成比(%)痰45778.783266.5支气管分泌物457.71008.0支气管肺泡灌洗液40.7413.3脑脊液203.450.4引流液122.1241.9尿61.0191.5血91.6282.2创面分泌物20.3776.2其他264.512510.0合计581100.01251100.0
2.2 ICU与普通病房患者铜绿假单胞菌检出情况 2016年ICU共检出4 961株病原菌,其中铜绿假单胞菌581株,占11.7%。普通病房共检出11 351株病原菌,其中铜绿假单胞菌1 251株,占11.0%。ICU铜绿假单胞菌检出率与普通病房比较差异无统计学意义(χ2=1.65,P=0.199)。
2.3 铜绿假单胞菌对常用抗菌药物的药敏结果 2016年全院检出的铜绿假单胞菌对单环β-内酰胺类抗生素ATM、碳青霉烯类抗生素IPM和MEM具有较高的耐药性,耐药率分别高达44.2%、38.7%、42.9%;对氨基糖苷类抗生素保持较高的敏感性,敏感率均在70%以上;对TZP、CLS的耐药率均在20%左右,但其中介率较高,均达到20%以上,具体药敏结果见表2。
2.4 ICU与普通病房铜绿假单胞菌的耐药性比较 ICU检出的铜绿假单胞菌对ATM耐药率最高,高达73.8% ,对TZP、CSL、CAZ、IPM、MEM的耐药率也高达50%以上。普通病房检出的铜绿假单胞菌对ATM的耐药率最高,达59.6%,其次是TZP、IPM,分别为48.0%、44.3%。ICU铜绿假单胞菌对被检测的12种抗菌药物耐药率均高于普通病房,差异均具有统计学意义(P<0.05)。见表3。
表22016年全院铜绿假单胞菌的药敏结果
Table2Antimicrobial susceptibility testing result ofP.aeruginosain the whole hospital in 2016
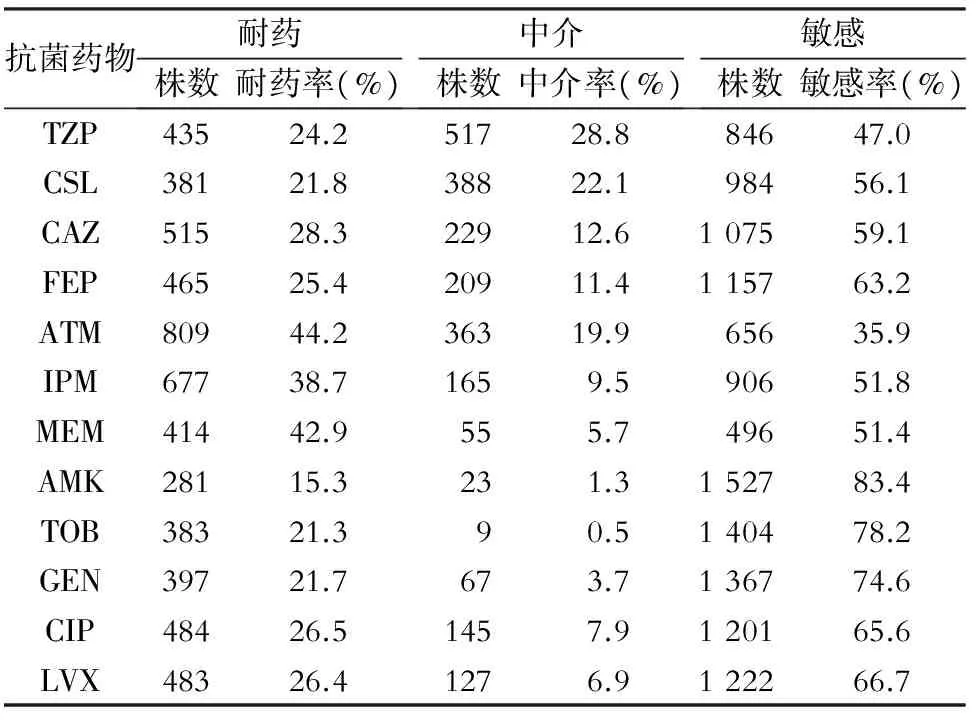
抗菌药物耐药株数耐药率(%)中介株数中介率(%)敏感株数敏感率(%)TZP43524.251728.884647.0CSL38121.838822.198456.1CAZ51528.322912.6107559.1FEP46525.420911.4115763.2ATM80944.236319.965635.9IPM67738.71659.590651.8MEM41442.9555.749651.4AMK28115.3231.3152783.4TOB38321.390.5140478.2GEN39721.7673.7136774.6CIP48426.51457.9120165.6LVX48326.41276.9122266.7
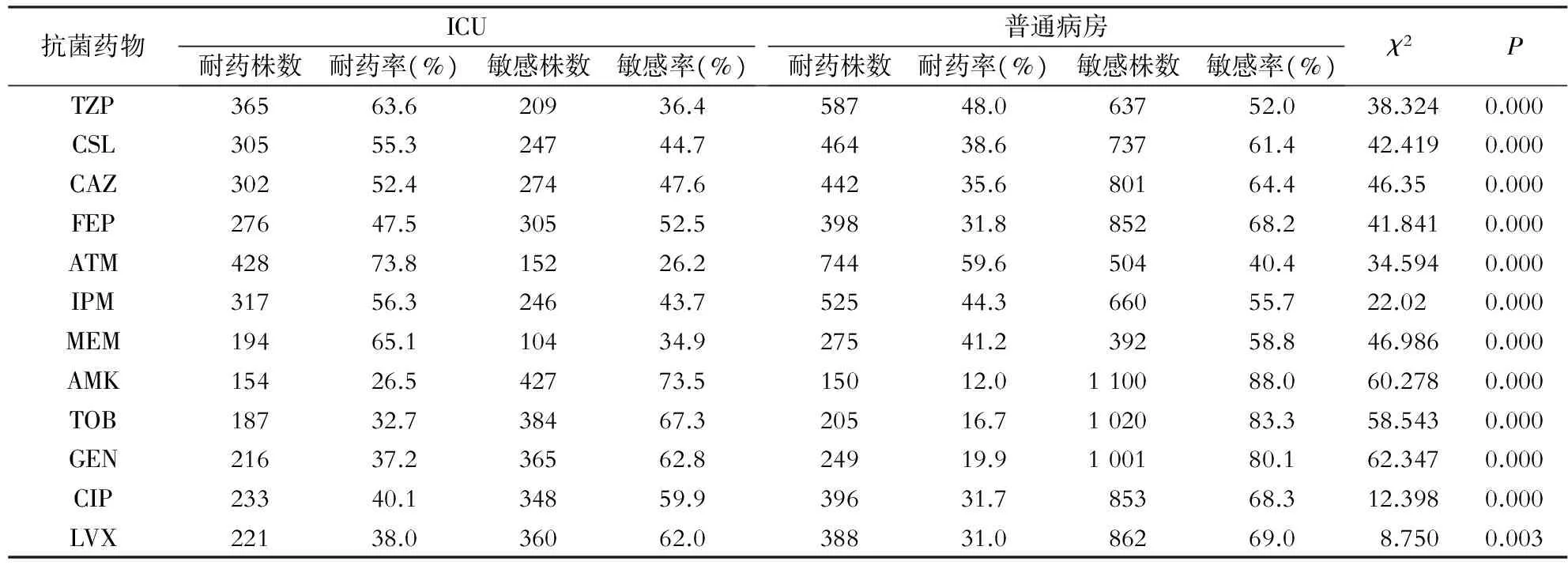
表3 ICU与普通病房铜绿假单胞菌的药敏结果比较
注:中介计入耐药中
3 讨论
目前,铜绿假单胞菌感染已成为各种感染中最严重的的问题之一[7-8]。由于抗菌药物的不规范使用,导致铜绿假单胞菌对越来越多的抗菌药物产生耐药性,使得临床抗感染治疗面临严峻挑战。本调查显示,2016年本院铜绿假单胞菌主要来自痰标本,与近年相关报道[9-10]一致。ICU分离的病原菌中铜绿假单胞菌检出率与普通病房相比,差异无统计学意义,说明铜绿假单胞菌在各类病房中均为重要病原菌。
本组结果显示,2016年本院检出的铜绿假单胞菌对ATM、碳青霉烯类抗生素具有较高的耐药性,对氨基糖苷类抗生素保持较高的敏感性,与王斌华等[11]报道相似;对TZP、CSL的耐药率相对较低,但其中介率达到了20%以上。临床应及时送检合格标本以寻找病原学依据,在未获得药敏试验结果前,可以根据本院流行病学数据进行经验治疗,等药敏结果出来后改为目标治疗。对于泛耐药铜绿假单胞菌感染的治疗,需要结合药敏试验结果,尤其是药物的最低抑菌浓度值进行联合用药。临床上曾经将氨基糖苷类抗生素联合β-内酰胺类抗生素作为铜绿假单胞菌感染的一线治疗方案,但并非所有两类抗生素组合均能取得较好的治疗效果,因此,应密切关注疗效,及时调整治疗方案。一般认为,铜绿假单胞菌对碳青霉烯类抗生素耐药常与该菌产生碳青霉烯酶、外膜蛋白(OprD2)缺失或改变有关[12]。文献[13]报道,临床分离铜绿假单胞菌对碳青霉烯类抗生素的耐药率与该类药物的使用量呈线性正相关,限制使用碳青霉烯类抗生素较未限制使用此类药物,临床分离铜绿假单胞菌的耐药率显著降低。本研究中铜绿假单胞菌对碳青霉烯类抗生素的耐药率较高,可能与抗感染过程使用此类药物较多有关。近年来β-内酰胺类抗生素与β-内酰胺酶抑制剂复合药物在抗感染过程发挥了重要作用,而本研究中此类药物的耐药率虽然不高,但其中介率已达20%,因此,临床上应引起重视,合理使用该类药物,降低病原菌对此类药物的选择压力,延缓耐药性产生。
铜绿假单胞菌的耐药机制比较复杂,耐药酶的产生、外膜蛋白OprD的缺失或改变、主动外排泵作用、抗菌药物作用靶点的改变、生物膜形成等均可导致铜绿假单胞菌耐药。Karlowsky等[14]回顾性分析1998—2001年美国65所医院ICU与非ICU分离的76 211株铜绿假单胞菌对10种常见抗菌药物的耐药性,发现ICU分离菌株对CAZ、FEP、GEN、IPM、MEM、TZP、替卡西林/克拉维酸的耐药率高出非ICU分离菌株1.0%~7.3%,对AMK、CIP、LVX的耐药率低于非ICU分离的菌株。本组ICU检出的铜绿假单胞菌对常用抗菌药物的耐药率均比普通病房高。ICU是综合性医院重要的抢救单元,收治的患者病情严重、基础疾病复杂、住院时间长、免疫力低下。患者入院后,通常会使用大量广谱抗菌药物进行抗感染治疗,诱导一系列耐药机制产生,从而导致铜绿假单胞菌对抗菌药物的敏感性降低;另外,ICU患者通常需要进行一系列有创性操作挽救患者的生命,增加了铜绿假单胞菌定植患者体内的机会[15-18],加上此时患者抵抗力弱,定植在静脉导管等生物材料以及机体的铜绿假单胞菌容易形成生物膜,从而导致抗生素的敏感性下降。因此,应尽量减少或避免铜绿假单胞菌感染的危险因素,如ICU的住院时间,机械通气、静脉导管以及导尿管的使用等侵入性操作,不合理使用广谱抗菌药物等。同时应做好对ICU、呼吸机等医疗设备的消毒工作,医务人员应重视手卫生,切断传播途径,防止发生交叉感染。
综上所述,2016年我院ICU与普通病房铜绿假单胞菌耐药情况不容乐观,应加强医院感染管理,合理使用抗菌药物,做好常见病原菌耐药性监测工作,有效控制感染。
[1] Kayabas U, Bayraktar M, Otlu B, et al. An outbreak ofPseudomonasaeruginosabecause of inadequate disinfection procedures in a urology unit: a pulsed-field gel electrophoresis-based epidemiologic study[J]. Am J Infect control, 2008, 36(1): 33-38.
[2] 余昊,杨虹.673例铜绿假单胞菌感染的分布特点及耐药性分析[J].国际检验医学杂志,2016,37(16):2327-2329.
[3] 杨妮娜,张翠英,栗志平. 681株铜绿假单胞菌感染的临床分布及耐药性分析[J].长治医学院学报,2016,30(3):219-222.
[4] 黄健云,王前,陈光辉,等.多药耐药铜绿假单胞菌感染的调查分析[J].中华医院感染学杂志,2013,23(23):5828-5830.
[5] Bendiak GN, Ratjen F. The approach toPseudomonasaeruginosain cystic fibrosis[J]. Semin Respir Crit Care Med, 2009, 30(5): 587-595.
[6] Clinical and Laboratory Standards Institute. Performance standards for antimicrobial susceptibility testing[S]. CLSI, M100-S25, 2015.
[7] 王海兴,李建国,项辉,等. 2092株铜绿假单胞菌医院感染的临床分布及耐药性分析[J].中华医院感染学杂志,2013,23(1):184-186.
[8] 龙彦,李彩琴. 2014~2015年某院铜绿假单胞菌临床分布及耐药性分析[J].国际检验医学杂志,2016,37(20):2903-2904.
[9] 梁小英.ICU与非ICU铜绿假单胞菌感染的耐药性比较[J].中国当代医药,2011,18(33):78-79.
[10] 王顺.ICU医院获得性感染铜绿假单胞菌的分布及耐药性分析[J].中华医院感染学杂志,2009,19(18):2483-2484.
[11] 王斌华,陈彩林,王培红,等.ICU与非ICU铜绿假单胞菌的耐药性分析[J].抗感染药学,2015,12(5):693-696.
[12] Zavascki AP, Carvalhaes CG, Picão RC, et al. Multidrug-resistantPseudomonasaeruginosaandAcinetobacterbaumannii: resistance mechanisms and implications for therapy[J]. Expert Rev Anti Infect Ther, 2010, 8(1): 71-93.
[13] Pakyz AL, Oinonen M, Polk RE. Relationship of carbapenem restriction in 22 university teaching hospitals to carbapenem use and carbapenem-resistantPseudomonasaeruginosa[J]. Antimicrob Agents Chemother, 2009, 53(5): 1983-1986.
[14] Karlowsky JA, Draghi DC, Jones ME, et al. Surveillance for antimicrobial susceptibility among clinical isolates ofPseudomonasaeruginosaandAcinetobacterbaumanniifrom hospitalized patients in the United States, 1998 to 2001[J]. Antimicrob Agents Chemother, 2003, 47(5): 1681-1688.
[15] Gikas A, Roumbelaki M, Bagatzouni-Pieridou D, et al. Device-associated infections in the intensive care units of Cyprus: results of the first national incidence study[J]. Infection, 2010, 38(3): 165-171.
[16] Mitharwal SM, Yaddanapudi S, Bhardwaj N, et al. Intensive care unit-acquired infections in a tertiary care hospital: An epidemiologic survey and influence on patient outcomes[J]. Am J Infect Control, 2016, 44(7): e113-e117.
[17] Riou M, Carbonnelle S, Avrain L, et al. In vivo development of antimicrobial resistance inPseudomonasaeruginosastrains isolated from the lower respiratory tract of intensive care unit patients with nosocomial pneumonia and receiving antipseudomonal therapy[J]. Int J Antimicrob Agents, 2010, 36(6): 513-522.
[18] Tumbarello M, De Pascale G, Trecarichi EM, et al. Clinical outcomes ofPseudomonasaeruginosapneumonia in intensive care unit patients[J]. Intensive Care Med, 2013, 39(4): 682-692.
ComparisonofantimicrobialresistanceofPseudomonasaeruginosafromintensivecareunitsandgeneralwardsinahospitalin2016
SHUIJian,ZOUMing-xiang,LIJun,WANGHai-chen,HUANGZi-yan,HUYong-mei,LIUWen-en
(XiangyaHospital,CentralSouthUniversity,Changsha410008,China)
ObjectiveTo investigate the distribution and antimicrobial resistance ofPseudomonasaeruginosa(P.aeruginosa) from intensive care units(ICUs) and general wards of a hospital, and provide scientific basis for rational use of antimicrobial agents in clinic.MethodsIdentification and antimicrobial susceptibility testing of clinically isolated bacteria in this hospital in 2016 were performed by VITEK 2 Compact automatic microbial analysis system, difference in antimicrobial resistance ofP.aeruginosabetween ICUs and general wards was compared.ResultsThe tested specimens were mainly sputum in both ICUs and general wards, accounting for 78.7% and 66.5% respectively. There was no significant difference in the isolation rate ofP.aeruginosabetween ICUs and general wards (11.7% vs 11.0%,P>0.05).P.aeruginosaisolated from ICUs had the highest resistance rate to aztreonam (73.8%),resistance rates to piperacillin/tazobactam, cefoperazone/sulbactam, ceftazidime, imipenem, and meropenem were all up to more than 50%;P.aeruginosadetected in general wards had the highest resistance rate to aztreonam(59.6%), followed by piperacillin/tazobactam and imipenem, accounting for 48.0% and 44.3% respectively;resistance rates ofP.aeruginosaisolated from ICUs to 12 kinds of antimicrobial agents were all higher than those of general wards(P<0.05).ConclusionResistance rate ofP.aeruginosafrom ICUs is higher than that in general wards, which should be paid attention, antimicrobial agents should be selected for clinical treatment of infection according to the results of antimicrobial susceptibility testing result.
intensive care unit; general ward; infection;Pseudomonasaeruginosa; drug resistance; microbial
[Chin J Infect Control,2018,17(1):6-9]
2017-05-20
湖南省自然科学基金(14JJ7003);湖南省发改委(湘发改高技[2012]1493号;湘发改投资[2014]658号)
税剑(1986-),男(土家族),湖北省恩施市人,硕士研究生,主要从事细菌耐药机制研究。
邹明祥 E-mail:zoumingxiang@126.com
10.3969/j.issn.1671-9638.2018.01.002
R181.3+2
A
1671-9638(2018)01-0006-04
文细毛)
