内皮抑素对缺氧条件下脉络膜视网膜内皮细胞增殖、迁移及管腔形成的作用
2017-12-27
·实验研究·
内皮抑素对缺氧条件下脉络膜视网膜内皮细胞增殖、迁移及管腔形成的作用
谢坤鹏刘平王新杜军辉
目的内皮抑素是一种重要的血管生成抑制剂,本研究旨在研究内皮抑素对缺氧条件下培养的猴脉络膜、视网膜内皮细胞(RF/6A)增殖、迁移和管腔形成的作用。方法取生长状况良好的RF/6A细胞用于用于实验,将细胞随机分为缺氧组、缺氧+不同浓度重组人内皮抑素组、对照组。培养24 h后采用MTT法检测细胞增殖,细胞划痕法检测细胞迁移,基质胶法检测管腔形成。结果缺氧24 h,细胞增殖活力、迁移和管腔形成均明显增加,使用0.5~10 μg/ml重组人内皮抑素预处理可明显抑制缺氧诱导的细胞增殖、迁移和管腔形成(P<0.05)。内皮抑素的上述抑制作用均随其浓度的升高而增强。结论内皮抑素能够明显抑制缺氧诱导的RF/6A细胞的增殖、迁移和管腔形成,提示内皮抑素对脉络膜和视网膜新生血管具有一定的抑制作用。
内皮抑素;缺氧;新生血管;脉络膜/视网膜内皮细胞
血管生成(angiogenesis)是一个复杂的过程,涉及血管生成因子的分泌,蛋白水解酶的分泌和激活,细胞外基质降解、内皮细胞活化、迁移、增殖、生长、出芽和管腔形成,新的血管分化和成熟以及血管网的重塑[1]。在血管生成过程中起重要作用的刺激因子和抑制因子间发生失衡,就会导致新生血管的生长。眼部新生血管的形成可见于多种眼部疾病中,如脉络膜新生血管(CNV)、糖尿病视网膜病变(diabetic retinopathy,DR)、视网膜中央/分支静脉阻塞,早产儿视网膜病变等(retinopathy of prematurity,ROP),出血、渗出及增生等为其特点,导致眼的正常结构破坏,严重危害视觉功能,极大影响患者生存质量,且波及的年龄范围较为广泛。
寻找有效治疗新生血管的药物,是近年来眼科十分关注的领域。内皮抑素是一种内源性新生血管抑制因子,相关细胞和动物实验研究表明,它能抑制血管内皮细胞的增殖和迁移,可以减轻视网膜、脉络膜的新生血管生成,有望为新生血管性眼病患者带来希望[2]。缺氧是病理性新生血管生成的重要诱因,本研究以猴视网膜/脉络膜内皮细胞(RF/6A细胞)为研究对象,观察内皮抑素对缺氧条件下细胞增殖、迁移和管腔形成的影响,以期为进一步研究内皮抑素在脉络膜和视网膜新生血管形成中的作用提供基础。
资料与方法
一、主要实验仪器和药品试剂
由中国科学院典型生化培养物保藏委员会附属细胞库储备提供的RF/6A细胞系;由美国Gibco公司制备提供的EMEM型培养液;由中国杭州四季青生物工程材料有限公司生产提供的胎牛血清;由美国Sigma生物科技公司制备并提供的MTT试剂盒;由美国Sigma生物科技公司生产的基质胶Matrigel;由中国南京先声制药有限公司生产的商品名为恩度的重组人内皮抑制素;由日本Olympus公司制造的型号为 IX-50的倒置显微镜设备;由美国Bio-Rad公司制造的680型自动酶标仪设备。
二、主要技术处理方法
1. 细胞样本培养处理和分组处理:将遵照临床检验操作技术规程采集获取的RF/6A细胞,放置在温度参数水平为37 ℃、包含有浓度为5%CO2气体、以及湿度参数水平为95%的培养箱之中,在富含浓度比例为10%胎牛血清物质的EMEM培养基的生化环境条件下运用常规实验技术方法进行培养处置。在持续培养时间达到3~4 d条件下,培养瓶瓶底呈现细胞铺满现象,遵照1:3的数值比例实施传代处置。每天运用显微镜动态观察细胞生长状态,并选取处在对数生长期,具备良好生长形态特征的细胞样本开展后续的实验过程。将选作实验检验样本的细胞随机划分为对照组、缺氧组(其培养气体环境物质构成结构比例为1%O2,5%CO2,94% N2)、缺氧气体培养环境结合差异化浓度的重组内皮抑素组(在细胞接种培养基中分别加入浓度为0.5、1,以及10 μg/ml等浓度水平的重组内皮抑素药物完成预处理后,将其放置到厌氧培养箱中等候开展后续的培养处置技术过程)。
2. 检验样本细胞的增殖处置:选取和应用MTT实验技术方法针对检验样本细胞的增殖能力实施检测处置。重点选取处于对数生长期的细胞作为检验样本,通过适当实验处理方法丢弃上层清液,在运用浓度水平为2.5 g/l的胰蛋白酶实施消化处置基础上,向其中加入包含有10%胎牛血清物质的DMEM培养液,继而制备形成细胞浓度参数水平为5×104个/ml的细胞培养悬液。抽取体积为200 μl的细胞培养悬液在96孔板中实施接种处置,在实施持续时间为24 h孵育处置条件下将原培养丢弃,并参照上文所述的实验技术方法将其等分为4组,并具体为每个实验分组结构设置6个复孔。接续遵照不同分组的特征添加彼此成分不同的细胞培养液,随即将细胞培养板放置在温度参数为37 ℃、含有5%CO2气体物质,以及具备饱和湿度环境的生化培养箱中严格遵照相关实验技术规程实施培养处置。在持续培养时间达到24 h条件,向培养板中的每个培养孔中添加浓度为5 mg/ml的MTT溶液20 μl,并放置在原有环境的培养箱中继续实施持续时间为4 h的孵育处理,之后将各个培养孔中的培养液物质彻底丢弃,并接续向每个孔洞中接续添加体积为200 μl的DMSO培养液,在持续振荡处置10 min条件下,要确保残余的结晶物实现充分溶解状态。并接续运用由美国Bio-Rad公司制造和出售的680型自动酶标仪设备,在波长参数为570 nm的空间点位具体测定分析每个独立培养孔的吸光度参数值。针对每组细胞实验检验样本重复开3次检验测定,确保实际测定的实验结果具备充分的准确性。
3. 检验样本细胞的迁移处置:选取运用细胞划痕法针对检验样本细胞的迁移能力实施检验处置。将RF/6A检验样本细胞遵照每个培养孔2×105个的细胞悬液浓度参数指标水平在6孔板中实施接种实验技术处置,等候检验样本细胞的贴壁生长过程实现程度达到90%条件下,运用移液枪尖技术构件在细胞培养板之上以垂直空间方向划一条直线,运用PBS实验试剂连续实施3次轻度漂洗处理,彻底清除漂浮细胞群,继而切实建构形成无细胞的“裸区”。遵照上文论述的分组技术方法将待检验细胞等分为4组,分别依次向4组待检验细胞中加入适当体积的所需培养液。针对每组待检验细胞具体设定3个独立平行孔,并基于倒置相差显微镜观察检验技术展开拍照记录技术处理环节,并以此作为0 h时点的参考监测点。在完成上述实验技术处理环节基础上,将细胞培养板放置到温度参数为37 ℃的培养箱实验技术环境中开展持续时间为24 h的孵育处置,并在此基础上再次实施照相检查。运用Photoshop图像处理技术软件具体开展后续的图像分析处理,计算测定具体进入无细胞“裸区”内部待检验细胞样本的总体面积参数水平(像素参数)[8]。上述检验处置技术过程反复实施3次。
4. 细胞管腔形成技术处置过程:运用Matrigel法实验技术方法检测确定待检验细胞样本的血管管腔结构形成状态。将Matrigel胶物质放置在温度参数水平为4 ℃环境条件下实施融化过夜处理,针对96孔细胞培养板和枪头技术组件实施预冷技术处置过程。在超净实验操作工作台环境中,选取96孔细胞培养板,并每个独立的细胞培养孔中缓慢添加体积参数为80 μl液态的Matrigel胶物质,在低速无菌离心技术处置条件下完全除去气泡物质。在37 ℃技术条件下开展持续时间介于30~60 min的孵育处置,并促使Matrigel胶实现凝固技术状态;遵照上文叙述的分组实验处理法顺次添加适当剂量的,包含有浓度参数水平为10%胎牛血清的DMEM培养基,将RF/6A细胞培养液稀释处理浓度为2×105个/ml的细胞培养悬液,并在每组中添加50 μl。在实施持续时间为24 h的孵育处置条件下,运用倒置相差显微镜设备时实施观察检验,随机取5个血管管腔在放大200倍技术条件下实施视野照相处理,针对具体形成的完整管腔进行计数处理,取平均计算值。每组设3个复孔,实验重复3次。

图1 倒置相差显微镜下RF/6A细胞迁移(24 h)代表图(①对照组,②缺氧组)图2 倒置相差显微镜下RF/6A细胞管状结构形成代表图(①对照组,②缺氧组)图3 倒置相差显微镜下RF/6A细胞迁移代表图(24 h)注:①缺氧组,②缺氧+0.5 μg/ml重组人内皮抑素组,③缺氧+1 μg/ml重组人内皮抑素组,④缺氧+10 μg/ml重组人内皮抑素组图4 倒置相差显微镜下RF/6A细胞管状结构形成代表图 注:①缺氧组,②缺氧+0.5 μg/ml重组人内皮抑素组,③缺氧+1 μg/ml重组人内皮抑素组,④缺氧+10 μ g/ml重组人内皮抑素组
三、统计学处理
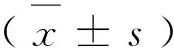
结 果
一、缺氧对RF/6A细胞增殖、迁移及管腔形成能力的影响
MTT结果显示,缺氧条件培养24 h的RF/6A细胞增殖明显强于对照组。两组细胞吸光度值分别为:对照组(0.49±0.01)、缺氧组(0.78±0.05)。统计分析发现,两组间的差异具有统计学意义(P<0.05)。细胞划痕法实验结果显示,培养24 h后,细胞逐渐迁移入细胞划痕区(图1),迁移面积(像素)为对照组(31753±1894)、缺氧组(47286±2310),缺氧组的细胞迁移面积明显大于对照组,组间差异具有统计学意义(P<0.05)。Matrigel实验结果显示,缺氧组细胞管腔形成能力明显强于对照组(图2),两组完整的管腔数分别为对照组(8.5±3.6)个、缺氧组(19.2±1.7)个,组间差异具有统计学意义(P<0.05)。以上提示缺氧对RF/6A细胞增殖、迁移和管腔形成具有促进作用。
二、重组人内皮抑素对RF/6A细胞增殖、迁移及管腔形成能力的影响
MTT结果显示,培养24 h不同分组细胞的吸光度值分别为:缺氧组(0.78±0.05)、缺氧+0.5 μg/ml 重组人内皮抑素组(0.57±0.02)、缺氧+1 μg/ml 重组人内皮抑素组(0.38±0.02)、缺氧+10 μg/ml 重组人内皮抑素组(0.16±0.07)。统计分析发现,四组间吸光度的差异具有统计学意义(P<0.05)。相对于缺氧组,各浓度重组人内皮抑素处理细胞的增殖能力下降,且随着内皮抑素浓度的增加而减弱。
细胞划痕法实验结果显示,培养24 h不同分组RF/6A细胞的迁移面积(像素)分别为:缺氧组(47286±2310)、缺氧+0.5 μg/ml 重组人内皮抑素组(30958±2490)、缺氧+1 μg/ml 重组人内皮抑素组(27346±2335)、缺氧+10 μg/ml 重组人内皮抑素组(12669±1143)。与缺氧组相比,各浓度重组人内皮抑素处理细胞的迁移能力明显降低,高浓度组细胞迁移面积明显小于低浓度组,组间差异具有统计学意义(P<0.05)(图3)。
Matrigel实验结果显示,不同分组RF/6A细胞形成的完整管腔数分别为:缺氧组(19.2±1.7)个、缺氧+0.5 μg/ml 重组人内皮抑素组(12.4±3.1)个、缺氧+1 μg/ml 重组人内皮抑素组(9.8±1.6)个、缺氧+10 μg/ml 重组人内皮抑素组(5.6±1.1)个。与缺氧组相比,各浓度重组人内皮抑素处理细胞的管腔能力明显降低,高浓度组的管腔形成数目明显小于低浓度组,组间差异具有统计学意义(P<0.05)(图4)。
以上实验结果提示,重组人内皮抑素能够明显抑制RF/6A细胞的增殖、迁移和管腔形成能力,抑制血管生成过程,且其抑制能力随着浓度的增加而增强。
讨 论
晚期视网膜和脉络膜新生血管的形成是许多缺氧、缺血性视网膜病变和视神经病变的共同病理改变和临床表现,是患者致盲的主要原因,继发的眼部病变,如玻璃体积血、增生性视网膜病变及视网膜脱离等均可导致严重的视力丧失[3,4]。新生血管的形成是一个多种因子参与其中的复杂过程,如血管内皮生长因子(VEGF)、色素上皮衍生因子(PEDF)、成纤维细胞生长因子(FGF)、转化生长因子(TGF)等。目前,激光,抗新生血管药物和玻璃体切除手术虽然对新生血管有一定的疗效,可在一定程度上延缓病变的进展,但均不可避免有损伤健康组织的风险,并且治疗后容易复发,且少数患者有眼部不良反应发生,故全世界尚未获得完全安全和有效的治疗方法。因此,探索视网膜和脉络膜新生血管的病理机制和开发安全有效的治疗方案已经成为了眼科的重要研究方向。
RF/6A 以一种混合来源的脉络膜-视网膜内皮细胞系,已经被广泛用于脉络膜和视网膜新生血管的体外研究,包括CNV、ROP 和 DR等。近年来,RF/6A也被用于探索视网膜或脉络膜新生血管的病理机制和可能的抑制剂[5-7]。因此,在本研究中我们采用RF/6A细胞研究内皮抑素对视网膜、脉络膜新生血管的作用。缺血缺氧是病理性新生血管形成的最主要的诱发因素,虽然CoCl2是最常用于模拟缺氧环境的化学制剂[8],但是CoCl2诱导的缺氧效应与实际的缺氧可能有所不同。鉴于此,本研究建立物理缺氧细胞模型,研究在不同培养条件下细胞增殖、迁移和管腔形成的变化。研究证实,在物理缺氧条件下,RF/6A细胞的增殖、迁移和管腔形成均明显强于常氧对照组,与采用CoCl2的化学缺氧条件取得了类似的结果[9]。
内皮抑素是哈佛大学的O’Reilly等在1997年从小鼠血管内皮细胞瘤培养液中分离出来的一种新型蛋白质,可以抑制内皮细胞的增生。内皮抑素的分子量约为20kD,对肝素具有较高的亲和力,通过其肝素结合位点与血管生成因子竞争结合肝素,从而起到抑制血管生成的作用[2]。研究发现,内皮抑素是最有潜力的抗新生血管形成的物质,可抑制内皮细胞的增殖和迁移,促进细胞凋亡,诱导细胞在内皮细胞周期阻滞在G1期,涉及KDR/Flk-1、ERK、Bcl2/BclXL等多个信号通路,但其确切的机制尚未完全阐明[10,11]。内皮抑素在人体内广泛分布,在眼部的组织中也有大量的表达,如结膜、角膜、虹膜、睫状体、视网膜、泪液、房水和玻璃体液中,局部存在高浓度的内皮抑素使一些眼组织能保持无血管状态[12]。通过各种不同的给药途径行内皮抑素及内皮抑素基因治疗(基因载体包括质粒,脂质体,腺病毒,腺相关病毒,逆转录病毒等)的研究证明,眼部新生血管的形成能有效的被内皮抑素及内皮抑素基因抑制[13-15]。
本研究采用的重组人内皮抑素(恩度)是国内合成的、国家食品药品监督管理局批准用于抗肿瘤的药物。该药比内皮抑素更容易纯化,显示出稳定的理化特性和更高的水溶性,具有更多的临床优势[16],鉴于其抗新生血管效应,恩度已被用于治疗多种癌症,包括非小肺癌、乳腺癌和胃癌等。但是,将之用于眼部疾病领域的报道较少。本研究发现,不同浓度的重组人内皮抑素能明显抑制缺氧诱导的细胞增殖、迁移和管腔形成,且这些抑制作用均随药物浓度的升高而增强,结果与Lin等人的发现相似[17],他们的研究发现,重组人内皮抑素能通过下调HIF-1α和VEGF的表达抑制CoCl2诱导的RF/6A 细胞增殖和迁移。但化学缺氧诱导的细胞效应与物理缺氧可能有所不同,本研究所得的结果可能更接近临床真实情况。
综上所述,本研究采用体外实验初步证实内皮抑素可抑制缺氧条件下RF/6A细胞的血管生成过程,但具体的分子机制值得深入研究。尽管RF/6A细胞作为脉络膜-视网膜细胞系被广泛用于脉络膜和视网膜新生血管的体外研究中,但脉络膜与视网膜内皮细胞属于不同的细胞类型,常表现出较大的分子差异性,因此需要进一步分别采用脉络膜和视网膜内皮细胞进行研究。重组人内皮抑素是高效的抗新生血管生成的物质,其蛋白或基因在治疗眼部新生血管方面具有较大的潜能,给新生血管性眼病患者带来希望。但目前研究仅限于细胞和动物模型中,将其应用于人眼部治疗还有待更多的研究。
[1] Risau W.Mechanisms of angiogenesis. Nature,1997,386: 671-674.
[2] 李彩云,张奕霞,陈宁宁,等. 内皮抑素对眼部新生血管抑制的研究进展. 现代生物医学进展,2014,14:798-800.
[3] Neely KA,Gardner TW.Ocular neovascularization:clarifying complex interactions. Am J Pathol,1998,153: 665-670.
[4] Kermorvant-Duchemin E, Sapieha P, Sirinyan M, et al. Understanding ischemic retinopathies: emerging concepts from oxygen-induced retinopathy. Doc Ophthalmol, 2010,120:51-60.
[5] Feng YF,Guo H,Yuan F,et al. Lipopolysaccharide promotes choroidal neovascularization by up-regulation of CXCR4 and CXCR7 expression in choroid endothelial cell.PLoS One,2015,10:0136175.
[6] Xua L, Shen W, Wang B, et al.Efficient siRNA delivery using PEG-conjugated PAMAM dendrimers targeting vascular endothelial growth factor in a CoCl2-induced neovascularization model in retinal endothelial cells.Curr Drug Deliv, 2016,13:590-599.
[7] Li F, Bai Y, Zhao M, et al. Quercetin inhibits vascular endothelial growth factor-induced choroidal and retinal angiogenesis in vitro.Ophthalmic Res,2015,53:109-116.
[8] Balaiya S, Murthy RK, Chalam KV. Resveratrol inhibits proliferation of hypoxic choroidal vascular endothelial cells. Mol Vis,2013,19:2385-2392.
[9] Li R, Du J, Chang Y. Role of Autophagy in Hypoxia-Induced Angiogenesis of RF/6A Cells in vitro. Curr Eye Res, 2016 ,41:1566-1570.
[10] Wang K,Wang KZ,Shen BZ,et al. MR reporter gene imaging of endostatin expression and therapy. Mol Imaging Biol,2010,12:520-529.
[11] Li J,Dong X,Xu Z,et al. Endostatin gene therapy enhances the efficacy of paclitaxel to suppress breast cancers and metastases in mice. J Biomed Sci,2008,15:99-109.
[12] M tt M, Heljasvaara R, Pihlajaniemi T, et al.Collagen XVIII/endostatin shows a ubiquitous distribution in human ocular tissues and endostatin-containing fragments accumulate in ocular fluid samples. Graefes Arch Clin Exp Ophthalmol, 2007, 245:74-81.
[13] 钟敏,何建中,李荣,等.重组人血管内皮抑制素抑制角膜新生血管的实验研究.南昌大学学报(医学版),2012,52:28-30.
[14] 陈丽娟,苗林. 重组人血管内皮抑素对脉络膜新生血管的抑制作用.眼科新进展,2012,32:922-925.
[15] Takahashi K, Saishin Y,Saishin Y,et al. Intraocular expression of endostatin reduces VEGF-induced retinal vascular permeability, neovascularization, and retinal detachment. FASEB J, 2003,17:896-898.
[16] Jiang LP, Zou C, Yuan X, et al. N-terminal modification increases the stability of the recombinant human endostatin in vitro. Biotechnol Appl Biochem,2009,54: 113-120.
[17] Lin K,Ye P,Liu J,et al. Endostar inhibits hypoxia-induced cell proliferation and migration via the hypoxia-inducible factor-1α/vascular endothelial growth factor pathway in vitro. Mol Med Rep, 2015,11:3780-3785.
Effectsofendostatinoninvitroproliferation,migrationandtubeformationofchoroid-retinalendothelialcellsfollowinghypoxia
XieKunpeng,LiuPing,WangXin.
DepartmentofOphthalmology,ZhengzhouPeople'sHospital,Zhengzhou,Henan450003;DuJunhui.DepartmentofOphthalmology,Xi’anNinthHospital,Xi’an,Shanxi710054,China
ObjectiveEndostatin has been considered as one of the most potent angiogenesis inhibitors. This study aimed to investigate the effects of endostatin on in vitro proliferation, migration and tube formation of RF/6A choroidretinal endothelial cells.MethodsWell cultured RF/6A cells were randomly divided into three groups: the hypoxia group, the hypoixa group treated with varying concentrations of recombinant human endostatin and the control group. After 24 hours, cell proliferation, migration and tube formation was detected by MTT assay, wound scratch assay and seeding cells in matrigel, respectively.ResultsUnder hypoxia conditions, cell proliferation, migration and tube formation increased (P<0.05). Pretreatment with 0.510 μg/ml recombinant human endostatin significantly inhibited hypoxiainduced cell proliferation, migration and tube formation (P<0.05). In addition, the inhibitory effect of endostatin on RF/6A cells under hypoxia increases with the higher endostatin concentration.ConclusionsEndostatin can obviously inhibit cell proliferation, migration and tube formation of RF/6A cells. These effects indicate the inhibitory role of endostatin in choroidal and retinal angiogenesis.
Endostatin; Hypoxia; Neovascularization; Choroid-retinal endothelial cells
[JClinOphthalmol,2017,25:465]
10.3969/j.issn.1006-8422.2017.05.027
陕西省自然科学基础研究计划(No.2016JM8018)
450003 郑州市人民医院眼科(谢坤鹏、刘平、王新);710054 西安市第九医院眼科(杜军辉)
刘平(Email:lxylp2388@sina.com)
[临床眼科杂志,2017,25:465]
(收稿:2017-03-20)
