不同有孢汉逊酵母与酿酒酵母混合发酵对威代尔冰葡萄酒香气的影响
2017-12-26申静云刘沛通段长青燕国梁
申静云,刘沛通,段长青,燕国梁
(中国农业大学 食品科学与营养工程学院,农业部葡萄酒加工重点实验室,北京,100083)
不同有孢汉逊酵母与酿酒酵母混合发酵对威代尔冰葡萄酒香气的影响
申静云,刘沛通,段长青,燕国梁*
(中国农业大学 食品科学与营养工程学院,农业部葡萄酒加工重点实验室,北京,100083)
为了研究菌株和接种方式对冰葡萄酒非挥发性产物和挥发性香气成分的影响,选用2株自筛非酿酒酵母——仙人掌有孢汉逊酵母(Hanseniasporaopuntiae)和葡萄汁有孢汉逊酵母(Hanseniasporauvarum),分别与商业酿酒酵母DV10混合发酵。结果表明:H.uvarum与DV10同时接种混合发酵可以显著降低乙酸产量(降低26.90%);H.opuntiae与DV10同时接种混合发酵促进了酯类和萜烯类物质的合成,总量分别增产88.61%和21.40%,其中乙酸苯乙酯含量提高14.60倍,β-大马士酮增产8.85%。除此之外,感官品评结果显示H.opuntiae与DV10混合发酵可显著增强花果香和黄油味。综合分析,认为H.opuntiae更适合应用于冰葡萄酒发酵,为冰酒混合发酵的进一步研究提供了数据基础和理论依据。
冰酒;非酿酒酵母;混合发酵;香气;感官评价
冰葡萄酒的品质主要取决于香气的成分和浓度[1],其香气的主要来源有3个:葡萄果实的品种香气,微生物代谢产生的发酵香气以及陈酿香气,其中发酵香气最为重要[2]。发酵香气的产生是多种酵母菌共同作用的结果,酵母菌的种类和数量直接决定了葡萄酒的香气和口感[1]。
目前葡萄酒酿造多采用商业活性干酵母,缺乏具有产地特色的专用酵母,因此很多学者从产区葡萄的自然发酵过程中筛选出优良的酵母菌株,用于酿造出具有本土特色的优质葡萄酒[3]。在研究过程中发现,葡萄酒的自然发酵多是由非酿酒酵母(Non-Saccharomyceswine yeast)触发的[4],非酿酒酵母能够提高酯类和高级醇类物质的产量,具有高活性的糖苷酶,可增加葡萄酒的花果类香气[5],与酿酒酵母混合发酵能够改善葡萄酒的感官品质[6]。其中,德尔布有孢圆酵母(Torulasporadelbrueckii)高渗条件下,低产乙酸和乙酸乙酯,高产甘油和苯乙醇[7];克鲁维酵母(Kluyveromyces)可以降低葡萄酒的酸度[8];星型假丝酵母(Candidastella)能够减少乙酸、乙醛等不良气味物质的产生,提高酯类物质的产量[9];汉逊酵母属(Hanseniaspora)可以分泌多种胞外酶(葡萄糖苷酶、木糖苷酶、蛋白酶)[10],提高乙酸苯乙酯的含量,提升葡萄酒的香气品质。
目前针对非酿酒酵母的混合发酵对普通干型葡萄酒品质影响的研究很多,但在冰酒中的研究有限。本文利用前期研究中筛选得到的2株非酿酒酵母:葡萄汁有孢汉逊酵母(Hanseniasporauvarum)和仙人掌有孢汉逊酵母(Hanseniasporaopuntiae),分别与商业酿酒酵母DV10混合发酵(同时接种和顺序接种),探究了不同菌株和接种方式对威代尔冰葡萄酒组成成分的影响和呈香差异。
1 材料与方法
1.1 试验材料
冰葡萄汁:威代尔冰葡萄汁(辽宁省桓仁县),还原糖380 g/L,可滴定酸(以酒石酸计)13.0 g/L,pH3.35。
菌株:葡萄汁有孢汉逊酵母(H.uvarum,HU14),仙人掌有孢汉逊酵母(H.opuntiae,HO11),由前期研究中从威代尔冰葡萄汁自然发酵筛选鉴定得到,保存于本实验室;酿酒酵母选用商业酿酒酵母DV10 (法国拉曼公司)。
1.2 发酵实验
将酵母菌株接种于500 mL的YPD培养基(1.0%酵母浸提物,2.0%蛋白胨,2.0%葡萄糖)中进行活化,摇床培养(28 ℃,180 r/min)至对数期,低温(4 ℃)离心收集菌体,经无菌水洗涤后接入葡萄汁中。非酿酒酵母和酿酒酵母的接种比例为9∶1[11],即非酿酒酵母接种量约为107CFU/mL,酿酒酵母接种量约为106CFU/mL。发酵在500 mL摇瓶中进行,每瓶装有350 mL葡萄汁,共设立5个实验组(见表1),每组重复3次,接种后以发酵栓液封瓶口,16 ℃恒温静置发酵。
发酵过程中定期取样,通过测定样品含糖量监测发酵进程。当发酵进行到第35天时,加入80 mg/L的SO2终止发酵。随后样品低温(4 ℃)离心后保留上清液(-20 ℃冻藏),用于香气化合物和其他代谢产物的测定。

表1 发酵实验组Table 1 Fermentation experiment groups
注:图中DV10表示商业酵母DV10单独发酵;HO11/DV10(D0)表示HO11与DV10同时接种混合发酵;HO11/DV10(D4)表示HO11与DV10先后4天接种混合发酵;HU14/DV10(D0)表示HU14与DV10同时接种混合发酵;HU14/DV10(D4)表示HU14与DV10先后4天接种混合发酵,下同。
1.3 发酵主产物分析
发酵液过滤(PES,0.22 μm)后,采用高效液相色谱HPLC1200(Agilent Technologies, Inc. PaloAlto, CA)进行发酵主产物分析。检测参考VERWAAL等的方法[12],离子交换色谱柱HPX-87H Aminex ion-exchange column (300 mm× 7.8 mm,美国Bio-Rad Laboratories),流动相为5 mmol/L的H2SO4溶液, 等度洗脱,流速0.6 mL/min。
葡萄糖、果糖、乙醇和甘油的测定使用示差折光检测器(RID,refractive index detector,G1362A,美国Agilent公司),进样量为20 μL,柱温45 ℃,分析时间30 min;有机酸(乙酸、苹果酸、柠檬酸、乳酸和琥珀酸)的测定采用二极管阵列检测器(DAD,photodiode array detector,G1315D,美国Agilent公司),进样量为10 μL,柱温60 ℃,分析时间30 min。
1.4 香气化合物的检测
利用本实验室已优化的顶空固相微萃取-气质联用技术方法测定[13]。在顶空固相微萃取结合气质联用仪(GC-MS,Agilent,USA)上进行,选用50/30 μm DVB/CAR/PDMS fiber(Supelco, Bellefonte, PA, USA)萃取。萃取前,萃取头270 ℃老化1 h。将5 mL发酵样品加入到15 mL样品瓶中,同时加入1 g NaCl、10 μL内标(4-甲基-2-戊醇)后迅速用带有聚四氟乙烯(PTFE)隔垫的样品瓶盖拧紧密封,在40 ℃恒温条件下,180 r/min平衡30 min。样品瓶中的气-液相香气物质达到平衡后,将已活化或热解析过的聚二甲基硅氧烷/碳筛/二乙烯苯(PDMS/CAR/DVB)萃取头插入样品瓶的顶空部分,在40 ℃恒温下搅拌萃取30 min,使样品瓶中的香气物质达到气-固和气-液平衡。然后将萃取头插入GC-MS进样口,250 ℃热解析8 min,不分流进样。
气质部分实验条件为:气相色谱质谱联用仪为 Agilent 6890N /5975B Inert MSD(美国 Agilent Technologies),配置 PAL-SPME 自动进样器(瑞士 CTC Analytics)。所用毛细管色谱柱为HP-INNOWAX 60 m×0.25 mm×0.25 μm(J &W Scientific, Folsom, CA, USA)。载气为高纯氦气(纯度 99.999%),流速:1 mL/min。自动进样。柱温箱升温程序:50 ℃保持1 min,然后以3 ℃/min的速度升温至220 ℃,保持5 min,总运行时间62.67 min。质谱接口温度为280 ℃,离子源温度为230 ℃,四级杆温度150 ℃,电离方式为电子轰击电离源(EI),离子源能量70 eV,质量扫描范围为20~350m/z。每个样品做3个独立重复。
香气物质的定性和定量分析:利用质谱全离子扫描(Scan)图谱,对于已有标准品的物质,依据本实验已建立的相同色谱条件下该化合物的保留时间、保留指数和质谱信息进行定性分析。没有标准品的物质,利用文献报道中相似色谱条件下该化合物的保留指数以及NIST 11标准谱库(NIST Chemistry WebBook. http://webbook.nist.gov/chemistry/)比对结果进行半定性分析;文献中未报道相似色谱条件下化合物保留指数的香气物质,则根据NIST 11标准谱库比对结果进行半定性分析。对于已有标准品的物质,制作其在模拟酒溶液中的标准曲线进行定量;没有标准品的物质,利用与其化学结构相似、官能团类似、碳原子数相近的标准物质的标准曲线进行半定量。同时为了评价各香气化合物对总香气的贡献,通过香气浓度除以香气阈值来计算各香气化合物的香气值。
1.5 糖苷酶活性的测定
根据CAPECE等人的方法进行半定量测定[10]:以纤维二糖为唯一碳源配制培养基。活化后的菌株接入到无碳源YNB液体培养基,摇床培养6 h(30 ℃,180 r/min)除去活化液中的残糖。取上述菌液涂布于YNB-cel平板(0.67%YNB, 0.5%纤维二糖, 2%琼脂),30 ℃培养24~48 h。通过观察YNB-cel平板上菌株的生长情况判断其糖苷酶活性的高低,菌落越大,数目越多表征其糖苷酶活性越高,反之则越低。
1.6 感官品评
品评试验共3轮,用1-5数字对酒样依次标记,每轮以不同顺序分发给品评者(13位经专业品评培训人员)盲品,对酒样进行描述性评价,并按照强度等级(1-10级)对特征香气进行强度打分。
1.7 统计分析和作图
采用SPSS 24.0(IBM公司)进行主成分分析(PCA)和单因素方差分析(ANOVA,p<0.05)。
2 结果与讨论
2.1 发酵主产物分析
混合发酵不仅会影响发酵进程,还会进一步影响葡萄汁发酵过程中产生的代谢产物的组成和含量。本实验测定了各酒样中发酵主产物,包括乙醇、甘油和6种重要的有机酸,结果如表2所示。
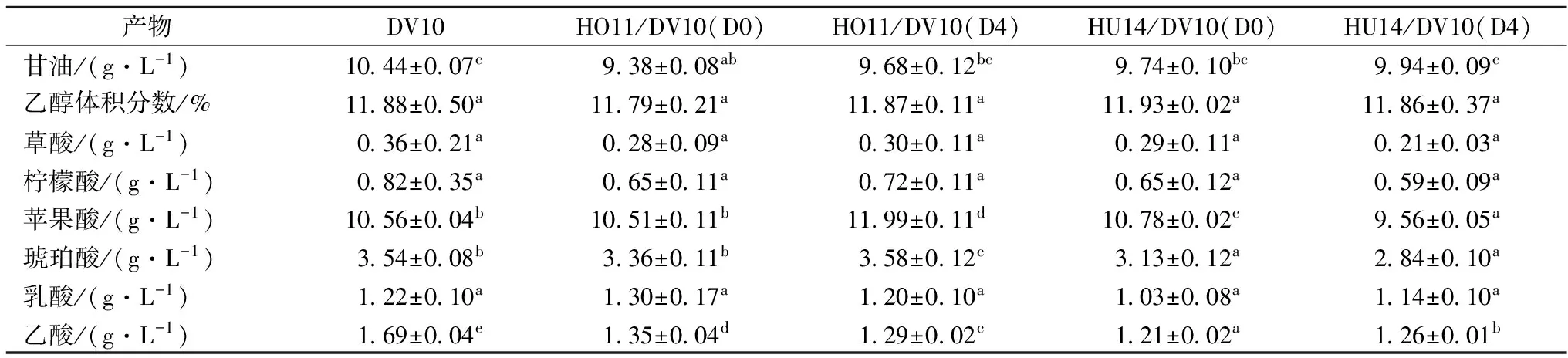
表2 酒精发酵结束时发酵主产物Table 2 Primary fermentation products in wine at the end of alcoholic fermentation
注:表中数据(平均值±相对标准差):利用独立样本T检验(Independent-Sample T Test)进行显著性方差分析,同一化合物含量后所标识不同的字母表示不同样本之间存在显著性差异(p<0.05)。
由表2可知,各样品的酒精度、草酸、柠檬酸和乳酸的含量并无显著差异。HO11与商业DV10混合发酵时,苹果酸和琥珀酸的产量均显著高于其他实验组,其中顺序接种时产量最高。过高含量的乙酸(> 2.10 g/L)会产生不良气味,降低冰酒的品质[14],有研究表明汉逊酵母属与酿酒酵母混合发酵能够减少乙酸的生成[15],本实验中混合发酵实验组的乙酸产量均显著低于商业DV10,证明了混合发酵的合理应用确实可以有效控制葡萄酒中乙酸的含量,其中HO11与商业DV10同时接种时降酸效果最为突出,约降低28.4%,其他依次为HU14/DV10(D4)、HO11/DV10(D4)、HO11/DV10(D0)、DV10。
2.2 香气化合物
实验测定了酒精发酵结束后各样品的香气组分,共检出57 种香气物质,包括醇类物质18种,酯类物质18种,醛酸类物质7种,C13降异戊二烯以及萜烯类化合物10种,其他化合物4种,见表3。
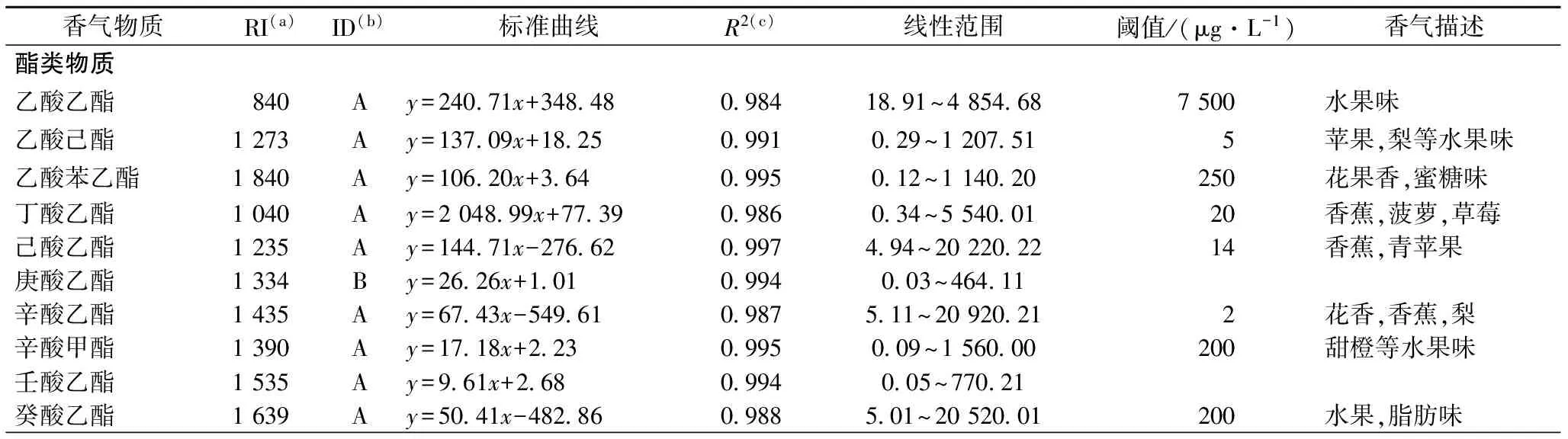
表3 威代尔冰葡萄酒香气物质、定量信息、标准曲线、线性范围和阈值Table 3 Volatile compounds identified in this work and their aroma parameters
续表3

香气物质RI(a)ID(b)标准曲线R2(c)线性范围阈值/(μg·L-1)香气描述乳酸乙酯1350Ay=4 65x+1 730 98912 12~200000 12水果香,奶油味水杨酸乙酯1826By=34 44x+21 470 9930 30~4352 21苯乙酸乙酯1785Ay=14 91x+2 230 9960 84~432 00250花香,果香月桂酸乙酯1848Ay=31 63x-68 690 9920 65~2665 001500花果香,奶香丁二酸二乙酯1682Ay=1323 67x+162 930 9965 11~20940 001200葡萄香气辛酸异戊酯1659By=8 11x+0 020 9900 02~324 00125水果味,奶油味水杨酸甲酯1792Ay=83 05x+3 610 9880 47~121 00己酸异戊酯1458Ay=15 16x-3 590 9990 61~1250 00高级醇类物质异丁醇1100Ay=61345 90x+6448 640 99982 59~338300 0040000生青味异戊醇1215Ay=8612 26x+2378 550 98965 12~267080 0030000指甲油味1⁃戊醇1256Ay=57 69x-0 270 9990 07~1150 0064000杂醇味,面包香1⁃己醇1358Ay=781 77x+35 690 9941 23~20210 008000果香,青香1⁃庚醇1455Ay=0 04x+0 020 9840 17~351 00脂肪味1⁃辛醇1400Ay=286 21x+0 400 9950 11~1650 0040脂肪味2⁃辛醇1417Ay=110 69x+0 950 9890 18~304 003⁃辛醇1392Ay=0 03x+0 010 9810 03~608 002⁃壬醇1517Ay=48 14x-0 470 9970 06~1000 001⁃癸醇1765Ay=25 50x-1 220 9980 05~860 00400花果香十二醇1974Ay=113 79x-12 880 9920 15~645 00苯甲醇1892Ay=5010 36x-7 320 9830 71~2930 00烘烤味,果香2⁃苯乙醇1903Ay=2466 51x-38 290 9964 95~82100 0010000玫瑰味,蜂蜜味1⁃辛烯⁃3⁃醇1456Ay=232 29x-2 820 9870 11~1650 0120蘑菇味,青香(E)⁃2⁃辛烯⁃1⁃醇1614By=340 90x+0 600 9980 16~668 003⁃己烯⁃1⁃醇1346Ay=600 90x+3 110 9890 22~912 00200青草香(Z)⁃3⁃己烯⁃1⁃醇1361Ay=5042 20x+49 180 9898 15~2087 50200青草香2,3⁃丁二醇1542Ay=90927 61x+3457 840 99764 52~264300 00150000奶油味,果香醛酸类物质己酸1860Ay=9361 39x-6 390 9950 87~14360 003000脂肪味,奶酪味辛酸2060Ay=2881 32x+157 500 9921 15~4730 00500腐臭味壬酸Ay=406 04x+15 620 9876 50~832 00癸酸2292Ay=10048 34x-12 640 99635 85~4590 0015000脂肪味苯甲醛1534Ay=937 10x-196 880 9964 90~20100 00300苦杏仁等坚果味苯乙醛1561Ay=2799 73x-605 960 9842 61~21350 001花香,蜜香壬醛1394Ay=128 13x-12 970 9820 05~227 5015生青味降异戊=烯及萜烯类物质β⁃大马士酮1802By=2522 59x+19 590 9845 07~162 5 0 05花香,水果味里那醇1530Ay=46 57x-3 590 9920 04~179 0015花香4⁃萜品醇1600Ay=201 40x-0 640 9900 12~260 00250百合花香,木香反式⁃玫瑰醚1360Ay=18 05x+0 210 9943 06~196 000 2花香,荔枝味乙偶姻1298Ay=-528 44x+4 250 9898 95~36680 00150000脂肪味,奶油味α⁃萜品醇1703Ay=13 58x+0 450 9900 03~122 00250紫丁香,蜜桃味橙花醇1805Ay=4869 38x-26 060 98010 40~5352 001000花香,甜木香β⁃香茅醇1770Ay=7 66x+14 200 9870 46~236 00玫瑰花香萜品油烯1290Ay=11 30x+6 690 9970 05~240 00松木香香叶醇1855Ay=11167 97x+348 480 9871 15~4575 7520柠檬味其他化合物3⁃甲硫基丙醇1726By=21131 67x+17 540 9958 75~560 001000脂肪味伞花烃1263By=6 44x+3 670 9900 05~210 00苯乙烯1271Ay=33 76x-4 600 9980 25~1022 00萘1756By=240 71x-271 840 9880 03~121 00
注:a):RI 表示该物质在HP-innowax毛细管柱上的保留指数;b):化合物的定性方式,A 表示由标样进行定性,B 表示由RI和NIST谱库比对进行定性;c):标线中x和y的回归系数。
图1为混合发酵实验酒样的4大类香气物质(酯类、酸类、萜烯类和高级醇类)的总含量图,由数据的比较分析可以看出,醇类和酯类仍是香气的主体成分,二者含量之和占香气物质总量的90%以上。
为进一步探究不同混合发方式对葡萄酒具体香气组分的影响,本研究对提取出的挥发性香气化合物进行了定性和定量分析,将发酵样品中OAV>1的呈香化合物的种类以及含量整理成表4。
高级醇是葡萄酒中重要的香气物质,其总量低于300 mg/L时,可以增加葡萄酒香气的复杂性[11]。本研究各样品的高级醇总量范围为140~170 mg/L,由图1可知,商业酵母DV10与HU14混合发酵时,高级醇的总含量呈现上升趋势,与HO11混合发酵时恰好相反,其中与HU14顺序接种条件下高级醇的产量最高。结合表4可知,HO11与商业DV10同时接种时异丁醇、2-苯乙醇、1-辛烯-3醇和 (Z)-3-己烯-1-醇的产量均显著提高,其中2-苯乙醇增产15.32%。
HU14与商业DV10顺序接种时异丁醇和2,3-丁二醇的产量均显著高于DV10单独发酵。2-苯乙醇是威代尔冰酒品种香气的重要组分[16],利用非酿酒酵母HO11在混合发酵可显著提高2-苯乙醇的含量,提升冰酒香气品质。

图1 各发酵酒样中酯类、酸类、萜烯类和高级醇类物质的含量Fig.1 Concentrations of total esters, total acids, total terpenes and total higher alcohols in wines
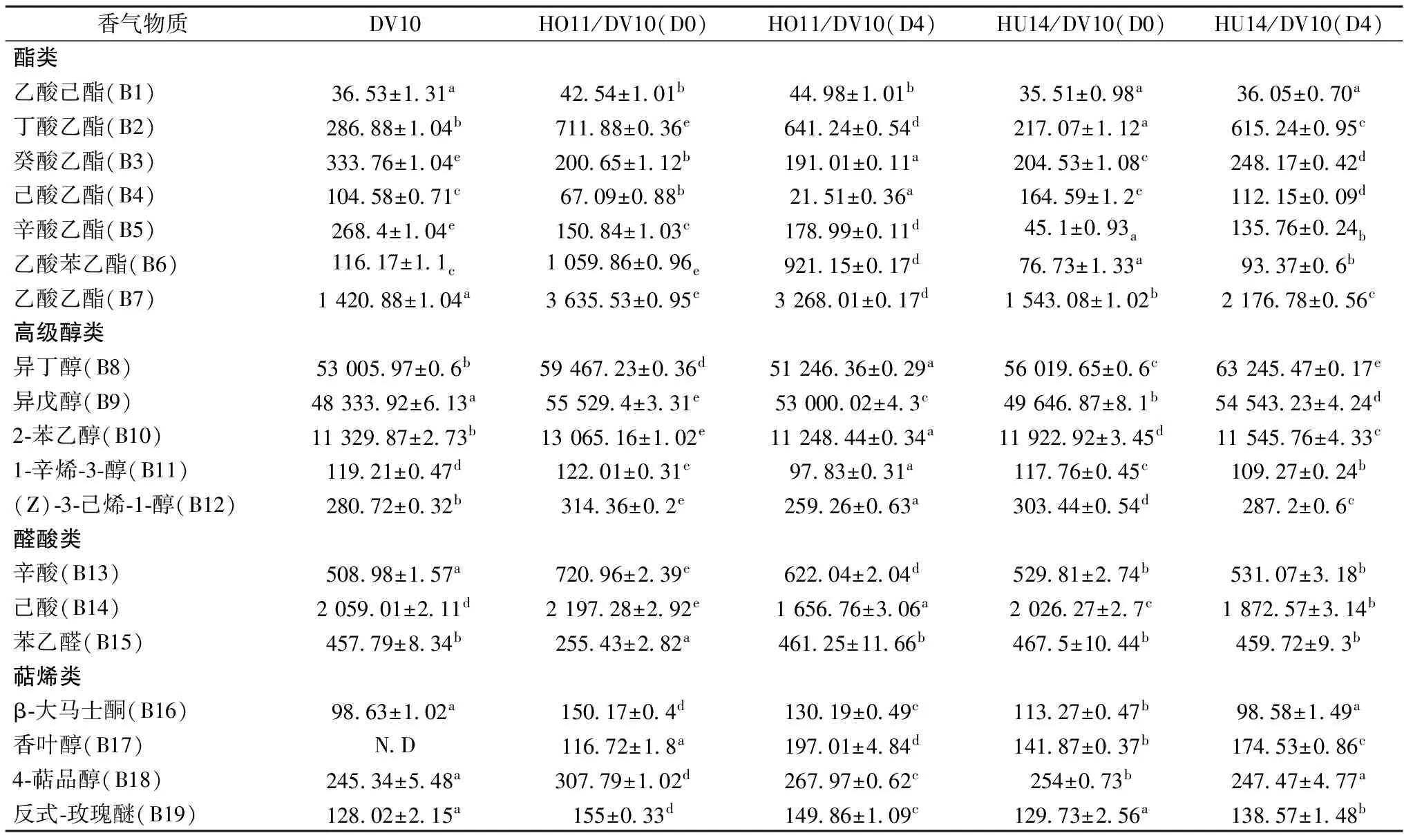
表4 酒精发酵结束酒样中挥发性香气物质的含量(OAV>1) 单位:μg/LTable 4 Volatile aroma compounds in wines after alcoholic fermentation(OAV>1)
注:表中数据(平均值±相对标准差):利用独立样本T检验(Independent-Sample T Test)进行显著性方差分析,同一化合物含量后所标识不同的字母表示不同样本之间存在显著性差异(p<0.05)。表中加粗物质为OAV>1的香气化合物;N.D表示未检出。
混合发酵方式下(除DV10与HU14同时接种外),酯类物质的总含量均显著高于商业DV10单独发酵,非酿酒酵母HO11的产酯能力更强,与DV10混合发酵(包括同时接种和顺序接种),酯类总含量是酿酒酵母单独发酵时产量的2倍,证明汉逊酵母可以增加葡萄酒内酯类物质的含量[17]。其中,HO11/DV10(D0)混合发酵总酯类产量最高,其次为HO11/DV10(D4)、HU14/DV10(D4)、DV10单独发酵。同时由表4可知,DV10单独发酵时己酸乙酯和辛酸乙酯产量较高,混合发酵则显著提高了乙酸乙酯的含量,为冰酒贡献甜水果气味和葡萄香气[11]。HO11/DV10(D0)的乙酸苯乙酯和丁酸乙酯产量显著升高,其中乙酸苯乙酯OAV值大于4,显著高于DV10单独发酵。
混合发酵对发酵酒样中总酸的含量影响并不显著,当商业DV10与HO11同时接种混合发酵时,总酸含量最高,萜烯类物质的含量也较高。萜烯类化合物阈值较低,是冰酒中花果香的重要来源,其含量与菌株以及接种方式有关[18-19]。由图1可知,DV10与HO11顺序接种时萜烯类物质产量最高,依次为HO11/DV10(D0)、HU14/DV10(D4)、HU14/DV10(D0),DV10单独发酵时最低,表明HU14和HO11菌株具有较高的糖苷酶活性,能够提高萜烯类物质的含量。β-大马士酮、反式-玫瑰醚、香叶醇、4-萜品醇4种物质的含量超出其感官阈值,β-大马士酮是威代尔冰酒中重要的香气物质,有愉悦的甜果香及蜂蜜味[20]。HO11与DV10混合发酵时,显著提高了β-大马士酮(增产约50%)、4-萜品醇(增产约25%)、反式-玫瑰醚(增产约17%)的含量,顺序接种条件下香叶醇的含量也显著高于其他组。香叶醇具有玫瑰和新鲜香叶的气味,本实验中该物质在混合发酵组中含量较高,但在DV10单独发酵下并未检测到。
当DV10与HU14混合发酵时,产萜烯能力整体逊于HO11。然而,目前针对H.opuntiae(CVE-HO11)的研究多见于汉逊酵母的分离鉴定[21-23],对其发酵特性的研究和应用较少,其在葡萄酒发酵过程中发酵性能仍待进一步探究。
为证明萜烯类物质的含量差异与菌株糖苷酶活性相关,进一步检测了各菌株的β-葡萄糖苷酶活性(图2),发现在YNB-cel平板上,HO11的菌落数明显多于HU14,表明HO11的糖苷酶活性比HU14高,而酿酒酵母基本没有生长,证明了酿酒酵母缺少糖苷酶活性[24]。

图2 糖苷酶活性YNB-cel平板鉴定结果Fig.2 The identification results of glycosidase activity on YNB-cel plate
2.3 香气组分的主成分分析
为进一步分析不同菌株和接种方式对冰酒香气的影响,本研究采用主成分分析法(PCA),如图3,对各实验组香气特点进行了评价。

图3 酒样中OAV>1的香气化合物PCA得分图(a)及各变量在PC1和PC2上的载荷图(b)Fig.3 PCA of aroma compounds(OAV>1) in final wines (a. loading plot; b. scatter diagram)
由图3可知,两个主成分(PC1和PC2)的总贡献率为86.23%,其中PC1的贡献率为50.49%,PC2的贡献率为35.74%。从图3-a可以看出,HU14/DV10(D0)与HU14/DV10(D4)分别位于PC2的正方向和PC2的负方向上,二相距较远,结合载荷图3-b可得知二者的香气物质有明显差异。其中,HU14/DV10(D0)的关键香气成分为癸酸乙酯(B3)、己酸乙酯(B4)和1-辛烯-3-醇(B11),而HU14/DV10(D4)主要为辛酸乙酯(B5)、苯乙醛(B15)和香叶醇(B17);非酿酒酵母HO11混合发酵实验组位于两个象限,HO11/DV10(D0)在PC1和PC2的正方向上,HO11/DV10(D4)位于PC1的正方向和PC2负方向,远离其他实验组的同时彼此之间也相距甚远。这不仅说明了HO11明显改变了酿酒酵母单独发酵时的呈香特征,还说明了HO11采用不同的接种方式应用于冰酒的发酵中,对香气产生的影响有显著性差异。其中HO11与DV10同时接种发酵区别于其他组的关键香气成分是(Z)-3-己烯-1-醇(B12)、β-大马士酮(B16)和4-萜品醇(B18),而顺序接种条件下则主要为乙酸己酯(B1)、丁酸乙酯(B2)、乙酸苯乙酯(B6)和反式-玫瑰醚(B19)。
2.4 感官评价结果
从图4可以看出,DV10单独发酵酒样具有愉悦的焦糖香气,生青味和酒精味明显,花果香气味稍淡但整体香气较为平衡。HO11/DV10(D0)发酵酒样花果类香气最为浓郁,焦糖味和黄油味明显,这一特点与其β-大马士酮检出量最高的结果相符;HO11/DV10(D4)酒样中焦糖味和黄油味最为突出,花果类香气浓郁;采用HU14/DV10(D0)方式的发酵样品中焦糖味占主导,其次是生青味和花果香,但整体香气不足;HU14/DV10(D4)酒样中酒精味最为明显,强度与对照组相近,削弱了单独发酵时突出的生青味和尖酸味,但花果香、焦糖味等均不突出,香气平衡性较差。总的来看,混合发酵过程中HU14菌株虽产香不足但削弱了酿酒酵母单独发酵时的尖酸味和生青味,而HO11菌株可以显著增强冰酒中的花果香、黄油味等愉悦的香气。
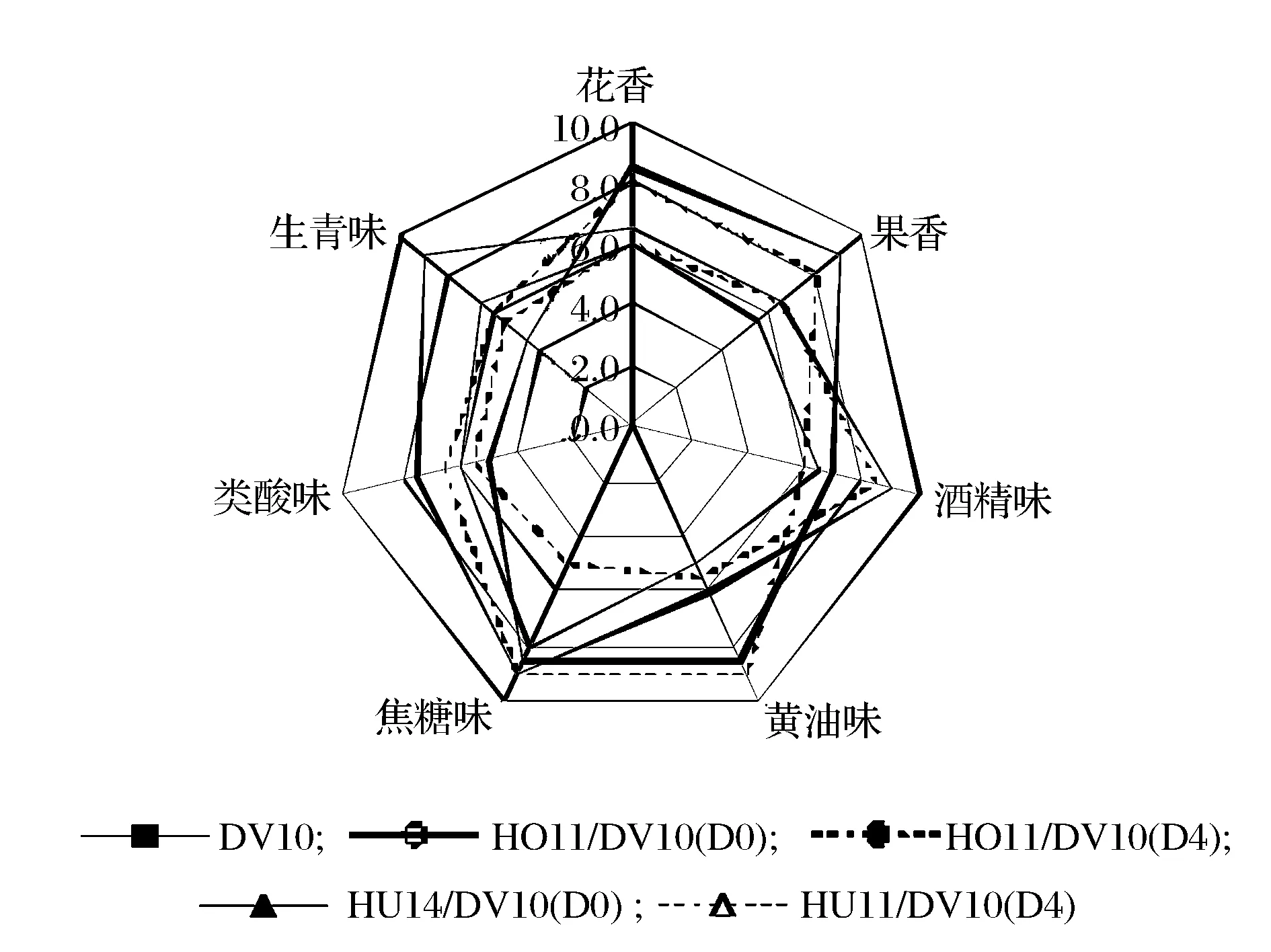
图4 葡萄酒香气轮廓图Fig.4 Wine aroma profile
3 结论
综上所述,在冰葡萄酒酿造过程中,采用混合发酵方式能够显著降低乙酸的产量,其中HU14菌株降低23.50%,HO11次之(降低21.89%);提高了酯类和萜烯等物质(β-大马士酮、反式-玫瑰醚、香叶醇等)的含量,其中HO11混合发酵组萜烯类物质的总量与对照相比增产22.40%,并极大地改变了威代尔冰酒的香气轮廓,削弱了酿酒酵母单独发酵产生的生青味和尖酸味。感官品鉴结果进一步证明HO11与DV10同时接种的混合发酵较好地保留了威代尔冰葡萄酒的特征香气,并赋予了其浓郁的花果香,增强了香气的复杂性和层次感,有效改善了冰酒的感官品质。以上结果表明HO11和酿酒酵母混合发酵方式可以作为提升冰酒香气品质的有效手段,具有很好的应用前景。
[1] 马玥, 唐柯, 徐岩,等. 固相萃取结合GC-O/MS分析威代尔冰葡萄酒中的香气活性化合物[J].食品与发酵工业,2015,41(4):153-159.
[2] 赵新节, 张家荣, 秦绍智,等. 玫瑰香冰葡萄酒香气成分分析[J].酿酒科技, 2013(9):107-111.
[3] 张丽珠.川藏高原威代尔冰葡萄中酵母菌的分离、筛选及其耐受性研究[J].中国酿造,2013,32(10):94-97.
[4] 李华, 王华, 袁春龙, 等. 葡萄酒工艺学[M].北京:科学出版社,2007:68-73;165-178.
[5] 王星晨, 胡凯, 陶永胜. 葡萄汁有孢汉逊酵母和酿酒酵母的混合酒精发酵动力学[J].食品科学,2016,37(3):103-108.
[6] CHAROENCHAI C, FLEET G H, HENSCHKE P A, et al. Screening of non-Saccharomyceswine yeasts for the presence of extracellular hydrolytic enzymes[J].Australian Journal of Grape and Wine Research,1997,3(1):2-8.
[7] RENAULT P, MIOTSERTIER C, MARULLO P, et al. Genetic characterization and phenotypic variability inTorulasporadelbrueckiispecies: Potential applications in the wine industry[J]. International Journal of Food Microbiology,2009,134(3):201-210.
[8] YAMAOKA C, KURITA O, KUBO T. Improved ethanol tolerance ofSaccharomycescerevisiaein mixed cultures withKluyveromyceslactison high-sugar fermentation.[J].Microbiological Research,2014,169(12):907-914.
[9] RANTSIOU K, DOLCI P.Candidazemplininacan reduce acetic acid produced bySaccharomycescerevisiaein sweet wine fermentations[J].Applied & Environmental Microbiology,2012,78(6):1 987-1 994.
[10] CAPECE A, FIORE C A, ROMANO P. Molecular and technological approaches to evaluate strain biodiversity inHanseniasporauvarumof wine origin[J].Journal of Applied Microbiology,2005,98(1):136-144.
[11] VIANA F, GIL J V, VALLÉS S, et al. Increasing the levels of 2-phenylethyl acetate in wine through the use of a mixed culture ofHanseniasporaosmophila, andSaccharomycescerevisiae[J].International Journal of Food Microbiology,2009,135(1):68-74.
[12] VERWAAL R, JIANG Y, WANG J, et al. Heterologous carotenoid production inSaccharomycescerevisiaeinduces the pleiotropic drug resistance stress response[J].Yeast,2010,27(12):983-998.
[13] LAN Y B, XU Q, YANG Z J, et al. Striking changes in volatile profiles at sub-zero temperatures during over-ripening of ‘Beibinghong’ grapes in Northeastern China[J].Food Chemistry,2016,212:172.
[14] HOWARD K L, MIKE J H, RIESEN R. Validation of a solid-phase microextraction method for headspace analysis of wine aroma components[J].American Journal of Enology and Viticulture,2005,56(1):37-45.
[15] JETTI R, YANG E, KURNIANTA A, et al. Quantification of selected aroma-active compounds in strawberries by headspace solid-phase microextraction gas chromatography and correlation with sensory descriptive analysis[J].Journal of Food Science,2007,72(7):S487-S496.
[16] STRAUSS M L, JOLLY N P,LAMBRECHTS M G, et al. Screening for the production of extracellular hydrolytic enzymes by non-Saccharomyceswine yeasts[J].Journal of Applied Microbiology,2001,91(1):182-190.
[17] LAGE P, BARBOSA C, MATEUS B, et al.H.guilliermondiiimpacts growth kinetics and metabolic activity ofS.cerevisiae: the role of initial nitrogen concentration[J].International Journal of Food Microbiology,2014,172:62-69.
[18] MOREIRA N, MENDES F, GUEDES D P P, et al. Heavy sulphur compounds, higher alcohols and esters production profile ofHanseniasporauvarumandHanseniasporaguilliermondiigrown as pure and mixed cultures in grape must[J].International Journal of Food Microbiology,2008,124(3):231-238.
[20] BOWEN A J, REYNOLDS A G. Aroma compounds in Ontario Vidal and Riesling icewines. I. Effects of harvest date[J]. Food Research International,2015,76:540-549
[21] NYCHAS G J, NISIOTOU A A. Yeast populations residing on healthy or botrytis-Infected grapes from a Vineyard in Attica, Greece[J].Applied and Environmental Microbiology,2007,73(8):2 765-2 768
[22] BOVO B, ANDRIGHETTO C, CARLOT M, et al. Yeast population dynamics during pilot-scale storage of grape marcs for the production of Grappa, a traditional Italian alcoholic beverage[J].International Journal of Food Microbiology,2009,129(3):221-228
[23] GAROFALO C, TRISTEZZA M, GRIECO F, et al. From grape berries to wine: population dynamics of cultivable yeasts associated to “Nero di Troia” autochthonous grape cultivar[J]. World Journal of Microbiology and Biotechnology,2016,32(4):59
[24] PÉREZ G, FARIA L. A quick screening method to identify β-glucosidase activity in native wine yeast strains: application of Esculin Glycerol Agar (EGA) medium[J]. World Journal of Microbiology and Biotechnology,2011,27(1):47-55.
EffectsofmixedfermentationbydifferentHanseniasporagenusyeastsandSaccharomycescerevisiaeonthearomacompoundsinVidalicewine
SHEN Jing-yun, LIU Pei-tong, DUAN Chang-qing, YAN Guo-liang*
(Key Laboratory of Viticulture and Enology, Ministry of Agriculture, College of Food Science and Nutritional Engineering, China Agricultural University, Beijing 100083,China)
Two isolated non-Saccharomyceswine yeasts strains,Hanseniasporaopuntiae(HO11) andHanseniasporauvarum(HU14), were fermented with commercialSaccharomycescerevisiaeDV10 in simultaneous and sequentialinoculation to investigate the effects of different strains and inoculation methods on non-volatile and volatile aroma compounds inVidalice wine. The results showed that mixed fermentation decreased the concentration of acetic acidin final wine compared to the pureS.cerevisiaefermentation, especially in the simultaneous fermentation of HU14/DV10, in which 26.90% decrement of acetic acid was observed. Simultaneous fermentation of HO11/DV10 generated more esters and terpenes,and the concentration of total esters and terpenes were 88.61% and 21.40% higher than that of monoculture ofS.cerevisiae, respectively. Among these compounds, phenyl ethyl acetate (14.6 folds higher than control) and β-damascone (8.85% higher than control) were increased significantly. Sensory evaluation further revealed that mixed fermentation of HO11 andS.cerevisiaeenhanced the floral and butter aroma ofVidalicewine.
ice wine; non-Saccharomyceswine yeasts; mixed fermentation; aroma; sensory evaluation
10.13995/j.cnki.11-1802/ts.014700
硕士研究生(燕国梁副教授为通讯作者,E-mail: glyan@cau.edu.cn)。
国家农业产业技术体系专项基金(CARS-30);中央高校基本科研业务费专项资金资助(2017SP003)
2017-05-05,改回日期:2017-06-20
