湖北长阳山区萝卜根肿病抗性鉴定筛选
2017-12-26甘彩霞袁伟玲邓晓辉於校青矫振彪焦忠久朱凤娟邱正明
甘彩霞 崔 磊 袁伟玲 邓晓辉 於校青 矫振彪 焦忠久 朱凤娟 邱正明
(湖北省农业科学院经济作物研究所,湖北武汉 430070)
湖北长阳山区萝卜根肿病抗性鉴定筛选
甘彩霞 崔 磊 袁伟玲 邓晓辉*於校青 矫振彪 焦忠久 朱凤娟 邱正明
(湖北省农业科学院经济作物研究所,湖北武汉 430070)
长阳山区是湖北高山地区主要的根肿病病区。以100份萝卜种质资源为材料,分别在长阳胡家坪和火烧坪进行根肿病田间成株期抗病性鉴定和苗期人工接种抗病性鉴定。综合成株期和苗期鉴定结果,筛选出抗根肿病种质资源13份,其中白皮萝卜8份(富源1号、华绿8号萝卜、重庆冰糖圆白、春不老、玉堂春、汉白玉、春玉和短叶13号),红皮萝卜3份(红罐、南京红和大红袍),绿皮萝卜2份(灌糖青和德日2号)。利用长阳火烧坪根肿病病圃田间鉴定了155个萝卜杂交组合,筛选出抗根肿病优良组合3个。
萝卜;根肿病;成株期;苗期;抗病性
萝卜(Raphanus sativus L.,n=9)是十字花科萝卜属一、二年生草本双子叶植物(Al-Shehbaz et al.,2006),在我国已有2 700多年的栽培历史,品种资源近2 000份,类型十分丰富,各生态区域均有适合本区域消费习惯和不同生长季节的传统地方品种(汪隆植和何启伟,2005),栽培非常普遍。萝卜是我国仅次于大白菜的第二大蔬菜作物,全国各省、市、县(区)都有种植,萝卜产品周年供应全国并远销日本、东南亚等地区。
十字花科芸薹根肿病(Plasmodiophora brassicae)会侵染和危害十字花科作物(Piao et al.,2009),包括白菜(Piao et al.,2002)、甘蓝(Crute et al.,1983)、油菜(Crute et al.,1983)、花椰菜(David et al.,2013)、茎瘤芥(榨菜)(肖崇刚 等,2002)、萝卜(Akito et al.,2010)和芜菁(Crute et al.,1983)等,是一种世界性土传病害。根肿病菌的休眠孢子可以在土壤中留存或者传播(Murakami et al.,2004),这些孢子可以存活15 a(Wallenhammar,1996)。根肿病菌侵染根部后细胞异常增大,影响根部对营养和水分的吸收,导致产量和品质下降,影响商品性,作物减产10%~15%(Dixon,2006)。轮作和撒生石灰可以尽量避免作物受到根肿病菌的侵害,但是选育抗根肿病品种是最有效的方法(Hirai,2006;Diederichsen et al.,2009;Piao et al.,2009)。
萝卜对根肿病的抗性强于其他十字花科作物,但受到根肿病菌的侵染仍会发病,品种间抗性差异很大。萝卜根肿病的危害程度逐年加重,我国北方一些萝卜品种高感根肿病,南方根肿病疫区也常有萝卜根肿病发生(Scheijgrond & Vos,1954;Yoshikawa,1993;甘彩霞 等,2016a)。本试验采用根肿病病区田间调查和苗期接种鉴定的方法对100份萝卜种质资源进行根肿病抗性筛选,筛选出的抗根肿病种质资源可作为下一步萝卜抗病育种工作的材料;同时在根肿病病圃对萝卜杂交组合进行筛选鉴定,以期获得优良的抗根肿病备选品种。
1 材料与方法
1.1 试验材料
成株期与苗期根肿病抗性鉴定材料为湖北省农业科学院经济作物研究所提供的100份萝卜种质资源。
成株期抗性鉴定在湖北省宜昌市长阳胡家坪地区进行,供试根肿病菌为该地区前茬感病甘蓝根部根肿菌瘤。苗期抗性鉴定在长阳火烧坪黍子岭村进行,供试根肿病菌为该地区感病大白菜根部根肿菌瘤,根肿病病原菌为致病力强的4号生理小种(汪维红 等,2013)。长阳县山区因长期单一品种连作,土壤酸化严重,pH值下降,且土壤有机质缺乏(甘彩霞 等,2016b)。
155份杂交组合抗性鉴定供试根肿病菌由湖北省宜昌市长阳火烧坪根肿病病圃提供。
1.2 试验方法
成株期抗性鉴定于2015年8月10日播种,播种前将试验基地前茬感病甘蓝根部根肿病瘤翻入土中,按照当地种植习惯,喷洒除草剂乙草胺(每667 m2用量50 g,兑水20 kg)及防治地下害虫药剂高效氯氰菊酯(每667 m2用量45~90 g,兑水20 kg施用,施药后7 d内不播种)。施底肥(每667 m2施125 kg腐熟的畜禽有机肥和100 kg复合肥)。垄距(包沟)1 m,厢面长7.5 m,覆带孔黑色地膜,地膜双行播种,穴距20 cm,行距40 cm。播种时每穴播2~3粒,每份材料播种30穴,3次重复,出苗后重点防治跳甲,7~8叶时定苗。10月10~11日进行根肿病的抗性及综合性状调查。
苗期抗性鉴定于2016年7月24日播种,供试接菌土取自未受侵染的种植地土壤,过筛,加入肥料,以100个穴盘的用土量为例,将500 kg无菌土与15 kg有机肥(菌种发酵富含氨基酸,氮磷钾总养分≥5%,有机质≥45%)混匀。将培养土加入50孔穴盘中,每份材料播25粒种子,备用。接种前采集大白菜根部根瘤冲洗干净,用塑料膜包裹沤烂并捣碎,用水冲洗根肿菌孢子并用纱布过滤,用血球计数板制成孢子浓度为1×107个·mL-1的接种菌液备用。将穴盘中培养土用孢子溶液浇透,水分沉降略干适宜播种时,在每穴中心点播覆土;将穴盘置于育苗床上,搭小拱棚,覆地膜于小拱棚上,膜四周用土压实,保温保湿,田间正常管理,隔1 d浇1次水,注意防治病害和地下害虫,午间温度超过20 ℃的晴天于10:00~16:00揭棚膜两头通风散热,避免高温烧苗,苗龄二叶一心时再用1×107个·mL-1的孢子菌液接种1次,9月7日调查发病情况。以苗期抗性鉴定结果为重点参考,田间成株期抗性调查辅助验证苗期抗性鉴定结果。
杂交组合抗性鉴定的根肿病圃,自2008年起每年4月底至5月上旬高山萝卜第1茬开始播种时在根肿病筛选的试验病圃种植感病大白菜,丰富病圃的菌源。6月底至7月底第2茬开始播种时进行田间根肿病鉴定。连续多年培育的根肿病病圃,可以有效进行田间根肿病抗性鉴定。试验于2016年6月28日播种,每穴播种2~3粒,每份杂交组合播种30穴,出苗后重点防治跳甲,7~8叶时定苗,8月18日进行抗性调查。
1.3 病情分级及抗病性评价标准
成株期病情分级采用甘彩霞等(2016a)的标准:0级,根系生长正常,无肿瘤;1级,萝卜根上有较小缢缩疤痕,或者萝卜根不发病,须根上有较小肿瘤鼓起;3级,萝卜根上有较大缢缩黑疤,或者须根上有较多肿瘤,须根上肿瘤直径≤3 mm;5级,萝卜根上有多个缢缩疤痕,或者须根上肿瘤直径>3 mm;7级,萝卜根上黑疤面积大,在表面形成黑洞凹陷,或者须根上肿瘤异常膨大、龟裂;9级,萝卜根上形成大的黑洞且中空腐烂,或者主根异常膨大、龟裂腐烂。
苗期病情分级标准:0级,无侵染疤痕或根瘤;1级,主根上有1~2个侵染疤痕,或者主须根上有1~2个小的根瘤;3级,主根上有3~4个侵染疤痕,或者主须根上有3~4个小的根瘤;5级,主根上有5~6个侵染疤痕,或者主须根上有5~6个小的根瘤或1个直径同于主根的大根瘤;7级,主根上有多个侵染疤痕连成片,或者主须根上有多个小的根瘤或1个及多个直径大于主根的根瘤;9级,主根上侵染疤痕形成大的凹陷变黑,或者主须根上根瘤聚集烂根。

抗病性评价标准:病情指数在0~11.11之间为抗病(R);病情指数在11.12~33.33之间为耐病(T);病情指数在33.34~55.55之间为感病(S);病情指数在55.56~100.00之间为高感(HS)。
本文利用自主设计加工的一种试验装置,测定了不同掺量粉煤灰混凝土的水和气体(氮气)渗透系数;同时,用NMR测试了试验混凝土的孔隙率及其孔径分布等微观结构参数。基于测试结果,研究了粉煤灰掺量对混凝土的水、气体渗透性及微观结构参数的影响,分析了粉煤灰混凝土的水、气体渗透性与其微观结构参数之间的关系。
2 结果与分析
2.1 萝卜种质资源的根肿病抗性鉴定
出苗株数少于10株的材料未进行调查分析。成株期共调查了49份萝卜材料的根肿病抗性,其中29份材料田间没有发病植株。苗期抗性鉴定共调查了71份材料的抗性。
根据苗期鉴定抗病性评价标准,参试白皮萝卜中根肿病抗病材料有18份(表1),其中华绿8号萝卜、217春不老白玉春、五月白和圆白叶的苗期接种鉴定病情指数均为0。综合成株期和苗期鉴定结果,筛选出白皮萝卜抗根肿病种质资源8份,包括富源1号、华绿8号萝卜、重庆冰糖圆白、春不老、玉堂春、汉白玉、春玉和短叶13号。
根据苗期鉴定抗病性评价标准,参试红皮萝卜中根肿病抗病材料有4份(表2),综合成株期和苗期鉴定结果,筛选出红皮萝卜抗根肿病种质资源3份,分别为红罐、南京红和大红袍。
根据苗期鉴定抗病性评价标准,参试绿皮萝卜中根肿病抗病材料有4份(表3),综合成株期和苗期鉴定结果,筛选出绿皮萝卜抗根肿病种质资源2份,分别为灌糖青和德日2号。
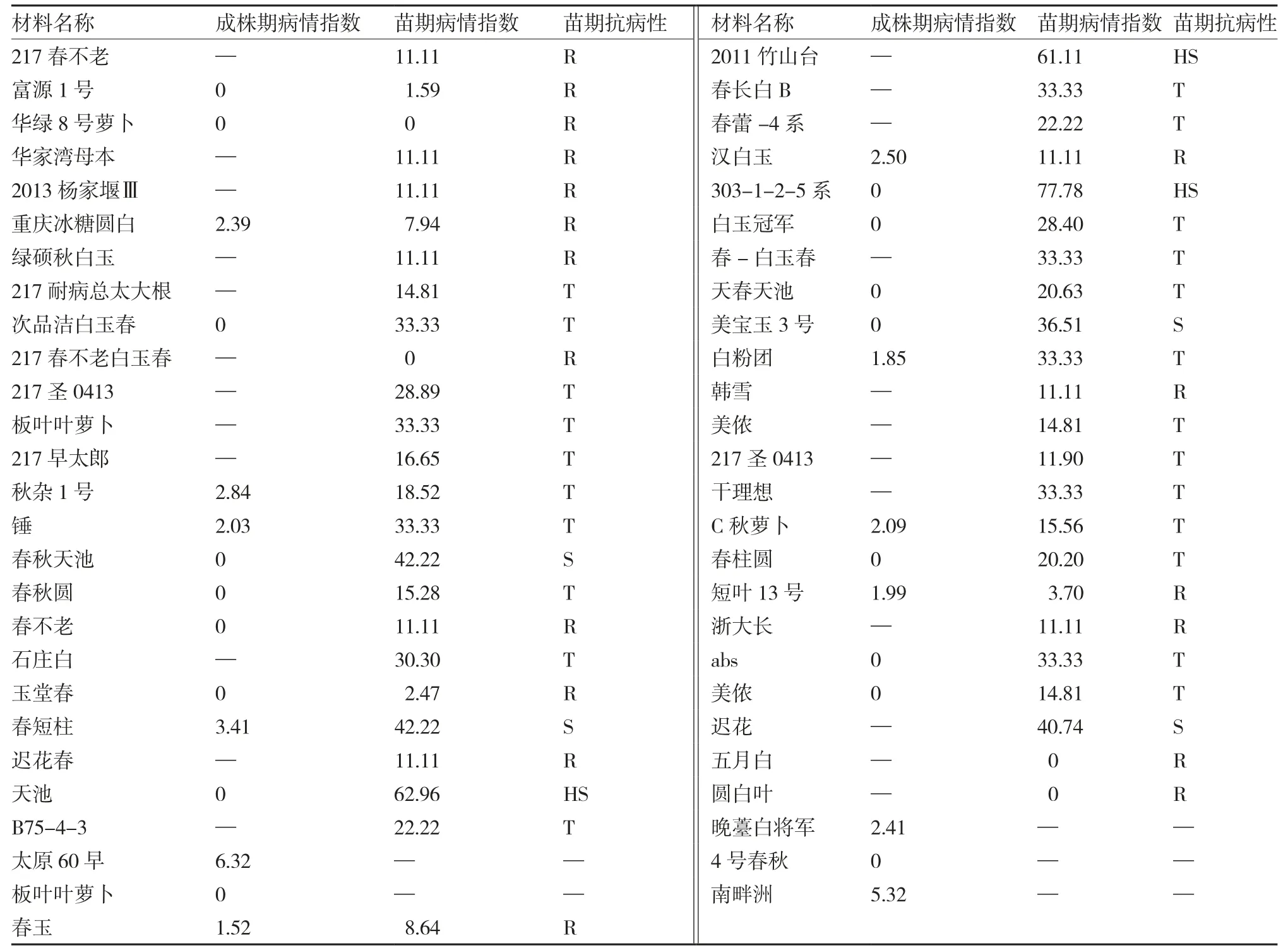
表1 白皮萝卜种质资源根肿病抗性调查结果

表2 红皮萝卜种质资源根肿病抗性调查结果
2.2 萝卜杂交组合根肿病抗性鉴定
在火烧坪田间根肿病病圃对155个试配组合进行根肿病抗性鉴定,25个组合田间表现为抗病,33个组合为耐病。其中白皮萝卜参试组合有98个,抗根肿病组合有15个(表4);红皮萝卜参试组合有23个,没有发现抗病组合(表5);绿皮萝卜参试组合34个,10个组合抗根肿病(表6)。综合其他经济性状,抗根肿病且性状表现优良的试配组合有3个,分别为L30-4-3A×L56、L30-4-3A×L36和L30-5-7-1A×L42-16-2(图1)。

表3 绿皮萝卜种质资源根肿病抗性调查结果

表4 白皮萝卜组合根肿病抗性调查结果

表5 红皮萝卜组合根肿病抗性调查结果
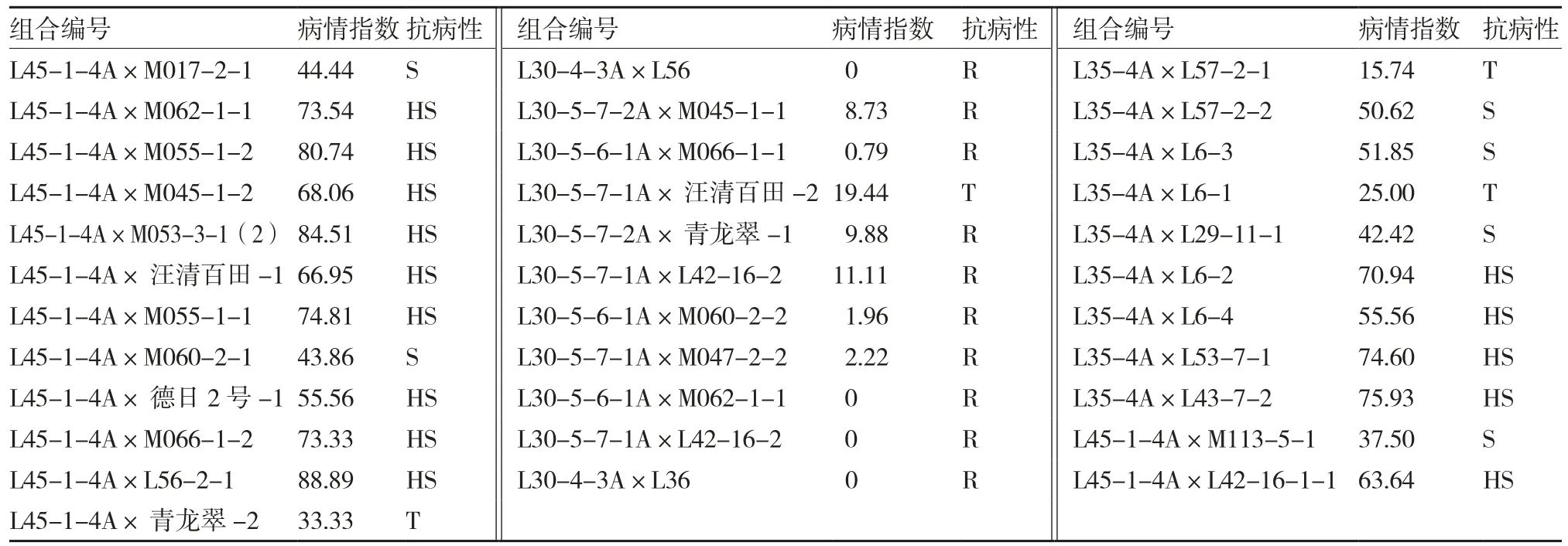
表6 绿皮萝卜组合抗根肿病抗性调查结果

图1 抗根肿病的优良萝卜组合
3 结论与讨论
由于受高山气候条件影响,加上种质资源库部分材料出芽率低,本试验没有对出苗株数少的材料进行成株期根肿病抗性结果分析,重点跟踪验证29份田间不发病的核心资源的抗性。苗期抗性鉴定在53份参试白皮萝卜中获得18份抗根肿病材料;10份参试红皮萝卜中获得4份抗病材料;20份参试绿皮萝卜中获得4份抗病材料。综合成株期和苗期抗性鉴定的结果,白皮萝卜富源1号、华绿8号萝卜、重庆冰糖圆白、春不老、玉堂春、汉白玉、春玉和短叶13号共8份种质资源为抗病材料;红皮萝卜红罐、南京红和大红袍共3份为抗病材料;绿皮萝卜灌糖青和德日2号共2份为抗病材料。
试配组合根肿病病圃抗性鉴定结果显示,参试红皮萝卜没有表现抗病的组合,白皮萝卜表现抗病的组合有15个,绿皮萝卜表现抗病的组合有10个。由于试验过程中,火烧坪地区连续阴雨天,一些萝卜综合经济性状表现不佳,影响了对试配组合表现的综合判断,综合根长、根形等性状及外观品质,抗根肿病且性状表现优良的试配组合有3个,分别为L30-4-3A×L56、L30-4-3A×L36和L30-5-7-1A×L42-16-2。可对抗性组合进行多年多点试验,再对鉴定出的组合继续优中选优。
本试验结合了田间调查和苗期鉴定综合判断参试材料的根肿病抗性,筛选出的抗性材料可在后期的抗病育种工作中加以综合利用。调查中发现,萝卜在田间的根肿病发病症状多数是形成侵染后的凹陷黑疤,极感病的材料会形成与芸薹属作物相同的根瘤。结合田间抗性鉴定结果推测,萝卜的根肿病抗病机制可能不仅仅是抗病基因在发挥作用,而是在侵染过程中作物自身的防御坏死机制启动了,萝卜的抗病机制可能在最初根毛的发育与脱落过程中已经进行,该推测有待进一步的研究探讨。
甘彩霞,余阳俊,袁伟玲,崔磊,於校青,邓晓辉.2016a.国内主要十字花科抗根肿病品种在湖北病区的表现.中国蔬菜,(6):53-58.
甘彩霞,李鹏程,邓晓辉,袁伟玲,崔磊,於校青.2016b.长阳县白萝卜栽培现状和优势品种推荐.长江蔬菜,(5):12-14.
汪隆植,何启伟.2005.中国萝卜.北京:科学技术文献出版社:1-14.
汪维红,余阳俊,丁云花,张凤兰,于栓仓,张德双,赵岫云,卢桂香.2013.湖北省长阳县十字花科蔬菜根肿病菌生理小种鉴定及抗源筛选.中国蔬菜,(12):55-60.
肖崇刚,郭向华,韩海波,彭洪江.2002.涪陵榨菜根肿病病原菌鉴定及主要特性.西南农业大学学报,24(6):539-541.
Akito K,Masato T,Nakao K,Takeshi H,Ning W,Tatsuhito F,Masashi H.2010.QTL mapping of clubroot resistance in radish(Raphanus sativus L.).Theor Appl Genet,120:1021-1027.
Al-Shehbaz I,Beilstein M,Kellogg E.2006.Systematics and phylogeny of the Brassicaceae(Cruciferae):an overview.Plant Syst Evol,259:89-120.
Crute I R,Phelps K,Barnes A,Buczacki S T,Crisp P.1983.The relationship between genotypes of three Brassica species and collections of Plasmodiophora brassicae.Plant Pathology,32:405-420.
David A,Caroline D,Xavier A,David M.2013.Salicylic acid suppression of clubroot in broccoli(Brassicae oleracea var.italica)caused by the obligate biotroph Plasmodiophora brassicae.Australasian Plant Pathol,42:141-153.
Diederichsen E,Frauen M,Linders E G A,Hatakeyama K,Hirai M.2009.Status and perspectives of clubroot resistance breeding in Crucifer Crops.J Plant Growth Regul,28:265-281.
Dixon G R.2006.The biology of Plasmodiophora brassicae Wor-a review of recent advances.Acta Hort,706:271-282.
Hirai M.2006.Genetic analysis of clubroot resistance in Brassica crops.Breed Sci,56:223-229.
Murakami H,Tsushima S,Akimoto T,Kuroyanagi Y,Shishido Y.2004.Quantitative studies on the relationship between plowing into soil of clubbed roots of preceding crops caused by Plasmodiophora brassicae and disease severity in succeeding crops.Soil Sci Plant Nutr,50:1307-1311.
Piao Z Y,Park Y J,Choi S R,Hong C P,Park J Y,Choi Y S,Lim Y P.2002.Conversion of AFLP marker linked to clubroot resistance gene into SCAR marker.Journal of the Korean Society Horticultural Science,43:653-659.
Piao Z Y,Ramchiary N,Lim Y P.2009.Genetics of clubroot resistance in Brassica species.J Plant Growth Regul,28:252-264.
Scheijgrond W,Vos H.1954.Investigation on the susceptibility to club root.Euphytica,3:125-139.
Wallenhammar A C.1996.Prevalance of Plasmodiophora brassicae in a spring oilseed rape area in central Sweden and factors influencing soil infestation levels.Plant Pathol,45:710-719.
Yoshikawa H.1993.Studies on breeding of clubroot resistance in cole crops(in Japanese with English summary).Bull Natl Res Inst Veg Ornam Plants Tea Japan Ser A,7:1-165.
Identification and Screening of Radish Clubroot Resistance in Changyang Mountainous Area of Hubei Province
GAN Cai-xia,CUI Lei,YUAN Wei-ling,DENG Xiao-hui*,YU Xiao-qing,JIAO Zhen-biao,JIAO Zhong-jiu,ZHU Feng-juan,QIU Zheng-ming
(Cash Crops Institute,Hubei Academy of Agricultural Sciences,Wuhan 430070,Hubei,China)
Changyang mountainous area is the main occurrence area for clubroot disease in Hubei mountainous region. Taking 100 radish germplasm resources as material,this paper carried out clubroot resistance identification during adult stage,and during seedling stage after artificial inoculation in the fields of Changyang Hujiaping and Huoshaoping. According to the result of comprehensive resistance identification of adult and seedling stages,13 resistant germplasm resources containing 8 white radishes(‘Fuyuan No.1’,‘Hualyu No.8’,‘Chongqingbingtangyuanbai’,‘Chunbulao’,‘Yutangchun’,‘Hanbaiyu’,‘Chunyu’and‘Duanye No.13’),3 red radishes(‘Hongguan’,‘Nanjinghong’and‘Dahongpao’)and 2 green radishes(‘Guantangqing’and‘Deri No.2’)were screened out. In addition,155 radish hybrid combinations were identified in Changyang Huoshaoping clubroot disease nursery and 3 good combinations resistant to clubroot were screened out.
Radish;Clubroot;Adult stage;Seedling stage;Disease resistance
甘彩霞,女,博士,副研究员,专业方向:萝卜抗病育种与种质资源创新,E-mail:gancaixiazhuanye@126.com
*通讯作者(Corresponding author):邓晓辉,男,研究员,专业方向:十字花科作物单倍体育种,E-mail:15927275107@163.com
2017-05-31;接受日期:2017-10-09
国家重点研发计划项目(2016YFD0100204-19),湖北省技术创新专项(2016ABA095)
