野生番茄LA2157中热稳定抗根结线虫基因Mi-9候选基因的分离与过表达载体构建
2017-12-26王银磊陈伟男赵丽萍宋刘霞余文贵赵统敏
王银磊 陈伟男 赵丽萍 周 蓉 宋刘霞 余文贵 赵统敏*
(1江苏省农业科学院蔬菜研究所,江苏南京 210014;2江苏省高效园艺作物遗传改良重点实验室,江苏南京 210014;3扬州大学园艺与植物保护学院,江苏扬州 225009)
野生番茄LA2157中热稳定抗根结线虫基因Mi-9候选基因的分离与过表达载体构建
王银磊1,2陈伟男3赵丽萍1,2周 蓉1,2宋刘霞1,2余文贵1,2赵统敏1,2*
(1江苏省农业科学院蔬菜研究所,江苏南京 210014;2江苏省高效园艺作物遗传改良重点实验室,江苏南京 210014;3扬州大学园艺与植物保护学院,江苏扬州 225009)
根结线虫是番茄上的重要土传病害,选育抗根结线虫品种是最有效的防治方法,但是目前转育到栽培番茄中的抗根结线虫基因Mi-1在土温高于28 ℃时就丧失了抗性。本试验利用热稳定抗根结线虫野生番茄材料LA2157,根据Mi-1基因的序列信息,对其中热稳定抗根结线虫Mi-9基因进行同源克隆,在LA2157中共获得2个候选基因片段;通过In-Fusion克隆技术,将候选基因与过表达载体pBI121进行连接,经电泳检测和测序分析,最终构建Mi-9候选基因的过表达重组载体。
番茄;根结线虫;Mi-9基因;同源克隆;过表达载体构建
番茄(Solanum lycopersicum L.)是我国主要蔬菜种类之一,根结线虫(Meloidogyne spp.)是番茄上重要的土传病害(刘维志,2000),对番茄生产造成严重的影响(赵统敏 等,2012)。在番茄育种中,选育抗根结线虫品种已经成为重要的育种目标之一(Filho & Stevens,1980)。
根结线虫属包括90多个种,其中最为常见、对植物危害严重的主要是南方根结线虫(M.incognita)、花生根结线虫(M. arenaria)、北方根结线虫(M. hapla)和爪哇根结线虫(M. javanica)4种。在北方日光温室,以南方根结线虫分布最广、为害最重(Sasser,1980;赵统敏 等,2012)。感病番茄植株从苗期到成株期均可被根结线虫侵染。根结线虫从侧根根尖侵入、寄生,形成根结,感病初期植株的表型症状并不明显,随着根系吸水能力的下降,在晴天中午气温较高时感病植株会出现类似缺水的萎蔫现象,气温下降时又恢复正常,但随着线虫群体的扩大,根结不断着生和变大,叶片衰老加快,植株生长势减弱,并通常伴随其他病害的发生,导致产量下降,严重的甚至整株枯萎死亡。此外,根结线虫侵染时造成的伤口,也成为其他土传病害的侵入通道,加重植株病害的发生(Dorhout et al.,1993)。
防治根结线虫的方法主要有物理防治、化学防治和生物防治。夏季休棚期,通过深翻耕作层土壤结合高温闷棚,施用杀线剂、生物菌剂可以在一定程度上降低虫口数量,但是不能从根本上解决根结线虫对番茄植株的为害,处理不当还会对人体和环境造成影响(Aboul-Eid et al.,2006)。20世纪40年代,随着抗根结线虫基因从野生番茄转育到栽培番茄中,利用抗病基因已成为防治根结线虫的重要方法之一。第一个被发现的抗根结线虫基因Mi-1,是通过远缘杂交胚挽救的手段从野生番茄转育到栽培番茄中的(Smith,1944)。时至今日,该基因仍然在番茄抗根结线虫中发挥着巨大的作用。Mi-1基因被定位在番茄6号染色体的短臂端,在定位区间内多个同源性极高的片段成簇出现,序列分析证实该基因家族在这一区间内存在7个同源片段。通过对这些基因的分析和功能验证,明确只有Mi-1.2(即Mi-1)对根结线虫具有抗性,其他基因不具有抗根结线虫的能力(Milligan et al.,1998)。但Mi-1基因在土壤温度高于28 ℃时,对根结线虫的抗性就会丧失,在我国保护地栽培区域,番茄生长季中很长的时间都会存在Mi-1基因抗性丧失的情况(Tzortzakakis et al.,2005)。随着番茄野生资源中抗病基因的挖掘,已经明确Mi-2、Mi-3、Mi-4、Mi-5和Mi-9基因在高温条件下仍然具有对根结线虫稳定的抗性(Cap et al.,1993;Veremis &Roberts,1996;Yaghoobi et al.,2005;Jablonska et al.,2007)。目前这些热稳定抗根结线虫基因均未被应用到栽培番茄中,加强对这些基因的利用,可以有效地解决Mi-1基因在生产中遇到的问题。
Mi-9基因是定位于野生番茄材料LA2157中的热稳定抗根结线虫基因,以Mi-1基因的部分序列构建TRV病毒诱导的沉默载体,可以将LA2157对根结线虫的抗性沉默,证明Mi-1与Mi-9基因具有同源性(Jablonska et al.,2007;Wang et al.,2013)。本试验采用同源克隆的方法对野生番茄LA2157中热稳定抗根结线虫基因Mi-9的候选基因进行分离,并构建过表达载体,为阐明Mi-9基因的抗病机理奠定基础。
1 材料与方法
1.1 试验材料
试验于2015年在江苏省农业科学院蔬菜研究所进行。供试材料为热稳定抗根结线虫野生番茄LA2157,含有热稳定抗性基因Mi-9;该材料从美国加州大学番茄种质资源中心引进。试验用根结线虫为南方根结线虫,利用感病番茄moneymaker进行繁殖,之后挑取卵块进行孵化,将收集得到的二龄幼虫用于接种试验(Ammiraju et al.,2003)。
试验用亚克隆载体为北京全式金生物技术有限公司的T3载体,构建重组载体所用骨架载体为江苏省农业科学院蔬菜研究所茄果类实验室保存的pBI121载体;大肠杆菌(Escherichia coli)菌株为Takara公司的DH5α和JM109。
1.2 试验方法
1.2.1 接种 2015年10月,采用50孔育苗穴盘在人工气候室内播种LA2157,苗龄40 d时定植于直径10 cm的营养钵,置于32 ℃恒温培养箱中;7 d后随机选取5株番茄幼苗接种南方根结线虫二龄幼虫,每株接种3 000条;接种30 d后,将5株植株的根系在32 ℃温水中洗净,用吸水纸吸干后包于锡箔纸中,液氮保存(Wang et al.,2013)。
1.2.2 RNA提取及cDNA合成 采用天根生化科技有限公司的RNA提取试剂盒对番茄根系样品进行RNA提取;然后利用TAKARA公司的反转录试剂盒进行cDNA的制备。
1.2.3 同源基因分离和相关引物设计 由于Mi-1与Mi-9基因具有同源性,在进行Mi-9基因的分离时,可以根据已知Mi-1的全基因组序列设计全长扩增引物,以含有Mi-9基因番茄材料LA2157的cDNA为模板,进行序列扩增。对扩增后的序列进行功能验证,可以最终获得Mi-9基因的全长序列信息。根据Mi-1基因的序列信息(序列登录号AF039682.1),利用Primer 5.0软件进行全长扩增引物的设计;同时,根据过表达载体pBI121序列信息,设计用于In-Fusion重组载体构建的引物和重组载体检测的引物(表1)。
1.2.4 In-Fusion重组载体构建 将全长引物Milong-up和Mi-long-low扩增后片段与T3载体进行连接,以此重组载体为模板,采用CTC0414-1 NF和CTC0414-1 NR进行扩增,利用Takara胶回收试剂盒对片段进行回收。将pBI121载体进行双酶切,所用内切酶为BamHⅠ和SmaⅠ。双酶切体系为:载体10 μL,buffer 10×T 1 μL,BamHⅠ和SamⅠ各1 μL,H2O 5 μL,BSA 2 μL。酶切4 h后,回收线性化的载体片段。将外源片段和线性化载体的胶回收产物各1 μL、5×In-Fusion HD Enzyme Premix 2 μL混样,50 ℃连接15 min,将连接产物1 μL转化至JM109感受态中,涂板培养,37 ℃过夜(陈菲帆 等,2015)。
1.2.5 重组载体检测 为了检测重组载体是否为阳性,在载体和基因的连接部分两侧分别设计正向引物和反向引物,扩增结果为目的片段大小时,可以确定载体为重组载体。利用Primer 5.0软件设计重组载体的检测引物nemjz-F和nemjz-R,该引物扩增片段大小为988 bp。PCR反应体系为:单克隆提取质粒DNA 1 μL,DNA聚合酶扩增MIX试剂5 μL,上下游引物各0.1 μL,H2O 4.8 μL。通过对扩增片段进行测序和分析,判断是否为重组载体。
2 结果与分析
2.1 Mi-9候选基因的分离
以野生番茄LA2157的cDNA为模板,采用Mi-long-up/Mi-long-low引物进行全长基因的分离,通过PCR扩增获得1条单一的扩增条带,大小约3 700 bp(图1)。此前在对Mi-1基因进行克隆的时候,已经明确在该基因的分布区间存在多个序列大小相似的同源片段,因此还需对所获得的条带进行分析,确定扩增条带为单基因还是多个基因组成。

图1 Mi-1基因及Mi-9候选基因PCR扩增结果

图2 Mi-1与Mi-9候选基因氨基酸序列比较结果
2.2 分离片段的比较分析
对扩增获得的条带进行回收和T3载体连接转化,对转菌后长出的大肠杆菌单克隆进行测序分析,确定该条带中共包含2个基因片段,将这2个基因分别命名为2157-1和2157-3。对这2个序列进行测序分析,之后与Mi-1基因蛋白序列进行比较(图2)。将基因2157-1和2157-3的翻译蛋白序列2157-1蛋白与2157-3蛋白进行同源性分析,确定同源性为93.16%,与Mi-1基因氨基酸序列同源性分别为92.36%和97.22%。2157-1蛋白由1 252个氨基酸组成,2157-3蛋白和Mi-1蛋白均由1 257个氨基酸组成。
2.3 过表达重组载体的构建
分别利用2157-1、2157-3基因序列与T3连接的质粒为模板,采用CTC0414-1 NF/CTC0414-1 NR引物进行扩增,对扩增片段进行胶回收。同时回收BamHⅠ和SmaⅠ双酶切后线性化的载体质粒pBI121(图3)。之后将载体分别与胶回收后的2157-1和2157-3基因序列片段进行连接。
2.4 重组载体的检测
用于检测重组载体的引物nemjz-F/nemjz-R可以在基因5′端检测外源基因与载体连接点。通过对转化后菌斑的扩增,2157-1、2157-3基因序列与pBI121重组质粒转化的大肠杆菌,均可以在900~1 000 bp间扩增出单一的条带,理论扩增片段大小为988 bp(图4),结果与预期吻合。为了进一步确定所得菌斑内质粒是否为阳性重组质粒,对上述PCR产物进行测序分析,结果证实为阳性重组质粒,至此完成了对候选基因片段过表达载体的构建。

图3 In-Fusion重组载体构建过程中外源片段的扩增(a)及载体线性化(b)
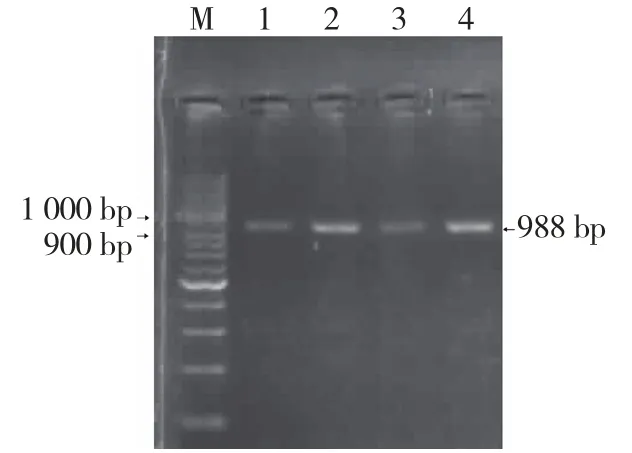
图4 重组载体菌液PCR检测结果
3 结论与讨论
番茄品种选育过程中往往将抗根结线虫和抗另一种番茄毁灭性病害——番茄黄化曲叶病毒病的品种称为双抗品种,可见选育抗根结线虫的番茄品种在育种中的重要性。根结线虫一旦在某一地区发生,就很难根除。除了对番茄造成危害以外,黄瓜、甘蓝、胡萝卜等多种蔬菜均是根结线虫的寄主(唐本安 等,2001;席先梅 等,2017)。选育抗病品种是最为根本、有效、环保的防治方法。但是番茄品种中目前所用的Mi-1基因在土温高于28 ℃时就丧失了对该病害的抗性,造成番茄的减产。
随着全球变暖的加剧,保护地连作障碍的加深,以及Mi-1对根结线虫热敏感的特性,对热稳定抗根结线虫基因在番茄品种中的应用需求日益迫切。通过前期材料筛选,获得1份热稳定抗根结线虫的栽培番茄材料ZN17,通过基因定位将热稳定抗病基因Mi-HT定位在番茄6号染色体Mi-1基因附近(Wang et al.,2013)。研究发现,热稳定抗根结线虫基因Mi-9也位于同一位点附近,通过病毒诱导的基因沉默技术,证实Mi-1、Mi-HT与Mi-9基因具有同源性。因此在对Mi-HT进行进一步研究中,就需要与Mi-9进行比较。本试验根据Mi-1的序列信息,设计全长扩增引物,对Mi-9基因进行同源克隆,获得了2个与Mi-1基因同源性很高的基因,为了研究这2个基因在高温下对根结线虫的抗性,将这2个基因分别与过表达载体pBI121进行重组载体的构建,为之后基因功能的分析奠定了基础。Mi-9基因的克隆与功能分析,也将为阐明热稳定抗根结线虫机理的深入研究提供依据。
陈菲帆,王琪琦,钟辉丽,付冰冰,任丹莉,李玉红.2015.基于In-Fusion技术的ERECTA基因植物表达载体的构建.北方园艺,(18):110-115.
刘维志.2000.植物病原线虫学.北京:中国农业出版社.
唐本安,唐敏,岳新民.2001.南方根结线虫生态地理居群对胡萝卜生产危害的研究.中国农学通报,17(1):28-32.
席先梅,白全江,张庆萍,李玉民,郭金涛,李敏.2017.设施黄瓜根结线虫化学防治技术研究.植物保护,43(2):235-240.
赵统敏,王银磊,杨玛丽,赵丽萍,余文贵.2012.番茄根结线虫病抗性基因的研究进展.江苏农业学报,28(6):1492-1497.
Aboul-Eid H Z,Noweer E M,Ashour N E,Ameen H H.2006.Evaluation of a nematode bio-product Dbx-20% against root-knot nematode Meloidogyne incognita affecting grapevine under field conditions.Communications in Agricultural & Applied Biological Sciences,71(3):659-663.
Ammiraju J,Veremis J,Huang X,Roberts P,Kaloshian I.2003.The heat-stable root-knot nematode resistance gene Mi-9 from Lycopersicon peruvianum is localized on the short arm of chromosome 6.Theoretical & Applied Genetics,106(3):478-484.
Cap G B,Roberts P A,Thomason I J.1993.Inheritance of heat-stable resistance to Meloidogyne incognita in Lycopersicon peruvianum and its relationship to the Mi gene.Theoretical & Applied Genetics,85(6-7):777-783.
Dorhout R,Gommers F J,Kollöffel C.1993.Phloem transport of carboxyfluorescein through tomato roots infected with Meloidogyne incognita.Physiological & Molecular Plant Pathology,43(1):1-10.
Filho H P M,Stevens M A.1980.Tomato breeding for nematode resistance:survey of resistant varieties for horticultural characteristics and genotype of acid phosphatases.Symposium on Production of Tomatoes for Processing,100:383-394.
Jablonska B,Ammiraju J S,Bhattarai K K,Mantelin S,Martinez de Ilarduya O,Roberts P A,Kaloshian I.2007.The Mi-9 gene from Solanum arcanum conferring heat-stable resistance to rootknot nematodes is a homolog of Mi-1.Plant Physiology,143(2):1044-1054.
Milligan S B,Bodeau J,Yaghoobi J,Kaloshian I,Zabel P,Williamson V M.1998.The root knot nematode resistance gene Mi from tomato is a member of the leucine zipper,nucleotide binding,leucine-rich repeat family of plant genes.Plant Cell,10(8):1307-1319.
Sasser J N.1980.Root-knot nematodes:a global menace to crop production.Plant Disease,64(1):36-41.
Smith P G.1944.Embryo culture of a tomato species hybrid.J Amer Soc Hort Sci,44:413-416.
Tzortzakakis E A,Adam M A M,Blok V C,Blok V C,Paraskevopoulos C,Bourtzis K.2005.Occurrence of resistance-breaking populations of root-knot nematodes on tomato in Greece.European Journal of Plant Pathology,113(1):101-105.
Veremis J C,Roberts P A.1996.Differentiation of Meloidogyne incognita and M. arenaria novel resistance phenotypes in Lycopersicon peruvianum and derived bridge-lines.Theoretical &Applied Genetics,93(5-6):960-967.
Wang Y,Yang W,Zhang W,Han Q,Feng M,Shen H.2013.Mapping of a heat-stable gene for resistance to southern root-knot nematode in Solanum lycopersicum.Plant Molecular Biology Reporter,31(2):352-362.
Yaghoobi J,Yates J L,Williamson V M.2005.Fine mapping of the nematode resistance gene Mi-3 in Solanum peruvianum and construction of a S. lycopersicum DNA contig spanning the locus.Molecular Genetics & Genomics,274(1):60-69.
Isolation of Heat-stable Candidate Gene Mi-9 for Resistance to Root-knot Nematode in Wild Tomato LA2157 and Construction of Over-expressive Vector
WANG Yin-lei1,2,CHEN Wei-nan3,ZHAO Li-ping1,2,ZHOU Rong1,2,SONG Liu-xia1,2,YU Wen-gui1,2,ZHAO Tong-min1,2*
(1Institute of Vegetable Crops,Jiangsu Academy of Agricultural Sciences,Nanjing 210014,Jiangsu,China;2Key Laboratory for High Efficient Horticulture Crops Genetic Improvement of Jiangsu Province,Nanjing 210014,Jiangsu,China;3School of Horticulture and Plant Protection,Yangzhou University,Yangzhou 225009,Jiangsu,China)
Root-knot nematode disease is one of the important tomato soil-borne diseases.Breeding varieties with root-knot nematode resistance is an effective control method to deal with this disease.But at present,Mi-1 the only gene transferred to tomato culture with resistance to root-knot nematode loses its resistance when the soil temperature is over 28 ℃.In this study,wild tomato accession LA2157 with heat-stable resistance to root-knot nematode was used.According to the sequence information of Mi-1,we carried out homologous cloning on Mi-9 gene with heat-stable resistance to root-knot nematode and gained 2 candidate gene segments from LA2157.The candidate gene was ligated with the overexpression vector pBI121 by In-Fusion cloning technique.Electrophoresis and sequencing analysis proved that the recombinant vectors of the candidate gene were constructed.
Tomato;Root-knot nematode;Mi-9 gene;Homologous cloning;Over-experessive vector construction
王银磊,男,副研究员,专业方向:蔬菜遗传育种与生物技术,E-mail:yinleiwang@163.com
*通讯作者(Corresponding author):赵统敏,男,研究员,专业方向:番茄育种,E-mail:tmzhaomail@163.com
2017-08-25;接受日期:2017-09-30
国家自然科学青年基金项目(31401884),江苏省自然科学青年基金项目(BK20140739)
