大黄鱼脾酪氨酸激酶的克隆与表达分析
2017-12-22王小龙叶坤王志勇韩芳
王小龙,叶坤,王志勇,韩芳
大黄鱼脾酪氨酸激酶的克隆与表达分析
王小龙,叶坤,王志勇,韩芳*
(集美大学水产学院/农业部东海海水健康养殖重点实验室,福建 厦门 361021)
克隆大黄鱼脾酪氨酸激酶基因(spleen tyrosine kinase,)并分析其结构,通过荧光定量PCR技术分析该基因的组织表达谱以及受LPS、PolyI:C和灭活副溶血弧菌()免疫刺激后的表达变化规律。结果显示:基因cDNA全长2 761 bp,其中开放阅读框为1 851 bp,编码616个氨基酸,预测相对分子质量为70 527,理论等电点为8.13;在所检测到的大黄鱼组织(心脏、肝脏、脾脏、头肾、中肾、鳃、肠、胃、脑)中均有表达,属广谱型表达;不同组织间的表达量存在差异,其中在头肾中的表达量最高,在中肾和脾脏中的次之,在胃中的表达量最低;大黄鱼受到LPS、Poly I:C和灭活副溶血弧菌免疫刺激后,脾脏、头肾和肝脏中基因的表达水平明显上调,表明在大黄鱼抵御病毒和细菌病原的免疫机制中发挥了重要作用。
大黄鱼;脾酪氨酸激酶;组织表达谱;副溶血弧菌;免疫刺激
大黄鱼()为石首鱼科(Sciaenidae)黄鱼属()代表性鱼类,是中国四大海水经济鱼类之一。中国大黄鱼养殖主要集中在东南沿海,其中以福建、浙江等地较多,近年来已经形成了年产量近15万t的养殖规模[1]。目前,大黄鱼养殖病害主要由细菌、病毒和寄生虫等引起,随之出现了乱用药、滥用药所导致的养殖水域水质恶化、种质资源退化等问题。小G蛋白Rab5A作为重要的分子开关在大黄鱼抵御病毒、细菌和寄生虫的先天性免疫过程中发挥了重要作用[2]。脾酪氨酸激酶(spleen tyrosine kinase, Syk)与Rab5A存在蛋白质互作。当前关于酪氨酸激酶特别是脾酪氨酸激酶的研究主要是针对哺乳动物。脾酪氨酸激酶是蛋白酪氨酸激酶家族中的一类非受体型酪氨酸激酶,在信号传递过程中,由于能量需求的增加,脾酪氨酸激酶通过催化ATP的γ磷酸基,将磷酸基转移到下游蛋白质的酪氨酸残基上,使其磷酸化,促进信号传递,进而调控细胞生长、增殖和分化等[3]。目前已有关于鲤鱼()、斑马鱼()[4]、大西洋鲑()、大菱鲆()[5]、斑点叉尾鮰()[6]以及七鳃鳗()[7]中脾酪氨酸基因序列研究的报道,但鲜有关于其基因表达特征和功能等的研究。笔者对大黄鱼脾酪氨酸激酶的克隆与表达特征以及病毒和细菌免疫刺激后基因表达的变化进行研究,以期揭示在大黄鱼中的免疫分子机制,为大黄鱼养殖病害防治及抗病育种提供参考。
1 材料与方法
1.1 材料
健康大黄鱼取自福建省宁德市金铃水产科技有限公司,体长为(15±2) cm,体质量为(130±10) g。试验前在温度为23~26 ℃、盐度为27~28 psu的充气海水中驯养2周。
脂多糖(lipopolysaccharides,LPS)、聚肌苷酸胞嘧啶核苷酸(PolyI:C)购自Sigma公司;副溶血弧菌()由集美大学水产学院鄢庆枇教授惠赠。
从暂养群体中选取6尾正常大黄鱼,剖取心脏、肝、脾、头肾、中肾、鳃、肠、胃和脑组织,于液态氮中冷冻,存放于–80 ℃冰箱。
从暂养群体中选取240尾大黄鱼,平均分成4组(1个对照组,3个试验组),用丁香酚麻醉后,试验组分别腹腔注射0.25 mL Poly I:C(1 g/L)、0.25 mL LPS(1 g/L)和0.25 mL的副溶血弧菌(,1×108cfu/mL)进行攻毒;对照组腹腔注射0.25 mL PBS。试验期间的饲养温度、pH和盐度等与驯养条件一致。试验组与对照组分别于刺激前以及刺激后3、6、12、24、48、72 h取样,每个时间点取5尾鱼的肝脏、脾脏和头肾。试验重复3次。
1.2 方法
1.2.1总RNA的提取及cDNA的合成
大黄鱼组织样品RNA的提取采用Trizol Reagent Kit (Invetrogeon,USA),并用RNase–free Dnase (Promega, USA)除去其中的DNA杂质,产物用1%琼脂糖凝胶电泳。cDNA第一条链的合成采用GoScript™ Reverse Transcription kit (Promega, USA)进行。以合成的cDNA为模板扩增大黄鱼管家基因–,用以对cDNA合成质量进行检测。将质量较好的cDNA于–20 ℃保存,备用。
1.2.2基因的克隆
大黄鱼基因cDNA具体数据源自GenBank数据库(登录号:XM_010751528.2),并参考其序列信息,设计1对引物F 和–R (表1),通过RT–PCR扩增其ORF。扩增程序:94 ℃ 预变性5 min;94 ℃变性30 s, 56 ℃退火30 s,72 ℃延伸2 min,30个循环;最后再72 ℃延伸10 min。PCR产物纯化后连接pMD–19T vector (TaKaRa, 大连,中国),送华大基因(上海)科技有限公司测序。

表1 LcSyk基因扩增的引物序列和退火温度
1.2.3生物信息学分析
序列同源性比对采用在线BLAST((http://blast. ncbi.nlm.nih/.govBlast.cgi);通过ExPASy(http://web. expasy.org/compute_pi/)预测大黄鱼脾酪氨酸激酶蛋白等电点及其相对分子质量;分别采用Signal IP Server 4.1(http://www.cbs.dtu.dk/services/SignalP/)和NetPhos 3.1 Server(http://www.cbs.dtu.dk/services/ NetPhos/)预测该蛋白质的信号肽和磷酸化位点;通过SMART (http://smart.embl–heidelberg.de/)预测大黄鱼脾酪氨酸激酶的结构功能域;采用SWISS– MODEL(https://swissmodel.expasy.org/)并结合Swiss PDB Viewer预测该蛋白的三级空间结构;将大黄鱼脾酪氨酸氨基酸序列与其他物种该蛋白进行多重比对后,用MEGA 5.02构建脾酪氨酸激酶的系统进化树。
1.2.4实时荧光定量PCR分析
根据大黄鱼管家基因–设计内参引物––F和––R (表1,=2.01,2=0.995 5),产物长度为107 bp[8]。在测序所得的基因ORF序列内设计试验引物–QF和–QR(表1,=1.93,2=0.999 6),产物长度为132 bp。反应体系(20 μL)为:10 μL TransStart Top Gree qPCR SuperMix (2×),0.4 μLQF(10 μmol/L),0.4 μLQR (10 μmol/L),0.4 μL Passive Reference Dye(50×),5 μLcDNA模板及3.8 μL ddH2O。扩增程序:94 ℃预变性30 s;94 ℃变性5 s,60 ℃退火15 s,72 ℃延伸10 s,共40个循环。试验设置3个生物学重复,每个样品进行3个技术性重复。采用2–ΔΔCt法结合SPSS19.0中的One–Way ANOVA和LSD Multiple Comparison Test分析各样品间基因表达的差异。
2 结果与分析
2.1 LcSyk基因的cDNA序列
基因cDNA全长2 761 bp,包括246 bp的5′端和664 bp的3′端非编码区,其开放阅读框(ORF)为1 851 bp,编码616个氨基酸(图1)。通过ExPasy预测其蛋白相对分子质量为70 527,理论等电点为8.13;采用TMHMM Server和Signal IP Server预测其没有跨膜区和信号肽,表明该蛋白可能是游离的非分泌蛋白;通过NetPhos 3.1 Server预测其存在18个丝氨酸(Ser)、6个酪氨酸(Tyr)及6个苏氨酸(Thr)磷酸化位点,推测大黄鱼脾酪氨酸激酶蛋白自身可能受磷酸化激酶的调控。由SMART进行分析的结果表明,该蛋白主要存在Src同源结构域(8–93 aa及161–245 aa,SH2 domain)和酪氨酸激酶催化结构域(352–607 aa,TyrKc domain)2种保守结构域。

起始和终止密码子用黑色方框标出;潜在的磷酸化位点(T为苏氨酸;Y为酪氨酸磷酸;S为丝氨酸磷)用黑色阴影突出显示;灰色阴影部分依次为SH2–N、SH2–C及TyrKc结构域。
2.2 LcSyk基因系统发育树的构建
BLASTp比对分析结果(图2)显示:大黄鱼LcSyk蛋白氨基酸序列与较多物种具有较高的一致性(63%~89%),从低到高分别为非洲爪蟾(,XP_002937073.2),原鸽(,XP_013222534.1),褐家鼠(,NP_036890.1),家兔(,XP_002708308.1),人(,NP_003168.2),原鸡(,NP_001026601.1),狨猴(,XP_008990899.1),鲤鱼(,AAK49117.1),斑马鱼(,NP_998008.2),大西洋鲑(,NP_001167144.1),斜带石斑鱼(,ALG38206.1)。采用MEGA5.02软件并以邻接法(NJ)构建系统发育树(图3),结果显示大黄鱼基因与斜带石斑鱼最近,并与其他鱼类(大西洋鲑、斑马鱼、鲤鱼)聚为一支,其余物种的基因分别以鸟类、哺乳类及两栖类为单位各自形成一个分支。
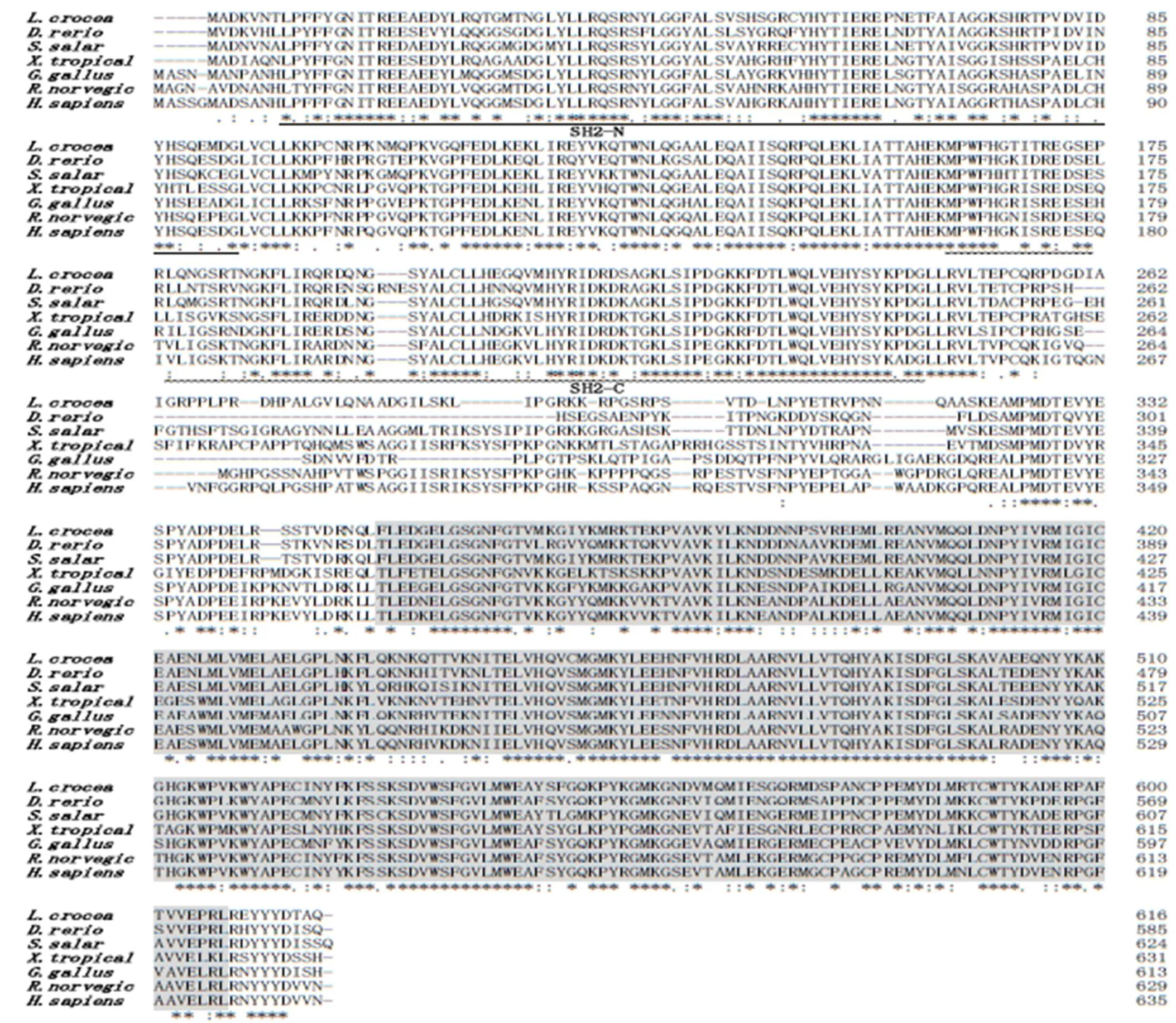
Syk蛋白的SH–N和SH–C及结构域分别用下划线和波浪线标出;TyrKc结构域用黑色阴影标出。

图3 根据LcSyk基因编码氨基酸绘制的N–J系统发育树
2.3 LcSyk蛋白的三级结构分析
如图4所示,LcSyk蛋白三级结构中的SH2–N、SH2–C及TyrKc结构域分别以绿色、蓝色和紫色标示出来。此外,以上结构域间还存在黄色标示的Inter SH2(A)及浅灰色标示的Interdomain linker(B)2个域间连接。LcSyk蛋白的N末端的前半部分包含2个SH2结构域紧密耦联的模块,由1个螺旋线圈状的域间连接A串联起来。SH2结构域与酪氨酸激酶催化结构域之间也有一段较长的域间连接B,结合大黄鱼基因和其他物种氨基酸序列的多重比对结果(图2)分析,发现该部分是不同Syk蛋白出现遗传分化的主要区域。
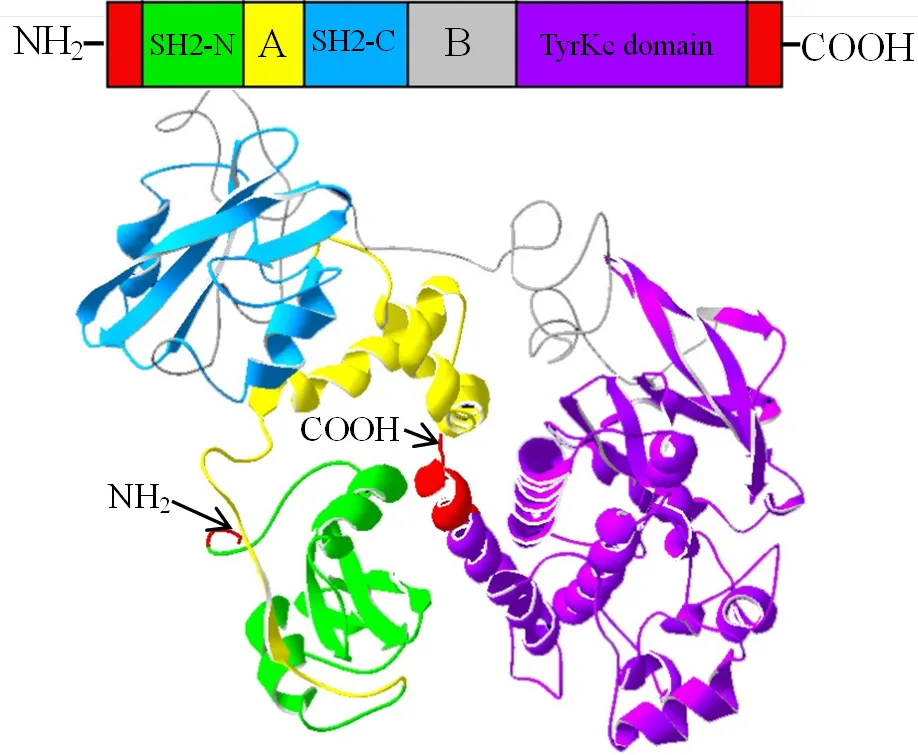
LcSyk蛋白不同的结构域分别以各自的颜色显示,其中A为Inter SH2;B为Interdomain linker。
2.4 大黄鱼LcSyk基因的组织表达分析
荧光定量PCR检测大黄鱼组织表达谱的结果(图5)显示,在所检测的大黄鱼9个组织或器官中均有脾酪氨酸激酶的表达,表明脾酪氨酸激酶在大黄鱼体内是广谱型表达。尽管基因mRNA在大黄鱼体内广泛表达,但其表达量存在明显差异(图5):头肾组织中的表达量最高(表达量从高到低依次为头肾、中肾、脾脏、鳃、肝脏、肠、脑、心脏、胃)。
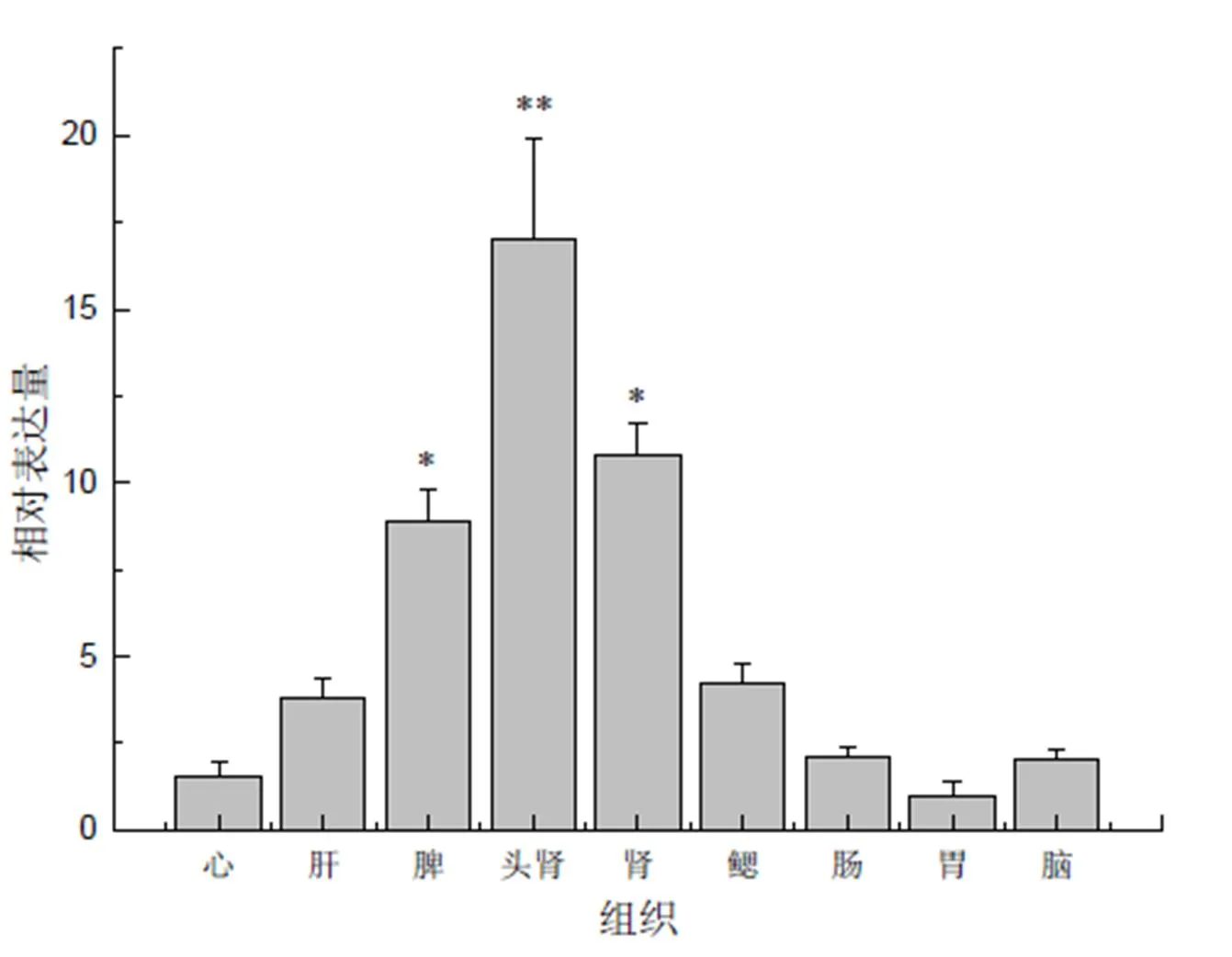
“*”示P<0.05水平差异;“**”示P<0.01水平差异。
2.5 大黄鱼LcSyk基因免疫刺激后的表达变化
在脾脏中,大黄鱼经LPS、Poly I:C和副溶血弧菌刺激后,表达量在前6 h相对于对照组无明显变化,之后逐渐升高,并在24 h时达到最高峰,分别为对照组的6.9、7.8、6.0倍,此后逐渐下降,其中副溶血弧菌刺激后72 h时仍明显高于对照组(图6)。
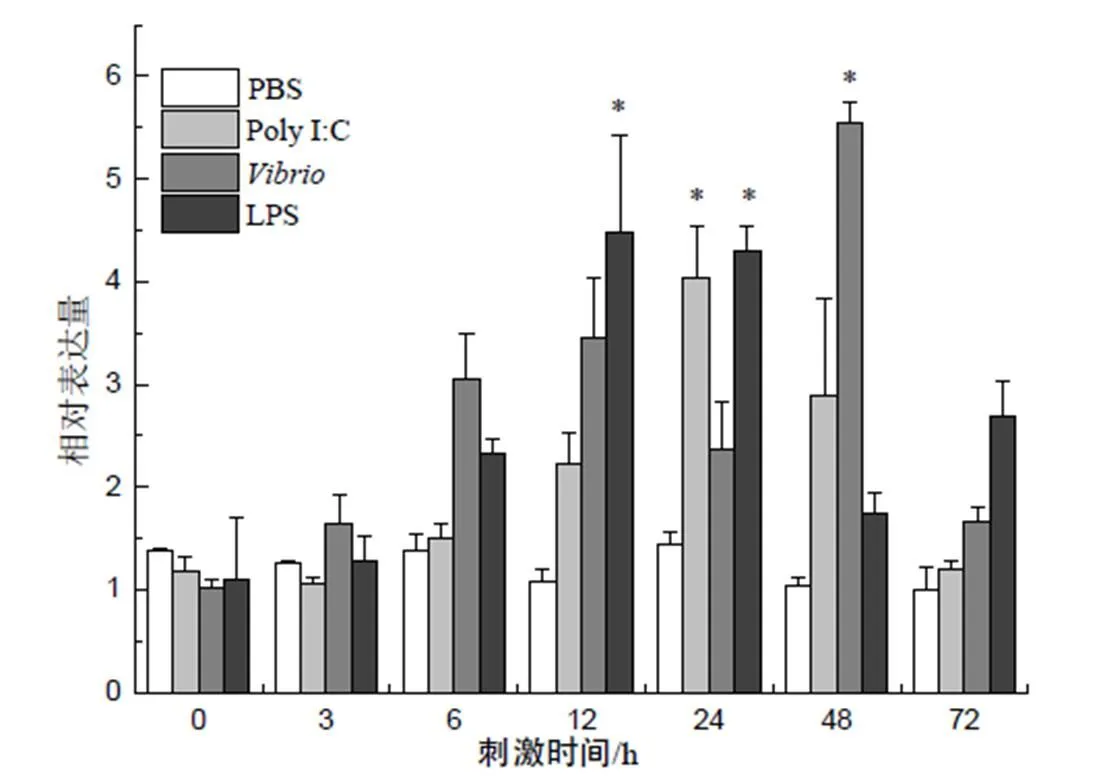
“*”示P<0.05水平差异。
在肝脏中,经LPS、Poly I:C和副溶血弧菌刺激后,大黄鱼脾酪氨酸激酶表达量均明显上调(图7),其中LPS免疫刺激组在刺激后12 h的表达量最高,约为对照组的4.5倍,之后表达量虽稍有下降,但免疫刺激后72 h仍明显高于对照组;副溶血弧菌刺激组在刺激后48 h的表达量最高,约为对照组的5.5倍。病毒类似物Poly I:C刺激组刺激后24 h脾酪氨酸激酶的表达量最高,约为对照组的4.0倍。
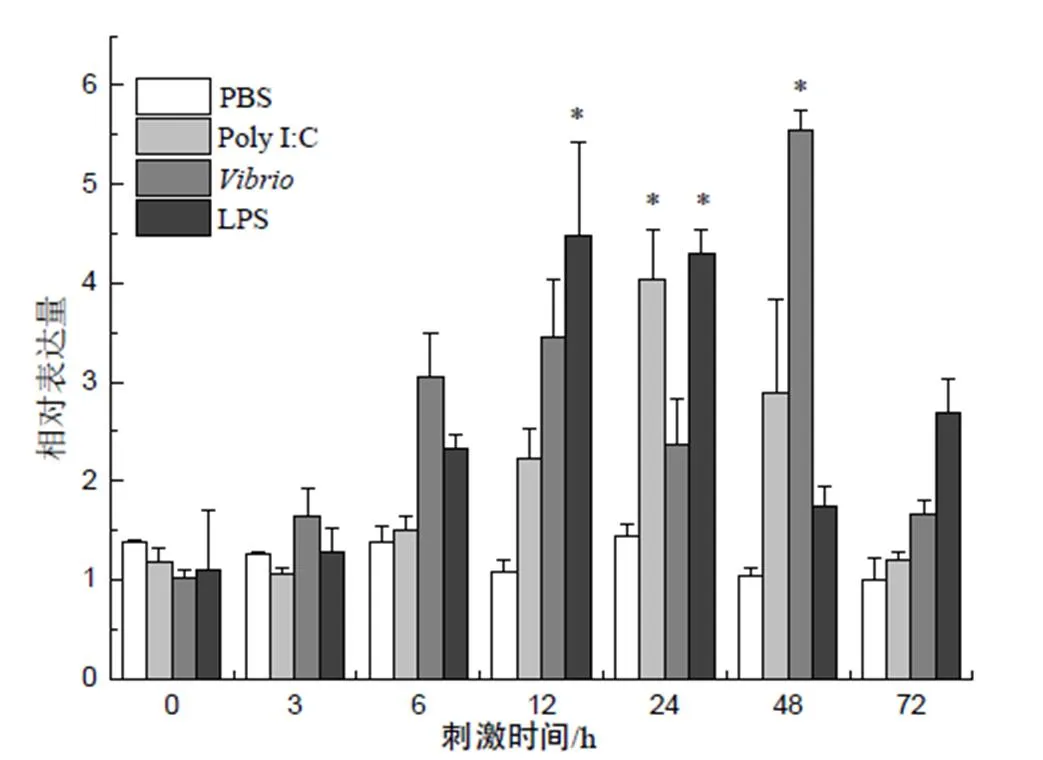
“*”示P<0.05水平差异。
在头肾中,大黄鱼经LPS和副溶血弧菌刺激后,表达量迅速升高(图8),并在刺激后3 h达到峰值,分别约为对照组的2.5倍和3.2倍,而病毒类似物Poly I:C免疫刺激组基因表达量的上调相对滞后,最终于刺激后48 h达到峰值,约为对照组的3倍。
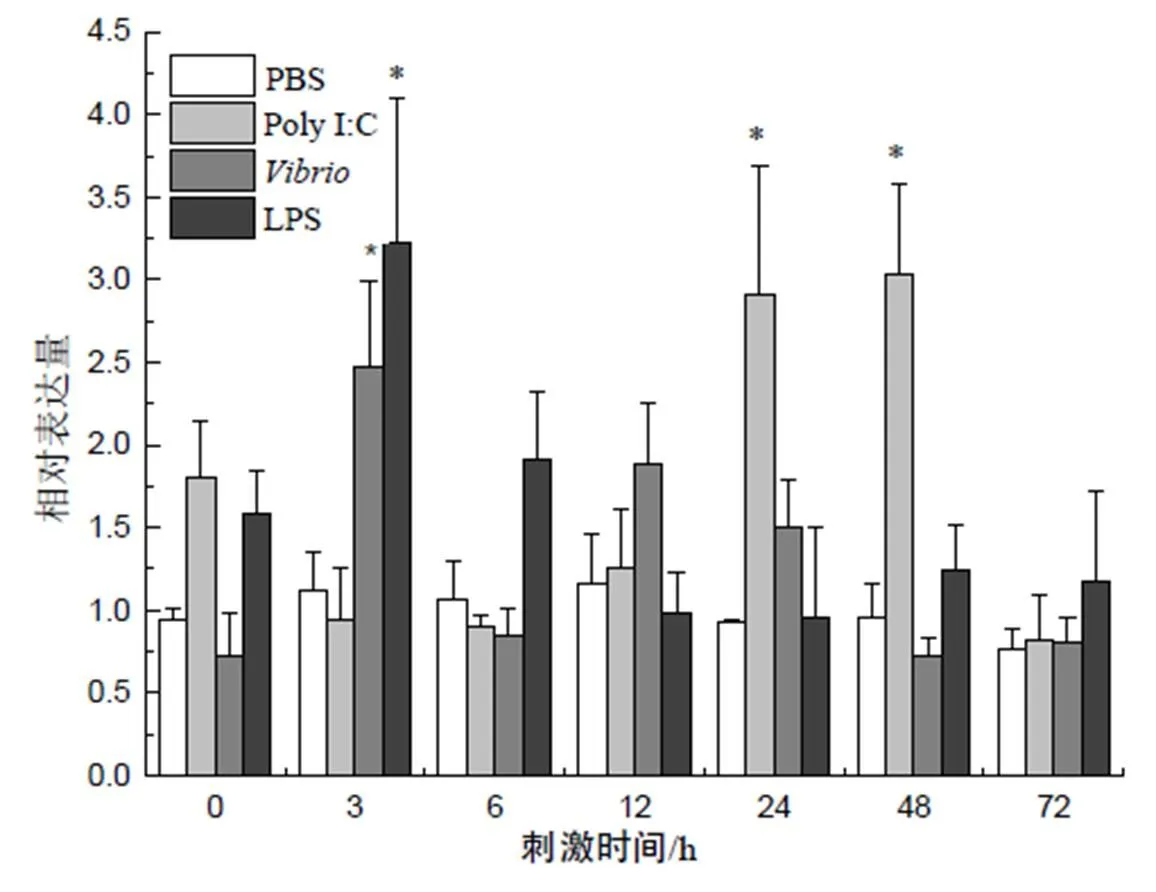
“*”示P<0.05水平差异。
此外,腹腔注射PBS对照组的表达量在脾脏、头肾和肝脏中各时相(刺激后0、3、6、12、24、48、72 h)的相对表达量均无明显升高或降低。
3 结论与讨论
酪氨酸激酶作为分子开关,调节B淋巴细胞的多种生理学功能[9–10]。Rab5A蛋白也是作为分子开关发挥生物学功能。一旦酪氨酸激酶发生突变,当其一直处于分子开关中“开”的状态时会导致许多癌症发生[11]。酪氨酸激酶功能失调也会造成许多炎性疾病,比如全身性炎症、某些慢性炎症、动脉粥样硬化等[12]。通过对酪氨酸激酶活性进行干预,可为有机体炎性疾病及自身免疫病治疗提供思路[13]。这一途径也可能为大黄鱼病害防治研究提供参考。
LcSyk蛋白含有酪氨酸激酶家族典型的Src同源结构域(SH2 domain)和酪氨酸激酶催化结构域(TyrKc domain)。Src同源结构域与受体酪氨酸激酶磷酸化残基具有很高的亲和力,它协助磷酸化反应完成,从而促进信号转导[14–15]。SH2与TyrKc结构域间还存在2个域间连接,它们赋予了LcSyk蛋白结构的灵活性和SH2结构域的独立性[16],可能为参与的多种信号转导通路提供较好的分子基础。本研究中通过对大黄鱼脾酪氨酸激酶基因表达谱的分析,发现是一个可以在多种组织中表达的基因,表明其在这些组织中具有重要的生理功能。基因在所检测的9个大黄鱼器官或组织中均有表达,属广谱型表达。这与对七鳃鳗的研究结果[7]一致。在不同组织中表达量的差异明显,在头肾组织中的表达量最高,在中肾和脾脏中也有高表达。硬骨鱼类的免疫器官主要包括胸腺、头肾、脾脏及黏膜淋巴组织[17]。胸腺在鱼苗早期发挥主要免疫作用。头肾相当于一种二级淋巴器官,在幼鱼和成鱼时期发挥免疫作用,是免疫细胞发生、增殖、分化的主要场所,同时也担负着捕获抗原和产生抗体的重任[18]。虹鳟鱼在注射有放射性物质标记的细菌后,70%以上被注射细菌驻留在头肾,说明头肾是捕获抗原与免疫应答启动的主要部位[19–20]。脾脏是鱼类机体中各种中性粒细胞、红细胞等产生、储存和成熟的主要场所,不仅具有各种免疫细胞的功能,还具有造血功能[18]。在大黄鱼肾脏和脾脏组织中的高表达,表明脾酪氨酸激酶在大黄鱼免疫应答中扮演着重要角色。
在大黄鱼中,经LPS、Poly I:C和副溶血弧菌刺激后,基因表达量不同程度上调。
本研究结果表明,基因在大黄鱼不同组织中的表达差异较明显,其中在头肾中的表达量最高,在胃中的表达量最低。不同物种的Syk蛋白在进化上较为保守,都包含Src同源结构域和酪氨酸激酶催化结构域。大黄鱼经Poly I:C、和LPS免疫刺激后,与基因的表达变化类似,均明显上调。推测与可能在其信号级联中通过炎症及吞噬作用共同在大黄鱼免疫机制中发挥着重要作用,但其具体作用机制还有待研究。
[1] 董金和. 中国渔业统计年鉴[M]. 北京:中国农业出版社,2013.
[2] HAN F,ZHANG Y,ZHANG D,et al. Thegene of marine fish,large yellow croaker (),and its response to the infection of[J]. Fish Shellfish Immunol,2016,54:364–373. DOI:10.1016/j.fsi.2016.04.025.
[3] HANKS S K,QUINN A M,HUNTER T. The protein kinase family:conserved features and deduced phylogeny of the catalytic domains[J]. Science,1988,241(4861):42–52. DOI:10.1126/science.3291115.
[4] CHALLA A K,CHATTI K. Conservation and early expression of zebrafish tyrosine kinases support the utility of zebrafish as a model for tyrosine kinase biology[J]. Zebrafish,2013,10(3):264–274. DOI:10. 1089/zeb.2012.0781.
[5] 王贤丽,张玉喜,孟亮,等. 大菱鲆T淋巴细胞酪氨酸激酶(LCK)基因全长cDNA的克隆及表达分析[J]. 中国水产科学,2009,16(5):660–667. DOI:10.3321/j. issn:1005–8737.2009.05.003.
[6] TAYLOR E B,WILSON M,BENGTEN E. The Src tyrosine kinase Lck binds to CD2,CD4–1,and CD4–2 T cell co–receptors in channel catfish,[J]. Mol Immunol,2015,66(2):126–138. DOI:10.1016/j. molimm.2015.02.023.
[7] LIU C,SU P,LI R,et al. Molecular cloning,expression pattern,and molecular evolution of the spleen tyrosine kinase in lamprey,[J]. Dev Genes Evol,2015,225(2):113–120. DOI:10.1007/s00427– 015–0492–5.
[8] ZHANG D L,Lü C H,YU D H,et al. Characterization and functional analysis of a tandem–repeat galectin–9 in large yellow croaker[J]. Fish Shellfish Immunol,2016,52:167–178. DOI:10.1016/j. fsi.2016.03.032.
[9] TANIGUCHI T,KOBAYASHI T,KONDO J,et al. Molecular cloning of a porcine gene syk that encodes a 72–kDa protein–tyrosine kinase showing high susceptibility to proteolysis[J]. J Biol Chem,1991,266(24):15790– 15796.
[10] FENG G,WANG X. Role of spleen tyrosine kinase in the pathogenesis of chronic lymphocytic leukemia[J]. Leuk Lymphoma,2014,55(12):2699–2705. DOI:10.3109/ 10428194.2014.891026.
[11] 邵圣娟,李艳妮. 靶向抗癌药伊马替尼耐药性的研究进展[J]. 中国新药与临床杂志,2013,32(7):512–520.
[12] RUETTEN H,THIEMERMANN C. Effects of tyrphostins and genistein on the circulatory failure and organ dysfunction caused by endotoxin in the rat:a possible role for protein tyrosine kinase[J]. British Journal of Pharmacology,1997,122(1):59–70.
[13] SINGH R,MASUDA E S,PAYAN D G. Discovery and development of spleen tyrosine kinase (SYK) inhibitors[J]. J Med Chem,2012,55(8):3614–3643. DOI:10.1021/jm 201271b.
[14] GRÄDLER U,SCHWARZ D,DRESING V,et al. Structural and biophysical characterization of theactivation switch[J]. J Mol Biol,2013,425(2):309–333. DOI:10.1016/j.jmb.2012.11.007.
[15] MAYER B J,HIRAI H,SAKAI R. Evidence that SH2 domains promote processive phosphorylation by protein– tyrosine kinases[J]. Curr Biol,1995,5(3):296–305. DOI:10.1016/s0960–9822(95)00060–1.
[16] FÜTTERER K,WONG J,GRUCZA R A,et al. Structural basis fortyrosine kinase ubiquity in signal transduction pathways revealed by the crystal structure of its regulatory SH2 domains bound to a dually phosphorylated ITAM peptide[J]. J Mol Biol,1998,281(3):523–537. DOI:10.1006/jmbi.1998.1964.
[17] MESEGUER J,LÓPEZ–RUIZ A,GARCÍ–AYALA A. Reticulo–endothelial stroma of the head–kidney from the seawater teleost gilthead seabream (L.):an ultrastructural and cytochemical study[J]. The Anatomical Record,1995,241(3):303–309. DOI:10.1002/ar.10924 10303.
[18] 田敬云,谢海侠,姚卫建,等. 鳜鱼头肾的组织发生及成鱼头肾B淋巴细胞的分布[J]. 动物学报,2005,51(3):440–446. DOI:10.3969/j.issn.1674–5507.2005.03.009.
[19] 王卫卫,吴谡琦,孙修勤,等. 硬骨鱼免疫系统的组成与免疫应答机制研究进展[J]. 海洋科学进展,2010,28(2):257–265. DOI:10.3969/j.issn.1671–6647.2010.02. 018.
[20] RADHA V,NAMBIRAJAN S,SWARUP G. Association of Lyn tyrosine kinase with the nuclear matrix and cell–cycle–dependent changes in matrix–associated tyrosine kinase activity[J]. Eur J Biochem,1996,236(2):352–359. DOI:10.1111/j.1432–1033.1996.00352.x.
责任编辑:王赛群
英文编辑:王库
Cloning and expression analysis of spleen tyrosine kinase gene in
WANG Xiaolong,YE Kun,WANG Zhiyong,HAN Fang*
(Fisheries College, Jimei University/Key Laboratory of Healthy Mariculture for the East China Sea, Ministry of Agriculture, Xiamen 361021, China)
The structure of spleen tyrosine kinase gene in()was analyzed from cloned samples, the expression ofmRNA in different tissues was analyzed by quantitative real–time PCR (qRT–PCR), and their expression levels were investigated after stimulated with LPS, polyinosinic polycytidynic acid and. The results showed that the full length cDNA ofwas 2 761 bp, including an ORF of 1 851 bp, encoding with 616 amino acids. The predicted molecular weight and theoretical isoelectric point was 70 527 and 8.13, respectively. The qRT–PCRexpression profiles ofshowed that it could express in all 9 examined tissues, including heart, liver, spleen, head–kidney, kidney, gill, intestine, stomach and brain, but the expression levels were different. The dominant expression level was detected in head–kidney, followed by kidney and spleen, but it was the lowest in stomach. Moreover, it was significantly up–regulated after stimulated with Poly I:C,and LPS. This suggested thatmight play an important role in enhancing immunity against bacteria and virus.
; spleen tyrosine kinase; tissue expression profile;; immune stimulation
Q953.3
A
1007-1032(2017)06-0662-07
2017–05–11
2017–11–01
国家自然科学基金项目(31402339);福建省高校杰出青年科研人才计划项目(20152018);农业部南海渔业资源开发利用重点实验室开放课题(FREU2016–05)
王小龙(1992—),男,湖北咸宁人,硕士研究生,主要从事水产动物免疫学研究,466198152@qq.com;
通信作者,韩芳,女,副教授,主要从事水产动物免疫学研究,hanfangyc@jmu.edu.cn
投稿网址:http://xb.hunau.edu.cn
