海洋链霉菌P10–16代谢产物的分离与鉴定
2017-12-21郭俊夫宗蜜蜜徐文平陶黎明
郭俊夫,宗蜜蜜,徐文平,陶黎明
海洋链霉菌P10–16代谢产物的分离与鉴定
郭俊夫,宗蜜蜜,徐文平,陶黎明
(华东理工大学药学院,上海 200237)
以海洋链霉菌P10–16为材料,采用柱层析、薄层层析和高效液相色谱等方法分离、纯化其代谢物质,利用质谱和核磁等鉴定其化合物的结构,并以稻瘟病菌为指示菌,研究化合物的抑菌活性。结果表明:从海洋链霉菌中首次分离出伊枯草菌素类化合物(伊枯草菌素A–2、A–3、A–4、A–6和A–7)和邻苯二甲酸二(2–乙基己基)酯(DEHP)。伊枯草菌素A–2对稻瘟病菌的半抑制浓度和最小抑制浓度分别为26.471、62.500 μg/mL, DEHP对稻瘟病菌的半抑制浓度和最小抑制浓度分别为1.916、15.625 μg/mL。
海洋链霉菌P10–16;分离;纯化;伊枯草菌素A;结构鉴定;抗菌活性
农业上大规模使用化学农药,既提高了病虫害抗药性,又造成了环境污染,还导致人畜中毒等事件增加,因此,高效、低毒、低残留的微生物农药是环境友好型农药研究的新方向。放线菌是较有价值的微生物,已有超过一万多种生物活性次级代谢产物从放线菌分离出来,而其中大约70%的产物来自链霉菌属[1]。20世纪50年代以来,陆地放线菌已经被逐步筛选出来,其中包括抗生素、抗癌、抗肿瘤[2]和免疫抑制药物[3]。近年来,科技工作者日益关注海洋天然产物的进展[4],在未勘探开发的栖息地中发现了新的微生物群[5–6]。海洋环境已经被证明是一个丰富的微生物栖息地以及新颖的次生代谢物产生地[7–8]。本研究中,以海洋链霉菌P10–16为材料,对其代谢活性物质进行了分离、纯化和鉴定,并研究其对稻瘟病菌的抑菌活性,现将结果报道如下。
1 材料与方法
1.1 材料
供试菌株:海洋链霉菌P10–16,从海南潮间带红树林老鼠簕中分离而来,由国家海洋局第一海洋研究所的田黎老师采集,保存于中国微生物菌种保藏中心(CGMCC No. 11467);稻瘟病菌由上海国家南方农药研究中心提供。
斜面培养基配方:可溶性淀粉20 g,K2HPO40.5 g,MgSO40.5 g, FeSO40.01 g,土壤浸提液200 mL,人工海水50 mL,琼脂15 g,加水配成1 L。调节pH至7.0~7.2。
发酵培养基配方:可溶性淀粉10 g,葡萄糖20 g,黄豆粉25 g,肉膏1 g,酵母粉4 g,氯化钠2 g,K2HPO40.05 g,加水配成1 L。调节pH至7.0~7.2。
抑菌活性指示菌培养基为马铃薯葡萄糖琼脂培养基(PDA)。
主要仪器:LC–20AT高效液相色谱仪和SCL–8A高效液相制备色谱仪(日本岛津公司)、SPY–50双层旋转摇床(上海市离心机械研究所)、Bruker DPX–400 spectrometer核磁共振仪(Bruker, Switzerland)、Mass spectrometer质谱仪(Mass Spectrometry Instruments Ltd., Britain)和Toshiba UV–2501PC紫外全光谱扫描仪(Toshiba, Japan)等。
主要试剂:乙腈、甲醇,色谱纯,美国Honeywell公司产品;甲醇、乙醇、二氯甲烷、丙酮、正丁醇、氯化钠、氢氧化钠、重铬酸钾、浓盐酸、浓硫酸均为分析纯。
1.2 方法
1.2.1菌株发酵培养
将发酵培养基装入250 mL锥形瓶中,每瓶60 mL,121 ℃灭菌20 min。冷却后,将1株长满斜面的菌株P10–16接入发酵培养基。在摇床上220 r/min、28 ℃培养7 d。发酵液4 000 r/min离心,收集上清液,待用。
1.2.2抑菌物质的分离与纯化
发酵上清液用正丁醇萃取3次,合并有机相。正丁醇萃取相减压蒸馏除去溶剂,用甲醇溶解过滤后得到粗提物。取少量粗提物溶于甲醇,用薄层层析和离体抗菌试验来探索粗提物在不同流动相中的活性分布,调节薄层层析流动相比例,把粗提物中的各个抗菌活性成分尽量分开,结合离体抗菌试验来确定活性成分在薄层层析板中的位置。探索发现在展开剂为二氯甲烷和甲醇,体积比为5∶2时,板中活性条带在不同Rf值中都有分布。
探索出展开剂比例后,将粗提物溶于适量甲醇进行硅胶柱(直径3 cm,长度100 cm,柱高50 cm,硅胶颗粒直径为0.074 mm)层析分离。薄层层析展开剂比例的结果可以指导柱层析流动相配制。根据探索得到的薄层色谱展开剂比例来配制柱层析的流动相比例,分别设置二氯甲烷和甲醇体积比为5∶1、5∶2、1∶1和0∶1进行梯度柱层析。每50 mL收一馏分,将不同的馏分点板,合并相同条带的馏分,得到7个组分,依次命名为A、B、C、D、E、F、G。
将7个组分进行离体抗菌试验,发现组分F活性较好且含量较高,故选取组分F进行下一步试验。将组分F进行薄层层析,通过活性跟踪发现Rf值为0.4~0.5区域条带有抑菌活性。刮下薄层层析硅胶板上的活性条带,将其浸泡在甲醇中,过滤浓缩后待用。
组分F在Rf值为0.4~0.5样品进行高效液相色谱(制备柱型号为VP250/21 Nucleosil 100–7 C18,柱温28 ℃,流速20 mL/min,紫外检测波长为210 nm)分离,流动相为37.5%的乙腈–水溶液,样品中含有5个具有抑菌活性的化合物。5个化合物的保留时间分别为12.8、18.7、20.0、36.3、41.1 min,相对应的质量分别为22、10、12、11、9 mg。
调整流动相比例为90%甲醇–水溶液,组分F在Rf值为0.4~0.5样品中含有1个具有抑菌活性的化合物,其保留时间为18.7 min,质量为16 mg,命名为化合物6。
1.2.3组分的结构鉴定
制备所得的6个化合物通过质谱和核磁光谱来确定结构。
1.2.4抗菌活性测定
本课题组前期试验发现, P10–16的次级代谢产物中的有效活性成分对稻瘟病菌有抑制作用,因此,选用稻瘟病菌作为指示菌。离体抗菌试验采用纸碟法。将高效液相色谱制备所得化合物进行离体抗菌试验。将待测化合物加无菌水配制成浓度为1 250 μg/mL的溶液,依次稀释,分别得到浓度为625、312.50、156.25、78.125 μg/mL的溶液。在无菌条件下将1 mL含有待测药物溶液和9 mL融化PDA混合均匀,分别制成浓度为125、62.5、31.25、15.625、7.812 5 μg/mL的含药平板,以不含药的平板为对照。用直径5 mm打孔器打孔,将稻瘟病菌接种于平板中央,28 ℃恒温培养。当对照平板上的菌丝刚好长满培养皿时,用十字交叉法测量菌落直径,计算各个浓度平板的生长抑制率。抑菌率=(对照平板菌落直径 – 处理菌直径)/(对照平板菌落直径 – 打孔器直径)×100%。以化合物浓度对数为横坐标,抑制率为纵坐标,得曲线方程,计算半抑制浓度和最小抑制浓度。
2 结果与分析
2.1 活性化合物的结构鉴定
2.1.1活性化合物1至化合物5的结构鉴定
化合物1至化合物5的结构式如图1 所示。化合物1的质谱图显示1 043.5和1 065.5有出峰,从而确定1 043.5为[M+H]+峰,1 065.5为[M+Na]+峰,化合物1的分子量为1 042,推测分子式为C48H75N12O14。根据化合物1中所有1H(表1)和13C(表2)的核磁信息并结合相关文献谱图[9],确定化合物1为伊枯草菌素A–2。
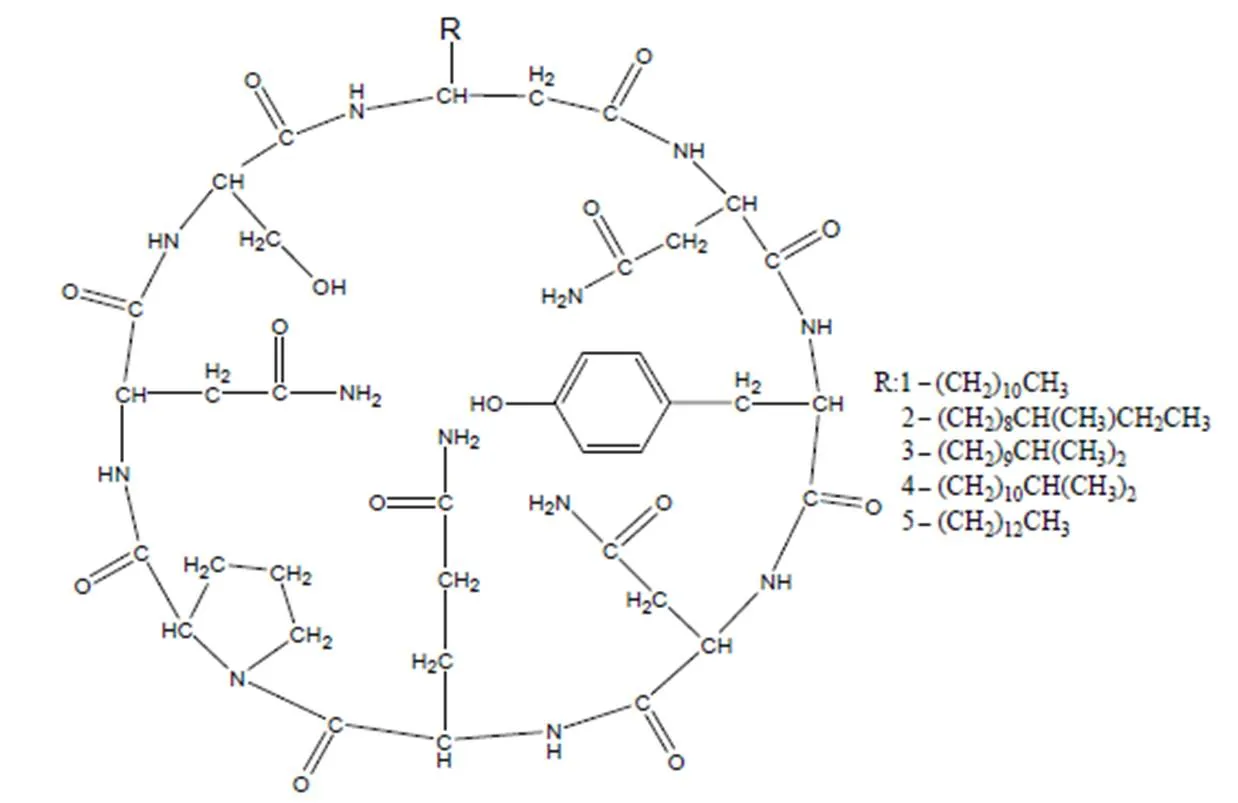
图1 化合物1至化合物5的结构式

表1 化合物1的1H核磁信息
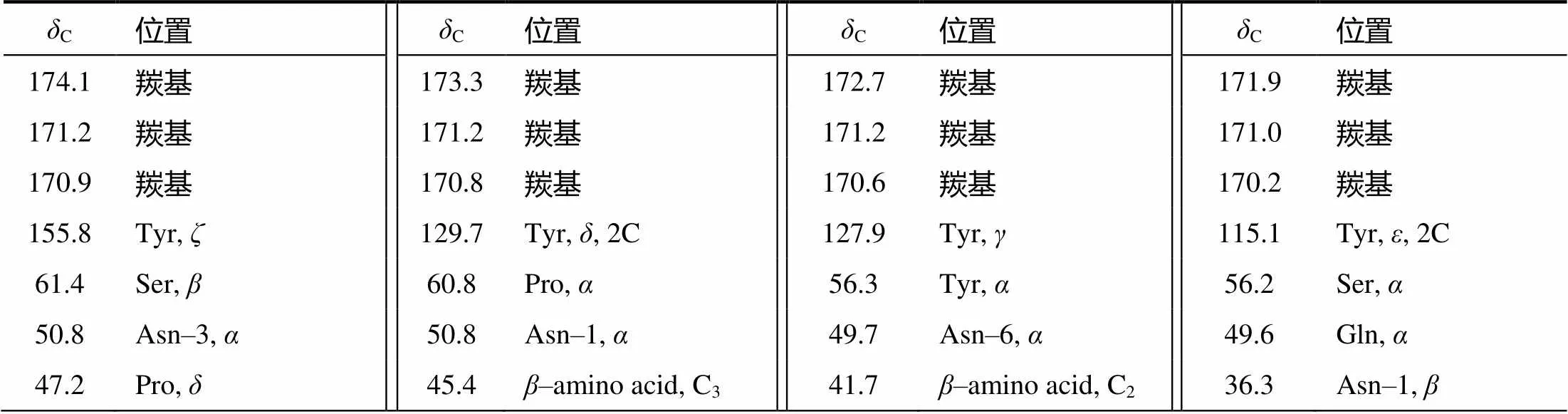
表2 化合物1的13C核磁信息
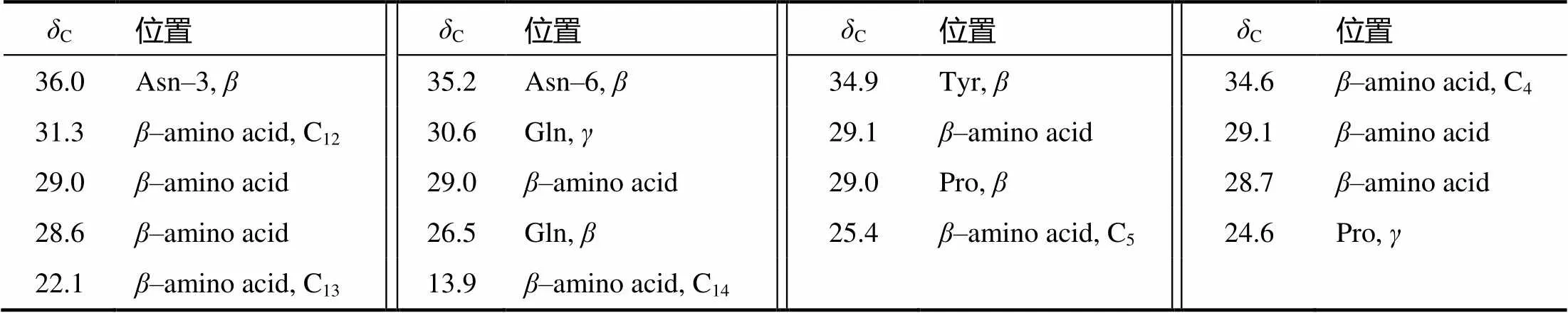
表2(续)
化合物2的质谱图显示1 057.199 1为[M+H]+峰,化合物3的质谱图显示1 057.135 1为[M+H]+峰,推断化合物2和3的分子量均为1 056。化合物4和5的质谱图均显示1 071.58为[M+H]+峰,推断化合物4和5的分子量均为1 070。结合文献谱图分析,化合物2至化合物5均属于伊枯草菌素A类化合物。化合物2至化合物5和化合物1除了–氨基酸侧链结构不同,均有相同的氨基酸排列顺序。–氨基酸侧链(–R)中1H和13C的主要核磁信号区别如表3。结合相关文献谱图[10],化合物2为伊枯草菌素A–3,化合物3为伊枯草菌素A–4,分子量均为1 056,分子式均为C49H77N12O14;化合物4为伊枯草菌素A–6,化合物5为伊枯草菌素A–7,分子量均为1 070,分子式均为C50H79N12O14。
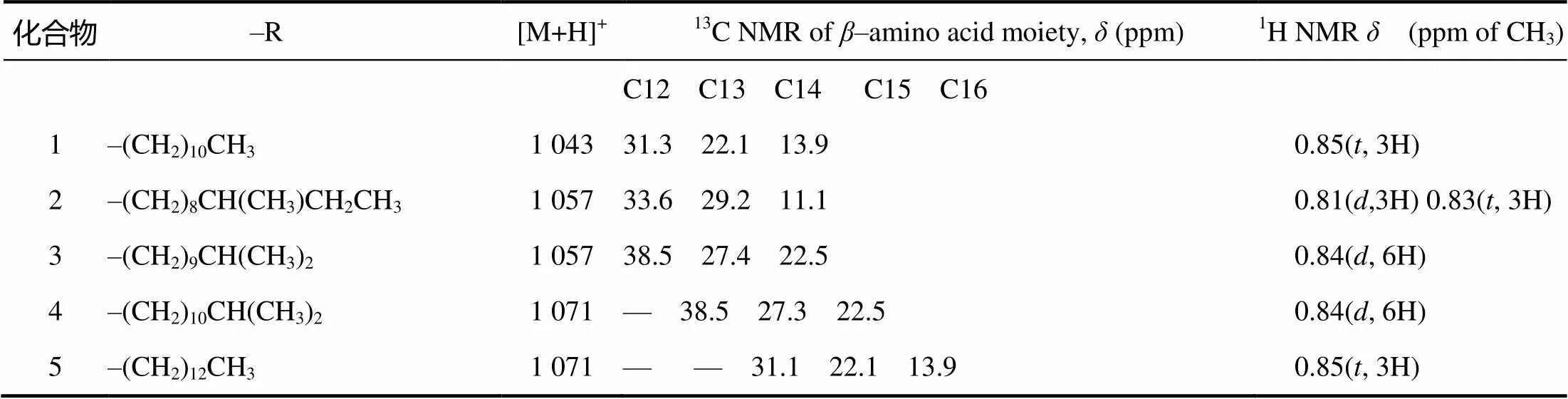
表3 化合物1~5的β–氨基酸侧链中1H和13C的主要核磁信号
2.1.2 活性化合物6的结构鉴定
化合物6的质谱图显示391.281 6为[M+H]+峰,可以推断化合物6的分子量为390,推测分子式为C24H28O4。根据1H NMR和13C NMR谱图信息(表4)并结合相关文献谱图[11],化合物6(图2)为邻苯二甲酸二(2–乙基己基)酯。
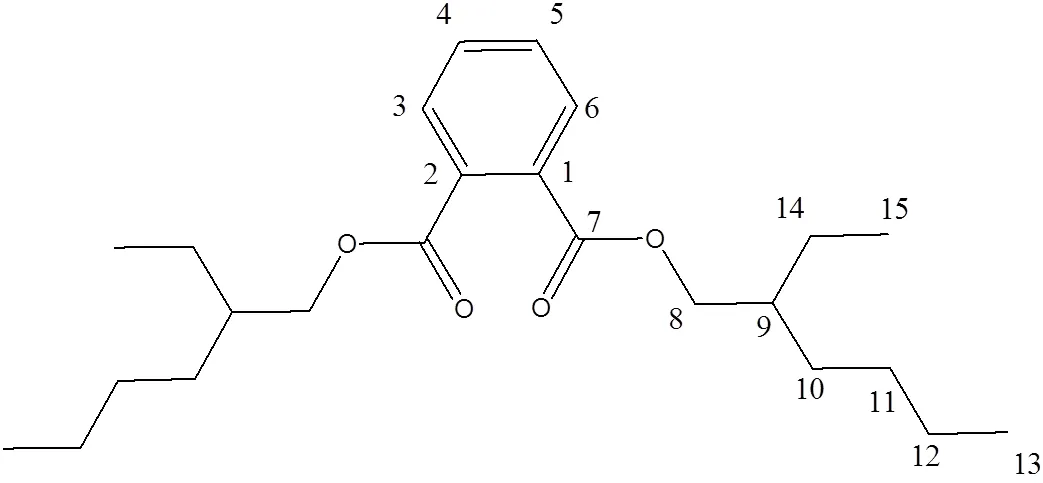
图2 化合物6的结构式
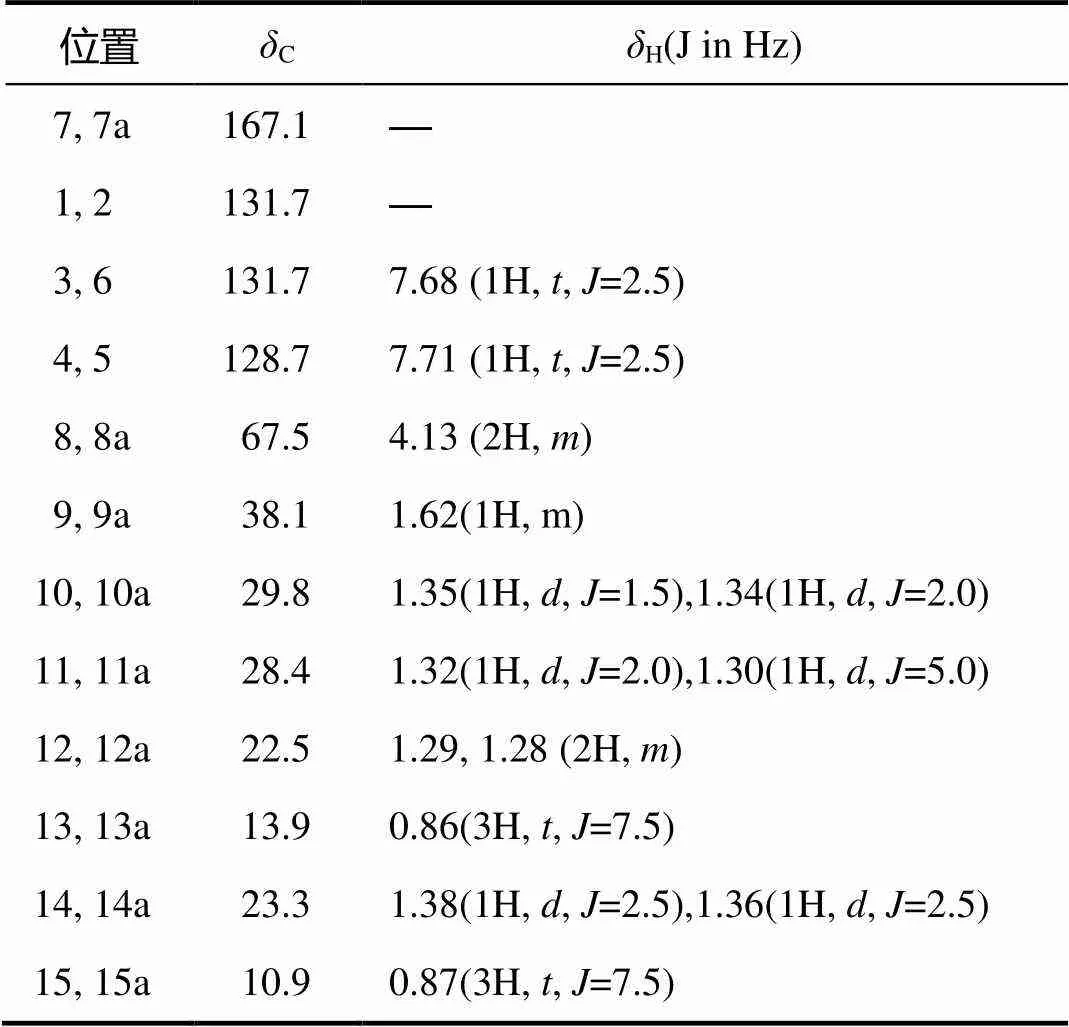
表4 化合物6的1H和13C的核磁信号
2.2 抗菌试验结果
伊枯草菌素A–2和DEHP对稻瘟病菌的抗性试验结果表明,随着化合物浓度的增加,对稻瘟病菌的抑制率逐渐增大。伊枯草菌素A–2的浓度()与抑制率()的回归方程为=2.436+1.516(2=0.994 0),伊枯草菌素A–2对稻瘟病菌的半抑制浓度为26.471 μg/mL,最小抑制浓度为62.500 μg/mL。DEHP的浓度()与抑制率()的回归方程为=1.042+4.640 (2=0.976 5),DEHP对稻瘟病菌的半抑制浓度为1.916 μg/mL,最小抑制浓度为15.625 μg/mL。
3 结论
从海洋链霉菌P10–16发酵代谢物中分离得到5个伊枯草菌素A类化合物(伊枯草菌素A–2、A–3、A–4、A–6、A–7)和邻苯二甲酸二(2–乙基己基)酯。伊枯草菌素A–2对稻瘟病菌的半抑制浓度和最小抑制浓度分别为26.471、62.500 μg/mL。邻苯二甲酸二(2–乙基己基)酯对稻瘟病菌的半抑制浓度和最小抑制浓度分别为1.916、15.625 μg/mL。
[1] BERDY J.Bioactive microbial metabolites[J].J Antibiot,2005,58(1):1–26.
[2] CRAGG G,KINGSTON D,NEWMAN D.Anticancer Agents from Natural Products [M].London:Taylor & Francis,2005.
[3] MANN.Natural products as immunosuppressive agents[J]. Nat Prod Rep,2001,18(4):417–430.
[4] 陈菲菲,王勇,王以光,等.海洋微生物来源的天然产物开发研究进展[J].应用与环境生物学报,2011,17(2):287–294.
[5] BREDHOLT H,FJAERVIK E,JOHNSEN G,et al. Actinomycetes from sediments in the Trondheim fjord,Norway:diversity and biological activity[J].Mar Drugs,2008,6(1):12–24.
[6] MALDONADO L A,FRAGOSO–YÁÑEZ D,PEREZ– GARCÍA A,et al.Actinobacterial diversity from marine sediments collected in Mexico [J].Antonie Van Leeu– wenhoek,2009,95:111–120.
[7] FELING R H,BUCHAN G O,MINCER T J,et al. Salinosporamide A:a highly cytotoxic proteasome inhibitor from a novel microbial source,a marine bacterium of the new genus[J].Angew Chem,2003,42:355–357.
[8] HUGHES C C,PRIETO–DAVO A,JENSEN P R,et al. The marinopyrroles,antibiotics of an unprecedented structure class from a marinesp.[J].Org Lett,2008,10:629–631.
[9] GARBAY–Jaureguiberry C,ROQUES B P,DELCAMBE L,et al.NMR conformational study of iturin A,an antibiotic from[J].FEBS Lett,1978,93(1):151–156.
[10] HIRADATE S,YOSHIDA S,SUGIE H,et al.Mulberry anthracnose antagonists(iturins)produced byRC–2[J].Phytochemistry,2002,61(6):693–698.
[11] KIM Y J,JONAS J.High pressure13C NMR study of the motional dynamics of liquid bis (2–ethylhexyl) phthalate[J]. Journal of Physical Chemistry,1995,99(18):6788.
责任编辑:尹小红
英文编辑:梁 和
Isolation and identification of metabolites from marineP10–16
GUO Junfu, ZONG Mimi, XU Wenping, TAO Liming
(School of Pharmacy, East China University of Science and Technology, Shanghai 200237, China)
The secondary metabolites from marineP10–16 were isolated and identified by silica gel column chromatography and TLC, their structures were elucidated with spectra data analysis of ESI–MS and NMR, and their antifungal activities were tested with the indicator fungus of rice blast. The results showed that five iturins (iturin A–2, A–3, A–4, A–6 and A–7) and DEHP were isolated from marine. Half maximal inhibitory concentration(50) and minimum inhibitory concentration()of iturin A–2 (Po) were 26.471, 62.500 μg/mL, while50andof DEHP (Po) were 1.9159, 15.625 μg/mL, respectively.
marineP10–16; isolation; purification; iturin A; structure elucidation; antimicrobial activity
Q939
A
1007-1032(2017)06-0615-05
2017–03–25
2017–09–28
“十二五”国家科技支撑项目(2011BAE06B04)
郭俊夫(1985—),男,湖南湘潭人,硕士研究生,主要从事天然产物分离研究,gjfdyx@163.com;
通信作者,陶黎明,教授,主要从事天然产物分离研究,taolm@ ecust.edu.cn
投稿网址:http://xb.hunau.edu.cn
