环境pH对褐环粘盖牛肝菌转录组的影响
2017-12-22陈有君李立民
杨 威,蒋 莹,陈有君,闫 伟,李立民,霍 峰
(内蒙古农业大学生命科学学院,内蒙古 呼和浩特 010020 )
环境pH对褐环粘盖牛肝菌转录组的影响
杨 威,蒋 莹,陈有君,闫 伟,李立民,霍 峰
(内蒙古农业大学生命科学学院,内蒙古 呼和浩特 010020 )
为了探明环境酸碱条件对褐环粘盖牛肝菌基因表达的影响,测序分析了生长在不同pH环境下的该菌转录组。结果发现,与生长在pH3环境下的菌丝相比,pH4、4.5、5、5.5、6、7、8条件下的菌丝,分别有743、870、1 177、1 512、1 628、3 135、2 902个基因发生了差异表达,这些差异表达基因在基因本体论数据库中分别注释到2 029、2 368、2 733、3 125、3 168、4 626、4 728个功能,在京都基因与基因组百科全书中分别定位到76、81、108、121、116、180、177个代谢途径,其中内质网对蛋白质的加工、泛醌和其他类萜醌的生物合成途径、谷胱甘肽代谢途径、ABC transporter途径、色氨酸代谢途径和抗生素生物合成途径等途径的富集程度较高。说明环境酸碱度对褐环粘盖牛肝菌蛋白质加工及物质跨膜转运等具有很大影响。
基因表达;代谢途径;褐环粘盖牛肝菌;酸碱条件
褐环粘盖牛肝菌〔Suillus lutens(L.:Fr.)Gray〕是一种优良的外生菌根真菌,其生命活动降低环境pH条件是其促进植物生长的机制之一,因此,其与环境酸碱条件的相互作用引起学者们进行大量研究。陈连庆等发现褐环粘盖牛肝菌在环境pH4.0~4.5条件下,生长最为良好,并且随着pH值的增大,菌丝的生长速率降低[3]。姚庆智等发现该菌生长最适的环境pH范围为6~7[4]。张茹琴等研究表明该菌在环境pH4.0~7.0条件下均可生长,其生长的最适pH为5.3~6.7,菌丝生长一段时间后,培养液pH值均有不同幅度的下降[5]。刘淑清等发现褐环粘盖牛肝菌生长的最适环境pH为4.5左右,在培养结束后培养液pH改变量均与其生物量成正相关[6]。蔡楠楠发现该菌在环境pH4.5~6条件下生长情况良好,pH4.5和pH6条件下获得的菌丝生物量高于pH5.0和pH5.5条件下的生物量,即生物量随pH变化呈双峰型;在pH3.0~6.0的培养条件下,随着pH的升高,培养后培养基pH的下降幅度逐渐增大,在pH6.0条件下下降幅度最大,达到1.59个pH单位,经测定发现在pH6.0条件下的草酸含量最多[7]。刘萌的研究表明,褐环粘盖牛肝菌在pH5.0~6.0下生长情况最佳,分泌的有机酸最多,生长最为旺盛[8]。王明慧发现褐环粘盖牛肝菌的草酸分泌量随pH的升高而逐渐增加,从pH4.0~4.5及pH5.5~6.0范围内,草酸的分泌量升高较快;并且发现该菌蛋白质含量随着pH的升高而逐渐上升,在pH 5时上升速率加快,且在pH 6时达到最高,达到最高值后蛋白质含量迅速下降[9]。但是关于pH对该菌基因转录影响,从而改变蛋白质合成方面还缺乏研究。
不同环境pH生长下的拟南芥,其许多基因发生变化,涉及细胞壁修饰、Ca2+信号、病原体诱导、水杨酸,以及WRKY和NAC等转录因子[10]。环境pH影响蓝莓的代谢途径有RNA转运、吞噬体、醚酯代谢、内吞作用和甘油磷脂代谢等,并且ERF、bHLH、NAC和WRKY等转录因子也发生改变[11]。环境pH能够影响野大豆许多基因的表达,包括参与代谢过程、膜转运、细胞结构建成、蛋白质合成和次生代谢的基因,乃至MRKY、MYB和SPL等转录因子[12]。蓝藻在不同环境pH条件下拥有不同的基因表达情况,乳酸发酵途径、ABC转运体、双组份调控体系、脂肪酸合成和戊糖磷酸途径等均有显著变化[13]。不同pH土壤处理下的平邑甜茶,其诸多基因的表达水平发生明显改变,参与的生理过程主要包括氮代谢、光合进程、植株病原互作、TCA循环、氧化磷酸化和激素信号转导[14]。说明环境pH对基因表达水平有显著的影响。但是褐环粘盖牛肝菌基因转录情况及转录调控规律与pH之间的关系尚不清楚,因此,本研究利用RNA-Seq技术测定了不同pH 环境下褐环粘盖牛肝菌的转录组序列,并对该菌在不同pH处理后基因的转录情况和不同环境pH之间基因的差异表达进行系统分析,以期从转录组学角度揭示环境pH对褐环粘盖牛肝菌基因表达的影响。
1 材料与方法
1.1 试验材料
供试菌株为褐环粘盖牛肝菌Sp9菌株,由内蒙古农业大学菌根生物技术研究室提供。基础培养基为Pachlewski(简称Pach)培养基,其组成参照蔡楠楠[7]文献中的配方。
1.2 试验方法
用打孔器打取直径为5 mm、生长旺盛的平板菌落,接入Pach培养基生长6 d后,挑取整个菌落转接到不同处理的液体培养基中,试验设8个处理,分别为 pH3、4、4.5、5、5.5、6、7、8。在保证培养基pH不变的条件下,25℃恒温培养5 d,进行RNA测序。液体培养接菌量为12块,装液量为50/150 mL。
1.3 测序数据分析
将获得的RNA建立文库,在Illumina HiSeq测序仪上进行测序,并使用Trimmomatic软件对原始测序数据进行质控,得到高质量测序数据(FP data),计算RPKM值(衡量基因表达量),RPKM是将map到基因的read数除以map到基因组上的所有read数(以million为单位)与RNA的长度(以KB为单位)。数据通过质量评估后,对样本间相关性检测和聚类分析,以及基因本体论 (GO)和京都基因与基因组百科全书(KEGG)分析。RPKM计算公式为:

2 结果与分析
2.1 基因表达水平分析
通过测序,共获得71.12 Gb碱基序列信息,过滤后的高质量数据有61.62 Gb,测序数据质量可靠。碱基平衡性优秀。数据可以进行后续的分析。
本试验主要针对基因组的蛋白编码基因mRNA 进行分析,对基因的表达量进行统计、并以此评估组内及组间样品基因表达特征的相关性,以及差异表达的基因。通过RPKM值的分布图(图1)可以看出,pH3~8差异基因的log10RPKM最大值均在3.4左右,中值均在1左右,最小值均在-1.3左右。log10RPKM数值越高,表示基因表达量越高。
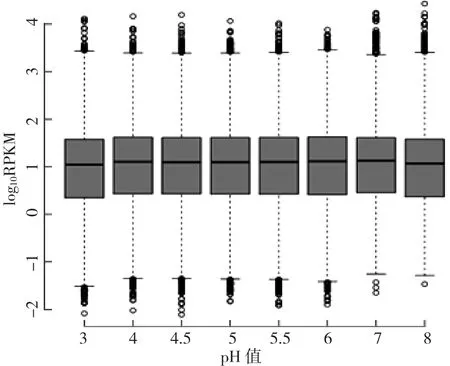
图1 RPKM值分布情况的boxplot
2.2 表达水平相关性分析
样品间基因表达水平相关性是检验实验可靠性和样本选择是否合理的重要指标。相关系数越接近于1,表明样品之间表达模式的相似度越高。如图2所示,pH3~6皮尔森相关系数的平方皆大于0.83,并且pH3~6之间的log10RPKM数值大部分均匀的落在对角线上,表明样品间的一致性较高,可能说明褐环粘盖牛肝菌在pH3~6之间的生长环境中基因表达变化程度较小,而在pH7的中性环境和pH8的弱碱性环境中,皮尔森相关系数基本小于0.8,并且pH7和pH8与其他pH之间的log10RPKM数值大部分落在对角线的左上区域,基因表达变化程度较大。说明褐环粘盖牛肝菌在酸性、中性以及弱碱的生长环境中,其基因存在不同的表达模式。通过样本聚类距离(图3),聚类分析结果同相关性散点图的结果高度一致,其中,样品pH7、8被聚到一类,而样品pH3~6被聚到一类,其中样品pH4.5、5、5.5、6被聚到一小类。
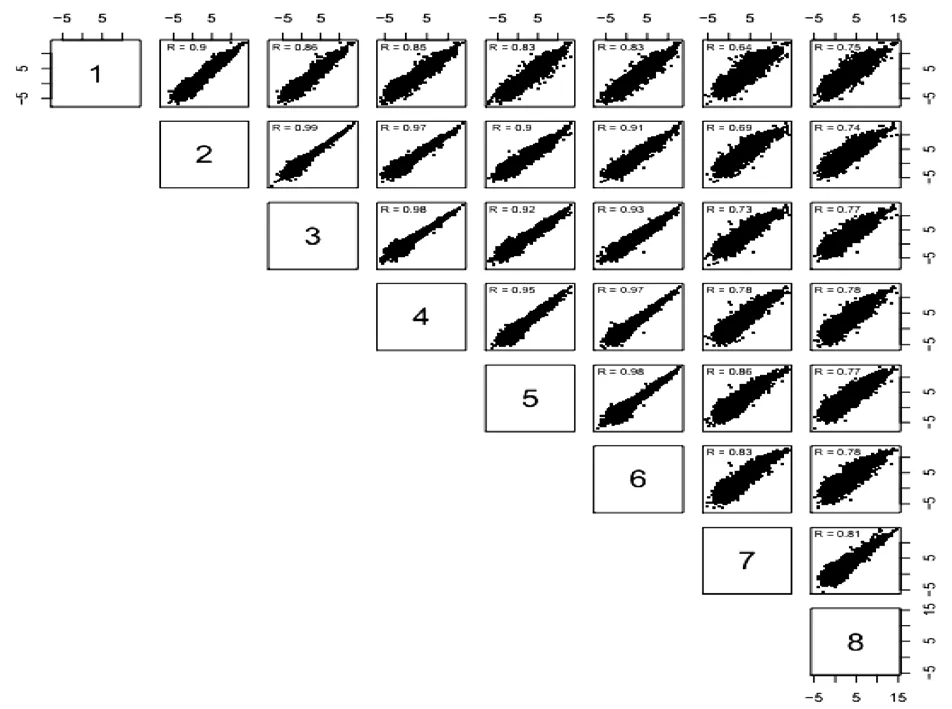
图2 基因表达相关性散点图
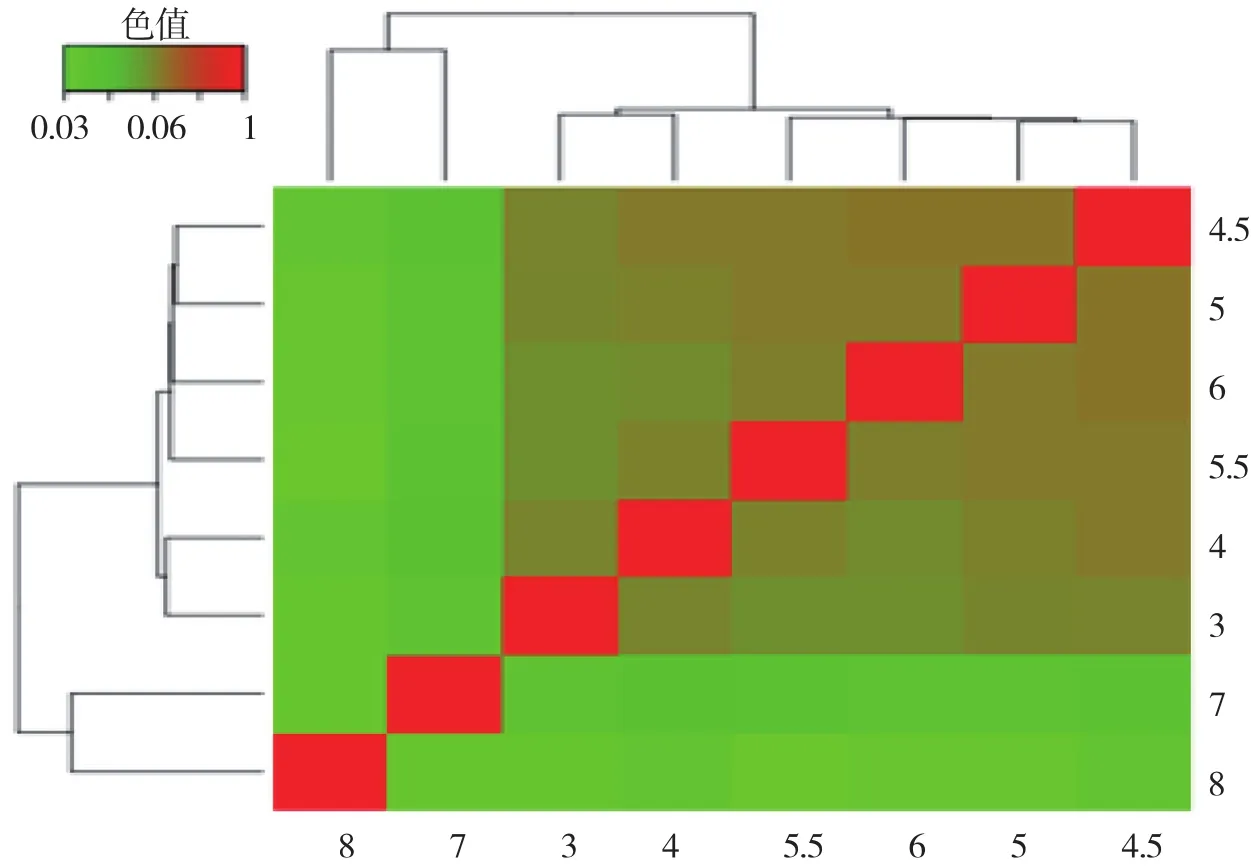
图3 基因表达水平的层次聚类图
2.3 差异表达基因分析

图4 相邻pH间差异表达基因数量
差异表达基因是指样品间或者同一样品经过不同处理后,上调表达的基因和下调表达基因的汇总。本试验筛选的阈值为:。获得每相邻组间的差异基因统计(图4),其中pH4.5与pH4、pH5与pH4.5、pH5.5与pH5、pH6与pH5.5差异表达的基因数量较小,pH7与pH6、pH8与pH7差异表达的基因数量较大。获得pH3下生长的菌丝与其他pH下生长菌丝的差异基因统计(图5),上调、下调基因的数目均随pH升高而逐渐增多,且上调基因一直多于下调基因。pH4、4.5、5、6与pH3相比的差异基因数目差异较小,平均pH差每变化1个单位,会有221个左右的差异基因;pH6、7与pH3相比的差异基因数目差异最大,达到1 507个。
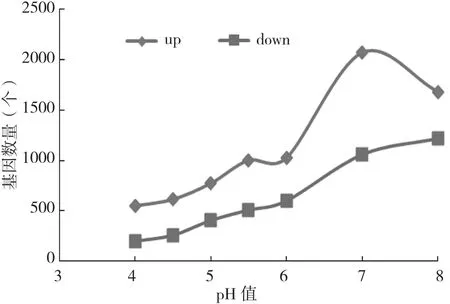
图5 pH3与其他pH间差异表达基因数量
2.4 差异表达基因GO注释分析
将pH3下生长的菌丝转录组与其他pH下的转录组比较,差异表达基因在GO上注释的功能数见图6。从图6可以看出,上调、下调基因的功能数均随pH升高而逐渐增多,平均pH差每变化1个单位,会有730个左右的功能差异,尤其是pH3~5.5,几乎是直线变化。pH8与pH7相比,注释的功能数差异较小。
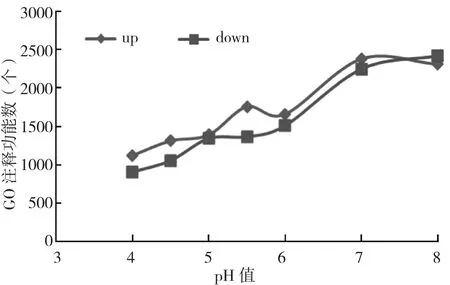
图6 差异表达基因的GO注释数量
表1归纳了7组pH中皆存在且差异表达基因较多的功能。从表1可以看出,在上调基因中,对化学物质的响应是富集程度最高的,平均差异基因数量有52个左右,占该功能基因总数的25%;其次是细胞对化学刺激,平均差异基因数量有47个左右,占该功能基因总数的31%;再次是对胞外刺激(外界刺激、营养水平)的响应,在前5组pH中的平均差异基因数量有27个左右,占该功能基因总数的52%。在下调基因中,氧化还原酶活性是富集程度最高的,平均差异基因数量有60个左右,占该功能基因总数的22%;其次是金属离子运输、过渡金属离子运输和跨质膜内运,平均差异基因数量分别有19、14和10个左右,占该功能基因总数的31%、49%和50%;再次是细胞脂类和甾醇类化合物的生物合成,平均差异基因数量有17个左右,占该功能基因总数的39%;最后是对胞外刺激(外界刺激、营养水平)的响应,在后2组pH中的平均差异基因数量有37个左右,占该功能基因总数的71%。
2.5 差异表达基因KEGG富集分析
将pH3下生长的菌丝转录组与其他pH下的转录组比较,差异表达基因在KEGG pathway上注释的途径数见图7。从图7可以看出,上调、下调基因所涉及的途径数均随pH升高而逐渐增多,平均pH差每变化1个单位,会有19个左右的途径差异。pH6、7与pH3相比,差异表达基因注释的途径数差异最大,达到64个。而pH7、8与pH3相比,差异表达基因注释的途径数差异较小。

图7 差异表达基因的KEGG pathway注释数量
表2归纳了7组pH中皆存在且差异表达基因涉及较多的途径。从表2可以看出,在上调基因中,戊糖和葡萄糖醛酸酯互换和内质网上的蛋白加工是富集程度最高的,平均差异基因数量分别有11、9个左右,占该途径基因总数的53%和10%;其次是甘油酯代谢、泛醌和其他类萜醌的生物合成,平均差异基因数量分别有2、3个左右,占该途径基因总数的18%和12%;最后是苯丙氨酸代谢,在后5组pH中平均差异基因数量有3个左右,占该途径基因总数的22%。在下调基因中,谷胱甘肽代谢是富集程度最高的,平均差异基因数量有11个左右,占该途径基因总数的36%;其次是ABC运转体、色氨酸代谢和抗生素合成,平均差异基因数量分别有3、5、24个左右,占该途径基因总数的9%、20%和12%;最后是苯丙氨酸,酪氨酸和色氨酸生物合成,在后6组pH中平均差异基因数量有5个左右,占该途径基因总数的32%。

表1 集中程度最高的GO功能
3 结论与讨论
试验结果表明,在弱酸环境下,pH变化引起褐环粘盖牛肝菌基因表达的变化较小;在中性或弱碱环境下,表达发生变化的基因数较多。pH3与其他pH比较的差异表达基因,在GO上注释的功能数差值,随着pH值的升高而增大;在KEGG中涉及的途径数差值,也随着pH值的升高而增加。
GO富集结果发现,对化学刺激、营养水平、胞外刺激的和外界刺激的响应方面,酸性条件和中性条件下的上调差异基因富集程度较高,而在弱碱条件下的下调差异基因富集程度较高。这可能暗示褐环粘盖牛肝菌在酸性和中性条件下能够通过分子调控更快更好地适应环境并生长,而在弱碱性条件下对环境的适应能力明显下降,生长发育能力也随之减弱。氧化还原酶活性、脂类生物合成和甾醇类化合物生物合成在7组pH下调差异基因中的富集程度也很高。氧化还原酶发生氧化或还原反应需要电子作供体或受体,氧化还原系统就是电子传递链[15]。脂质是生物体内储存能量的最佳物质,是生物膜结构的重要基础,能够作为生长因子和抗氧化剂,参与固醇类激素的信号传递和信号识别及免疫[16],而且能够参与膜内电子的传递。甾醇类化合物是细胞膜的重要组成部分,能够直接影响细胞膜的流动性,并且能够参与细胞膜的识别和调节细胞的生理功能[17]。我们推断在不同pH的生长环境下,褐环粘盖牛肝菌的生物膜结构发生了一定变化,在调节电子的传递、细胞膜的流动性和识别上均有改变,从而使该菌自身能够更快的适应各种pH环境。
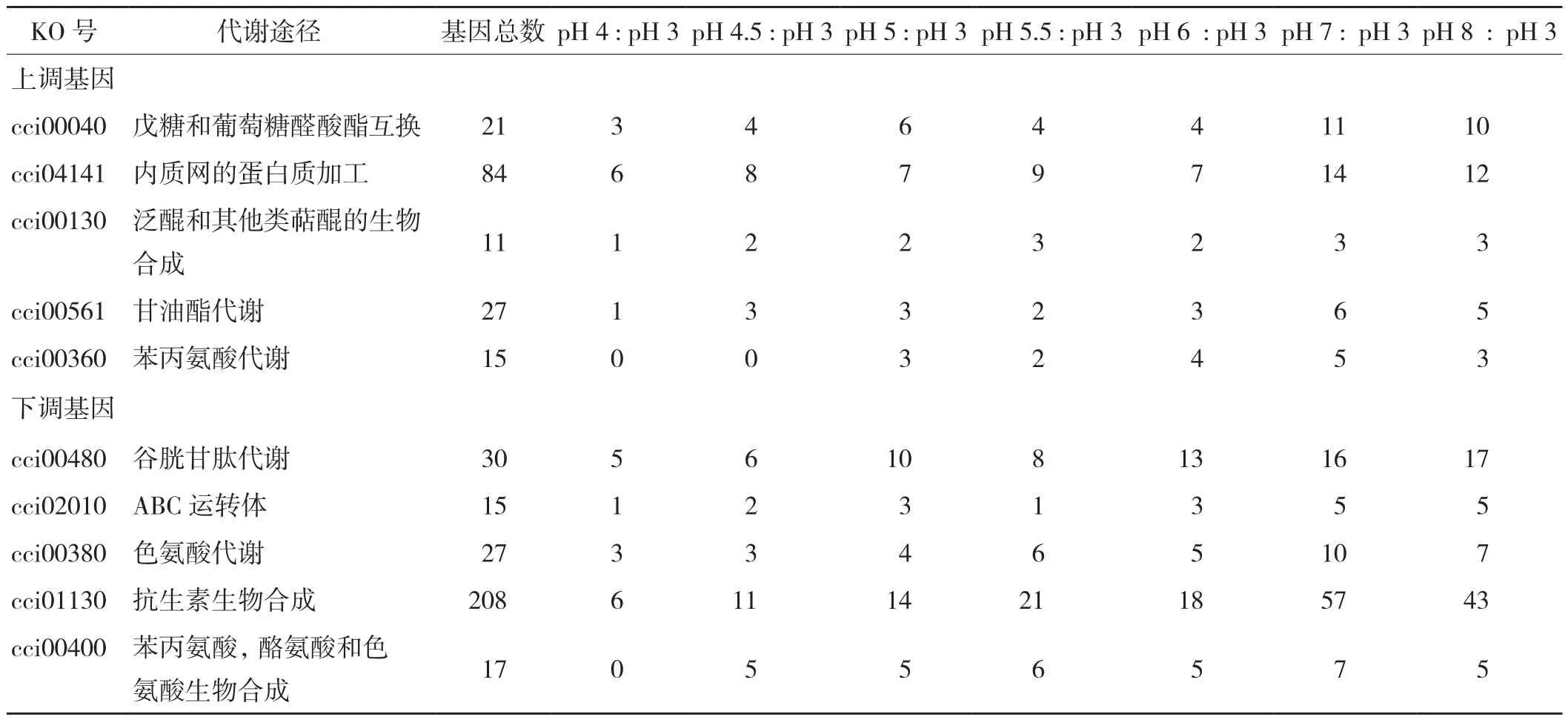
表2 富集程度最高的KEGG通路
研究发现,在pH3与其他pH的差异表达基因富集到的KEGG通路展示中,内质网上的蛋白加工通路是7组上调差异表达基因富集程度最高的,内质网对蛋白质的加工有糖基化、羟基化、酰基化、二硫键形成等,在这些加工中最主要的是糖基化[18-20]。其次是泛醌和其他类萜醌的生物合成通路、甘油酯代谢通路和苯丙氨酸代谢通路在上调差异基因中富集程度也较高。泛醌,属维生素,作为生物体呼吸链中重要的递氢体,能够刺激跨膜电子运输[21-22]。萜类化合物是普遍存在的一类代谢产物,如赤霉素、脱落酸等植物激素、类胡萝卜素、能够组成细胞膜的甾体和涉及电子传递的醌类等;在调节植物与环境之间的关系上表现出相当重要的生态功能[23-24]。甘油脂能够提高膜的流动性,对激活一些结合在膜上的酶是相当有意义的,对维持不同环境下的生物膜流动性也十分重要[25]。苯丙氨酸代谢途径是重要的次生代谢途径,能够应答伤害、病原菌等多种胁迫诱导[26]。在7组pH下差异表达基因中,谷胱甘肽代谢通路的富集程度最高。谷胱甘肽是重要的抗氧化剂和自由基清除剂,把机体内的自由基,金属离子转化为无害的物质,排泄出体外,同时对细胞膜起到保护的作用[27]。ABC transporter通路、色氨酸代谢通路和抗生素生物合成通路在下调差异基因中的富集程度也较高。ABC transporter通路对细胞膜的发生和功能维护上具有重要意义,其最重要的功能是利用ATP水解产生的能量将与其结合的底物转出质膜[28]。色氨酸调节蛋白质合成,并参与植物体内众多代谢反应的调控,如激素响应、渗透胁迫等[29]。抗生素能够与细胞膜相互作用,从而提高细胞膜的通透性、打开膜上的离子通道,使菌体内部的有用物质漏出或者菌体电解质平衡失调而死。可以调节生长发育的化学物质,并且能够作用于能量代谢系统,从而抑制菌丝体的生长发育[30-31]。由此,我们推测不同pH的生长环境可能会对褐环粘盖牛肝菌的细胞膜造成一定的影响,而真菌自身通过调节位于膜上的ABC运转系统、谷胱甘肽代谢系统、泛醌和其他类萜醌的生物合成系统和甘油酯代谢系统等相关基因的表达实现保护细胞膜以及排出由pH变化产生的不利物质等。
在褐环粘盖牛肝菌与环境pH的代谢和转录调控等途径中,还检测到很多代谢途径,这些途径的相关基因在不同pH环境中均存在不同程度的变化,还有待进一步研究。
[1] Bois G,Bertrand A,Piche Y,et al. Growth,compatible solute and salt accumulation of five mycorrhizal fungal species grown over a range of NaCl concentrations[J]. Mycorrhiza,2006,16(2):99-109.
[2] 李国光. 褐环粘盖牛肝菌草酸分泌及其代谢途径的研究[D]. 呼和浩特:内蒙古农业大学,2012.
[3] 应国华,吕明亮,陈连庆. 褐环粘盖牛肝菌菌种分离研究[J]. 林业科学研究,2004,17(1):66-71.
[4] 姚庆智,闫伟. 11株外生菌根真菌菌株纯培养营养生理特性的研究[J]. 内蒙古大学学报,2005,36(2):187-191.
[5] 张茹琴,唐明,张峰峰,等. 酸碱度和重金属对3种外生菌根真菌生长的影响[J]. 北京林业大学学报,2008,30 (2):145-150.
[6] 刘淑清,陈有君,包健,等. pH 条件和接种量对褐环乳牛肝菌生长影响[J]. 内蒙古科技与经济,2008(22):29-31.
[7] 蔡楠楠. 褐环粘盖牛肝菌菌丝与培养基pH的相互作用[D]. 呼和浩特:内蒙古农业大学,2011.
[8] 刘萌. 培养环境pH对褐环粘盖牛肝菌三羧酸循环中酶活性的影响[D]. 呼和浩特:内蒙古农业大学,2015.
[9] 王明慧. pH对褐环粘盖牛肝菌草酸代谢几个关键酶活性的影响[D]. 呼和浩特:内蒙古农业大学,2013.
[10] Lager I,Andreasson O,Dunbar TL,et al.Changes in external pH rapidly alter plant gene expression and mo- dulate auxin and elicitor responses[J]. Plant Cell & Environment,2010,33(9):1513.
[11] 陈雅彬. 不同根际pH处理下蓝莓根系转录组及氮、铁代谢相关基因表达[D]. 金华:浙江师范大学,2015.
[12] 葛瑛. 野大豆碱胁迫转录谱与基因组整合分析[D]. 哈尔滨:东北农业大学,2010.
[13] 李益. 蓝藻基因组结构、功能与调控模式的生物信息学研究[D]. 成都:电子科技大学,2015.
[14] 葛顺峰. 苹果园土壤碳氮比对植株—土壤系统氮素平衡影响的研究[D]. 泰安:山东农业大学,2014.
[15] Angelini R,Federico R. Histochemical evidence of polyamine oxidation and generation of hydrogen peroxide in the cell wall[J]. Journal of Plant Physiology,1989,135(2):212-217.
[16] Meyer Zhd,Jakobs K H. Lysophospholipid receptors:signalling,pharmacology and regulation by lysophosph- o lipid metabolism[J].Biochimica et Biophysica Acta,2007,1768(4):923-940.
[17] Piironen V,Lindsay D G,Miettinen T A,et al.Plant sterols:biosynthesis,biological function and their importa- nce to human nutrition[J].Journal of the Science of Food & Agriculture,2000,80(7):939-966.
[18] Kanapin A,Batalov S,Davis M J,et al. Mouse proteome analysis[J]. Genome Research,2003,13(6B):1335.
[19] Vitale A,Boston R S. Endoplasmic reticulum quality control and the unfolded protein response:insights from plants[J]. Traffic,2008,9(10):1581-1588.
[20] Sitia R,Braakman I. Quality control in the endoplasmic reticulum protein factory[J].Nature,2003,426(6968):891-904.
[21] Marinetti T D,Okamura M Y,Feher G.Localization of the primary quinone binding site in reaction centers fro- m Rhodopseudomonas sphaeroides R-26 by pHotoaffinity labeling[J].Biochemistry,1979,18(14):3126-3133.
[22] 古练权,朱钦士,徐建兴. 泛醒类化合物分子中侧链的化学结构与分子传递电子效能的关系[J]. 生物化学杂志,1987,3(6):481-489.
[23] Bennett R N,Wallsgrove R M. Tansley review No. 72. secondary metabolites in plant defence mechanisms[J]. New Phytologist,1994,127(4):617-633.
[24] Vanetten H D,Mansfield J W,Bailey J A,et al.Two classes of plant antibiotics:phytoalexins versus“phytoa- ntici pins”[J]. Plant Cell,1994,6(9):1191.
[25] 郝静芳. 拟南芥甘油-3-磷酸酰基转移酶的三个基因(GPAT6,7,9)在种子油脂合成及幼苗耐盐中的作用[D]. 南京:南京农业大学,2013.
[26] Paolo G D,Camilli P D. Phosphoinositides in cell regulation and membrane dynamics[J]. Nature,2006,443 (7 112):651.
[27] Musgrave WB,Yi H,Kline D,et al. Probing the origins of glutathione biosynthesis through biochemical analysis of glutamate-cysteine ligase and glutathione synthetase from a model photosynthetic prokaryote[J]. Biochemical Journal,2013,450(1):63-72.
[28] Annilo T,Shulenin S,Costantino J,et al.Evolution of the vertebrate ABC gene family:Analysis of gene birth and death[J]. Genomics,2006,88(1):1-11.
[29] Verney E,Sidransky H. Effect of metyrapone on tryptophan binding to rat hepatic nuclei[J].Metabolism- clinical & Experimental,1994,43(1):79-84.
[30] Michael H,Linda M,Alison K,et al. ApHid alarm pheromone produced by transgenic plants affects aphid and parasitoid behavior[J].Proceedings of The National Academy of Sciences of The United States of America,2006,13(27):10509-10513.
[31] Dakora F D,PHillips D A. Diverse functions of isoflavonoids in legumes transcend anti-microbial definitions of phytoalexins[J]. Physiological &Molecular Plant Pathology,1996,49(1):1-20.
Effect of environmental pH on Suillus luteus transcriptome
YANG Wei,JIANG Ying,CHEN You-jun,YAN Wei,LI Li-min,HUO Feng
( College of Life Science,Inner Mongolia Agricultural University,Huhhot 010020,China )
In order to explore the influence of environmental acid-base conditions on gene expression of Suillus luteus,we sequenced the transcriptome of the strain grown in different pH environment. The result showed that,compared with the hyphae grown at pH 3,the hyphae at pH 4,4.5,5,5,5,6,7 and 8 had 743,870,1 177,1 512,1 628,3 135 and 2 902 genes differentially expressed respectively. These differential expressed genes were respectively annotated to 2 029,2 368,2 733,3 125,3 168,4 626 and 4 728 functions in gene ontology,and set to 76,81,108,121,116,180 and 177 metabolic pathways in the Kyoto Genome and Genome Encyclopedia. Among them,the degree of enrichment is higher in protein processing on endoplasmic reticulum,ubiquinone and other like terpene quinone biosynthetic pathway,glutathione metabolism pathway,ABC transporter pathway,tryptophan metabolic pathway,antibiotic biosynthetic pathway and other ways,indicating that environmental acid-base conditions have significant effects on protein processing and transmembrane transport of S. luteus.
expression of gene;metabolic pathway;Suillus luteus;acid and alkali conditions
S646.3
A
1004-874X(2017)08-0047-08
2017-05-31
杨威(1994-),女,在读硕士生,E-mail:778329902@qq.com
杨威,蒋莹,陈有君,等. 环境pH对褐环粘盖牛肝菌转录组的影响[J].广东农业科学,2017,44(8):47-54.
陈有君(1961-),男,博士,教授, E-mail:cyoujun@sina.com
(责任编辑 杨贤智)
