巴西橡胶树HbRALF34的克隆及表达分析
2017-12-21聂智毅黎瑜康桂娟蔡海滨曾日中
聂智毅,黎瑜,康桂娟,蔡海滨,曾日中
巴西橡胶树的克隆及表达分析
聂智毅,黎瑜,康桂娟,蔡海滨,曾日中*
(中国热带农业科学院橡胶研究所/农业部橡胶树生物学与遗传资源利用重点实验室,海南 儋州 571737)
依据橡胶树胶乳转录组数据,利用RT–PCR技术鉴定了一个快速碱化因子(rapid alkalinization factor, RALF)家族基因cDNA序列。该cDNA长度为767 bp,开放阅读框长度为411 bp,编码136个氨基酸。序列比对显示该RALF基因与有较高相似性,因而命名为。以热研7–33–97无性系橡胶树为材料,采用实时荧光定量PCR对不同组织及乙烯、茉莉酸、伤害、过氧化氢、高盐、低温、干旱等处理下的表达模式进行分析。结果表明:在橡胶树叶片、花、树皮以及胶乳中均有表达,其中胶乳中表达量最高;与健康橡胶树相比,在死皮橡胶树胶乳及树皮中的表达量显著上调;乙烯、茉莉酸、过氧化氢及伤害处理能诱导该基因表达,而低温、干旱及高盐处理则抑制该基因表达,表明可能参与橡胶树的信号传导、产排胶调控以及胁迫响应。
巴西橡胶树;;快速碱化因子;基因克隆;表达分析
巴西橡胶树(Muell. Arg.)是一种重要的热带经济林木,其树皮乳管中的胶乳是天然橡胶的重要商业来源。用乙烯(ethylene, ET)及茉莉酸(jasmonic acid, JA)等植物激素刺激可增加胶乳产量,但其增产机制仍未完全明确[1–2]。目前,乙烯利(2–chlorethylphosphonic acid, ethephon)刺激增产技术已广泛应用于天然橡胶的生产,可有效增加天然橡胶产量,降低割胶强度,在提高劳动生产率的同时,延长橡胶树经济寿命[3]。但是应用乙烯利刺激也会导致橡胶树排胶时间过长、早衰以及死皮(tapping panel dryness, TPD)等负面效应,严重影响了天然橡胶的可持续生产[4]。对橡胶树乳管ET及JA等激素响应基因进行分离鉴定,从橡胶树产排胶和衰老等方面对ET及JA信号响应基因进行系统分类及深入研究,有助于揭示ET及JA等刺激橡胶树增产的生理生化和分子机制,并为研发安全、高效、增产的新型刺激剂打下基础。
快速碱化因子(rapid alkalinization factor, RALF)是广泛存在于高等植物中的一类多肽信号分子,由PEARCE等[5]在提取纯化烟草的系统素时偶然发现。RALF参与多种植物生长发育及胁迫响应生理过程[6]。NIE等通过cDNA芯片技术分析了ET刺激下橡胶树胶乳的基因表达变化,发现一个RALF基因在ET刺激下显著上调表达[7]。本研究中,通过比对橡胶树胶乳转录组数据库,鉴定该基因开放阅读框(open reading frame, ORF)序列,利用生物信息学软件对该基因编码蛋白质的结构特征进行预测并分析其进化关系;以实时荧光定量PCR技术(real– time quantitative PCR, RT–qPCR)研究该基因的表达模式,初步分析其功能,旨在为揭示该基因的生物学功能,探明ET与JA等促进橡胶树增产的机制以及橡胶树死皮发生机理。
1 材料与方法
1.1 材料
供试材料为热研7–33–97无性系橡胶树。
主要试剂:RevertAid First Strand cDNA Synthesis Kit购自Thermo Fisher;100 bp DNA Ladder、pMD– 18T Vector及2×SYBRPremix Ex TaqII购自TaKaRa;普通琼脂糖凝胶DNA回收试剂盒、PCR MasterMix购自北京天根生化科技有限公司;茉莉酸甲酯(methyl jasmonate, MeJA)、聚乙二醇6000 (PEG6000)购自Sigma–Aldrich;总RNA提取以及其余相关试剂购自上海生工生物有限公司。相关引物(表1)由上海生工生物有限公司合成。

表1 HbRALF34克隆和表达分析所用引物序列
1.2 方法
1.2.1材料处理
ET、JA、H2O2及伤害处理均选用树围已达到开割标准的未开割热研7–33–97无性系橡胶树。参照HAO和WU[8]的方法:JA处理以羊毛脂为载体,在每株橡胶树割线下方刮去外周木栓层,涂2 g含1%JA的羊毛脂;ET处理在每株橡胶树割线下方涂1%的乙烯利。参照TANG等[9]的方法,以8颗图钉间距均匀的刺入橡胶树割线树皮进行伤害处理。参照ZHU等[10]的方法,在每株橡胶树割线下方涂1.5%的H2O2。各处理3次重复。每重复处理6株橡胶树,以处理0 h作为对照。
选用热研7–33–97无性系橡胶组培苗为低温、干旱及高盐胁迫处理材料。橡胶组培苗根部清洗后置清水中,以30 ℃、相对湿度80%、12 h光照(强度为600 μmol/(m2·s))和12 h黑暗、静置培养2~3 d进行胁迫处理。将橡胶组培苗根部浸没于1 mol/L的NaCl溶液中进行高盐胁迫处理;参照刘辉等[11]的方法,橡胶组培苗浸没于30%PEG6000作为干旱胁迫处理;橡胶组培苗于人工气候箱中以4 ℃、相对湿度80%、16 h光照(强度为600 μmol/(m2·s))和8 h黑暗培养作为低温处理。各处理3次重复。每个重复5株橡胶组培苗,以处理0 h为对照。
1.2.2样品的采集
采集1990年定植的热研7–33–97无性系橡胶树树皮、叶片、雄花、雌花及胶乳作为基因组织表达差异分析的样品。ET及JA处理0、4、8、24、48、72 h,采集胶乳作为ET及JA诱导表达分析样品;伤害及H2O2处理0、6、24、48 h,采集胶乳作为伤害及H2O2诱导表达分析样品;低温、干旱及高盐胁迫处理0、3、24、48 h,采集橡胶组培苗叶片作为低温、干旱及高盐胁迫表达分析样品;选取树围相对一致的健康橡胶树和死皮橡胶树,割胶采集胶乳,收集割下的树皮,快速用0.1% DEPC处理过的蒸馏水洗去附着的胶乳,并用灭菌的滤纸吸干,作为健康及死皮橡胶树胶乳及树皮表达差异分析样品。胶乳样品直接滴入液氮中收集,花、叶片及树皮样品经液氮研磨成粉末。所有样品于–70 ℃中冻存,备用。
1.2.3橡胶树各组织的总RNA提取及cDNA合成
橡胶树各组织总RNA参照XU等[12]方法提取,以DNase I去除残留的DNA。按照反转录试剂盒说明书,以各组织、各处理及对照样品RNA为模板合成克隆及表达分析所需cDNA。
1.2.4基因ORF的扩增及序列分析
采用BioEdit5.0.6,以序列L0012[7]比对胶乳转录组数据库(SRA数据库登录号SRR1648124)[13],并利用DNAMAN 8.0.8进行分析,获得该基因完整ORF序列。以引物RALFOF及RALFOR对基因ORF进行验证。PCR反应条件:94 ℃保持 5 min;94 ℃保持30 s;55 ℃保持30 s;72 ℃保持30 s;共35个循环;72 ℃保持7 min。扩增结束后以1%琼脂糖凝胶电泳检测扩增片段大小。PCR产物回收后与pMD–18T载体于16 ℃连接8 h后转化大肠杆菌DH5α感受态细胞,挑取插入片段大小正确的阳性克隆送上海英骏生物技术有限公司进行测序。分别采用Pfam27.0 (http://pfam.xfam.org/)和Compute pI/Mw (http://web. expasy.org/compute_pi/)分析蛋白的保守结构域、分子量和等电点。以SignalP 4.1 (http://www.cbs.dtu.dk/services/SignalP/)及TMHMM 2.0 (http://www.cbs.dtu. dk/services/TMHMM/)进行信号肽及蛋白跨膜结构域预测。将序列进行BLASTX (http://www.ncbi.nlm. nih.gov/)比对,获得该基因的同源序列,以ClustalX 2程序进行多重比对,运用MEGA5.05软件的邻接法(neighbour–joining, NJ)构建系统进化树,并进行1 000次Bootstrap统计学检验。
1.2.5基因表达模式分析
以为内参(GenBank登录号AB268099,扩增引物为Hb18SF及Hb18SR),用引物RALFQF1和RALFQR1对各组织、各处理及对照进行RT–qPCR分析。反应条件:95 ℃保持30 s;95 ℃保持5 s;58 ℃保持20 s;72 ℃保持20 s;共45个循环。循环结束后利用熔解曲线检测产物特异性。以公式2–ΔΔCt计算基因的相对表达量。
1.3 数据处理
采用SPSS 19.0进行数据统计分析。
2 结果与分析
2.1 基因的克隆及序列分析
通过比对橡胶树胶乳转录组数据库,并以RT–PCR验证,获得的目的基因含完整ORF的cDNA序列,该cDNA序列大小为767 bp,目的基因ORF大小为411 bp,编码136个氨基酸。生物信息学分析结果显示,该序列编码的蛋白相对分子量为15 600,理论等电点为8.38;结构域分析表明,该蛋白N端存在1个跨膜结构域,第1~25位氨基酸是信号肽序列;C端存在1个RALF结构域(图1)。与拟南芥蛋白数据库比对结果表明,该蛋白与拟南芥() RALF家族蛋白中的AtRALF34一致性最高,为56%。比对其他物种结果显示,与该基因编码蛋白一致性最高的是木薯() RALF蛋白,一致性达85%,其次是麻疯树() RALF蛋白,一致性为80%。此外,与蓖麻()、可可()、葡萄()及胡杨()等物种RALF34蛋白有较高一致性,因此将其命名为。

下划线部分表示RALF结构域;□表示跨膜结构域;*表示起始及终止密码子;双横线表示YISY基序;▲表示预测的信号肽剪切位点;◆表示双碱性氨基酸基序。
2.2 多序列比对及系统发生分析
选择拟南芥、木薯、麻疯树、蓖麻、可可、胡杨和葡萄等7个物种的HbRALF34同源蛋白序列与HbRALF34进行氨基酸多重序列比对和系统进化分析。多重序列比对结果显示,这些RALF蛋白的RALF结构域高度保守(图2)。系统进化分析结果显示,橡胶树HbRALF34与同属大戟科的木薯、麻疯树及蓖麻RALF蛋白亲缘关系最近(图3)。

图2 HbRALF34与其他RALF蛋白序列比对

图3 HbRALF34与其他植物RALF蛋白的系统进化树
2.3 HbRALF34的组织表达特性
组织表达分析结果(图4)表明,在橡胶树树皮、叶片、胶乳、雄花及雌花中皆有表达,其中,表达量最高的组织是胶乳,树皮次之,表达量最低的组织是叶片。比较健康橡胶树和死皮橡胶树中表达差异发现,相对于健康橡胶树,死皮橡胶树胶乳及树皮中的表达极显著上调(图5)。

各柱形上不同小写字母表示在P<0.05水平差异显著。
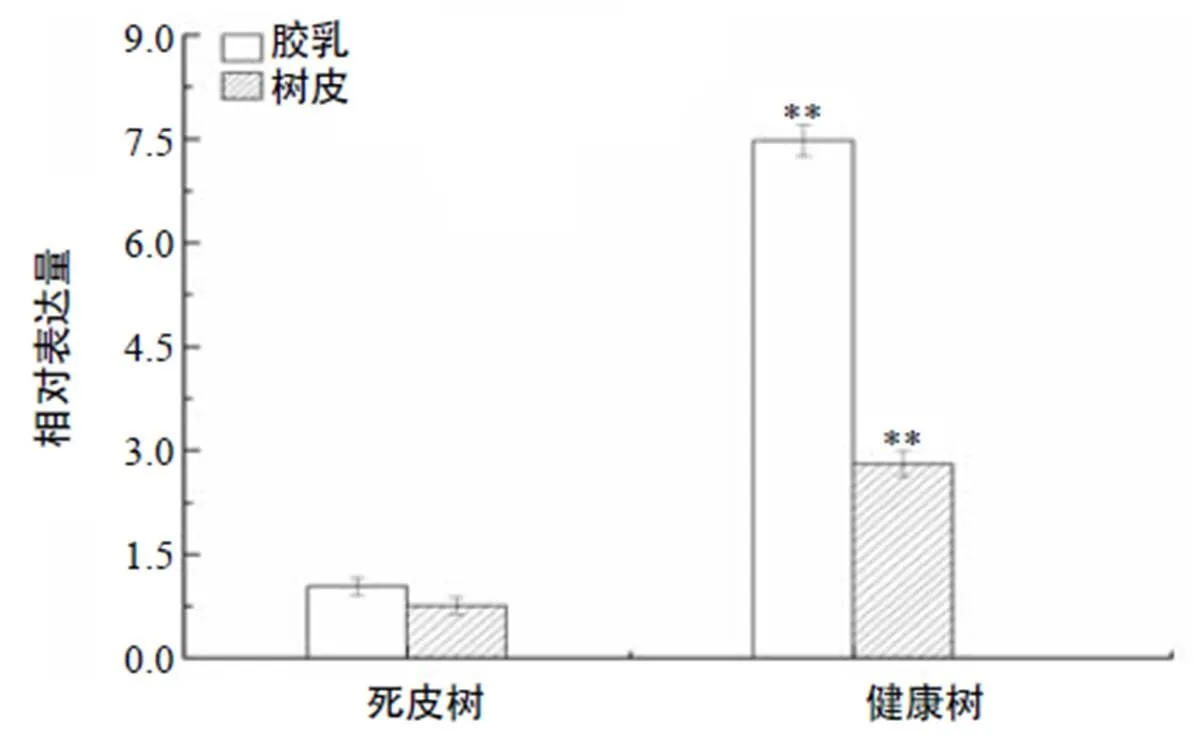
“**”表示差异极显著(P<0.01)
2.4 HbRALF34的诱导表达分析
的诱导表达分析结果显示,胶乳中受伤害及H2O2(表2)、ET及JA(表3)诱导先上调表达,表达量达到最高后迅速下降。伤害处理6 h时,的表达水平显著高于对照,为对照的2.1倍;处理24~48 h时,该基因的表达显著低于对照。H2O2处理6 h 时,的表达显著高于对照,为对照的1.6倍;24 h时,该基因的表达基本恢复到与对照相近的水平。ET处理4 h 时,为对照的2.3倍;8 h时表达量达到最高,约为对照的3.5倍;处理24~48 h时,该基因的表达显著低于对照,处理72 h后基本恢复到与对照相近的表达水平。JA处理后,的表达在8 h与对照差异显著,表达量是对照的1.7倍,处理24~72 h,的表达显著低于对照。橡胶树叶片中,的表达受低温、高盐及干旱胁迫的抑制。低温、高盐及干旱胁迫处理后,的表达量皆在3 h显著低于对照,直到处理后48 h仍显著低于对照(表4)。

表2 伤害及H2O2处理下胶乳HbRALF34的表达量
同行不同字母示差异显著(<0.05)。
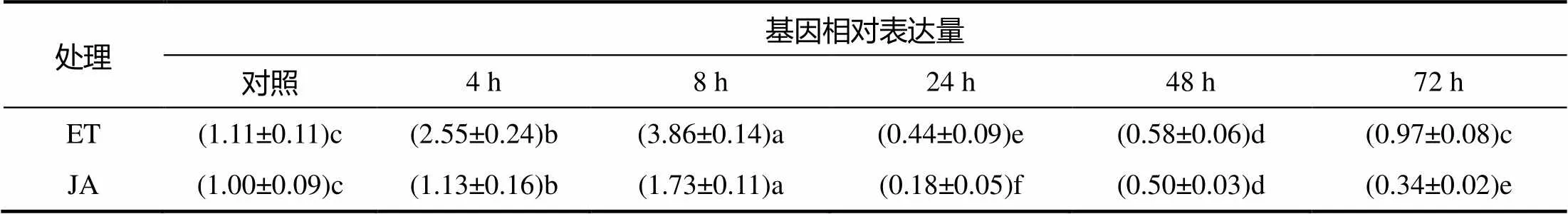
表3 ET及JA处理下胶乳HbRALF34的表达量
同行不同字母示差异显著(<0.05)。

表4 干旱、低温及盐胁迫处理下橡胶树叶片HbRALF34的表达量
同行不同字母示差异显著(<0.05)。
3 结论与讨论
本研究克隆的编码1个典型的RALF前体蛋白,其N端存在信号肽及跨膜结构域,C端包含1个RALF结构域,RALF结构域的N末端存在1个绝对保守的YISY基序(motif)。此外,HbRALF34存在3个双碱性氨基酸基序(dibasic amino acid motif),可能作为水解酶特异性识别位点,用于RALF蛋白加工成熟或RALF的降解失活[5,14]。蛋白序列比对及系统进化分析表明,橡胶树HbRALF34与拟南芥、蓖麻及可可等物种RALF家族中的RALF34蛋白同源性最高。目前,植物中的RALF34功能仍未清楚[6],对HbRALF34的功能研究将有助于解析该类RALF基因的生物学功能。
的组织表达分析结果表明,在橡胶树不同的组织皆有表达,而且存在显著的表达差异,以胶乳中表达最高,暗示HbRALF34可能在橡胶树多种生理过程中发挥作用,且与橡胶树乳管中的生理过程密切相关。橡胶树乳管是一种植物防卫结构,胶乳是乳管细胞中的细胞质,橡胶树的产排胶过程是一种植物创伤反应过程[15–18]。伤害、ET及JA刺激皆能增加橡胶树胶乳产量。其中,ET刺激可通过调节橡胶树乳管水循环、延缓乳管堵塞物形成及提高乳管糖代谢水平等调控橡胶树产排胶[7]。ET刺激橡胶树胶乳的pH值变化呈现出刺激点附近趋向碱化的趋势[19]。JA则可促进橡胶树乳管分化及橡胶生物合成[18]。而ET与JA是伤害信号转导的相关信号分子,它们之间相互作用,共同参与橡胶树的创伤反应[18–20]。已有研究表明,RALF及其受体可以调控H+–ATP酶的活性,从而调节植物细胞内外pH值;RALF还参与植物细胞内Ca2+信号的调控及MAPK的激活等[6]。细胞pH变化是植物调节细胞生长及响应外界环境刺激所产生的重要反应,是植物防御反应信号传递途径中的重要部分[21–23];而Ca2+与MAPK在调控植物生长发育及胁迫应答中皆发挥重要作用[24–27]。本研究结果显示,在橡胶树胶乳中表达最高,而在胶乳中受伤害、ET及JA诱导上调表达,表明其可能参与伤害、ET及JA等信号的传导,与橡胶树产排胶调控相关。橡胶树死皮是由强割(一种机械伤害)和强乙烯刺激所导致的产排胶失调[28–31]。与健康橡胶树相比,死皮橡胶树胶乳及树皮中的表达均极显著上调,显示可能与橡胶树死皮相关,进一步表明了与橡胶树产排胶调控的关系。此外,H2O2、低温、高盐及干旱胁迫皆能迅速引起表达的显著变化,表明可能参与橡胶树的胁迫应答。下一步通过对HbRALF34进行亚细胞定位,分离其受体,分析HbRALF34与受体的关系,深入研究HbRALF34及其受体的生物学功能,了解它们在橡胶树生长发育、产排胶调控、死皮发生及胁迫应答中的作用,有助于进一步揭示该类RALF的作用机制。
[1] 段翠芳,曾日中,黎瑜.激素对巴西橡胶树橡胶生物合成的调控[J].热带农业科学,2005,24(5):61–68.DOI:10.3969/j.issn.1009–2196.2004.05.014.
[2] 朱家红,张全琪,张治礼.乙烯利刺激橡胶树增产及其分子生物学基础[J].植物生理学通讯,2010,46 (1):87–93.DOI:10.13592/j.cnki.ppj.2010.01.024.
[3] 许闻献,曾庆.中国橡胶树割制改革30年[J].热带农业科学,2000,20(6):57–71.DOI:10.3969/j.issn.1009– 2196.2000.06.013.
[4] 蔡磊,校现周,蔡世英.乙烯利与橡胶树排胶及死皮关系[J].云南热作科技,1999,22(4):18–21.DOI:10. 16005/j.cnki.tast.1999.04.009.
[5] PEARCE G,MOURA DS,STRATMANN J,et al.RALF,a 5–kDa ubiquitous polypeptide in plants,arrests root growth and development[J].Proc Natl Acad Sci USA,2001,98:12843–12847.DOI:0.1073/pnas.201416998.
[6] MURPHY E,DE SMET I.Understanding the RALF family:a tale of many species[J].Trends Plant Sci,2014,19(10):664–671.DOI:10.1016/j.tplants.2014.06.005.
[7] NIE Z,KANG G,DUAN C,et al.Profiling ethylene–responsive genes expressed in the latex of the mature virgin rubber trees using cDNA microarray[J]. PloS One,2016,11(3):e0152039.DOI:10.1371/journal. pone.0152039.
[8] HAO B Z,WU J L.Laticifer differentiation in:induction by exogenous jasmonic acid and linolenic acid[J].Ann Bot,2000,85:37–43.DOI:10. 1006/anbo.1999.0995.
[9] TANG C,HUANG D,YANG J,et al.The sucrose transporter HbSUT3 plays an active role in sucrose loading to laticifer and rubber productivity in exploited trees of(para rubber tree)[J].Plant Cell Environ,2010,33(10):1708–1720.DOI:10.1111/j. 1365–3040.2010.02175.x.
[10] ZHU J,ZHANG Q,WU R,et al.HbMT2,an ethephon– induced metallothionein gene fromresponds to H2O2stress[J].Plant Physiol Bioch,2010,48(8):710–715.DOI:10.1016/j.plaphy.2010.04.004.
[11] 刘辉,邓治,陈江淑,等.巴西橡胶树类钙调素蛋白基因克隆与表达分析[J].分子植物育种,2015(12):2721–2727.DOI:10.16005/j.cnki.tast.1999.04. 009.
[12] XU J,AILENI M,ABBAGANI S,et al.A reliable and efficient method for total RNA isolation from various members of spurge family (Euphorbiaceae)[J]. Phytochem Anal,2010,21(5):395–398.DOI:10.1002/ pca.1205.
[13] NIE Z,KANG G,LI Y,et al.Whole–transcriptome survey of the putative ATP–binding cassette(ABC) transporter family genes in the latex–producing laticifers of[J].PloS One,2015,10(1):e0116857.DOI:10.1371/journal.pone.0116857.
[14] OLSEN AN,MUNDY J,SKRIVER K.Peptomics,identification of novel cationicpeptides with conserved sequence motifs[J].In Silico Biol,2002,2(4):441–451.
[15] GIDROL X,CHRESTIN H,TAN H L,et al.Hevein,a lectin–like protein from(rubber tree) is involved in the coagulation of latex[J].J Biol Chem,1994,269(12):9278–9283.
[16] SUBROTO T,VAN KONINGSVELD G A,SCHREUDER H A,et al.Chitinase and β–1,3–glucanase in the lutoid–body fraction oflatex[J]. Phytoche– mistry,1996,43(1):29–37.DOI:10.1016/0031–9422(96) 00196–3.
[17] KO J H,CHOW K S,HAN K H.Transcriptome analysis reveals novel features of the molecular events occurring in the laticifers of(para rubber tree)[J]. Plant Mol Biol,2003,53(4):479–492.DOI:10.1023/B:PLAN.0000019119.66643.5d.
[18] 袁红梅,洪灏,黄惜.巴西橡胶树产排胶机理的研究进展[J].分子植物育种,2015,13(5):1151–1156.DOI:10. 13271/j.mpb.013.001151.
[19] 肖再云,校现周.橡胶树PR107气刺微割排胶影响面胶乳pH值测定及分析[J].热带农业科学,2009,29(8):1–4.DOI:10.3969/j.issn.1009–2196.2009.08.001.
[20] LEON J,ROJO E,SANCHEZ–SERRANO J J.Wound signalling in plants[J].2001,J Exp Bot,52 (354):1–9. DOI:10.1093/jexbot/52.354.1.
[21] JOHANNES E,COLLINGS D A,RINK J C,et al. Cytoplasmic pH dynamics in maize pulvinal cells induced by gravity vector changes[J].Plant Physiol,2001,127(1):119–130.DOI:10.1104/pp.127.1.119.
[22] FELIX G,DURAN J D,VOLKO S,et al.Plants have a sensitive perception system for the most conserved domain of bacterial flagellin[J].Plant J,1999,18(3):265–276.DOI:10.1046/j.1365–313X.1999.00265.x.
[23] FELIX G,REGENASS M,BOLLER T.Sensing of osmotic pressure changes in tomato cells[J].Plant Physiol,2000,124(3):1169–1180.DOI:10.1104/pp. 124.3.1169.
[24] CHEVAL C,ALDON D,GALAUD J P,et al. Calcium/ calmodulin–mediated regulation of plant immunity[J]. Biochim Biophys Acta,2013,1833(7):1766–1771.DOI: 10.1016/j.bbamcr.2013.01.031.
[25] 郑仲仲,沈金秋,潘伟槐,等.植物钙感受器及其介导的逆境信号途径[J].遗传,2013,35(7):875–884.DOI: 10.3724/SP.J.1005.2013.00875.
[26] CHINNUSAMY V,SCHUMAKER K,ZHU J K. Molecular genetic perspectives on cross–talk and specificity in abiotic stress signalling in plants[J].J ExpBot,2004,55(395):225–236.DOI:10.1093/jxb/ erh005.
[27] 胡风庆.MAPK对高等植物细胞分裂和生长的调节[J]. 中国生物工程杂志,2002,22(5):58–64.DOI:10.3969/j. issn.1671–8135.2002.05.011.
[28] CHRESTIN H,BANGRATZ J,D'AUZAC J,et al.Role of the lutoidic tonoplast in the senescence and degeneration of the laticifers of[J].Z Pjlanzenphysiol Bd,1984,114(3):261–268.DOI:10. 1016/S0044–328X (84)80020–3.
[29] 范思伟,杨少琼.巴西橡胶死皮病的概念,假说和发病机理[J].热带作物研究,1991 (2):73–80.
[30] YUSOF F,SITI ARIJA M A,GHANDIMATHI H,et al. Changes in some physiological latex parameters in relation to over–exploitation and the onset of induced tapping panel dryness[J].J Nat Rubb Res,1996,10:182–198.
[31] PUTRANTO R A,HERLINAWATI E,RIO M,et al. Involvement of ethylene in the latex metabolism and tapping panel dryness of[J]. International Journal of Molecular Sciences,2015,16(8):17885– 17908.DOI:10.3390/ijms160817885.
责任编辑:尹小红
英文编辑:梁 和
Cloning and expression analysis offrom
NIE Zhiyi, LI Yu, KANG Guijuan, CAI Haibin, ZENG Rizhong*
(Rubber Research Institute, Chinese Academy of Tropical Agricultural Sciences/Key Laboratory of Biology and Genetic Resources of Rubber Tree, Ministry of Agriculture, Danzhou, Hainan 571737, China)
Based on the latex transcriptome date, a cDNA sequence of rapid alkalinization factor (RALF) family gene was identified by RT–PCR. The cDNA is 767 bp in size with a 411 bp open reading frame and encodes 136 amino acids. BLASTX searches of GenBank showed that the deduced amino acid sequences of RALF gene was similar to,thus was named as. Expression profiles ofin different tissues ofclone Reyan 7–33–97 and in response to ethylene (ET), jasmonic acid (JA), wounding, hydrogen peroxide (H2O2), high salt, low temperature and drought were assayed via real–time quantitative PCR (RT–qPCR). The results suggested thatwas ubiquitously expressed in the leaves, flowers, barks and latex of rubber tree, and its highest expression was in latex. Compared with healthy rubber tree, the expression level ofwas increased in latex and bark of tapping panel dryness rubber tree. Moreover, the expression ofwas induced by ET, JA, H2O2and wounding treatments, but was inhibited by high salt stress, low temperature and drought treatments. All these results suggest thatis likely involved in signal transduction, regulating rubber biosynthesis and latex flow, as well as responding to stress in.
;; rapid alkalinization factor; gene cloning; expression analysis
S794.1
A
1007-1032(2017)06-0597-07
2017–05–22
2017–11–04
国家自然科学基金项目(31770642,31270713);海南省自然科学基金项目(20153108)
聂智毅(1978—),男,广西梧州人,副研究员,主要从事天然橡胶质量相关的遗传与环境因素研究,narzyzizip@163.com;
通信作者,曾日中,研究员,主要从事天然橡胶质量相关的遗传与环境因素研究,hnzrz@aliyun.com
投稿网址:http://xb.hunau.edu.cn
