外源硫化氢对加工番茄种子耐盐性及抗氧化酶的影响
2017-12-18郑州元林海荣崔辉梅
郑州元,林海荣,崔辉梅
(1.石河子大学农学院,新疆石河子832003;2.特色果蔬栽培生理与种质资源利用兵团重点实验室,新疆石河子832003)
外源硫化氢对加工番茄种子耐盐性及抗氧化酶的影响
郑州元1,2,林海荣1,崔辉梅1,2
(1.石河子大学农学院,新疆石河子832003;2.特色果蔬栽培生理与种质资源利用兵团重点实验室,新疆石河子832003)
为明确硫化氢对盐胁迫下加工番茄种子萌发的缓解作用,用NaCl半致死浓度为85 mmol·L-1的KT-63(耐盐性弱)和半致死浓度为120 mmol·L-1的KT-18(耐盐性强)为材料,用各自的半致死浓度与不同浓度的NaHS(0.2,0.4,0.6,1.0mmol·L-1)分别配成混合液处理种子。结果表明,随着 NaHS浓度的增加,种子的发芽率、发芽势、发芽指数、活力指数、SOD、POD、CAT活性呈先上升后下降的趋势,其中与盐胁迫单独处理相比,用0.4 mmol·L-1NaHS处理,种子的发芽率、发芽势、发芽指数、活力指数、SOD、POD、CAT活性在 KT-63中分别提升70%、250%、120%、130%、6.7%、150%和180%,在 KT-18中分别提升 50%、250%、60%、80%、4.3%、160%和 200%,而MDA的含量显著降低,并且对KT-63的缓解效应强于KT-18。综上所述,H2S(0.4 mmol·L-1)有效缓解了加工番茄萌发过程中盐胁迫的抑制作用,促进了种子的萌发。
硫化氢;盐胁迫;加工番茄;种子萌发;抗氧化酶
土壤盐渍化和次生盐渍化对农业的威胁已成为一个全球性问题,土壤中过高的盐分会引起植物生理干旱,植物感受刺激后通过Na+受体作用激活Ca2+通道以及活性氧,如过氧化氢(H2O2)和羟自由基(HO·)在细胞中的积累,影响植物正常营养吸收,阻碍植物正常生长发育,引起植株氧化胁迫,质膜受损,最终引起对植物的伤害甚至死亡[1-2]。在中国绝大部分加工番茄种植在西北地区盐渍土壤中[3],而新疆又是我国最大的加工番茄种植和加工基地。新疆地处内陆干旱地区,降水稀少蒸发量大,地表积盐较重,最容易引起土壤盐渍化[4]。加工番茄是中度耐盐植物,土壤盐渍化严重影响加工番茄种子萌发率、幼苗和根系的生长发育以及果实的产量和品质。因此,研究与加工番茄抗盐性及其调控相关的抗氧化酶活性,对指导加工番茄生产中的抗盐性具有实际意义。
近年来的研究发现H2S是继NO、CO之后的第三种内源气体信号分子,参与多种植物的生理过程[5]。已有的结果表明,外源H2S能促进小麦种子在正常情况下和 PEG,Cu2+,Cr,Al3+胁迫下的萌发[6-10],同时外源H2S能促进盐胁迫下紫花苜蓿种子的萌发[11],以及根的发生[12],气孔的运动[13]。然而,因为气候、地域影响,有关H2S对盐胁迫下新疆加工番茄种子萌发影响以及种子萌发过程中相关抗氧化酶活性及膜质过氧化方面的研究并不清楚。本试验以新疆两种加工番茄为材料,研究外源H2S处理对NaCl胁迫下加工番茄种子萌发和相关抗氧化酶(SOD,POD,CAT)活性及丙二醛含量的影响,揭示外源H2S调控NaCl胁迫下加工番茄种子萌发特性及抗氧化酶活性机制,以期为提高加工番茄耐盐性及揭示其耐盐性机理提供理论依据。
1 材料与方法
1.1 供试材料
供试番茄材料为:KT-63,KT-18两个自交品系,由石河子大学农学院实验室提供;外源硫化氢供体为NaHS,购自sigma公司(中国)。种子实验在恒温培养箱内进行,实验于2015年8月在石河子大学农学院生理实验室进行。
1.2 试验设计
挑选大小一致且饱满的加工番茄种子用37℃~40℃的温水浸种3 h,之后用10%的高锰酸钾溶液浸种10min,用蒸馏水冲洗3次。用前期预实验筛选的NaCl半致死浓度为 85 mmol·L-1耐盐性弱的KT-63和半致死浓度为 120 mmol·L-1耐盐性强的KT-18用于实验,用各自的半致死浓度NaCl和不同浓度NaHS配成混合溶液,试验处理分别为蒸馏水处理(CK1),85 mmol·L-1NaCl处理(CK2),0.2 mmol·L-1NaHS+85 mmol·L-1NaCl(T1),0.4 mmol·L-1NaHS+85 mmol·L-1NaCl(T2),0.6 mmol·L-1NaHS+85mmol·L-1NaCl(T3),1.0 mmol·L-1NaHS+85mmol·L-1NaCl(T4);蒸馏水处理(CKn),120mmol·L-1NaCl处理(CKp),0.2mmol·L-1NaHS+120mmol·L-1NaCl(M1),0.4 mmol·L-1NaHS+120 mmol·L-1NaCl(M2),0.6 mmol·L-1NaHS+120 mmol·L-1NaCl(M3),1.0mmol·L-1NaHS+120mmol·L-1NaCl(M4)处理。每个处理3个重复,每个重复挑选30粒种子置于铺有10层滤纸含有不同处理液的培养皿中,6天换一次滤纸。将培养皿置于25℃,16 h/8 h光暗交替的恒温培养箱中培养12 d,每天观察种子的萌发情况并记录发芽数,以胚根长度达到种子自身长度一半为发芽标准。
1.3 测试指标及方法
采用常规方法测定发芽率、发芽势、发芽指数、活力指数,具体参见孟红梅等[14]的方法。用直尺测定胚轴和胚根长,用称重法测定10棵幼苗鲜重。用高俊凤[15]的硫代巴比妥酸(TBA)比色法测定丙二醛(MDA)含量;用氮蓝四唑(NBT)还原法测定超氧化物歧化酶(SOD)活性,以抑制光化还原50%为1个酶活性单位;用愈创木酚法测定过氧化物酶(POD)活性;参照Chance和Maehly[16]的方法测定过氧化氢酶(CAT)活性。
1.4 数据统计分析
数据均取3次重复的平均值,采用Microsoft Excel处理数据,用SPSS 19.0软件对数据进行单因素方差分析,并运用Duncan’s检验法对显著性差异(P<0.05)进行多重比较,结果以平均值 ±标准误(means±SD)表示,用 Microsoft Excel作图。
2 结果与分析
2.1 外源H2S对NaCl胁迫下加工番茄种子发芽的影响
不同浓度的NaHS处理对NaCl胁迫下两种番茄种子的萌发有一定的影响。随着NaHS浓度的增加,两种加工番茄品系的发芽相关指标呈现先上升后下降的趋势(表 1)。用 0.2~1.0 mmol·L-1NaHS+NaCl处理较NaCl单独处理两个品系发芽率显著增加,在 0.4~1.0mmol·L-1时达到与空白对照相近的水平,都表现为差异不显著,并且两个品系都在0.4mmol·L-1时发芽率、发芽势、发芽指数和活力指数在胁迫条件下达到最高,在KT-63中,NaHS浓度为 0.4mmol·L-1时发芽率、发芽势、发芽指数和活力指数较 CK2分别提升 0.7倍、2.5倍、1.2倍和 1.3倍,差异显著。在KT-18中,NaHS浓度为0.4mmol·L-1时发芽率、发芽势、发芽指数和活力指数较CKp分别提升 0.48倍、2.5倍、0.6倍和 0.8倍,其中发芽率、发芽指数和活力指数都达到显著水平。结果表明 0.4~1.0 mmol·L-1NaHS都能缓解 NaCl胁迫对番茄种子萌发的抑制作用,其中以0.4 mmol·L-1效果最好,同时对发芽指标的缓解效果看,0.4 mmol·L-1的NaHS对耐盐性弱的KT-63缓解效应更强。
2.2 外源H2S处理对NaCl胁迫下发芽加工番茄种子生长的影响
由图1可以看到NaCl胁迫显著降低了KT-63和KT-18的胚轴长,在添加不同浓度的NaHS处理之后,随着NaHS浓度增加胚轴长度都呈现由上升到下降的趋势。在 KT-63中,T2-T4条件下较CK2相比胚轴长度都达到了显著水平,其中NaHS浓度为 0.4mmol·L-1胚轴最长,较 CK2相比提升了12.2%。在KT-18中,M1-M3比起 CKp胚轴长度显著增加,在 NaHS浓度为 0.4 mmol·L-1时达到最大,较 CKp增加了 6.0%,其中 M4比 CKp显著降低。说明低浓度的NaHS能促进盐胁迫下加工番茄萌发期幼苗胚轴的伸长,在耐盐性不同的两个品系中,NaHS浓度为 0.4 mmol·L-1时处理效果最好,对耐盐性强的 KT-18而言,1.0mmol·L-1的浓度抑制了胚轴伸长。
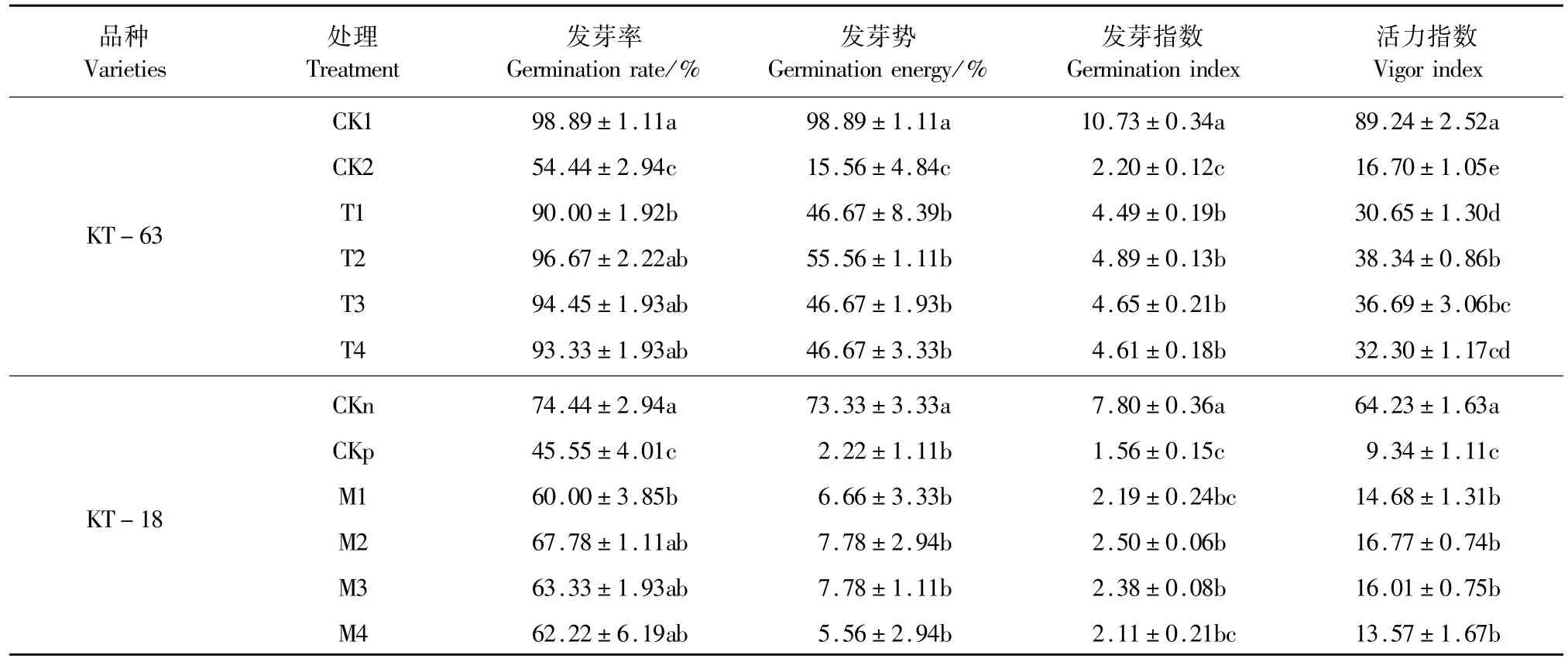
表1 NaHS对NaCl胁迫下加工番茄种子萌发的影响Table 1 Effect of exogenous NaHSon seed germination of processing tomato under NaCl stress
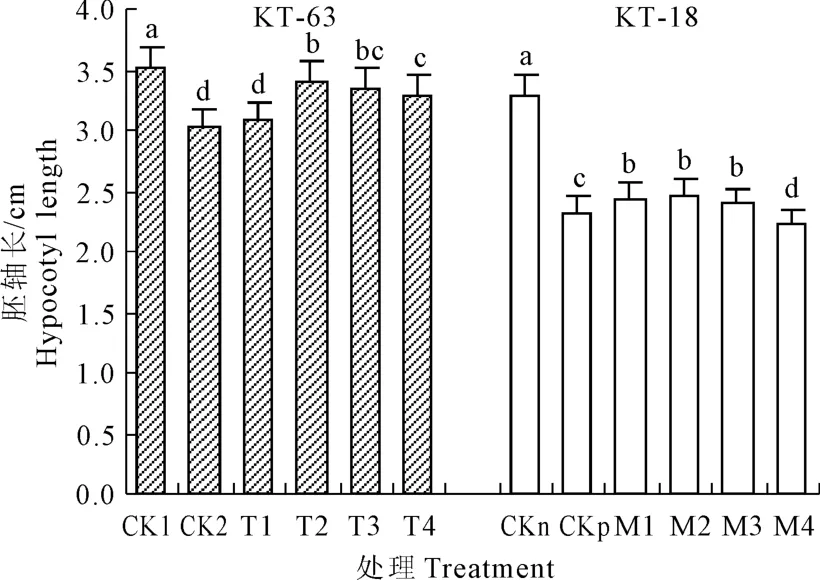
图1 NaHS对NaCl胁迫下番茄幼苗胚轴长的影响Fig.1 Effectof exogenous NaHSon hypocotyl length of tomato seedlings under NaCl stress
不同浓度的NaHS处理对NaCl胁迫下加工番茄的胚根长有一定影响。图2表明,与空白对照相比,NaCl胁迫使两种番茄胚根长都显著降低。随着NaHS处理浓度的增加总体上胚根长呈现先升后降的趋势,在KT-63中,T1-T3较CK2处理有明显的促进作用,当浓度为 1.0 mmol·L-1时迅速下降。在KT-18中,NaHS处理也促进了盐胁迫下胚根的伸长,但没有达到显著水平,在M3-M4时缓慢下降。当 NaHS浓度为 1.0mmol·L-1时较 0.6 mmol·L-1时胚根长在KT-63和KT-18中分别下降11.4%和3.0%。这个结果说明低浓度的NaHS可以促进盐胁迫下加工番茄萌发期胚根的伸长,缓解盐胁迫对胚根伸长的抑制作用,当浓度为 1.0mmol·L-1时,缓解效应下降,对于耐盐性强的KT-18,NaHS的效应随浓度的变化较缓慢。
图3表明,T2-T3和M1-M3处理与盐胁迫单独处理相比,分别显著增加了KT-63和KT-18在盐胁迫下的侧根数目,但在T4和M4时侧根数目又迅速减少了,KT-63和KT-18两品系侧根数目都在 NaHS浓度为 0.4mmol·L-1时达到了最多。说明NaHS可以促进盐胁迫下侧根的形成,但高浓度的NaHS可能还会抑制侧根的形成。

图2 NaHS对NaCl胁迫下番茄幼苗胚根长的影响Fig.2 Effect of exogenous NaHSon root length of tomato seedlings under NaCl stress
图4 表明,在T2-T4和M2-M4分别能显著增加KT-63和KT-18在盐胁迫下胚轴鲜重,并且NaHS浓度为 0.4 mmol·L-1时两种在盐胁迫下的加工番茄胚轴鲜重达到最重,分别较CK2和CKp增加了20.7%和23.5%。在KT-18中,M4胚轴鲜重与CKp相比有所下降。说明因耐盐性不同,NaHS对两个品系胚轴鲜重的影响程度也不一样,对于KT-18来说高浓度的NaHS没有缓解作用还加剧了胁迫。

图3 NaHS对NaCl胁迫下番茄幼苗侧根数的影响Fig.3 Effectof exogenous NaHSon lateral root number of tomato seedlings under NaCl stress
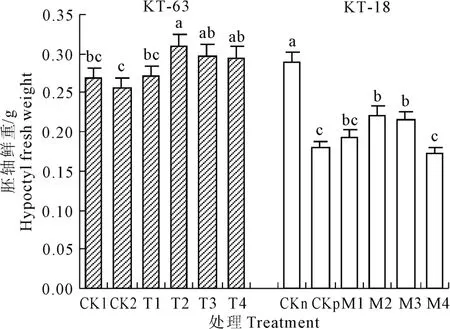
图4 NaHS对NaCl胁迫下番茄幼苗胚轴鲜重的影响Fig.4 Effect of exogenous NaHSon hypocotyl fresh weightof tomato seedlings under NaCl stress
图5 表示,T1-T4处理显著增加了KT-63在盐胁迫下胚根的鲜重,但是在KT-18中NaHS处理使盐胁迫下胚根鲜重有所增加却没有达到显著水平,两个加工番茄品系都是在 NaHS浓度为 0.4 mmol·L-1时对胚根鲜重的作用效果最好,分别比CK2和CKp增加了40.9%和13.3%。以上结果表明,NaHS缓解盐胁迫抑制胚轴鲜重增加的效应在耐盐性弱的品系中更加明显,表现为对盐敏感对缓解物质NaHS的作用效果也敏感。

图5 NaHS对NaCl胁迫下番茄幼苗胚根鲜重的影响Fig.5 Effect of exogenous NaHSon root fresh weight of tomato seedlings under NaCl stress
2.3 外源H2S处理对NaCl胁迫下加工番茄种子发芽抗氧化酶活性的影响
图6表明,两个品系加工番茄种子在NaCl胁迫(CK2,CKp)下较空白对照(CK1,CKn)相比 SOD活性显著下降。而外源NaHS处理有效缓解了NaCl对番茄种子发芽过程中SOD活性的降低,盐胁迫下随着NaHS处理浓度的增加,SOD活性呈现先上升后下降的趋势。在盐胁迫下两个品系中SOD活性都在NaHS浓度为 0.4mmol·L-1时达到了最高,SOD活性分别比CK2和CKp提高了6.7%和4.3%。以上结果说明,在这两个品系中 0.4 mmol·L-1的 NaHS浓度为缓解NaCl胁迫下SOD活性降低的最适宜浓度,并且NaHS对耐盐性弱的KT-63缓解效应表现的更强。
由图7可以看出,在两个番茄品系中盐胁迫显著降低了萌发过程中幼苗中POD的活性。加入外源NaHS后,随NaHS浓度的增加,POD活性总体呈先升后降的趋势。在 KT-63中,T2与 CK2相比POD活性显著增加,活性提升了1.5倍,而 T4时POD活性比 CK2还要低。在 KT-18中,从 M1-M4,与CKp相比POD活性都显著增加,并且在M2时达到最高,比CKp增加1.6倍。以上结果表明,NaHS对幼苗NaCl胁迫下POD活性的影响效果与浓度和品系有关,耐盐性弱的KT-63对不同浓度的NaHS也较为敏感,高浓度的NaHS还会进一步降低POD的活性,而对于耐盐性较强的KT-18,POD活性随NaHS浓度增加变化相对较为缓和,但这两个品系中最佳 NaHS作用浓度都是 0.4mmol·L-1。

图6 NaHS对NaCl胁迫下番茄幼苗SOD活性影响Fig.6 Effect of exogenous NaHS on SOD activity of tomato seedlings under NaCl stress
如图8所示,在各处理中,CAT活性表现出与POD相似的变化趋势。在 KT-63中,T1-T3较CK2的 CAT活性都显著增加,并且在 T2和 T3时CAT活性比CK1还要高,都达到显著水平,分别是CK2的1.77倍和 1.78倍。在 KT-18中,M2-M4水平下CAT活性与CKp相比显著升高,并且在M2时CAT活性最高,是CKp的2倍。结果表明,在加入NaHS后,对CAT活性影响效应在两个品系中不完全一样,在KT-63中NaHS处理后较空白对照相比CAT活性显著提升,但在KT-18中没有这样明显的效应。说明NaHS效应在这两个抗盐性不同品系间有差异,表现为盐胁迫下KT-63对NaHS的作用效果更敏感。

图7 NaHS对NaCl胁迫下番茄幼苗POD活性影响Fig.7 Effectof exogenous NaHSon POD activity of tomato seedlings under NaCl stress

图8 NaHS对NaCl胁迫下番茄幼苗CAT活性影响Fig.8 Effect of exogenous NaHS on CAT activity of tomato seedlings under NaCl stress
2.4 外源H2S处理对NaCl胁迫下加工番茄种子发芽丙二醛含量的影响
由图9可知,CK2与CK1相比,CKp与CKn相比丙二醛(MDA)含量均显著升高。添加NaHS后,随着NaHS浓度的升高MDA含量在两个番茄品系中都表现先降低后升高的趋势。在KT-63中,从T1-T4的MDA含量都显著比CK2低,并且在T3降到最低。在KT-18中,NaHS处理组中MDA含量较CKp也显著降低,在 M2降到了最低。这说明用NaHS处理盐胁迫下加工番茄可以缓解萌发期由盐胁迫所引起的MDA的积累。在不同浓度NaHS处理中,0.6mmol·L-1和 0.4mmol·L-1NaHS可以使盐胁迫下KT-63和KT-18中MDA含量分别降到最低,比CK2和CKp分别下降36.0%和26.0%。说明NaHS可以显著缓解萌发期两种耐盐性不同番茄幼苗的膜脂过氧化程度。
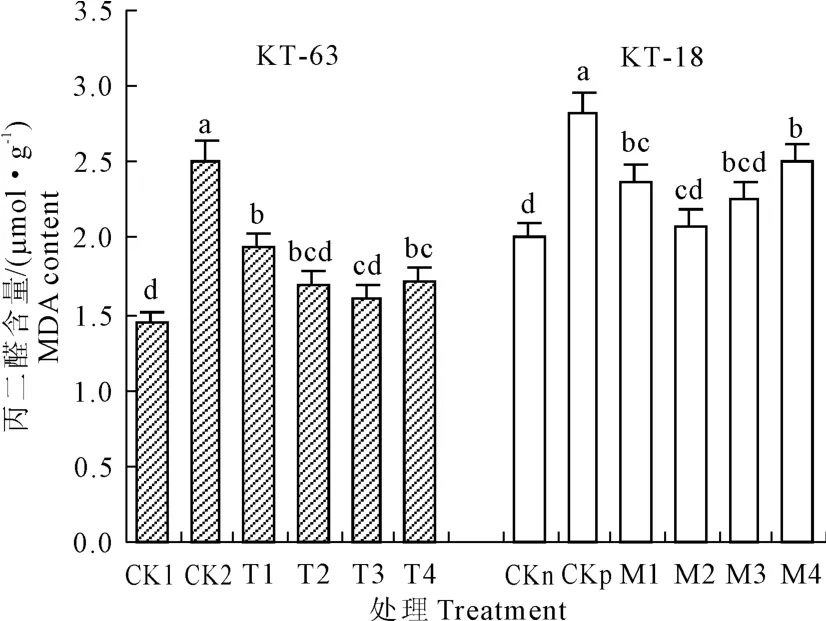
图9 NaHS对NaCl胁迫下番茄幼苗MDA含量影响Fig.9 Effectof exogenous NaHSon MDA content of tomato seedlings under NaCl stress
3 讨论与结论
种子萌发是植物生长发育的重要阶段,但是近年来的研究结果表明盐胁迫对种子的萌发具有显著的抑制作用。由于高浓度的盐胁迫使水势降低,造成种子吸水困难,同时还会破坏细胞质膜的完整性,进而影响芽和根的伸长。在植物生育期中,种子萌发期是对盐胁迫较为敏感的时期,利用外源物质提高种子萌发期的抗盐性是很重要的方法。
外源物质H2S被报道参与植物的生长发育以及胁迫耐性的获得[17]。NaHS处理能改善幼苗的生长状况,可以提高能源植物小桐子种子的发芽率和发芽势[18]。本实验中H2S供体NaHS可以提高盐胁迫下两种耐盐性不同加工番茄种子发芽指标,说明H2S能缓解盐胁迫对加工番茄种子萌发的抑制,这个结果与Wang等[11]H2S可以缓解盐胁迫对紫花苜蓿种子萌发的抑制相一致。NaHS处理对盐胁迫下萌发期幼苗胚轴的影响,说明NaHS能促进盐胁迫下加工番茄萌发期幼苗胚轴和胚根的伸长,胚轴和胚根鲜重的增加,还能促进侧根的形成,这个结果与Li等[19]的一致。不同浓度的 NaHS处理对 NaCl胁迫下加工番茄种子发芽和生长的影响说明低浓度的NaHS能促进盐胁迫下加工番茄种子的萌发,而高浓度的NaHS对胁迫的缓解作用降低,甚至加重胁迫作用,这种表现在耐盐性弱的KT-63中更为明显。这可能与高浓度的NaHS产生的渗透胁迫有关,同时对于环境变化感受较为明显的品系来说,是不是因为品系间基因型存在差异进而对环境的感受也存在差异,有待进一步研究。
SOD,POD,CAT在清除超氧自由基、过氧化物、过氧化氢等方面具有重要作用[20]。在本实验中NaHS处理使盐胁迫下SOD,POD,CAT活性在两种番茄中都有所增加,这个结果与何庆元[21]在大豆中的结论相似。在正常环境下植物体内活性氧的产生与清除是处于动态平衡的,当植物遭受逆境胁迫时,这种动态平衡就会被打破,使 SOD、POD、CAT活性发生变化[22]。本实验中耐盐性弱的 KT-63对NaHS的作用效果也相对敏感,而耐盐性强的KT-18对NaHS浓度的变化表现迟钝。说明NaHS对番茄萌发过程中盐胁迫产生的氧化损伤具有一定的缓解效应,番茄幼苗盐胁迫的缓解作用可能与品系有关,同时这三种抗氧化酶在耐盐性不同的两个品系中的升降幅度不同,可能是NaHS对不同品系的作用效应或对这三种酶活性的调节存在差异,这有待于进一步研究。
MDA含量是衡量膜质过氧化的一个重要指标,其含量的多少与植物遭受的氧化胁迫成正比[23]。本实验中盐胁迫显著增加了两种加工番茄萌发过程MDA的含量,这个结果与刘文瑜等[24]的研究结果一致。用不同浓度的NaHS处理后MDA含量发生不同程度的降低。说明NaHS能降低番茄种子在盐胁迫下萌发过程中MDA的积累,能够通过缓解质膜受损程度来促进幼苗的生长,但是在两品系中MDA含量最低时的NaHS浓度不同,可能是不同浓度NaHS处理对MDA含量的调节在品系间存在差异。
综上,本文中外源H2S对盐胁迫下两个耐盐性不同加工番茄品系种子耐盐性及抗氧化酶影响的研究表明,外源NaHS能不同程度增加两种加工番茄品系的发芽相关指标,当 NaHS浓度为0.4 mmol·L-1时种子发芽率、发芽势、发芽指数、活力指数、胚轴长、胚根长、侧根数、胚轴鲜重、根鲜重在盐胁迫下都达到了最大。同样的,低浓度的NaHS增强了种子萌发过程中的抗氧化酶活性,其中NaHS浓度为0.4mmol·L-1时 SOD、POD、CAT活性在盐胁迫下最强。种子在盐胁迫萌发过程中MDA含量在KT-63和 KT-18中分别在 NaHS浓度为 0.6 mmol·L-1和0.4mmol·L-1时降到了最低。整体表现为低浓度的NaHS缓解了盐胁迫下加工番茄种子的萌发,增强了抗氧化酶的活性,降低了丙二醛含量的积累,并且NaHS对耐盐性弱的KT-63缓解效应表现得更强。
[1] Deinlein U,Stephan A B,Horie T,etal.Plant salt-tolerancemechanisms[J].Trends in plant Science,2014,19(6):371-379.
[2] 王 聪,朱月林,杨立飞,等.NaCl胁迫对菜用大豆种子膨大过程中抗氧化系统及渗透调节物质的影响[J].西北植物学报,2012,32(2):297-305.
[3] Mao R,Fitzpatrick R,Liu X,et al.Chemical properties of selected soils from the North China Plain[C]//Mcvicar TR,Li R,Walker J,etal.Regionalwater and soil assessment formanaging sustainable agriculture in China and Australia.Canberra:Australian Centre for International Agricultural Research,2002.
[4] 曾幼玲,蔡忠贞,马 纪,等.盐分和水分胁迫对两种盐生植物盐爪爪和盐穗木种子萌发的影响[J].生态学杂志,2006,25(9):1014-1018.
[5] WANG R.Physiological implications of hydrogen sulfide:a whiff exploration that blossomed[J].Physiol Rev,2012,92(2):791-896.
[6] Zhang H,Hu L Y,Hu K D,et al.Hydrogen sulfide promoteswheat seed germination and allevi-ates oxidative damage against copper stress[J].Integr Plant Biol,2008,50(12):1518-1529.
[7] Zhang H,Hu LY,Li P,et al.Hydrogen sulfide alleviated chromium toxicity in wheat[J].Biol Plant,2010,54(4):743-747.
[8] Zhang H,Jiao H,Jiang CX,etal.Hydrogen sulfide protects soybean seedlings against drought-induced oxidative stress[J].Acta Physiol Plant,2010,32(5):849-857.
[9] Zhang H,Tan ZQ,Hu L Y,et al.Hydrogen sulfide alleviates aluminum toxicity in germinating wheat seedlings[J].Integr Plant Biol,2010,52(6):556-567.
[10] Zhang H,Wang M F,Hua L Y,et al.Hydrogen sulfide promotes wheat seed germination under osmotic stress[J].Russ JPlant Physiol,2010,57(4):532-539.
[11] Wang YQ,Li L,CuiW T,etal.Hydrogen sulfide enhancesalfalfa(Medicago sativa)tolerance against salinity during seed germination by nitric oxide pathway[J].Plant Soil,2012,351(1-2):107-119.
[12] Zhang H,Tang J,Liu X P,et al.Hydrogen sulfide promotes root organogenesis in Ipromoea batatas,Salixmatsudana and Glycinemax[J].Integr Plant Biol,2009,51(12):1084-1092.
[13] 王兰香,侯智慧,侯丽霞,等.H2O2介导的H2S产生参与干旱诱导的拟南芥气孔关闭[J].植物学报,2012,47(3):217-225.
[14] 孟红梅,韩多红,李彩霞,等.NaCl胁迫对板蓝根种子萌发的影响[J].干旱地区农业研究,2008,26(1):213-216.
[15] 高俊凤.植物生理学实验指导[M].北京:高等教育出版社,2006.
[16] Chance B,Maehly A C.Assay of catalase and peroxidase[J].Methods in Enzymology,1995,764(2):775.
[17] Lisjak M,Teklic T,Wilson ID,et al.Hydrogen sulfide:Environmental factor or signalingmolecule[J].Plant cell Environ,2013,36(9):1607-1616.
[18] Li ZG,Gong M,Liu P.Hydrogen sulfide isamediator in H2O2-induced seed germination in Jatropha curcas[J].Acta Physiol Plant,2012,34(6):2207-2213.
[19] Li Y J,Chen J,Xian M,etal.In Site Bioimaging ofHydrogen Sulfide Uncovers Its Pivotal Role in Regulating Nitric Oxide-Induced Lateral Root Formation[J].PLoSONE,2014,9(2):e90340.doi:10.1371/journal.pone.0090340.
[20] Bowler C,Van M,Inzc D.Superoxide dismutaseand stress tolerance[J].Annual Review plant Physiology and Plant Molecular Biology,1992,(43):83-116.
[21] 何庆元,向仕华,吴 萍,等.硫化氢对盐胁迫条件下大豆抗氧化酶活性的影响[J].大豆科学,2015,34(3):427-431.
[22] 赵可夫,卢元芳,张宝泽,等.Ca2+离子对小麦幼苗降低盐害效应的研究[J].植物学报,1993,35(1):51-56.
[23] 李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000:267-268.
[24] 刘文瑜,杨宏伟,魏小红,等.外源NO调控盐胁迫下蒺藜苜蓿种子萌发生理特性及抗氧化酶的研究[J].草业学报,2015,24(2):85-95.
Effects of exogenous hydrogen sulfide on salt tolerance and antioxidant enzymes of processing tomato seeds
ZHENG Zhou-yuan1,2,LIN Hai-rong1,CUIHui-mei1,2
(1.College of Agriculture,ShiheziUniversity,Shihezi,Xinjiɑng 832003,Chinɑ;2.Xinjiɑng Productionɑnd Construction Corps Key Lɑborɑtory of Speciɑl Fruitsɑnd Vegetɑbles Cultivɑtion Physiologyɑnd Germplɑsm Resources Utilizɑtion,Shihezi,Xinjiɑng 832003,Chinɑ)
The effects of exogenous hydrogen sulfide on the seed germination of processing tomato under salt stress were investigated.Seeds of two processing tomato cultivars KT-63(salt resistance isweak)and KT-18(stronger salt tolerance)were treatmentwith semi-lethal concentration of NaCl(85mmol·L-1,120mmol·L-1)and NaHS(0.2,0.4,0.6,1.0mmol·L-1)mixture,respectively.The results showed that:With increasing NaHS level,the germination rate,germination energy,germination index,vigor index,SOD,POD and CAT activities first increased and then decreased.Compared with salt stress,treatmentswith 0.4mmol·L-1NaHS significantly increased seed germination rate,germination index,vigor index and the activities of SOD,POD and CAT in KT-63(70%,250%,120%,130%,6.7%,150%and 180%,respectively)and KT-18(50%,250%,60%,80%,4.3%,160%and 200%,respectively),and the content of MDA was decreased.Themitigation effect of hydrogen sulfide on KT-63 is stronger than KT-18.Results provide evidence that0.4mmol·L-1of H2Smay alleviate damage to seeds caused by salt stress,expedition of seed germination.
hydrogen sulfide;salt stress;processing tomato;seed germination;antioxidase
S641.2;S603.4
A
1000-7601(2017)05-0236-06
10.7606/j.issn.1000-7601.2017.05.35
2016-08-05
2016-12-13
留学回国人员科技活动项目(2010LX005)
郑州元(1989—),男,甘肃武威人,硕士研究生,研究方向为蔬菜遗传育种。E-mail:1294450645@qq.com。
崔辉梅(1971—),女,新疆石河子人,教授,主要从事蔬菜种质资源与遗传育种研究。E-mail:chm agr@shzu.edu.cn。
