盐酸氯苯胍在眼斑拟石首鱼体内的药代动力学和残留消除规律研究
2017-12-18汤菊芬廖建萌黄月雄简纪常
汤菊芬,黄 瑜,蔡 佳,廖建萌,黄月雄,简纪常
( 1.广东海洋大学 水产学院,广东 湛江 524088; 2.广东省水产经济动物病原生物学及流行病学重点实验室,广东 湛江 524088; 3.广东省湛江市质量计量监督检测所,广东 湛江 524022 )
盐酸氯苯胍在眼斑拟石首鱼体内的药代动力学和残留消除规律研究
汤菊芬1,2,黄 瑜1,2,蔡 佳1,2,廖建萌3,黄月雄1,2,简纪常1,2
( 1.广东海洋大学 水产学院,广东 湛江 524088; 2.广东省水产经济动物病原生物学及流行病学重点实验室,广东 湛江 524088; 3.广东省湛江市质量计量监督检测所,广东 湛江 524022 )
在水温(28±2) ℃、盐度28 条件下,采用30 mg/kg的剂量口灌法,用HPLC-MS/MS检测研究了盐酸氯苯胍在体质量为(350.15±5.18) g的眼斑拟石首鱼体内的药代动力学和残留消除规律。结果显示,单剂量口灌给药后,眼斑拟石首鱼血浆中盐酸氯苯胍的药时数据符合一级吸收二室模型,药物在血浆中的达峰时间、血药质量浓度峰值、药时曲线下面积和消除半衰期分别为2.39 h、958.78 μg/L、33 247.57 μg/(L·h)和19.24 h;盐酸氯苯胍在肌肉、肝脏和肾脏的血药含量峰值分别为156.72、227.68 μg/kg和553.44 μg/kg,达峰时间分别为2.0、1.5、2.0 h;药时曲线下面积分别4664.04、4897.74、17 228.19 μg/(kg·h);消除半衰期分别为19.68、24.33、22.81 h。按30 mg/kg剂量连续5 d口灌给药后,鱼血浆、肌肉、肝脏、肾脏中的药物消除半衰期(t1/2)分别为24.46、35.39、39.60、33.94 h。若以10 μg/kg为最高残留限量,肌肉作为食用靶组织,在本试验条件下,建议休药期不少于7 d。
盐酸氯苯胍;眼斑拟石首鱼;药代动力学;残留消除
眼斑拟石首鱼(Sciaenopsocellatus),属鲈形目、石首鱼科、拟石首鱼属,原产于美国东海岸和墨西哥湾。该鱼生长迅速,条件适宜时饲养一年即可达到1 kg 以上的商品规格,肉质鲜美,抗病害能力强,是优良的海水养殖种类。我国于1991 年由国家海洋局第一海洋研究所引进其稚鱼,人工育苗获得成功,现已大规模地投入生产。但近年来由于养殖密度的不断增大,水环境条件恶化,微孢子虫病害频发,给眼斑拟石首鱼的养殖产业带来很大的经济损失,目前尚未发现有良好治疗该疾病的药物。
盐酸氯苯胍是一种广谱、高效、低毒,安全、适口性好的抗球虫药,主要影响三磷酸腺苷而干扰球虫蛋白质代谢。随着水产养殖产业病害的频发,人们发现盐酸氯苯胍对养殖鱼类的孢子虫病有一定的防治效果[1-2]。而目前,国内外对盐酸氯苯胍的研究大多集中在对家禽等动物药物残留的检测方法上[3-8],对其在水产动物体内的药代动力学和残留消除的研究尚未见报道。本试验研究了盐酸氯苯胍在眼斑拟石首鱼体内的药代动力学和残留消除规律,为盐酸氯苯胍在鱼类寄虫病害防治中的应用及规范用药提供参考。
1 材料与方法
1.1 材料
试验鱼购自湛江市南三岛某鱼排,在广东海洋大学东海岛实验基地用不含任何药物的配合饲料暂养1周,预先检测确认鱼体内无盐酸氯苯胍残留。挑选健康、规格整齐,体质量为(350.15±5.18) g的鱼作为试验鱼。
盐酸氯苯胍标准品纯度为98.5%(美国JK公司);色谱级甲醇(天津四友精细化学品有限公司);色谱级甲酸(广东光华科技股份有限公司);乙酸、无水硫酸钠等均为分析纯(国药集团上海化学试剂有限公司);水为超纯水。
试验仪器:液相色谱—质谱联用仪(配有ESI源,美国Thermo Fisher公司);XS-205电子分析天平(METTLER-TOLEDO公司);德国IKA-T25均质机(上海珂淮仪器有限公司);Sartorius arium-611VF超纯水机(上海摩速科学器材有限公司);HR2860高速匀浆机(荷兰皇家飞利浦电子公司);XW-80A漩涡混匀器(上海比朗仪器有限公司);HU3120B超声波清洗器(海比朗仪器有限公司);TDL-5-A离心机(上海安亭科学仪器厂);N-EVAP111氮吹仪(美国Organomation公司)。
1.2 方法
1.2.1 盐酸氯苯胍标准溶液配置
准确称取盐酸氯苯胍标准品10 mg(精确至0.0001 g),置于10 mL棕色容量瓶中,用甲醇溶解并定容至10 mL,成质量浓度1.0 mg/mL标准溶液,再用甲醇稀释100倍,成质量浓度10 μg/mL的标准储备液,冰箱中-4 ℃储存备用。
准确量取10 μg/mL盐酸氯苯胍标准储备液,用甲醇∶水=1∶1(体积比)分别稀释成质量浓度为0、1、2、5、10、20、50、100 ng/mL共8个质量浓度的标准工作液。
1.2.2 色谱条件和质谱条件
参照文献[9],洗脱程序和质谱条件见表1和表2。

表1 梯度洗脱程序

表2 盐酸氯苯胍的保留时间和质谱条件
1.2.3 给药及样品采集
药物代谢组:将停饲24 h的眼斑拟石首鱼随机分成15个组(与采样时间点对应),每组10尾置于一个0.3 m3的玻璃钢桶中,另取数尾鱼作为空白对照组。盐酸氯苯胍按30 mg/kg剂量口灌试验鱼,于给药后的第0.15、0.25、0.5、1、1.5、2、4、6、8、12、24、48、72、96 h和120 h取样,每组取5尾鱼,尾静脉采血后快速取其肝脏、肾脏和背部的肌肉样品适量。每尾鱼血液分别置于用肝素钠处理过的离心管中,5000 r/min离心8 min,提取上清液于离心管中冰箱-20 ℃保存。肝脏、肾脏、肌肉分别置于无菌离心管中, 在冰箱中-20 ℃保存备用。
残留消除组:眼斑拟石首鱼随机分成7个组,每组10尾,按30 mg/kg剂量连续5 d口灌盐酸氯苯胍,分别在最后一次给药后0.5、1、2、3、5、7 d和10 d采样,采样方法同药物代谢组。
1.2.4 样品处理
参照文献[4-5]稍加修改:血浆和各组织在室温下自然解冻,取1 mL血浆或适量组织样品(肌肉和肝各2.0 g、肾脏0.2 g,剪碎)置于50 mL离心管中,依次加入5 mL甲醇(含1%甲酸,体积比)和4 g无水硫酸钠,涡旋振荡,超声15 min,4000 r/min离心10 min,吸取上清液。重复上述操作一次,合并上清液于50 mL离心管中,在40 ℃水浴中用氮气吹干。用5.0 mL甲醇溶解残渣,涡旋振荡,超声15 min,4000 r/min离心10 min,上清液用0.22 μm微孔滤膜过滤,滤液待上机检测。
1.2.5 数据处理
用Excel 2003处理药时数据,模型的拟合和参数推算用DAS 3.0软件处理。
2 结 果
2.1 盐酸氯苯胍在眼斑拟石首鱼各组织中的药时曲线
眼斑拟石首鱼按30 mg/kg口灌盐酸氯苯胍后,药时曲线见图1。由图1可见,各组织中的药时曲线均呈现双峰现象,血浆、肌肉、肝脏、肾脏中的两次出峰时间分别为2 h、12 h,2 h、12 h,1.5 h、8 h,2 h、12 h,两次血药含量峰值分别为1227.07 μg/L、1036.58 μg/L,156.72 μg/kg、115.88 μg/kg,227.68 μg/kg、186.83 μg/kg,553.44 μg/kg、499.45 μg/kg。
2.2 盐酸氯苯胍在眼斑拟石首血浆中的药代动力学参数
经DAS 3.0软件分析,盐酸氯苯胍血浆的药时数据符合一级吸收二室模型,理论方程为:C口灌=16 822.78e-1.54t+1245.30e-0.036t-18 068.08e-1.42t,其药动学参数见表3。
2.3 盐酸氯苯胍在美国红鱼组织中的药代动力学参数
用统计矩原理推算出盐酸氯苯胍在眼斑拟石首鱼体内组织中的药动学参数(表4)。血药含量峰值和药时曲线下面积肾脏>肝脏>肌肉,平均驻留时间肝脏>肾脏>肌肉,消除半衰期肝脏>肾脏>肌肉。说明盐酸氯苯胍主要分布在肾脏中,药物在肝脏中的平均驻留时间最长,其消除半衰期也高于肾脏和肌肉。
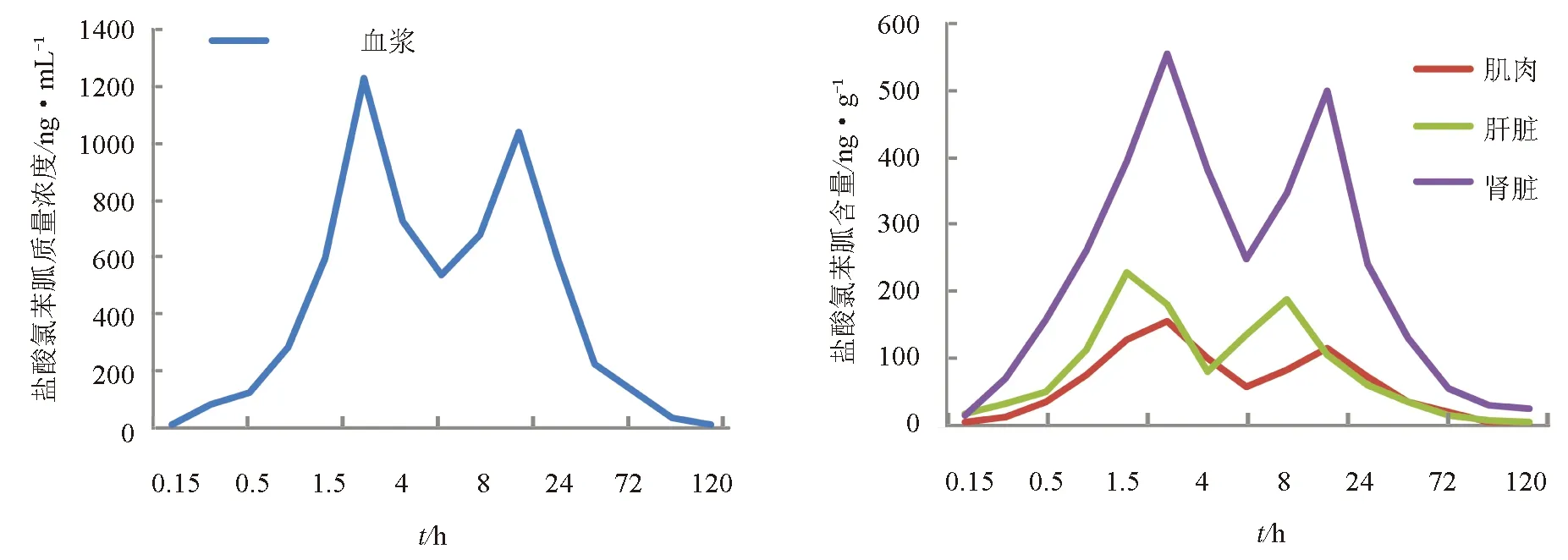
图1 眼斑拟石首鱼口灌盐酸氯苯胍后血浆和组织中的药时曲线

参数口灌给药分布相的零时截距/mg·L-116822.781分布速率常数/h-11.536消除相的零时截距/mg·L-11245.305消除速率常数/h-10.036药物吸收速率常数/h-11.416分布相半衰期/h0.451消除相半衰期/h19.241吸收半衰期/h0.489表观分布容积/L13.995总清除率/L·h-12.378药物自中央室的消除速率/h-10.397药物自中央室到周边室的一级运转速率/h-11.036药物自周边室到中央室的一级运转速率/h-10.139药时曲线下面积(0~72h)/μg·(L·h)-133247.57药时曲线下面积(0~∞h)/μg·(L·h)-133623.031达峰时间/h2.39峰质量浓度/mg·L-1958.78
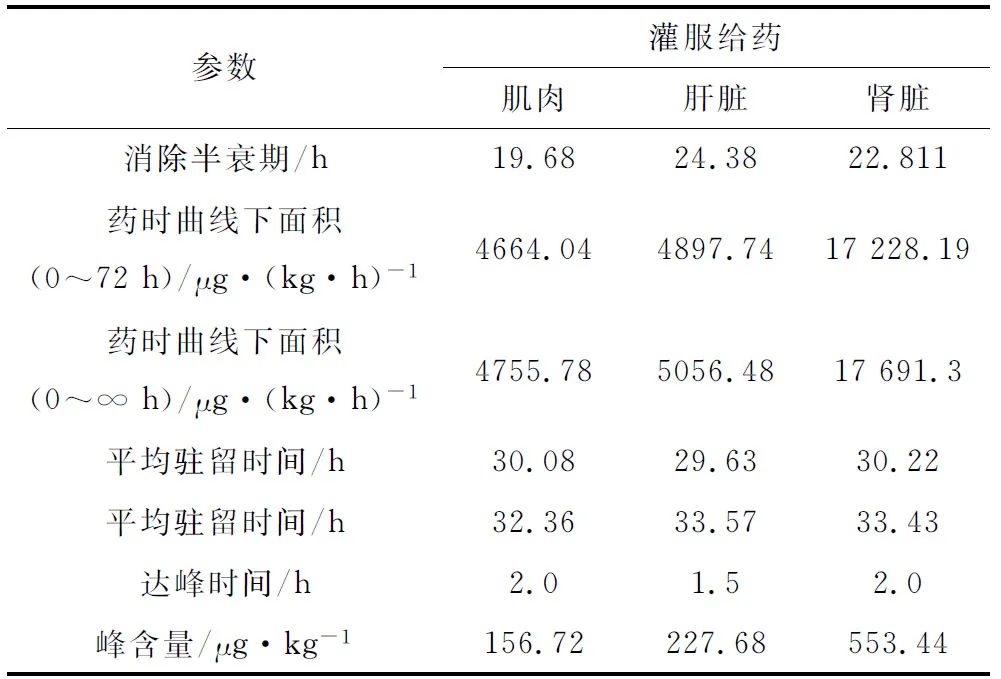
表4 眼斑拟石首鱼口灌盐酸氯苯胍后组织中的药代动力学参数
2.4 盐酸氯苯胍在眼斑拟石首鱼体内的消除
眼斑拟石首鱼按30 mg/kg剂量连续5 d口灌盐酸氯苯胍后,药时数据用Excel 2003回归处理后得到药物含量与时间的消除曲线方程及相关参数(表5),药物的消除曲线见图2。由图2和表5可见,盐酸氯苯胍在不同组织中的残留量依次为血浆>肝脏>肾脏>肌肉。不同组织中的消除半衰期依次为肝脏>肌肉>肾脏>血浆, 说明盐酸氯苯胍在肝脏中消除最慢。
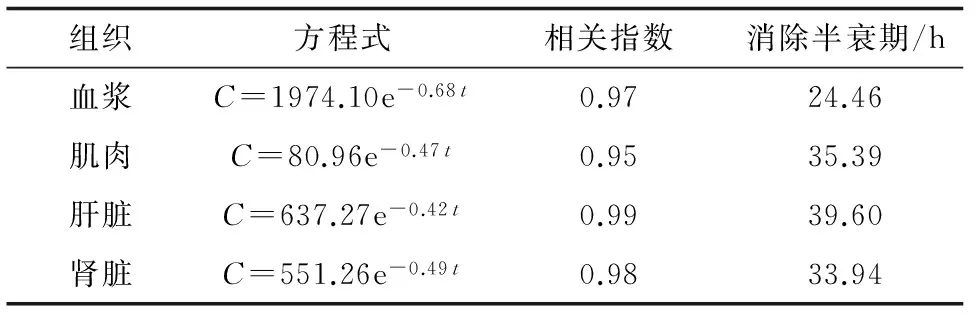
表5 眼斑拟石首鱼体口灌盐酸氯苯胍后血浆和组织中的消除曲线方程及参数
3 讨 论
3.1 盐酸氯苯胍在眼斑拟石首鱼血浆和组织中的药时曲线和药代动力学特征
以30 mg/kg单剂量口灌盐酸氯苯胍后,眼斑拟石首鱼血浆和组织中的药时曲线出现明显的双峰现象。目前,关于口服药物药时曲线的双峰现象研究报道较多,认为其主要原因是肝肠循环和非齐性吸收所致,两峰相隔时间2~20 h[10-11]。药物进入十二指肠后,可在小肠重吸收返回肝脏,形成肝肠循环,引起双峰现象。口服药物进入体内时,要经过胃肠道上、下两个部位的吸收,不同部位和管壁对药物的通透性不同,也可导致双峰现象[12]。
目前国内外尚未有盐酸氯苯胍作为驱虫渔药及在水产动物体内的药代动力学研究报道,在其他动物体内的药代动力学研究也极为鲜见。本试验在水温(28±2) ℃、盐度28条件下,盐酸氯苯胍按30 mg/kg的剂量口灌后,眼斑拟石首鱼血浆中的药时数据符合一级吸收二室模型,血浆、肌肉、肝脏、肾脏中的药物含量均在约1.5 h出现第一次峰值,血药含量峰值分别为211.38 μg/L、37.58 μg/kg、863.02 μg/kg、1063.24 μg/kg,药时曲线下面积分别为5229.16 μg/(L·h)、1017.03 μg/(kg·h)、20 841.20 μg/(kg·h)、30 743.04 μg/(kg·h)。说明口灌给药,盐酸氯苯胍在眼斑拟石首鱼体内吸收较为缓慢,在肝脏和肾脏中分布较多,血浆、肌肉中分布较少。
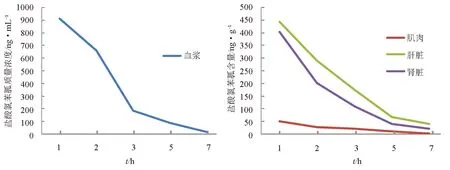
图2 眼斑拟石首鱼按30mg/kg剂量连续5 d口灌盐酸氯苯胍后血浆和组织中药物的消除曲线
消除半衰期和平均驻留时间是反映药物在动物体内消除速度的重要参数。眼斑拟石首鱼单剂量口灌盐酸氯苯胍后,消除半衰期分别为血浆(46.99 h)>肌肉(26.35 h)>肾脏(24.31 h)>肝脏(14.05 h),平均驻留时间分别为血浆(129.72 h)>肌肉(41.29 h)>肾脏(39.19 h)>肝脏(27.62 h)。消除半衰期和平均驻留时间反映药物在血浆和组织中消除、驻留时间快慢顺序一致,说明盐酸氯苯胍在眼斑拟石首鱼体血浆和肌肉中消除较为缓慢、驻留时间较长。
3.2 连续口灌给药后盐酸氯苯胍在眼斑拟石首鱼体内的残留、消除及休药期
眼斑拟石首鱼连续5 d口灌给药后,组织中的药物残留量肾脏>血浆>肝脏>肌肉。血浆和组织中的药物消除半衰期分别为肌肉(46.14 h)>肝脏(36.11 h)>肾脏(28.62 h)>血浆(26.92 h),表明盐酸氯苯胍在眼斑拟石首鱼体内消除较为缓慢,肌肉中的消除最慢,与班付国等[13]的研究结果基本一致,但盐酸氯苯胍在眼斑拟石首鱼体内的消除速度比氯苯胍在鸡体内的消除慢,可能与研究对象对药物的代谢速度不同有关。
目前,中国、欧盟及美国等多个国家和地区都制订了氯苯胍在动物源食品中的最高残留限量。农业部2002年发布第235号公告中规定,盐酸氯苯胍在鸡脂肪、皮、可食组织中的最高残留限量分别为200、200、100 μg/kg[14]。中国和欧盟等国家和地区对水产品中盐酸氯苯胍暂无明确的残留限量要求。根据日本2006年实施的食品中农业化学品残留“肯定列表制度”,要求对于未制定最大残留限量标准的农业化学品在食品中含量不得超过0.01 mg/kg,对于已建立最高残留限量标准的化学物质则在食品中含量不得超过最高标准[15]。本研究将盐酸氯苯胍的最高残留限量暂定为0.01 mg/kg,以肌肉作为食用靶组织。在停药后第5 d,肌肉中的药物残留量为2.57 μg/kg,低于设定的最大残留限量(0.01 mg/kg),考虑本试验未检测皮肤中的药物含量,为充分保证消费者的安全,应将休药期适当延长。因此,在本试验条件下,建议盐酸氯苯胍在眼斑拟石首鱼体内休药期至少为7 d。
[1] 吴仕辉,陈昆慈,戴晓欣,等.分散固相萃取/高效液相色谱法测定水产品中氯苯胍的残留量[J].分析测试学报,2011,30(12):1356-1361.
[2] 杨先乐,陆承平,战文斌,等.新编渔药手册[M].北京:中国农业出版社,2005:204-241.
[3] 李俊玲,刘学江,徐强,等.饲料中盐酸氯苯胍的测定[J].饲料广角,2003(15):20-23.
[4] 刘勇军,吴银良,姜艳彬.高效液相色谱法测定鸡组织与鸡蛋中的盐酸氯苯胍的残留量[J].色谱,2010,28(9):905-907.
[5] 莫金杰,刘娟,胡玉霞,等.HPLC法测定盐酸氯苯胍原粉含量[J].畜牧市场,2011(2):19-20.
[6] Kot-Wasik A, Wasik A. Determination of robenidine in animal feeds by liquid chromatography coupled with diode-array detection and mass spectrometry after accelerated solvent extraction[J]. Analytica Chimica Acta, 2005, 543(1):46-51.
[8] Olejnik M, Szprengier-Juszkiewicz T, Jedziniak P. Multi-residue confirmatory method for the determination of twelve coccidiostats in chicken liver using liquid chromatography tandem mass spectrometry[J].Journal of Chromatography A,2009,1216(46):8141-8148.
[9] 汤菊芬,蔡佳,廖建萌,等.HPLC-MS/MSi法测定水产品中的诺氟沙星、盐酸小檗碱和盐酸氯苯胍残留量[J].中国兽药杂志,2014,48(8):55-60.
[10] Kroboth P D, Smith R B, Rault R, et al. Effects of end-stage renal disease and aluminum hydroxide on temazepam kinetics[J]. Clinical Pharmacology and Therapeutics,1985, 37(4):453-459.
[11] Pentikainen P J, Neuvonen P J, Penttila A. Pharmaeokinetics and pharmaeodynamics of glipizide in healthy volunteers[J]. Int J Clin Pharmacol Ther Toxieol, 1983, 21(2):98-107.
[12] Feng J, Xu W, Tao X, et al. Simultaneous determination of baicalin, baicalein, wogonin, berberine, palmatine and jatrorrhizine in rat plasma by liquid chromatography-tandem mass spectrometry and application in pharmacokinetic studies after oral administration of traditional Chinese medicinal preparations containing scutellaria-coptis herb couple[J]. Journal of Pharmaceutical and Biomedical Analysis, 2010, 53 (3):591-598.
[13] 班付国,吴宁鹏,李慧素,等.氯苯胍在鸡组织中的残留消除规律研究[J].中国兽药杂志,2012,46(11):24-26.
[14] 动物性食品中兽药最高残留限量(农业部2002年235号公告)[J].中国猪业,2010(8):10-12.
[15] 吴晓峰,沈毅诚,孙蓓玲. 日本“肯定列表制度”我国出口水产品面临的严峻挑战[J].中国动物检疫,2006,23(6):49-50.
PharmacokineticsandEliminationofRobenidineHydrochlorideResiduesinRedDrumSciaenopsocellatus
TANG Jufen1,2, HUANG Yu1,2, CAI Jia1,2, LIAO Jianmeng3, HUANG Yuexiong1,2, JIAN Jichang1,2
( 1.Fisheries College, Guangdong Ocean University, Zhanjiang 524088, China; 2.Guangdong Provincial Key Laboratory of Pathogenic Biology and Epidemiology for Aquatic Economic Animals, Zhanjiang 524088, China; 3.Guangdong Zhanjiang Institute of Supervision and Test on Quality and Measure, Zhanjiang 524022, China )
The pharmacokinetics and elimination regularity of robenidine hydrochloride (ROBH) residues were investigated in plasma and tissues of red drumSciaenopsocellatuswith body weight of (350.15±5.18) g orally administrated at a single dose of 30 mg/kg body weight at water temperature of (28±2) ℃ and salinity of 28 by HPLC-MS/MS method. Results showed that ROBH concentration-time data in plasma of red drum was described as a two-compartment model with first-order absorption after a single dose of oral administration, with the peak time (tp) of 2.39 h, the maximum concentration (Cmax) of 958.78 μg/L, the area under the concentration-time curve (AUC0—∞) of 33 247.57 μg/(L·h) and the elimination hal-life (tl/2β) of 19.24 h in plasma. The findings indicated that ROBH in red drum had the ability to be distributed widely in diverse tissues and that ROBH residues were eliminated slowly. TheCmaxwas found to be 156.72 μg/kg in muscle, 227.68 μg/kg in liver and 553.44 μg/kg in kidney, andtpwas 2.0 h in muscle, 1.5 h in liver and 2.0 h in kidney. AUC0—∞were shown to be 4664.04 μg/(kg·h) in muscle, 4897.74 μg/(kg·h) in liver and 17 228.19 μg/(kg·h) in kidney, withtl/2βof 19.68 h in muscle, 24.33 h in liver and 22.81 h in kidney. Thet1/2was 24.46 h in plasma, 35.39 h in muscle, 39.60 h in liver and 33.94 h in kidney in red drum with oral continuous administration at a dose of 30 mg/kg for 5 days. If the maximum residue limits (MRLs) was considered as 0.01 mg/kg and the muscles as edible target tissue, the withdrawl period should be over 7 days under this experiment condition.
robenidine hydrochloride;Sciaenopsocellatus; pharmacokinetics; residue
10.16378/j.cnki.1003-1111.2017.04.015
S943.339
A
1003-1111(2017)04-0493-05
2016-08-24;
2016-10-14.
农业部公益性行业专项(20120385);广东省科技计划(农村科技领域)项目(2015A020209181).
汤菊芬(1964—),女,高级工程师,硕士;研究方向:水产动物病害防治.E-mail:tjf10002000@163.com. 通讯作者:简纪常(1964—),男,教授,博士;研究方向:鱼类分子免疫学.E-mail:jianjc@gmail.com.
