方斑东风螺“脱壳病”病原及病理初步研究
2017-12-18狄桂兰张朝霞孔祥会虞晋晋陈海阳柯才焕
狄桂兰,张朝霞,孔祥会,虞晋晋,陈海阳,柯才焕
( 1. 河南师范大学 水产学院,河南 新乡 453007; 2. 厦门大学 海洋与地球学院,福建省海洋生物资源开发利用协同创新中心,福建 厦门 361005 )
方斑东风螺“脱壳病”病原及病理初步研究
狄桂兰1,张朝霞2,孔祥会1,虞晋晋2,陈海阳2,柯才焕2
( 1. 河南师范大学 水产学院,河南 新乡 453007; 2. 厦门大学 海洋与地球学院,福建省海洋生物资源开发利用协同创新中心,福建 厦门 361005 )
为明晰方斑东风螺“脱壳病”的病原或病理,对东风螺“脱壳病”进行了病原分离纯化、病原菌形态观察、组织病理观察、人工感染试验,并对病原菌16S rDNA 序列进行 PCR 扩增和测序,以及系统发育树分析。试验中分离纯化了3种纯菌W、B、Y。致病菌W杆状,端生单鞭毛。致病菌Y杆状,两端略尖,周生菌毛。致病菌B短杆状,无鞭毛。结果显示,患病个体和人工感染个体的腹足及连壳肌肉组织均出现明显病变,肌纤维受损,出现空腔,并存在细菌;肝胰腺组织无明显病变,但血细胞显著减少。腹足肌注射人工感染试验结果表明,致病菌W在3种细菌中毒力最强。混合菌感染的毒力在混合比例接近原始比例时达到最大。致病菌B与报道的鲍希瓦氏菌相似度为99%;致病菌Y与报道的哈维弧菌相似度为98%;致病菌W与报道的变形假单胞菌相似度为99%。推测致病菌W、B、Y可能是此次方斑东风螺脱壳病的重要病原菌。
方斑东风螺;脱壳病;16S rDNA 序列分析;病原;组织病理
方斑东风螺(Babyloniaareolata)属腹足纲、新腹足目、蛾螺科,是热带、亚热带种类,在我国主要分布在福建、广东和广西沿海,为名贵贝类,其肉质细嫩、口味鲜美、营养丰富,经济价值高。近年来,因过度捕捞使方斑东风螺的自然资源大大减少,需要对方斑东风螺进行人工养殖以满足人们的需要。福建、广东、广西及海南的东风螺养殖已具规模,尤其在海南省形成了较大的养殖规模, 现有养殖水池面积约3.0×105m2, 产值超过2亿元[1]。随着方斑东风螺养殖业的迅速发展,病害相随而至,常给养殖生产造成毁灭性的破坏[2]。疾病的种类越来越多,危害也日益严重,已报道的方斑东风螺疾病病原已有近10种,如浮游期纤毛虫病[3-4],稚螺和幼螺养殖期肉壳分离病[5],养成期单孢子虫(Haplosporidiumsp.)病[6]、吻管水肿病[7]、肿吻病[8],除此之外,还存在弧菌(Vibrio)爆发症、脓疱病、足部肿大症和呼吸管炎等疾病[9-10]。2005—2006年20%以上的养殖场爆发疾病,部分养殖场甚至绝收,造成的经济损失达千万元以上[11]。2011年4月,海南文昌等地工厂化养殖的方斑东风螺大面积爆发疾病[12],养殖病害已成为影响我国南方沿海省市东风螺养殖业发展的“瓶颈”问题。其中脱壳病(肉壳分离疾病)就是最常见、最严重的一种,造成的经济损失占60%以上,是目前制约东风螺人工养殖规模化生产的主要因素[2,11]。病螺症状为软体自行脱离螺壳,离开螺壳后软体外观完整,能正常爬行,能吸附池壁或潜埋于底沙,但不摄食,主要发生在壳高0.5 cm以下的稚、幼螺阶段,严重时可造成螺苗在短时间内大量死亡[2]。针对东风螺稚螺常见的脱壳性流行病,罗杰等[13-14]提出主要原因是水温升高、底质恶化;黄进光等[15]认为盐度下降、营养不良也可造成该流行病爆发;杨章武等[2]认为,东风螺脱壳病存在生物性病原的可能性比较小,东风螺水泥池人工养殖脱壳病的病因属于综合性因素,是综合性因素造成的不适环境条件长期作用的结果。裴琨[9]认为该病属于肠胃炎病。根据郑雅友等[16]的研究,多种常用水产药物对该病并无明显的治疗效果,对病螺的初步检测,未发现异常菌群。黄郁葱[17]自脱壳病螺分离到3株弧菌(Vibrio),感染试验结果是东风螺未被感染,据此认为“脱壳病”并非细菌感染造成。王国福等[11]从病害微生物角度对患病螺进行了病毒和细菌的分离培养,结果并未分离到病毒;细菌分离培养鉴定为弧菌,但分离获得的弧菌应用于健康螺未见感染症状,笔者认为病毒和弧菌并不是方斑东风螺肉壳分离病的原发性诱因。
目前,对东风螺脱壳病的研究还不够深入,而对东风螺“壳肉分离症”有防治方法报道,但尚未找到确切病原[1-2,11],确定东风螺脱壳病的病因或病原还有待于进一步的研究。笔者通过对福建晋江爆发的东风螺脱壳病进行病原分析,探索该病的病原和病理,为东风螺脱壳疾病研究提供科学依据。
1 材料与方法
1.1 材料
1.1.1 方斑东风螺
病螺样品取自晋江养殖厂,壳长(2.04±0.31)cm,体质量(2.18±1.18) g。在同一养殖场取相同规格健康螺作为对照。
人工感染试验所用健康螺,购于厦门海沧养殖厂,平均壳长(1.6±0.2) cm,平均肉质量(0.5±0.03) g。暂养于厦门大学海洋与地球学院生态养殖基地,水温20.0~30.0 ℃,盐度28.3~35.1,pH 7.8~8.5,充气,投喂牡蛎、鱼等。
1.1.2 培养基
硫代硫酸盐—柠檬酸盐—胆盐—蔗糖琼脂培养基,牛肉膏蛋白胨培养基。
1.2 方法
1.2.1 病原菌的分离纯化
剪取濒死病螺的肌肉、肝胰腺等组织小块(2 mm×3 mm×3 mm),用无菌海水冲洗,于1.5 mL无菌离心管中剪碎后进行组织匀浆,提取匀浆液,用涂布法接种于硫代硫酸盐—柠檬酸盐—胆盐—蔗糖琼脂培养基平板。28 ℃培养24~48 h,观察菌落颜色和菌落特征。挑取菌落分离纯化3次,编号后接种到牛肉膏蛋白胨培养基斜面上。
用无菌生理盐水将28 ℃培养24 h的菌从斜面上冲下,制成菌悬液。菌悬液和无菌甘油以5∶4配比后分装于1.5 mL的无菌离心管中,于-70 ℃存放。
1.2.2 病原的观察
菌悬液制备同1.2.1。将菌悬液滴在取样板上,将覆有Foumovar膜的铜网反扣在悬液上。10 min后吸去多余液体,置2%的磷钨酸液滴上负染5 min,用滤纸吸去余液,室温晾干,JEM-100CX电子显微镜下观察。
1.2.3 组织病理观察
挑取濒死病螺,无菌剪取肝胰腺、连壳肌、腹足肌等组织小块(2 mm×3 mm×3 mm),浸于波恩氏液中,固定24 h后,梯度酒精脱水,二甲苯透明,石蜡包埋。切片5~7 μm,苏木素—伊红对染,用Leica自动染色机对制片进行复水、染色、脱水,中性树脂封片保存。用健康螺的同样组织做对照。用光学显微镜观察。
1.2.4 回归感染
养殖条件:试验用红色小桶体积为4.5 L,海水盐度30,pH 8.0~8.4,水温为22~25 ℃,不投喂。
制作病原菌的密度标准曲线:菌悬液制备同1.2.1。采用光电比浊计数法[18]制作病原菌密度标准曲线。将一部分菌悬液原液稀释为不同倍数,用721型分光光度计测其在波长为560 nm下的吸光值A。另一部分原液用平板计数法[18]求出原液中细菌密度,绘制标准曲线。
1.2.4.1 纯菌悬液及混合菌悬液的制备
纯菌悬液:以菌株W为例,将分离纯化的菌株W接种至牛肉膏蛋白胨培养基试管斜面上,28 ℃培养24 h后,制成菌悬液。用标准曲线求出原液密度。原液分别稀释1.25倍、1.43倍、1.67倍、2倍、2.5倍、3.3倍、5倍,待用。菌株B原液稀释后测吸光值,原液分别稀释2倍、12.5倍、14.3倍、16.7倍、25倍、33.3倍、50倍。菌株Y原液稀释后测吸光值,原液分别稀释2.9倍、3.5倍、4.4倍、8.8倍。
混合菌悬液:以菌株W与菌株B混合为例,两株菌的纯菌悬液制备同上。取菌株W的2.5倍和5倍稀释液,分别与菌株B的12.5倍、14.3倍、16.7倍、25倍、33.3倍、50倍稀释液等体积混匀,待用。菌株W与菌株Y混合时,同样取菌株W的2.5倍和5倍稀释液,分别与菌株Y的2.9倍、3.5倍、4.4倍、8.8倍稀释液等体积混匀。
1.2.4.2 菌悬液的回归感染
以足部注射方式对健康螺进行感染,每个螺肉平均质量0.5 g,各注射25 μL样品液,注射后前24 h每6 h观察一次,24~48 h每小时观察一次,48~72 h每6 h观察一次,72 h以后每24 h观察一次。试验持续14 d。
纯菌感染:以纯菌W感染为例,共设11组试验组,每组20个螺(设置3个平行)。注射配制好的纯菌悬液共9组,设2组对照,1组为原液密度灭活菌株W的菌悬液(沸水浴20 min灭活),1组注射0.9%无菌生理盐水。观察病螺的病症,记录螺的死亡时间,取刚死东风螺的肝胰腺、腹足肌等组织,制作组织切片,操作同1.2.3。纯菌B、Y感染各设8组试验组,每组10个螺(设置3个平行),菌株B对照为原液密度的灭活菌株B的菌悬液,菌株Y对照为原液密度的灭活菌株Y的菌悬液。
混合菌感染:以菌株B、W混合感染为例,共设12组,每组注射20个螺(设置3个平行),11组分别注射不同密度比例的混合菌悬液,对照组注射生理盐水。观察病螺的症状,记录螺的死亡时间,取刚死螺的内脏,制作组织切片,操作同1.2.3。菌株W、Y混合感染共设9组,每组10个螺(设置3个平行)。
充气影响:共设4组,每组10个螺(设置3个平行)。两组注射纯菌W的3.3倍稀释液,两组注射0.9%无菌生理盐水,其中一组纯菌W感染和一组无菌生理盐水不充气。记录螺的死亡时间和数量。
1.2.5 16S rDNA序列测定与分析
1.2.5.1 细菌模板 DNA的提取
用1.0 mL TE缓冲液收集菌悬液于1.5 mL EP管中,4 ℃,10 000 r/min离心15 min,弃上清液,用0.6 mL TE缓冲液重悬;将菌液沸水浴10 min,置于-20 ℃冰箱20 min,4 ℃,12 000 r/min离心15 min,吸上清液1 mL做为PCR模板,-20 ℃保存备用。
1.2.5.2 PCR的扩增和测序
选择通用引物进行PCR扩增。引物由上海生物工程公司合成。
Primer A:5′-AGAGTTTGATCCTGGCTCAG-3′
Primer B:5′-GGTTACCTTGTTACGACTT-3′
然后进行PCR反应。PCR产物按DNA 凝胶回收试剂盒说明书回收和纯化,将所得菌株16S rDNA PCR产物送北京六合华大基因科技股份有限公司测序,对于出现杂合的样品进行克隆后再测序。
1.2.6 菌株 16S rDNA 序列比对及构建系统进化树
所测序列用NCBI数据库(http://blast.ncbi.nlm.nih.gov/Blast.cgi)中的 BLAST 程序进行16S rDNA 序列比对,分析其与数据库中序列的相似性。选取相似性相对较高且代表性较好的序列,使用Clustal X 2.0软件进行多序列比对并构建Fasta格式数据文件。用Mega 6.0软件,以邻接法构建系统进化树,并通过自举法进行置信度检测,使用1000次的自展测试进化树的可靠性。
2 结 果
2.1 病螺症状
发病养殖场患病螺症状为腹足发硬,触觉反应迟钝,黏液分泌增多,部分个体吻伸出或肿大,少数个体脱壳,脱壳个体占患病螺数的20%以下(图1)。

图1 正常(a)和发病(b)的方斑东风螺
2.2 病原的分离与观察
2.2.1 病原菌的分离纯化
通过分离纯化得到3株纯菌,根据菌落在硫代硫酸盐—柠檬酸盐—胆盐—蔗糖琼脂培养基平板上的颜色,将其编号为B(黑色)、W(白色)、Y(黄色)(图2)。在平板面积上,菌落B 40个,菌落W 14个,菌落Y 1204个(图2)。
B菌落大小0.5~2.5 mm,圆形,不透明,黑色,边缘光滑。W菌落大小2~6 mm,近似圆形,不透明,乳白偏粉红色,边缘不光滑,细锯齿状。Y菌落大小1~2 mm,近似圆形,不透明,黄色,边缘不光滑,细锯齿状。

图2 分离病原菌的培养基平板
2.2.2 病原的观察
在电镜下可清晰看到3株菌的形态。菌株W杆状,端生单鞭毛,大小为0.6~1 μm×2~2.5 μm(图3a)。菌株Y杆状,两端略尖,周生菌毛,大小为0.8~1 μm×3~5 μm(图3b)。菌株B短杆状,无鞭毛,大小为0.6~0.8 μm×1~2 μm(图3c)。

图3 电镜下的3种菌的形态a,菌株W形态;b,菌株Y形态;c,菌株B形态.
2.3 组织病理观察
组织病理观察见图4,与健康螺比较,患病螺和感染螺腹足肌肉组织出现明显病变,并能观察到大量细菌。健康螺腹足肌组织较致密,主要由大量横纵排列的肌纤维组成,最外面一层为致密上皮细胞,具少量皱襞。肌纤维排列有序,细胞核圆形或长条形,散布在肌纤维之间(图4a)。患病螺腹足肌组织内大量小空腔,空腔内存在少量细菌(图4b)。人工感染螺腹足肌纤维出现裂缝或空腔,其内可观察到成团的细菌,由于空腔的存在,使肌纤维排列失去规律而紊乱(图4c,d)。

图4 正常和发病方斑东风螺腹足肌组织学变化a,正常东风螺腹足肌组织,较致密,肌纤维排列有序;b,患病东风螺腹足肌组织,存在小空斑,内可见细菌;c、d,人工感染东风螺腹足肌组织,存在小空斑,内可见细菌.箭头示细菌,V示空斑.
患病螺和感染螺的连壳肌组织内均可观察到较为明显的病变,健康螺的连壳肌组织同腹足肌,较致密,由大量横纵排列的肌纤维组成,肌纤维结构完整,排列有序,细胞核圆形或长条形,散布在肌纤维之间(图5a)。患病螺连壳肌组织均出现小裂缝或小空腔,附近存在少量细菌(图5b),感染螺的组织中症状与患病螺类似,但更为明显,肌纤维被细菌腐蚀断裂,继而扩大为空腔(图5c,d)。
对比患病螺、感染螺和健康螺的肝胰腺组织,健康螺肝胰腺细胞形状虽大小不一,但排列紧密,细胞结构完整,可见众多血细胞存在于结缔组织中和肝胰腺组织细胞间(图6a)。患病螺肝胰腺组织无明显病变,但组织内血细胞数量极少,未观察到细菌(图6b)。感染螺症状与患病螺相似,血细胞数量极少,未观察到明显病变,但可观察到少量细菌(图6c,d)。
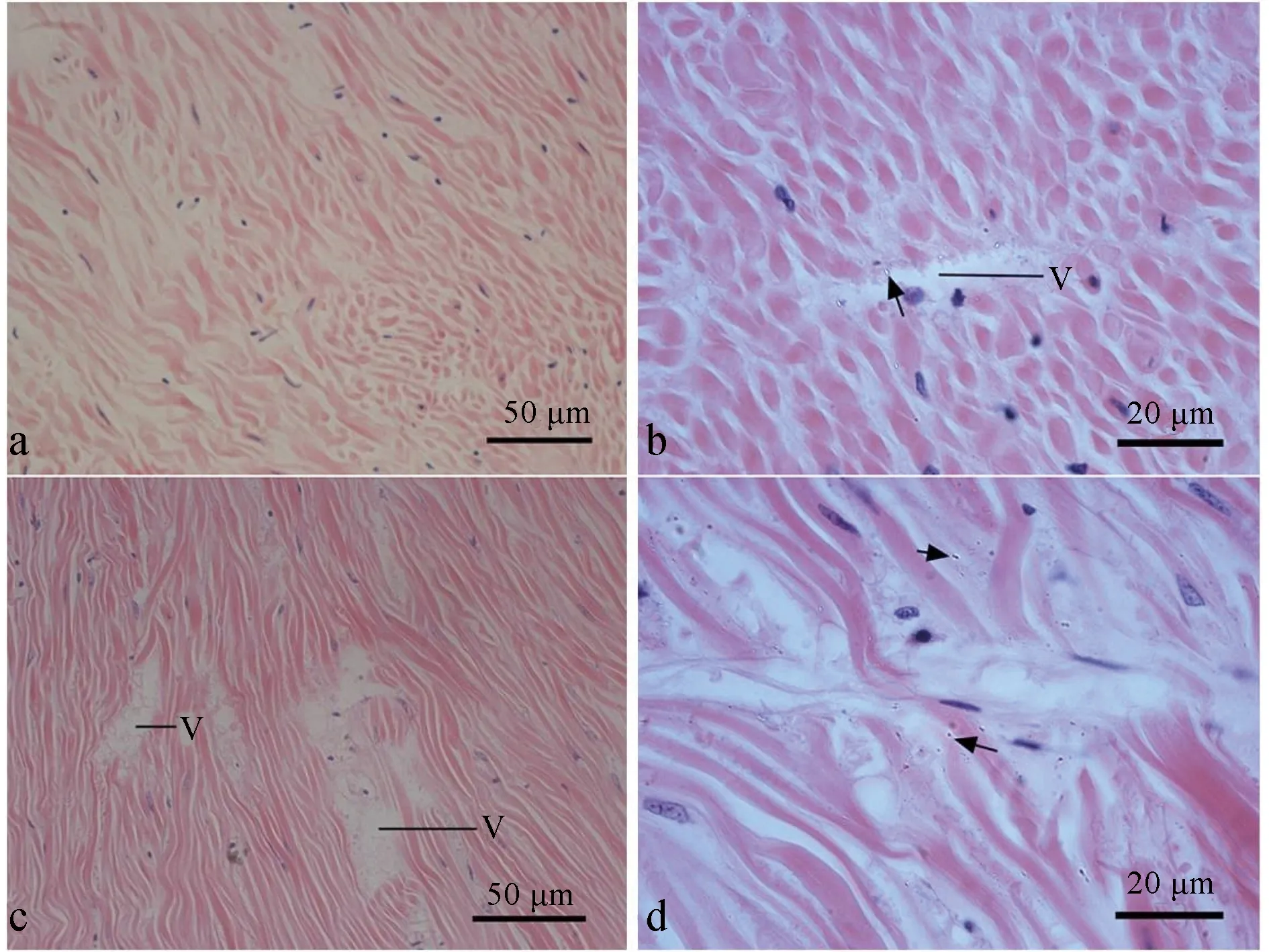
图5 正常和发病方斑东风螺的连壳肌组织学变化a,正常东风螺连壳肌组织,肌纤维结构完整;b,患病螺连壳肌组织,肌纤维受到腐蚀;c、d,人工感染螺连壳肌组织.箭头示细菌,V示空斑.

图6 正常和发病方斑东风螺的肝胰腺组织学变化 a,正常螺的肝胰腺组织,存在大量血细胞;b,患病螺的肝胰腺组织;c,回归感染死亡的螺的肝胰腺组织;d,为c的放大图.箭头示细菌, CA示结缔组织.
2.4 菌悬液的回归感染
2.4.1 纯菌悬液的回归感染
纯菌W回归感染死亡结果见表1。当注射密度低于2×107cfu/g时,无死亡。随着注射密度的增大,死亡率由2×107cfu/g时的10%逐步提至8×107cfu/g时的70% (表1)。同时,最初死亡时间呈现提前趋势,由2×107cfu/g时的33 h提前至6×107cfu/g时的17 h,并稳定在17 h,不再随注射密度的增加而提高(表1)。死亡出现在17~46 h,并集中出现在17~33 h,即螺在2 d内死亡,2 d后螺不再出现死亡。对照组无死亡。
纯菌B回归感染死亡结果见表2。当注射密度低于6×107cfu/g时,无死亡。注射密度6×107cfu/g时,最初死亡时间为60 h。当注射密度5×108cfu/g时,27 h出现死亡,并于63 h全部死亡。随着注射密度增加,死亡率上升,死亡时间提前。对照组无死亡。
纯菌Y回归感染死亡结果见表3。当注射密度低于4×107cfu/g时,没有死亡发生,注射密度4×107cfu/g时,最初死亡时间为33 h,当注射密度1.75×108cfu/g时,最初死亡时间为45 h。对照组无死亡。

表1 纯菌W菌悬液回归感染结果
注:表中死亡数为3组的平均值,余同.
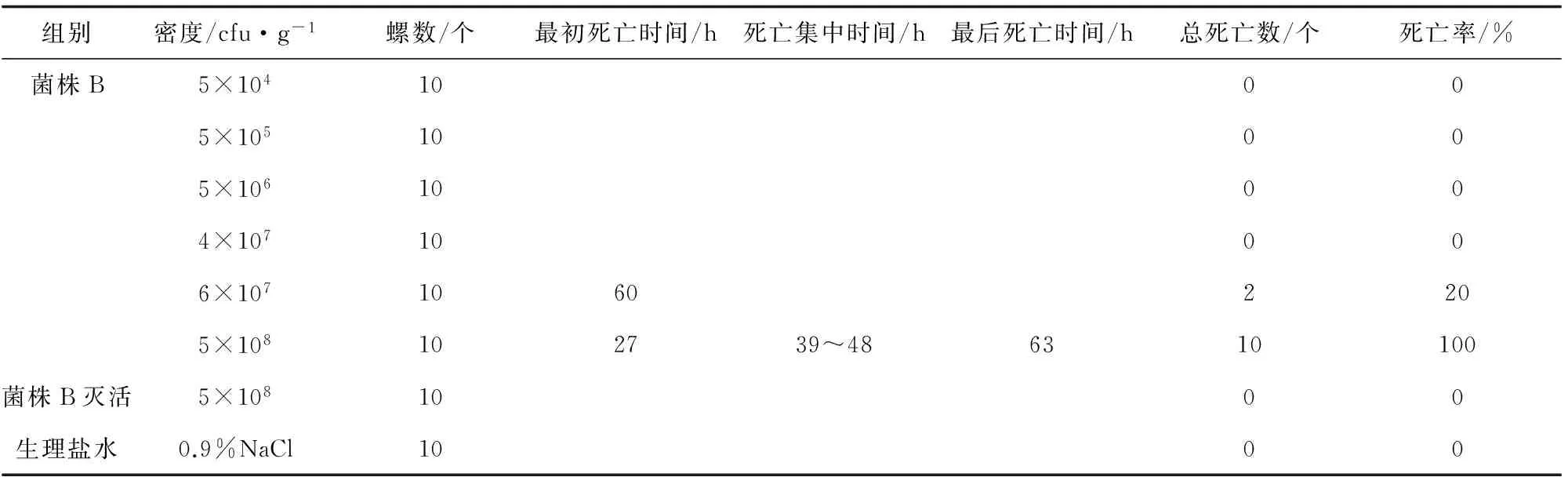
表2 纯菌B菌悬液回归感染结果
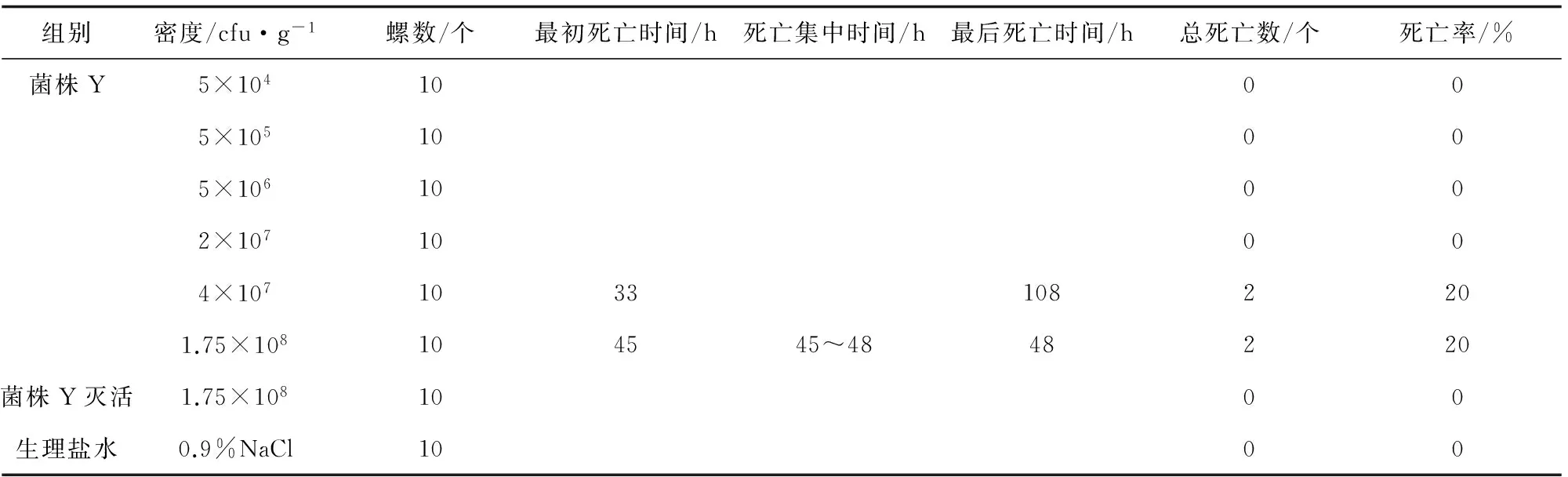
表3 纯菌Y菌悬液回归感染结果
2.4.2 混合菌悬液回归感染
混合菌悬液W∶B回归感染的死亡结果见表4。W菌悬液注射密度5×106cfu/g时无死亡,与B菌悬液的混合密度比高于1∶8时,无死亡,达到1∶8时,死亡率20%,混合密度比为1∶12时,死亡率50%。故随着混合悬液中菌株B的密度比例的增加,死亡率呈上升趋势。同时,最初死亡时间由混合密度比1∶8时的36 h提前至1∶12时的27 h。W菌悬液注射密度为2×107cfu/g时,死亡率为10%,W、B菌悬液混合感染与纯菌感染不同,随着混合菌悬液中B菌悬液密度比例的增加,死亡率先升后降,死亡率达到最大值60%时对应的密度混合比为1∶3,最接近原始比例(表4)。最初死亡时间也与纯菌感染不同,没有呈现与注射密度的正比关系。B菌悬液注射密度6×107cfu/g时死亡率20%,当与W菌悬液混合以密度比例为12∶1时,死亡率增加至50%,当混合密度比例达3∶1时,死亡率增加至60%,可见当B菌悬液密度不变时,死亡率随W菌悬液密度的增加而略有上升。死亡集中出现在24~42 h,晚于W菌悬液感染。对照组无死亡。
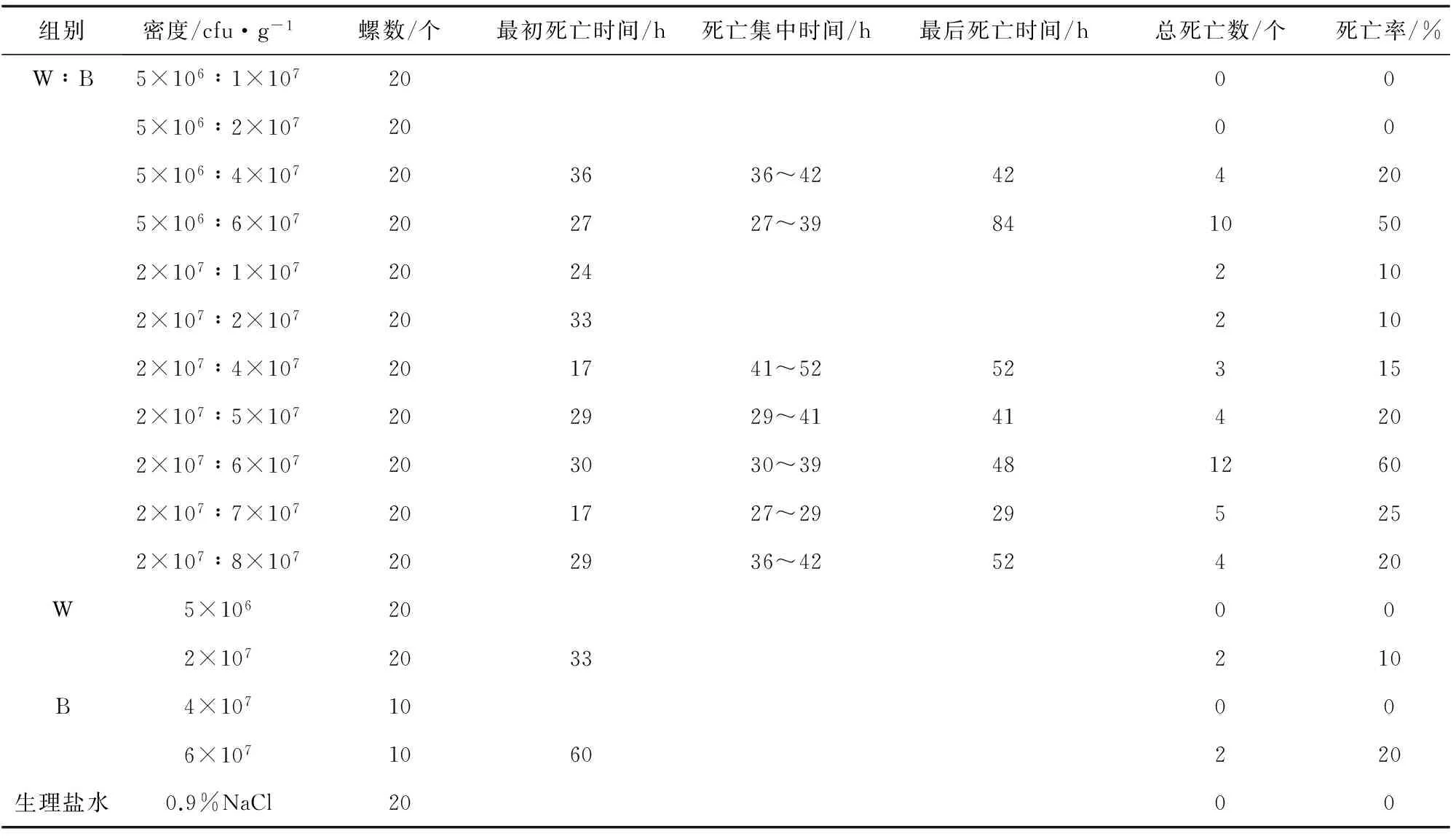
表4 混合菌悬液W∶B致病性分析结果
注:为方便数据比较,表中纯菌感染试验数据参考表1、表2纯菌感染试验,余同.
混合菌悬液W∶Y回归感染的死亡结果见表5。当致病菌W菌悬液注射密度为5×106cfu/g时,混合密度比为1∶4时有一例死亡,随致病菌Y菌悬液比例增加,未发现死亡,混合密度比达1∶35时死亡率90%。当致病菌W菌悬液注射密度为2×107cfu/g时,随着致病菌Y菌悬液密度比例的增加,死亡率呈上升趋势,死亡率达90%时混合密度比约为1∶9,最接近原始比例。最初死亡时间呈提前的趋势,由混合密度比1∶1时的21 h提前到1∶3时的18 h,但随着致病菌Y菌悬液比例的增加,死亡时间不再提前。当致病菌Y菌悬液密度不变时,死亡率随致病菌W菌悬液密度的增加有不等上升。而致病菌W菌悬液感染注射密度2×107cfu/g时,死亡率为10%,最初死亡时间30 h;致病菌Y感染注射密度1.75×108cfu/g时,死亡率为20%,最初死亡时间45 h;两者混合感染死亡率达90%,大于前两者死亡率之和,同时最初死亡时间18 h,分别提前了12 h和27 h,表明混合了致病菌W菌悬液的致病菌Y菌悬液的死亡率比同等密度的纯菌感染有明显提高,且死亡时间提前。死亡时间集中在18~48 h,对照组无死亡。
2.4.3 充气对W菌悬液回归感染的影响
充气对W菌悬液回归感染的影响结果见表6。充气的致病菌W菌悬液感染死亡率为40%,不充气的致病菌W菌悬液感染死亡率为70%,比前者提高30%,生理盐水对照组均无死亡。试验表明,缺氧降低了东风螺对细菌的耐受性,提高螺的死亡率,但充气不是决定性因素。
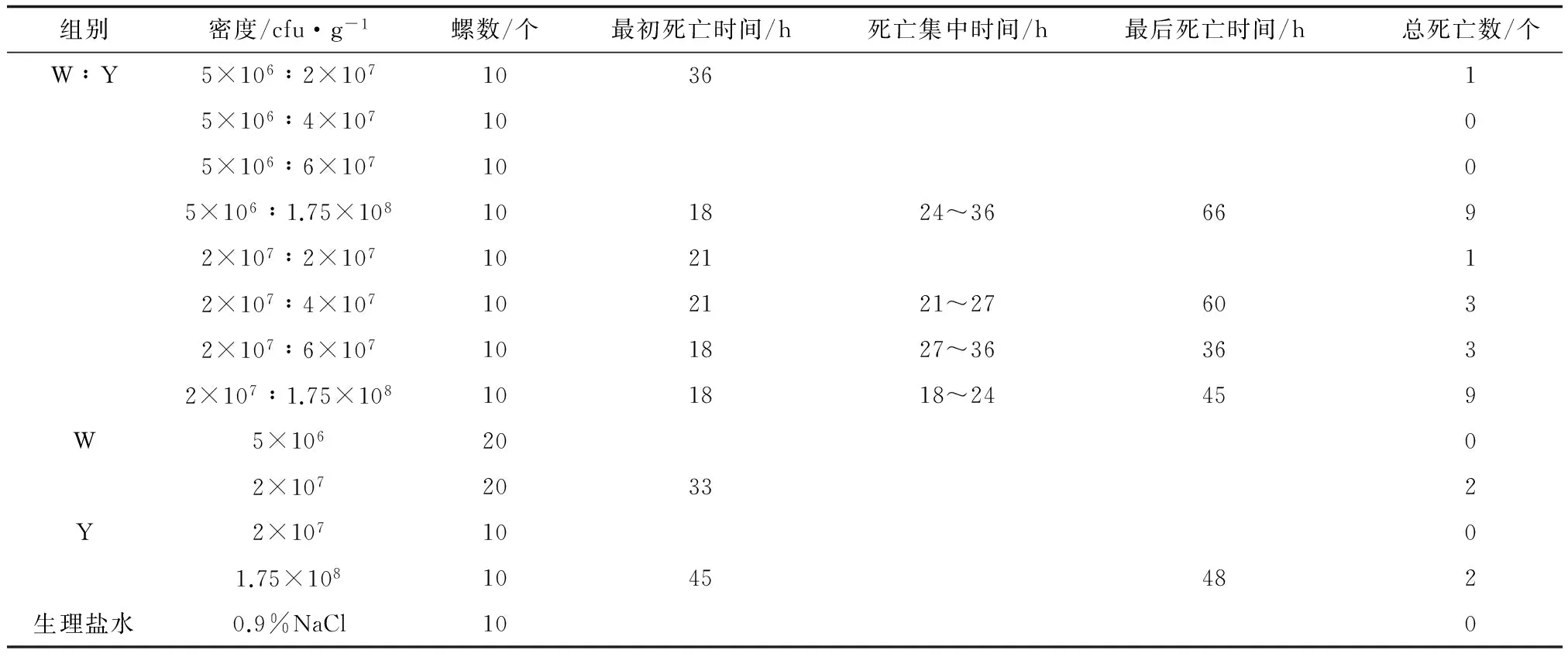
表5 混合菌悬液W∶Y致病性分析结果

表6 充气与否对W致病菌回归感染试验的影响
2.5 16S rDNA序列测定结果
利用细菌16S rDNA通用引物对分离的3株菌进行PCR扩增,挑选阳性克隆菌落送至北京六合华大基因科技股份有限公司测序,得到DNA序列。
2.6 系统进化树构建
将序列提交至GenBank进行同源性比对,致病菌B与报道的鲍希瓦氏菌(Shewanellahaliotis)相似度为99%;致病菌Y与报道的哈维弧菌(V.harveyi)相似度为98%;致病菌W与报道的变形假单胞菌(Pseudomonasplecoglossicida)相似度为99%。选择了19个同源性较高的典型菌株序列,利用Clustal X进行多序列比对,再利用Mega 6.0绘制进化树(图7~图9)。

图7 菌株B的系统发育进化树
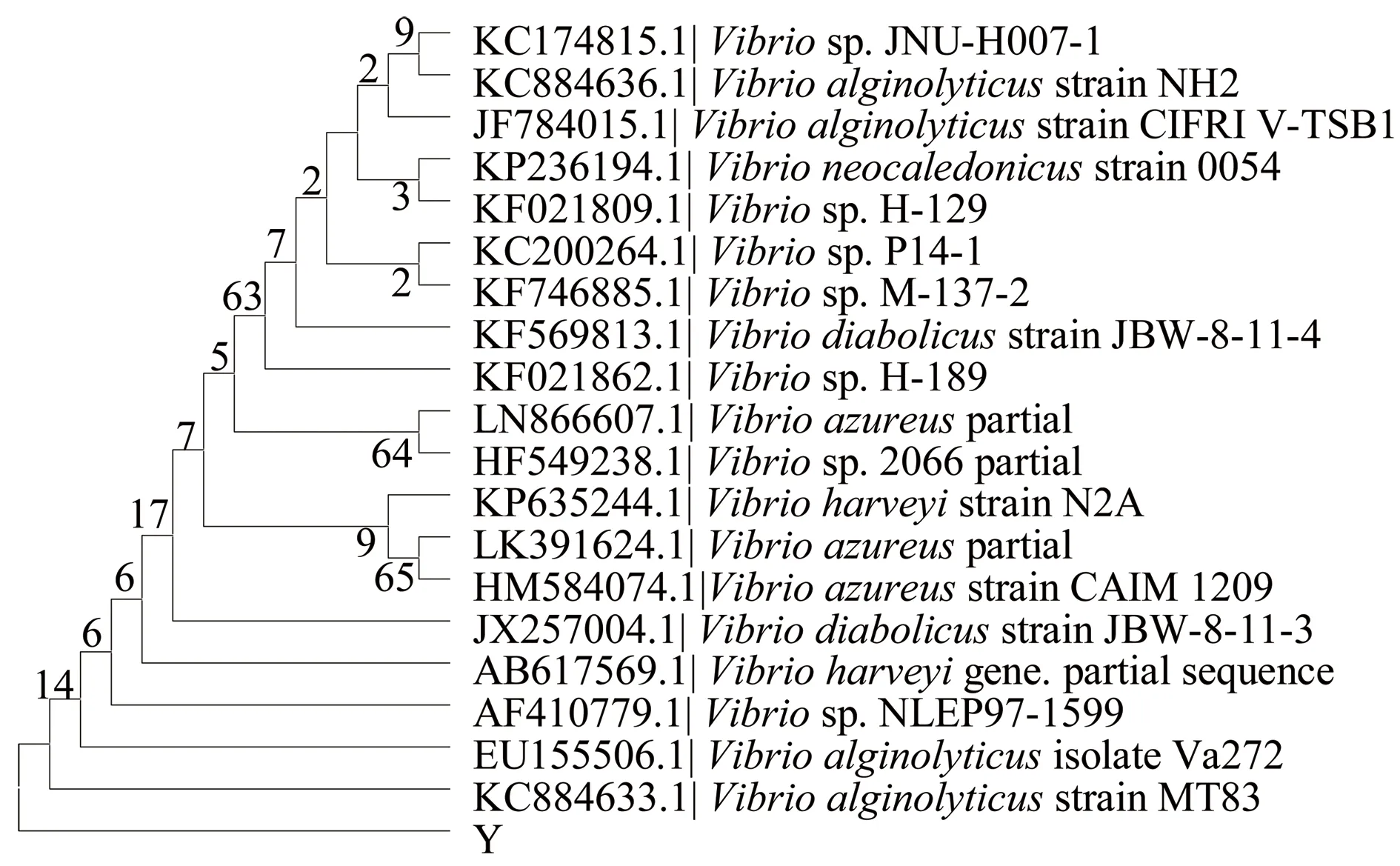
图8 菌株Y的系统发育进化树

图9 菌株W的系统发育进化树
3 讨 论
3.1 东风螺脱壳病症状及流行性分析
东风螺本次发病症状为不钻入底质,食量减小,腹足发硬,触觉反应迟钝,黏液分泌增多,部分个体吻伸出或肿大,少数个体脱壳,脱壳个体占患病螺数的近20%。与养殖户所说的弧菌爆发病症状食量减小、不钻沙、无力状、吻伸出类似。与裴琨[9]描述的肠胃炎也有一定相似性:食道发炎、红肿、伸缩困难、不能收回内脏;肠胃充血、发炎、溃烂;死螺的肉与壳分离[9]。但此次试验未观测病螺肠胃,故无法判断是否为肠胃炎,而裴琨[9]并未找到肠胃炎的病因。感染试验的死亡螺症状与患病螺相似,注射后主要表现为不钻入底质、腹足僵硬、吻伸出、触觉反应迟钝,黏液分泌增多,但不出现脱壳,而是少量个体出现足部脓疱。不出现脱壳症状的原因可能是由于季节差异,脱壳性流行病大多发生在秋冬季[19],而回归感染试验则是在4月、5月进行。在方斑东风螺的养殖过程中,肿吻病和脱壳病常共同存在,可能是分离的3种致病菌为肿吻病的致病菌。也可能壳肉分离与非生物因素和非细菌性的因素等综合因素有关[20-21]。
3.2 东风螺脱壳病组织病理分析
东风螺肝胰腺组织切片病理观察发现,患病螺和感染螺与健康螺的区别主要在于组织内血细胞数量的多寡,健康螺肝胰腺组织中存在一定数量的血细胞,而患病螺和感染螺肝胰腺组织内血细胞稀少。在腹足类免疫中,血细胞具有重要的作用,主要有吞噬、囊化、组织修复等功能[22]。因此,患病螺和感染螺肝胰腺组织内的血细胞可能集中到病灶处行使吞噬、囊化等免疫功能而受到损伤,从而造成肝胰腺组织内血细胞数量剧减。
3.3 纯菌悬液的回归感染
在病原分离的硫代硫酸盐—柠檬酸盐—胆盐—蔗糖—琼脂培养基平板面积上,致病菌B菌落40个,致病菌W菌落14个,致病菌Y菌落1204个,致病菌W菌落的比例最小。同时对比纯菌回归感染试验结果,致病菌W菌悬液注射密度4×107cfu/g时,死亡率40%,最初死亡时间18 h;致病菌Y菌悬液注射密度4×107cfu/g时,死亡率20%,最初死亡时间33 h;致病菌B菌悬液注射密度6×107cfu/g时,死亡率20%,最初死亡时间60 h。在同等密度或更低密度下,致病菌W菌悬液感染的死亡率均比致病菌Y菌悬液和致病菌B菌悬液高,最初死亡时间均较早。综上推测,W菌悬液是3株菌中对东风螺毒力最强的一株。
3.4 混合菌悬液的回归感染
致病菌W菌悬液回归感染试验结果在3株菌中最为典型,死亡率与注射密度成正比,最初死亡时间与菌悬液密度成反比,符合一般的线性规律。而两种混合菌组合感染结果均呈现非线性关系,在致病菌W、B菌悬液组合中,致病菌W菌悬液注射密度为1.2×107cfu/g时,死亡率为10%,随着混合菌悬液中致病菌B菌悬液密度比例的增加,死亡率先升后降,最大值60%对应的密度混合比例1∶3,最为接近原始比例(14∶40)。在致病菌W、Y菌悬液组合中,死亡率最高值90%分别在致病菌W菌悬液低密度组的1∶35密度混合比例处和菌W高密度组的1∶9密度混合比例处出现,最为接近原始比例(14∶1204)。据此可以推测,各株致病菌可能存在协同作用,且在混合密度比例接近原始比例时对东风螺的毒力达到最大。分离得到的3株优势菌是此次东风螺流行病的重要致病菌。
3.5 东风螺脱壳病的优势病原菌
致病菌B与报道的鲍希瓦氏菌的相似度为99%;致病菌Y与报道的哈维弧菌的相似度为98%;致病菌W与报道的变形假单胞菌的相似度为99%。

部分希瓦氏菌[如腐败希瓦氏菌(S.putrefacens)和海藻希瓦氏菌(S.algae)]是人类和其他生物的潜在病原,可引起多种疾病。希瓦氏菌属感染海水养殖动物的宿主包括金带篮子鱼(Siganusrivulatus)、欧洲海鲈(Dicentarchuslabrax)、大黄鱼、大菱鲆 (Scophthalmusmaximus)、方斑东风螺和海马(Hippocampussp.)。对东风螺海藻希瓦氏菌和鲍鱼希瓦氏菌(S.abalone)的生物学特性与致病性的研究发现[25],海藻希瓦氏菌对东风螺均具有较强的致病性,而鲍鱼希瓦氏菌对东风螺无明显致病作用。
变形假单胞菌曾在带有细菌性出血性腹水的养殖香鱼(Plecoglossusaltivelis)中分离得到[26]。变形假单胞菌已被证明是闽东地区大黄鱼内脏白点病的病原菌[27-28]。
本试验中,致病菌W是3株菌中对东风螺毒力最强的一株。各株菌可能存在协同作用,并且在混合密度比例接近原始比例时对东风螺的毒力达到最大。
3.6 溶解氧对致病菌W回归感染的影响
溶解氧是养殖水质的指标之一,对东风螺的免疫也有重要影响。研究充气对致病菌W回归感染的影响时发现,不充气的致病菌W感染组死亡率比充气的致病菌W高30%,而生理盐水对照组均无死亡。表明溶解氧充足有利于东风螺发挥自身免疫功能,提高对外界异物的抵抗性;溶解氧不足,则降低螺对病原菌的抵抗力。在生产上,东风螺放养密度很高,造成养殖螺活动空间小,溶解氧消耗大,易造成东风螺免疫力下降,当环境发生变化,海水中的病原微生物繁殖加速、数量剧增、毒性加强,即引发了东风螺细菌性疾病。
4 结 论
本研究从方斑东风螺患病个体中分离出3种致病菌W、B和Y。患病个体和感染个体的腹足及连壳肌肉组织均出现明显病变,并存在细菌;肝胰腺组织无明显病变,但血细胞显著减少。致病菌W在3种细菌中毒力最强。致病菌混合感染的毒力在混合比例接近原始比例时达到最大。推测致病菌W、B、Y是此次方斑东风螺流行病的重要病原菌。增加水体溶解氧可提高方斑东风螺机体免疫和降低疾病的发生。
[1] 王江勇, 王瑞旋, 苏友禄,等. 方斑东风螺“急性死亡症”的病原病理研究[J]. 南方水产科学, 2014, 9(5):93-99.
[2] 杨章武, 张扬波. 东风螺脱壳病活体接触感染试验[J]. 水产养殖, 2010, 31(9):1-3.
[3] 黄海立,余德光. 方斑东风螺幼虫纤毛虫病的防治方法[J].科学养鱼,2007(7):56.
[4] 郑养福. 方斑东风螺浮游期聚缩虫病的防治[J]. 福建水产,2007(2):50-51.
[5] 王建钢,乔振国. 方斑东风螺肉壳分离病病因的初步研究[J]. 现代渔业信息,2011,26(10):16-18.
[6] 彭景书,戈贤平,李明,等. 方斑东风螺单孢子虫病的研究[J]. 水生生物学报,2011,35(5):803-807.
[7] 黄郁葱, 简纪常, 吴灶和,等. 方斑东风螺吻管水肿病病原菌的初步研究[J]. 渔业现代化, 2009, 36(4):37-41.
[8] 张新中, 文万侥, 冯永勤,等.方斑东风螺肿吻症病原菌的分离鉴定及药敏分析[J]. 海洋科学, 2010, 34(5):7-12.
[9] 裴琨.方斑东风螺工厂化养殖的关键技术[J].水产科技情报,2006,33(3):107-111.
[10] 贾春红,李淑芳,张继东,南药组方对方斑东风螺病原性弧菌的抗菌作用研究[J].水产科学,2013,32(8):459-462.
[11] 王国福, 张瑞姿, 曾令明,等. 方斑东风螺肉壳分离病的防治方法[J]. 河北渔业, 2008(8):37-40.
[12] 刘巧红, 王世锋, 蔡岩,等. 海南养殖方斑东风螺暴发性疾病病原分离鉴定及药敏分析[J]. 渔业科学进展, 2014, 35(1):74-81.
[13] 罗杰,杜涛,梁飞龙,等.方斑东风螺养殖方式的初步研究[J].海洋科学,2004,28(7):39-43.
[14] 钟春雨,张锡佳,曲于红,等.泥东风螺的人工育苗及养成技术[J].齐鲁渔业,2005,22(6):5-6.
[15] 黄进光,李活,谢成营,等.方斑东风螺工厂化养殖[J].海洋与渔业,2006(2):20-21.
[16] 郑雅友,杨章武,李正良,等.方斑东风螺人工育苗技术[J].福建水产,2005(2):58-60.
[17] 黄郁葱.东风螺三种病害的病原及组织病理学研究[D].湛江:广东海洋大学,2006.
[18] 沈萍,范秀容,李广武.微生物学实验[M].3版.北京:高等教育出版社,1999.
[19] 张汉华,吴进锋,陈利雄,等.东风螺的人工养殖实用技术和产业发展展望[J].农业网络信息,2006(1):81-83.
[20] 王志成,梁志辉,彭银辉,等.方斑东风螺室内水泥池养殖研究[J].水产科学,2010,29(1):40-43.
[21] 冯永勤,周水灿,李芳远,等.方斑东风螺规模化苗种繁育技术研究[J].水产科学,2009,28(4):209-213.
[22] 王晓勤.腹足类血淋巴细胞的研究[J].国外医学寄生虫病分册,1994,21(2):52-55.
[23] Jiang Q, Shi L, Ke C, et al. Identification and characterization ofVibrioharveyiassociated with diseased abaloneHaliotisdiversicolor[J]. Diseases of Aquatic Organisms, 2013,103(2):133-139.
[24] 赵旺,吴开畅,王江勇,等.方斑东风螺“翻背症”的病原及初步治疗研究[J].水产科学,2016,35(5):552-556.
[25] Li S F, Zhang J, Qiu D, et al. Biological characteristics and pathogenicities ofShewanellaalgaandShewanellaabalonefromBabylonia[J]. Agricultural Science & Technology, 2015, 16(9):1845-1850,1859.
[26] Nishimori E, Kita-Tsukamoto K, Wakabayashi H.Pseudomonasplecoglossicidasp. nov., the causative agent of bacterial haemorrhagic ascites of ayu,Plecoglossusaltivelis[J]. International Journal of Systematic and Evolutionary Microbiology, 2000, 50(1): 83-89.
[27] 胡娇,张飞,徐晓津,等.大黄鱼 (Pseudosciaenacrocea)内脏白点病的病原分离鉴定及致病性研究[J].海洋与湖沼, 2014,45(2):409-417.
[28] Mao Z J, Li M F, Chen J G. Draft genome sequence ofPseudomonasplecoglossicidastrain NB2011, the causative agent of white nodules in large yellow croaker (Larimichthyscrocea) [J]. Genome Announc, 2015, 1(4):e00586-13.
PathogenandPathologyofShellandFleshSeparatingDiseaseinIvoryShell,Babyloniaareolata
DI Guilan1, ZHANG Zhaoxia2, KONG Xianghui1, YU Jinjin2, CHEN Haiyang2, KE Caihuan2
( 1.College of Fisheries, Henan Normal University, Xinxiang 453007, China;2. Fujian Collaborative Innovation Center for Exploitation and Utilization of Marine Biological Resources, College of Ocean and Earth Sciences, Xiamen University, Xiamen 361005, China )
The pathogens in shell and flesh separating disease in Fujian were isolated and purified from ivory shellBabyloniaareolata, and artificially infected, whose sequences were analized by 16S rDNA, and whose histopathology was observed. Three dominant bacterial strains (B, W and Y) were isolated from the proboscis, muscle and hepatopancreas of moribund ivory shell collected from a farm in Jinjiang, Fujian by aseptic methods, physiological and biochemical methods combined with molecular biology methods to classify and identify the pathogen. The results showed that the organs of ivory shell including foot muscle, connecting shells muscle, digestive gland, and hepatopancreas were severely damaged and a series of serious lesions were caused, with muscle fibers arranged disorderly, hollow myofibers, and blood cell decrease in hepatopancreas and connective tissue. The bacterial pathogen B was postulated to beShewanellahaliotis, the bacterial pathogen Y was postulated to beVibrioharveyi, and the bacterial pathogen W was postulated to bePseudomonasplecoglossicida. It was shown that the bacterial pathogen W has strong toxiferous to ivory shell, and the maximum toxicity in mixed bacteria when the proportion of the mixed bacteria was close to the original proportion. In summary, the findings provide the theoretical basis and guide in preventing and controlling of the shell and flesh separating disease in ivory shell.
Babyloniaareolata; shell and flesh separating disease; 16S rDNA sequence; pathogeny; histopathology
10.16378/j.cnki.1003-1111.2017.04.003
S968.31
A
1003-1111(2017)04-0411-10
2016-03-28;
2016-06-03.
国家自然科学基金资助项目(31640085);现代农业产业技术体系建设专项资金资助项目(CARS-48);河南省科技厅基础与前沿技术研究项目(152300410206).
狄桂兰(1974—),女,博士;研究方向:水产动物疾病与免疫.E-mail:gldi123@163.com.通讯作者: 柯才焕(1962—),男,教授;研究方向:贝类遗传育种. E-mail:chke@xmu.edu.cn.
