丙氨酰—谷氨酰胺和维生素E对军曹鱼的影响
2017-12-18丁兆坤李伟峰黄金华许友卿
丁兆坤,李伟峰,黄金华,许友卿
( 广西大学,水产科学研究所,广西 南宁 535004 )
丙氨酰—谷氨酰胺和维生素E对军曹鱼的影响
丁兆坤,李伟峰,黄金华,许友卿
( 广西大学,水产科学研究所,广西 南宁 535004 )
本研究探讨了添加不同剂量和比例的丙氨酰—谷氨酰胺和维生素E对军曹鱼幼鱼相对质量增加率、特定生长率和不同组织器官RNA/DNA比值的影响。在饲料中添加不同剂量和比例的丙氨酰—谷氨酰胺和/或维生素E,饲喂军曹鱼幼鱼12周后,称其体质量,计算相对质量增加率和特定生长率,测定肝脏、肌肉、脑、心脏、肾和血清的RNA和DNA含量,计算RNA/DNA比值。将鱼特定生长率与各组织器官RNA/DNA比值做线性回归方程分析,比较二者的相关性。结果显示,添加丙氨酰—谷氨酰胺、维生素E可促进幼鱼的特定生长率。试验鱼主要组织器官RNA/DNA比值与特定生长率的线性回归相关系数r2的大小为肌肉>血清>肝脏>肾>心脏>脑。其中鱼肉RNA/DNA比值与其特定生长率的线性回归相关系数r2=0.8422,血清RNA/DNA比值与特定生长率的线性回归相关系数r2=0.82705,均呈高度正相关。由此得出结论,在本试验条件下,添加丙氨酰—谷氨酰胺和/或维生素E可促进军曹鱼幼鱼的相对质量增加率和特定生长率,也增加其主要组织器官RNA/DNA比值;当每千克干饲料添加丙氨酰—谷氨酰胺 5 g 和维生素E 50 IU时,效果最佳。军曹鱼幼鱼的特定生长率与其肌肉、血清的RNA/DNA比值高度正相关,可互为指示。
丙氨酰—谷氨酰胺;维生素E;生长率;RNA/DNA比值;军曹鱼
核酸分析法为研究幼鱼对环境变化的反应、近期生长和死亡率状况提供了有价值的参考。鱼组织RNA与DNA比值可指示仔、稚、幼鱼的近期生长和营养条件[1-4]。维生素E是一种必需微量营养素,可以促进鱼类生长等[5-7]。谷氨酰胺是一种条件必需氨基酸,在鱼类和畜禽等动物的研究中已被证实具有促进肠道发育等功能[8-10]。有报道称,联合应用谷氨酰胺和维生素E可协同提高细胞生存发育能力[11],促进肉鸡肠道发育等[12-13]。然而,目前尚未见在饲料中联合添加谷氨酰胺和维生素E对鱼类生长协同影响的报道。
由于谷氨酰胺的溶解度低和性质不稳定,故试验和临床均用丙氨酰—谷氨酰胺替代谷氨酰胺。丙氨酰—谷氨酰胺不但安全有效,与谷氨酰胺的生理作用无异,而且丙氨酰—谷氨酰胺于体内经二肽酶水解还可以同时释放出谷氨酰胺和丙氨酸供组织利用[14]。
军曹鱼(Rachycentroncanadum)是我国南方重点养殖的鱼类[15-17]。由于军曹鱼是热带、亚热带广盐性海水鱼,生长快、营养高和味道美,已迅速发展为优良的海水养殖品种,因此吸引了许多学者研究之[17-21]。本试验添加不同剂量和比例的丙氨酰—谷氨酰胺二肽、维生素E投喂军曹鱼幼鱼12周,研究其对军曹鱼幼鱼特定生长率及主要组织器官肝脏、肌肉、脑、心脏、肾和血清RNA/DNA比值的影响,以理解军曹鱼稚、幼鱼的营养生理,丙氨酰—谷氨酰胺和维生素E的协同作用,为调控动物特别是鱼类营养和配制高效合理的饲料提供科学依据,促进丙氨酰—谷氨酰胺和维生素E的联合应用,对促进军曹鱼及其他海洋性鱼类养殖业的健康发展具有理论和应用意义。
1 材料与方法
1.1 试验饲料主要成分
鱼油和北太平洋白鱼粉(蛋白质>65%,美国海鲜公司);维生素E(α-生育酚)(1000 IU/g Sigma T3634,美国Sigma-aldrich公司);L-丙氨酰-L-谷氨酰胺二肽和L-丙氨酸(纯度>99%,中国青岛福林生化有限公司);维生素混合物、矿物质混合物和大豆磷脂(中国广州诚一生物技术有限公司);酪蛋白(食品级,中国甘肃华玲牛奶公司广州分公司);其他饲料原料均为食品级,购自国内不同的生物技术公司。
1.2 试验饲料的配制
以白鱼粉、酪蛋白、豆粕为蛋白源,鱼油、大豆磷脂为脂肪源,淀粉作为主要糖源配制基础饲料,其组分是基于本团队的研究结果[20-21]。丙氨酰—谷氨酰胺和维生素E的添加量参考了其他学者的研究[17, 22-24],每千克干饲料分别添加丙氨酰—谷氨酰胺0、10、0、10、5、2.5 g和维生素E(α-生育酚)0、0、100、100、50、25 IU,共6个饲料组,依次为D0、D1、D2、D3、D4、D5,其中D0组为对照组,未添加丙氨酰—谷氨酰胺和维生素E。经高效液相色谱分析,各饲料组丙氨酰—谷氨酰胺和维生素E实际含量分别为0.00、9.70、0.00、9.80、4.70、2.40 g/kg和27.30、26.70、128.20、127.80、78.50、50.90 IU/kg。试验饲料配方和干饲料营养成分见表1。
所有原料粉碎后过60目网筛。先以表1中各组数据比例将维生素E(α-生育酚)和鱼油分组调配均匀,丙氨酰—谷氨酰胺与矿物质混合物分组调配均匀,再按各组数据比例称量各组其他饲料成分,全部混合一起,充分搅拌均匀。投喂前每千克干饲料加养殖用海水0.7 kg,充分混合,揉成饲料面团,再手工制成适合鱼口径的小圆颗粒,投喂。为便于饲料的保存和保持饲料的新鲜,每次手工制作饲料量不超过3 d的投喂量,于冰箱-20 ℃保存,用前充分解冻放凉至室温。
1.3 试验鱼的驯化、养殖与取样
军曹鱼2100尾,鱼龄24 d,体质量约3 g,体长(4.05±0.32) cm,购自广东省湛江市流沙镇海水鱼种育苗场。先在广西水产科学研究所防城港海水养殖中试基地标准化养殖车间的养殖池内驯化,驯化养殖池为9 m×7 m×1.7 m,水深0.8 m。用过滤充氧的海水驯化养殖,海水盐度27~30,温度26~32 ℃,pH 7.8~8.0,溶解氧≥6 mg/L。每日于8:00和 17:00投喂2次,投喂量为当时鱼体质量的5%(每周称量体质量1次,调整投喂量)。驯化1月后,随机选取390尾体质量为(14.87±0.51) g,体长(12.86±0.24) cm的军曹鱼幼鱼,其中30尾用于0周解剖取组织器官样品,其余360尾随机分为6组,每组3个平行,养于18个400 L的养殖桶,水质条件与驯化相同,每桶流水量2~3 L/min,用气石充气。饲喂12周后结束养殖试验,在停止投喂24 h后抽取样品。先以76.92 μg/g含量的间氨基苯甲酸乙酯甲磺酸盐逐尾鱼麻醉,测量所有鱼体长、体质量,随机取每桶3尾全鱼样品,另3尾鱼尾静脉采血,4000 r/min离心12 min取血清,然后解剖取肝脏、背侧肌、肾、脑、心脏等组织器官,分别称量样品、装样品袋、标记固定,用液氮速冻保存,运回广西大学水产研究所实验室,用于RNA和DNA测定。
1.4 试验鱼主要组织器官DNA、RNA含量的测定
1.4.1 DNA的测定
用上海生物工程技术有限公司生产的UNIQ-10柱式动物基因组DNA抽提试剂盒,抽提试验鱼主要组织器官样品的DNA。用核酸蛋白分析仪检测样品DNA含量。
DNA含量计算公式:
CDNA/μg·mg-1=CA×50/1000/m
式中,CDNA为样品DNA的含量(μg/mg),CA为测定质量浓度(ng/μL),50(μL)为样品DNA被稀释体积,1000为ng和μg的换算倍数,m为样品质量(mg)。

表1 养鱼试验饲料配方(g/kg 干饲料)和营养组成(% 干物质)
注:a.维生素预混料:维生素A 80 000 IU/kg, 维生素D340 000 IU/kg, 维生素K3120 mg/kg, 维生素B1150 mg/kg, 维生素B2320 mg/kg, 盐酸吡哆300 mg/kg, 维生素B122 mg/kg, 烟酸15 mg/kg, 泛酸钾720 mg/kg, 叶酸40 mg/kg, 生物素2 mg/kg, 肌醇2000 mg/kg, 维生素C 100 mg/kg, 氯化胆碱10 000 mg/kg.b.矿物质预混料(mg/kg):Fe 160, Zn 600, Mn 40, Cu 200, I 10, Mg 200, Co 20, Mo 20,等.
1.4.2 RNA的测定
称量约100 mg组织,于液氮条件下研磨成粉末,用Trizol匀浆,加入氯仿,振荡离心后取上清液;加入异丙醇,振荡离心后去除上清液;加入乙醇,振荡离心后去除上清液;加入100 μL 无RNase的H2O,待RNA溶解后,用核酸蛋白分析仪检测样品RNA含量。
RNA含量计算公式:
CRNA/μg·mg-1=CA×100/1000/m
式中,CRNA为样品RNA的含量(μg/mg),CA为测定质量浓度(ng/μL),100(μL)为样品RNA被稀释体积,1000为ng和μg的换算倍数,m为样品质量(mg)。
1.5 计算公式与数理统计
相对质量增加率/%= (mt-mi)/mi×100%
特定生长率/%·d-1=(lnmt-lnmi)/t×100%
饲料系数=mf/(mt-mi)
式中,mt为最终体质量 (g),mi为最初体质量 (g),mf为饲料投喂量(g),t为养殖天数(d)。
试验数据采用SPSS 18.0统计软件单因素方差分析模块,对试验鱼各项测定指标进行统计分析,若差异显著(P<0.05),则进行Duncans多重比较。数据全部以平均值±标准差表示。
2 结 果
2.1 丙氨酰—谷氨酰胺和/或维生素E对军曹鱼幼鱼生长指标的影响
添加不同剂量和比例的丙氨酰—谷氨酰胺和/或维生素E投喂军曹鱼幼鱼12周后,总平均体质量由起始的(14.87±0.51) g增至212.14 g。各试验组鱼相对质量增加率均分别高于对照组,依次为D4>D3>D5>D2>D1>D0。其中D4组相对质量增加率显著高于对照组(P<0.05),其他各组与对照组无显著性差异(P>0.05)(图1a)。
各组鱼的特定生长率均分别高于对照组,其中D4组鱼的特定生长率最高并显著高于对照组(P<0.05)。联合添加丙氨酰—谷氨酰胺和维生素E的D3、D4、D5组鱼的特定生长率均高于单独添加丙氨酰—谷氨酰胺的D1组和单独添加维生素E的D2组,但差异不显著(P>0.05)(图1b)。
联合添加丙氨酰—谷氨酰胺和维生素E的D3、D4、D5组鱼的饲料系数均分别显著低于对照组(P<0.05),其中D4组鱼的饲料系数最低,并显著低于单独添加丙氨酰—谷氨酰胺的D1组和单独添加维生素E的D2组(P<0.05)(图1c)。

图1 丙氨酰—谷氨酰胺和/或维生素E对军曹鱼幼鱼生长指标的影响图中数据以平均数±标准差表示,柱上不同的字母表示显著性差异(P<0.05).
2.2 丙氨酰—谷氨酰胺和/或维生素E对军曹鱼幼鱼组织器官RNA/DNA比值及其与特定生长率关系的影响
除脑外,各试验组鱼肝脏、肌肉、肾、心脏、血清RNA/DNA比值均分别高于对照组,其中D3、D4、D5组鱼肌肉RNA/DNA比值均显著高于对照组(P<0.05)(表2)。试验鱼肝脏、肌肉、脑、肾、心脏、血清RNA/DNA比值与其特定生长率的线性回归关系中,其相关系数r2大小为肌肉>血清>肝脏>肾>心脏>脑。其中肌肉RNA/DNA比值与特定生长率的线性回归相关系数r2=0.8422(图2b),血清RNA/DNA比值与特定生长率的线性回归相关系数r2=0.82705(图2f),均显示高度正相关;肝脏RNA/DNA比值与特定生长率的线性回归相关系数r2=0.61722(图2a),显著相关;肾RNA/DNA比值与特定生长率的线性回归相关系数r2=0.47954(图2d),心脏RNA/DNA比值与特定生长率的线性回归相关系数r2=0.3252(图2e),均显示低度相关;脑RNA/DNA比值与特定生长率的线性回归相关系数r2=0.02696(图2c),无直线相关。
此外,添加不同剂量和比例的丙氨酰—谷氨酰胺和/或维生素E饲喂12周后,军曹鱼幼鱼血清RNA/DNA比值高于第0周(表2)。
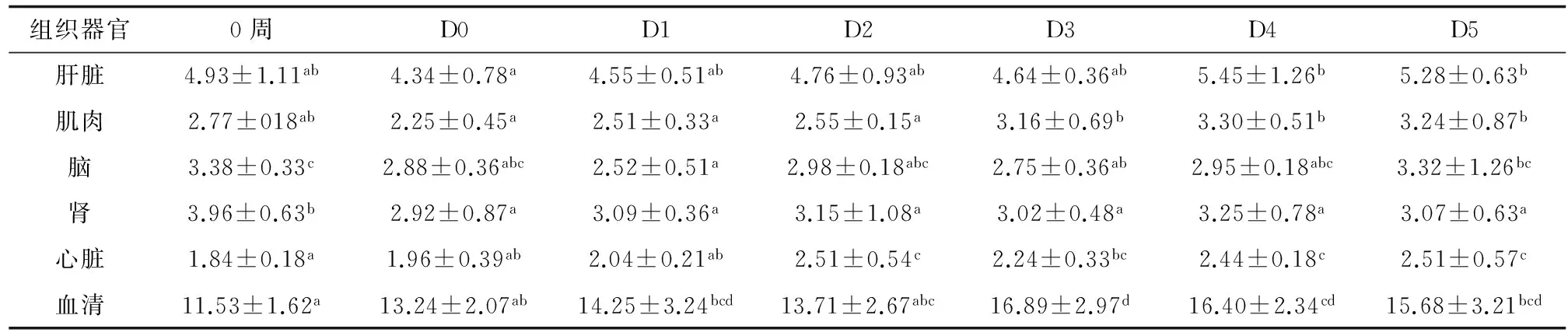
表2 丙氨酰—谷氨酰胺和/或维生素E对军曹鱼幼鱼组织器官RNA/DNA比值的影响
注:表中数据以平均数±标准差表示,横排中标有不同字母的数据,表示试验组间有显著差异(P<0.05),n=3×3.

图2 丙氨酰—谷氨酰胺和/或维生素E对军曹鱼幼鱼肝组织器官RNA/DNA比值与特定生长率的线性回归关系的影响
3 讨 论
3.1 丙氨酰—谷氨酰胺和维生素E对军曹鱼幼鱼生长的影响

维生素E是必需微量营养素,具有多种重要的生化和生理作用,包括促进鱼的生长。维生素E可能通过阻止脂质氧化,促进对日粮中不可或缺营养素的吸收而刺激生长[23]。研究表明,日粮添加维生素E促进了杂交罗非鱼(Oreochromisniloticus×O.aureus)[30]、大鳇鱼(H.huso)[31、鲟鱼(A.naccarii)[32]、杂交条纹鲈[33]、金头鲷[34]、南亚野鲮(Labeorohita)[35]、麦瑞加拉野鲮(Cirrhinusmrigala)[36]、草鱼(Ctenopharyngodonidellus)[23]、虹鳟(Onchorynchusmykiss)[37]的生长。然而,维生素E对金头鲷[38]、大菱鲆(Scophthalmusmaximus)、大西洋庸鲽(Hippoglossushippoglossus)[34]、白鲟鱼(A.transmontanus)[39]和银鳟(O.kisutch)[40]等鱼的生长影响不显著。结果相异可能是由于饲料配方,比如所用油脂的的类型和剂量,还有鱼种和规格不同等原因所致。
联合添加丙氨酰—谷氨酰胺和维生素E的D3、D4、D5组鱼相对质量增加率、特定生长率均高于单独添加丙氨酰—谷氨酰胺的D1组和单独添加维生素E的D2组(图1)。这表明在促鱼类生长方面,丙氨酰—谷氨酰胺和维生素E具有一定协同作用。由于谷氨酰胺是谷胱甘肽的前体物质[41],增加谷氨酰胺可显著提高胞内谷胱甘肽含量[42],而谷胱甘肽可还原和再生维生素E,使维生素E发挥作用[43];谷氨酰胺和维生素E可协同刺激上皮细胞的生长和再生[11];谷氨酰胺和维生素E均可促进鱼类的生长等,因此二者能协同增效[9]。本试验结果与Ayazi[44]的报道一致。
3.2 丙氨酰—谷氨酰胺和维生素E对军曹鱼幼鱼主要组织器官的RNA/DNA比值的影响
添加不同剂量和比例丙氨酰—谷氨酰胺和/或维生素E,对军曹鱼幼鱼主要组织器官的RNA/DNA比值的影响因剂量和组织器官而异,特定生长率与RNA/DNA比值线性回归分析显示,回归系数依次为肌肉>血清>肝脏>肾>心脏>脑。当丙氨酰—谷氨酰胺和维生素E的添加量分别为5 g/kg和50 IU/kg(D4)时,军曹鱼幼鱼肌肉RNA/DNA比值最高,且显著高于对照组(P<0.05)。这与D4组鱼特定生长率最高,并显著高于对照组(P<0.05)的结果一致。当对各组鱼肌肉RNA/DNA比值与其特定生长率进行线性回归分析时,r2=0.8422(图2),显示高度正相关,它们可以互为指示。然而,D3、D4、D5组鱼肌肉RNA/DNA比值均显著高于对照组(P<0.05),而只有D4组鱼特定生长率显著高于对照组(P<0.05)。如此结果一方面表明RNA/DNA比值比特定生长率更灵敏地反映生长状况;另一方面表明丙氨酰—谷氨酰胺和维生素E协同作用有剂量依赖性,只有D4最优配合,才能发挥最佳的效果。鱼的生长主要通过合成蛋白质来实现,而蛋白质是由rRNA翻译合成的。蛋白质的含量可以通过RNA的水平来检测,因此蛋白质的合成和鱼的生长可通过检测RNA含量来预测[45]。即使在鱼的初始生长阶段,通过RNA/DNA比值也可以估算鱼的生长速度。由于鱼细胞内DNA的含量是固定的,而且鱼DNA的总量与鱼细胞的数量相关[46];通过鱼细胞中RNA的含量可以得到RNA/DNA比值[47]。因此,RNA/DNA比值是鱼RNA含量的一个较好的指标,而且能准确指示正处于生长过程中的鱼的代谢[21]。换言之,在正常生理条件下,细胞DNA含量稳定,而RNA含量与蛋白质合成密切相关[48],RNA/DNA比值或RNA总量可作为蛋白质合成的指标之一。相对于其他组织,肌肉RNA/DNA能更敏感[49]地反映鱼类生长及健康状况[50-51],是海洋生物研究中的重要指标之一[52-54]。通过研究RNA/DNA比值、RNA总量,可以直观、深入地了解营养因子或环境变化对鱼体的影响[21]。本研究结果相似于其他学者的报道:肌肉RNA/DNA比值与相对质量增加率呈正相关,肌肉相关系数r2=0.958。红鳍东方鲀(Takifugurubripes)肌肉RNA/DNA比值能非常灵敏地反映鱼体的生长[55]。
添加不同剂量和比例的丙氨酰—谷氨酰胺和/或维生素E饲喂12周后,各组军曹鱼幼鱼血清RNA/DNA比值均高于第0周,表明军曹鱼幼鱼血清RNA/DNA比值随着鱼体的生长而增加,而且鱼血清RNA/DNA比值与特定生长率的线性回归相关系数r2=0.82705,显示高度正相关。表明鱼血清RNA/DNA比值也可以准确地指示生物新陈代谢和蛋白质合成状况。而蛋白质的合成使组织不断地修补和更新,并增生新的组织,促进生长,增加体质量[56]。王桂芹等[57]在饲料中维生素B6与蛋白质的交互作用研究中发现,乌鳢(Channaargus)血清RNA/DNA比值与乌鳢特定生长率显著正相关,这与本研究结果相似。
总之,在本试验条件下,添加不同剂量和比例的丙氨酰—谷氨酰胺和/或维生素E可促进军曹鱼幼鱼的相对质量增加率和特定生长率,也增加其主要组织器官RNA/DNA比值;当每千克干饲料添加丙氨酰—谷氨酰胺 5 g 和维生素E 50 IU时,效果最佳。军曹鱼幼鱼的特定生长率与其肌肉、血清的RNA/DNA比值高度正相关,可互为指示。
[1] Rooker J R, Holt G J. Application of RNA:DNA ratios to evaluate the condition and growth of larval and juvenile red drum (Sciaenopsocellatus) [J]. Mar Freshw Res, 1996, 47(2):283-290.
[2] Peck M A, Buckley L J, Caldarone E M, et al. Effects of food consumption and temperature on growth rate and biochemical-based indicators of growth in early juvenile Atlantic codGadusmorhuaand haddockMelanogrammusaeglefinus[J]. Marine Ecology Progress Series, 2003, 251(1):233-243.
[3] Tanaka Y, Satoh K, Yamada H, et al. Assessment of the nutritional status of field-caught larval Pacific bluefin tuna by RNA/DNA ratio based on a starvation experiment of hatchery-reared fish [J]. Journal of Experimental Marine Biology and Ecology, 2008, 354(1):56-64.
[4] Masuda Y, Oku H, Okumura T, et al. Feeding restriction alters expression of some ATP related genes more sensitively than the RNA/DNA ratio in zebrafish,Daniorerio[J]. Comparative Biochemistry and Physiology Part B, 2009, 152(3):287-291.
[5] 许友卿, 易波, 丁兆坤. 维生素E和维生素C的协调抗氧化作用及对水产动物的影响[J]. 饲料工业, 2011, 32(14):59-62.
[6] 许友卿, 李文龙, 丁兆坤. 添加维生素E对鱼类的抗氧化作用及其机理[J]. 饲料工业, 2010, 31(18):6-10.
[7] 许友卿, 谢亮亮, 丁兆坤. 维生素E和硒在机体的协同作用[J]. 饲料工业, 2012, 33(4):30-33.
[8] 许友卿, 李伟峰, 丁兆坤. 谷氨酰胺对水生动物免疫的影响及机理[J]. 动物营养学报, 2012,24(3):406-410.
[9] 许友卿, 李伟峰, 丁兆坤. 谷氨酰胺和维生素E协同对机体的影响及机理[J]. 动物营养学报, 2013, 25(8):1671-1676.
[10] 许友卿, 易波, 丁兆坤. 谷氨酰胺对水生动物的抗氧化作用及其机理[J]. 饲料工业, 2013, 34(4):22-24.
[11] Jiang J, Zheng T, Zhou X Q, et al. Influence of glutamine and vitamin E on growth and antioxidant capacity of fish enterocytes [J]. Aquaculture Nutrition, 2009, 15(15):409-414.
[12] Murakami A E, Sakamoto M I, Natali M R, et al. Supplementation of glutamine and vitamin E on the morphometry of the intestinal mucosa in broiler chickens [J]. Poultry Science, 2007, 86(3):488-495.
[13] Sakamoto M I, Murakami A E,Silveira T G V, et al. Influence of glutamine and vitamin E on the performance and the immune responses of broiler chickens [J]. Brazilian Journal of Poultry Science, 2006, 8(4):243-249.
[14] Wang C A,Xu Q Y, Xu H, et al. Dietary L-alanyl-L-glutamine supplementation improves growth performance and physiological function of hybrid sturgeonAcipenserschrenckii♀×A.baerii♂[J]. Journal of Applied Ichthyology, 2011, 27(2):727-732.
[15] 刘迎隆, 麦康森, 徐玮, 等. 摄食不同淀粉含量饲料对军曹鱼血清生化指标的影响[J]. 水生生物学报, 2015, 39(1):46-51.
[16] 何伟聪, 董晓慧, 谭北平, 等. 益生菌对军曹鱼幼鱼生长性能、消化酶和免疫酶活性的影响[J]. 动物营养学报, 2015, 27(12):3821-3830.
[17] Zhou Q C, Wang L G, Wang H L, et al. Dietary vitamin E could improve growth performance, lipid peroxidation and non-specific immune responses for juvenile cobia (Rachycentroncanadum) [J]. Aquaculture Nutrition, 2013, 19(3):421-429.
[18] Zheng X, Ding Z, Xu Y, et al. Physiological roles of fatty acyl desaturases and elongases in marine fish: characterisation of cDNAs of fatty acyl 6 desaturase and elovl5 elongase of cobia (Rachycentroncanadum) [J]. Aquaculture, 2009, 290(1/2):122-131.
[19] 周晖, 陈刚, 林小涛.三种蛋白源部分替代鱼粉对军曹鱼幼鱼生长和体成分的影响[J]. 水产科学, 2012, 31(6):311-315.
[20] Ding Z,Xu Y, Zhang H, et al. No significant effect of additive ratios of docosahexaenoic and eicosapentaenoic acids on the survival and growth of cobia (Rachycentroncanadum) juvenile [J]. Aquaculture Nutrition, 2009, 15(3):254-261.
[21] Xu Y, Ding Z, Zhang H, et al. Different ratios of docosahexaenoic and eicosapentaenoic acids do not alter growth, nucleic acid and fatty acids of juvenile cobia (Rachycentroncanadum) [J]. Lipids, 2009, 44(12):1091-1104.
[22] Pohlenz C, Buentello A, Bakke A M, et al. Free dietary glutamine improves intestinal morphology and increases enterocyte migration rates, but has limited effects on plasma amino acid profile and growth performance of channel catfishIctaluruspunctatus[J]. Aquaculture, 2012(370/371):32-39.
[23] Li J, Liang X, Tan Q, et al. Effects of vitamin E on growth performance and antioxidant status in juvenile grass carpCtenopharyngodonidellus[J]. Aquaculture, 2014, 430(1):21-27.
[24] Liu J, Mai K, Xu W, et al. Effects of dietary glutamine on survival, growth performance, activities of digestive enzyme, antioxidant status and hypoxia stress resistance of half-smooth tongue sole (CynoglossussemilaevisGünther) [J]. post larvae Aquaculture, 2015, 446(1):48-56.
[25] Cheng Z, Gatlin Ⅲ D M,Buentello A. Dietary supplementation of arginine and/or glutamine influences growth performance, immune responses and intestinal morphology of hybrid striped bass (Moronechrysops×Moronesaxatilis)[J]. Aquaculture, 2012(362/363):39-43.
[26] Qiyou X, Qing Z, Hong X, et al. Dietary glutamine supplementation improves growth performance and intestinal digestion/absorption ability in young hybrid sturgeon (Acipenserschrenckiifemale ×Husodauricusmale) [J]. Journal of Applied Ichthyology, 2011, 27(2):721-726.
[27] Lin Y, Zhou X Q. Dietary glutamine supplementation improves structure and function of intestine of juvenile Jian carp (Cyprinuscarpiovar. Jian) [J]. Aquaculture, 2006, 256(1/4):389-394.
[28] Xu H, Zhu Q, Wang C, et al. Effect of dietary alanyl-glutamine supplementation on growth performance, development of intestinal tract, antioxidant status and plasma non-specific immunity of young mirror carp (CyprinuscarpioL.) [J]. Journal of Northeast Agricultural University, 2014, 21(4):37-46.
[29] Coutinho F, Castro C, Rufino-Palomares E, et al. Dietary glutamine supplementation effects on amino acid metabolism, intestinal nutrient absorption capacity and antioxidant response of gilthead sea bream (Sparusaurata) juveniles [J]. Comparative Biochemistry and Physiology, Part A, 2016(191):9-17.
[30] Huang C, Huang S. Effect of dietary vitamin E on growth, tissue lipid peroxidation, and liver glutathione level of juvenile hybrid tilapia,OreochromisniloticusO.aureus, fed oxidized oil [J]. Aquaculture, 2004, 237(1):381-389.
[31] Amlashi A S, Falahatkar B, Sattari M, et al. Effect of dietary vitamin E on growth, muscle composition, hematological and immunological parameters of sub-yearling belugaHusohusoL. [J]. Fish & Shellfish Immunology, 2011, 30(3):807-814.
[32] Agradi E, Abrami G, Serrini G, et al. The role of dietary n-3 fatty acid and vitamin E supplements in growth of sturgeon (Acipensernaccarii) [J]. Comparative Biochemistry & Physiology Part A, 1993, 105(1):187-195.
[33] Kocabas A M, Gatlin Ⅲ D M. Dietary vitamin E requirement of hybrid striped bass (Moronechrysopsfemale ×M.saxatilismale) [J]. Aquaculture Nutrition, 1999, 5(1):3-7.
[34] Tocher D R, Mourente G, Van dereecken A, et al. Effects of dietary vitamin E on antioxidant defense mechanisms of juvenile turbot (ScophthalmusmaximusL.), halibut (HippoglossushippoglossusL.) and sea bream (SparusaurataL.) [J]. Aquaculture Nutrition, 2002, 8(3):195-207.
[35] Sau S K, Paul B N, Mohanta K N, et al. Dietary vitamin E requirement, fish performance and carcass composition of rohu (Labeorohita) fry [J]. Aquaculture, 2004, 240(1/4):359-368.
[36] Paul B N,Sarkar S, Mohanty S N. Dietary vitamin E requirement of mrigal,Cirrhinusmrigalafry [J]. Aquaculture, 2004, 242(1/4):529-536.
[37] Niu H, Jia Y, Hu P, et al. Effect of dietary vitamin E on the growth performance and nonspecific immunity in sub-adult turbot (Scophthalmusmaximus) [J]. Fish & Shellfish Immunology, 2014, 41(2):501-506.
[38] Montero D, Tort L,Robaina L, et al. Low vitamin E in diet reduces stress resistance of gilthead seabream (Sparusaurata) juveniles [J]. Fish & Shellfish Immunology, 2001, 11(6):473-490.
[39] Moreau R,Dabrowski K. Alpha-tocopherol downregulates gulonolactone oxidase activity in sturgeon [J]. Free Radical Biology & Medicine, 2003, 34(10):1326-1332.
[40] Huang C H, Higgs D A,Balfry S K,et al. Effect of dietary vitamin E level on growth, tissue lipid peroxidation and erythrocyte fragility of transgenic coho salmon,Oncorhynchuskisutch[J]. Comparative Biochemistry & Physiology Part A, 2004,139(2):199-204.
[41] Schuster H, Blanc M C, Bonnefont-Rousselot D, et al. Protective effects of glutamine dipeptide and α-tocopherol against ischemia-reperfusion injury in the isolated rat liver [J]. Clinical Nutrition, 2009, 28(3):331-337.
[42] Roth E,Oehler R, Strasser E, et al. Regulative potential of glutamine-relation to glutathione metabolism [J]. Nutrition, 2002, 18(3):217-221.
[43] Gupta A, Singh S, Jamal F, et al. Synergistic effects of glutathione and vitamin E on ROS mediated ethanol toxicity in isolated rat hepatocytes[J]. Asian Journal of Biochemistry, 2011, 6(4):347-356.
[44] Ayazi M. Effect dietary glutamine and vitamin E supplementation on performance, some antioxidant indices in broiler chickens under continuous heat stress temperature[J]. International Journal of Farming and Allied Sciences, 2014, 3(12):1303-1310.
[45] Höök T O, Gorokhova E, Hansson S. RNA:DNA ratios of Baltic herring larvae and copepods in embayment and open sea habitats[J]. Estuarine Coastal & Shelf Science, 2008, 76(1):29-35.
[46] Cavalier-Smith T. Nuclear volume control by nucleoskeletal DNA, selection for cell volume and cell growth rate and the solution of the DNA C-value paradox [J]. Journal of Cell Science, 1978, 34(1): 247-278.
[47] Mustafa S. Influence of maturation on the concentrations of RNA and DNA in the fish of the catfishClariusbatrachus[J]. Transactions of the American Fisheries Society, 1977, 106(5):449-451.
[48] Tanaka Y,Gwak W S, Tanaka M, et al. Ontogenetic changes in RNA, DNA and protein contents of laboratory-reared Pacific bluefin tunaThunnusorientalis[J]. Fisheries Science, 2007, 73(2):378-384.
[49] Olivar M P, Diaz M V, Chícharo M A. Tissue effect on RNA:DNA ratios of marine fish larvae[J]. Scientia Marina, 2009, 73(4):171-182.
[50] Buckley L J,Caldarone E M, Clemmesen C. Multi-species larval fish growth model based on temperature and fluorometrically derived RNA/DNA ratios: results from a meta-analysis[J]. Marine Ecology Progress Series, 2008(371):221-232.
[51] Björnssona B T, Stefanssonb S O, Mccormickc S D. Environmental endocrinology of salmon smoltification[J]. General & Comparative Endocrinology, 2011, 170(2):290-298.
[52] Franke A, Clemmesen C. Effect of ocean acidification on early life stages of Atlantic herring (ClupeaharengusL.) [J]. Biogeosciences Discussions, 2011, 8(4):7097-7126.
[53] Talmage S C. The effects of elevated carbon dioxide concentrations on the early life history of bivalve shellfish[D]. Stony Brook: State University of New York at Stony Brook, 2011.
[54] Catarino A I, Bauwens M, Dubois P. Acid-base balance and metabolic response of the sea urchinParacentrotuslividusto different seawater pH and temperatures[J]. Environmental Science & Pollution Research, 2012, 19(6):2344-2353.
[55] 梁萌青, 王成刚, 陈超, 等. 几种添加剂对红鳍东方鲀的促生长效果与RNA/DNA关系 [J]. 海洋水产研究, 2001, 22(2):38-41.
[56] 李云, 沈盎绿, 徐兆礼. 悬沙胁迫下日本囊对虾仔虾的生长和DNA 损伤[J]. 中国水产科学, 2011, 18 (3):493-499.
[57] 王桂芹, 李子平, 牛小天, 等. 饲料能量和维生素B6对乌鳢生长和蛋白质合成与调控的影响[J]. 中国饲料, 2011(16):36-40.
EffectsofDietaryAlanyl-GlutamineandVitaminESupplementsonCobiaRachycentroncanadum
DING Zhaokun, LI Weifeng, HUANG Jinhua, XU Youqing
( Institute for Fishery Sciences, Guangxi University, Nanning 530004, China )
This experiment was performed to study the effects of dietary alanyl-glutamine (AGD) and vitamin E (VE) on the relative weight gain (RWG), specific growth rate (SGR) and RNA/DNA ratio in different tissues/organs of cobia (Rachycentroncanadum) juveniles. Different AGD and/or VE supplements were used to feed the juveniles for 12 weeks. The RWG, SGR, and RNA and DNA content in the liver, muscle, brain, heart, kidney, and serum of the juveniles were measured; their RNA/DNA ratio was calculated, respectively. The SGR and the RNA/DNA ratio of the tissues/organs were analyzed by linear regression. The results showed that dietary AGD and/or VE supplements promoted the SGR of the juveniles. RNA/DNA ratios were exoressed as linear regression against SGR and their orders of r2were: muscle r2> serum r2> liver r2> kidney r2> heart r2> brain r2. In these r2,muscle r2was 0.8422 and serum r2was 0.82705, with highly positive correlations. It was concluded that dietary AGD and/or VE supplements promoted SGR of the juveniles and increased the RNA/DNA ratio in above tissues/organs. The best supplementation was found to be 5 g of AGD and 50 IU of VE per kg dried feed under our experiment conditions.
alanyl-glutamine; vitamin E; specific growth rate; RNA/DNA;Rachycentroncanadum
10.16378/j.cnki.1003-1111.2017.04.001
S965.389
A
1003-1111(2017)04-0395-08
2016-08-20;
2016-10-26.
国家自然科学基金资助项目(31360639);广西生物学博士点建设项目(P11900116, P11900117);广西自然科学基金资助项目(2014GXNSFAA118286, 2014GXNSFAA118292).
丁兆坤(1956—),男,教授,博士生导师;研究方向:环境生物学,鱼类营养、生理生化与分子生物学.E-mail: zhaokun.ding@hotmail.com. 通讯作者:许友卿(1958—),女,教授,博士生导师;研究方向:环境生物学,鱼类营养、生理生化与分子生物学. E-mail: youqing.xu@hotmail.com.
